琥珀酰化燕麦分离蛋白制备条件的优化及其结构分析
2016-09-14刘金阳赵城彬东北农业大学食品学院黑龙江哈尔滨50030黑龙江农业工程职业学院黑龙江哈尔滨50030
刘金阳,赵城彬,陈 旸,张 瑶,张 扬,吴 非(.东北农业大学食品学院,黑龙江哈尔滨50030;.黑龙江农业工程职业学院,黑龙江哈尔滨50030)
琥珀酰化燕麦分离蛋白制备条件的优化及其结构分析
刘金阳1,赵城彬1,陈旸1,张瑶1,张扬2,吴非1
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.黑龙江农业工程职业学院,黑龙江哈尔滨150030)
为提高燕麦分离蛋白(OPI)的溶解性,采用琥珀酰化法对燕麦分离蛋白进行改性。通过单因素实验研究反应温度、pH、酸酐添加量、蛋白浓度对OPI溶解性的影响,同时采用荧光发射光谱对其结构变化进行分析。在单因素实验的基础上,运用响应面法优化出琥珀酰化改性燕麦分离蛋白的适宜条件:反应温度为50℃、pH为8.5、酸酐添加量为10%、蛋白浓度为4%,在此条件下溶解度为68.38%。荧光发射光谱检测得出,琥珀酰化后OPI的荧光强度增强,是由于改性后侧链结构展开,更多的亮氨酸暴露出来所引起。
燕麦分离蛋白,琥珀酰化,优化,结构
燕麦作为一种优质谷物,其蛋白质含量高于其他谷物,并且氨基酸配比均衡,必需氨基酸含量都接近或略高于世界卫生组织推荐值[1-2]。研究表明,燕麦分离蛋白(OPI)具有免疫性,可以用作婴儿食品的添加剂以及生物医药制剂[3]。然而,OPI的溶解性较差,不能满足食品加工的要求,OPI的应用由此受到了极大的限制。琥珀酸酐是美国食品法典允许使用的食品加工助剂,而且因加工中采用氢氧化钠调节体系的pH,反应的产物中会产生少量的琥珀酸钠和琥珀酸二钠,两者都是食品鲜味剂,可改善食品风味。因此,琥珀酰化改性法是一种安全无毒还能提高蛋白风味的改性方法,可以既不影响蛋白质营养价值,又能提高其功能性质。目前,国内外对燕麦蛋白的酰化改性研究很少,只能借鉴于酰化改性对其他植物蛋白溶解性等功能性质的研究[4-11],而对改性燕麦分离蛋白结构的测定分析更是鲜有报道。因此,本文不仅着重探寻适宜的酰化改性条件来改善OPI的溶解性,同时采用荧光发射光谱法对酰化改性前后的OPI结构进行初步分析,为OPI进一步的深层研究提供理论依据。
1 材料与方法
1.1材料与仪器
燕麦分离蛋白(OPI) 实验室自制,蛋白质含量为85.76%;琥珀酸酐国药集团化学试剂有限公司;G-250考马斯亮蓝上海荔达生物科技有限公司;牛血清蛋白上海伯奥生物科技有限公司;茚三酮莱阳市双双化工有限公司;所用其他试剂均为分析纯。
LGJ-10型冷冻冻干机上海医用离心机厂;JJ-1精密定时电动搅拌器江苏省金坛市荣华仪器制造有限公司;FE20实验室pH计梅特勒-托利多仪器(上海)有限公司;数显搅拌水浴锅常州赛普实验仪器厂;紫外分光光度计北京普析通用仪器有限责任公司;日立F4500荧光分光光度计日本HITACHI公司;其他仪器均为实验室常规仪器。
1.2实验方法
1.2.1琥珀酰化OPI的制备将2 g OPI分散在50 mL去离子水中(蛋白质浓度为4%,w/v),在室温下搅拌1 h,用1 mol/L NaOH调节pH为8.5,然后分批加入一定量的琥珀酸酐(琥珀酸酐占OPI的质量比为10%),反应过程中不断搅拌,并用1 mol/L NaOH维持pH稳定不变,直至溶液pH不再变化反应结束。将蛋白溶液在4℃透析24 h以除去残余的琥珀酸酐,冻干即为酰化蛋白[12]。
1.2.2OPI琥珀酰化条件的单因素实验基本反应条件为:反应温度50℃,pH8.5,琥珀酸酐添加量10%,蛋白质浓度4%。在其他条件不变的情况下,以溶解度和酰化度为考察指标,选择反应温度为30、40、50、60、70℃,pH为7.0、7.5、8.0、8.5、9.0,琥珀酸酐添加量为5%、10%、15%、20%、25%,蛋白浓度为1%、2%、3%、4%、5%(w/v),进行单因素实验,考察各因素对其溶解度和酰化度的影响,每个样品做3组平行实验。
1.2.3OPI琥珀酰化条件的响应面实验在单因素实验基础上,根据Box-Behnken设计原理,反应温度(A)、pH(B)、琥珀酸酐添加量(C)和蛋白浓度(D)为自变量,溶解度(R1)为响应值设计响应面优化实验设计了四因素三水平的响应面分析实验,对实验数据结果采用Design-Expert 7.1软件进行分析。实验的因素和水平取值见表1。
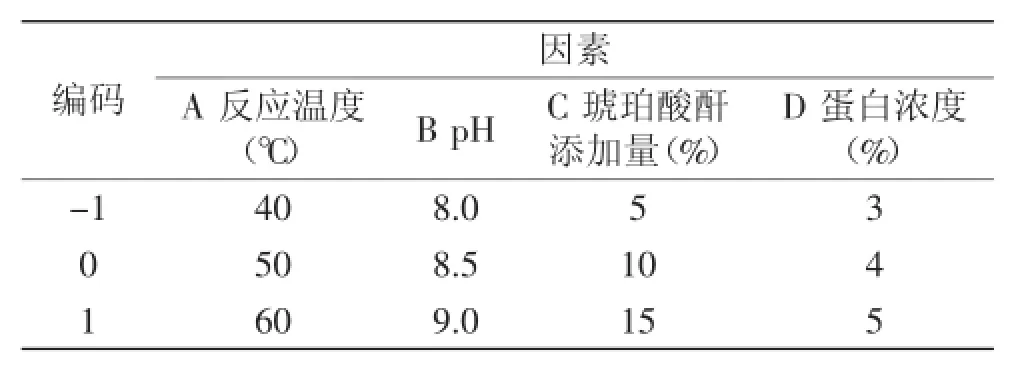
表1 响应面实验因素水平表Table 1 Code of factors and levels
1.2.4溶解度的测定根据Bradford法稍作改动。配制1%酰化蛋白样品10 mL,于25℃磁力搅拌0.5 h,分散液以4000 r/min离心15 min,取50 μL上清液与试管中,并加入50 μL生理盐水和5 mL考马斯G-250振荡1 min,放置10 min后,以100 μL生理盐水和5 mL考马斯G-250作空白,于595 nm处进行比色测定,以牛血清蛋白(1 mg/mL)绘制标准曲线,所得标准曲线方程为y=0.6731x+0.0067(R2=0.9974)。蛋白质的溶解度表示为上清液蛋白浓度占总蛋白浓度的百分比。每个样品测定三次。
1.2.5酰化度的测定酰化度采用茚三酮法测定:配制1%(w/v)的蛋白液,取1 mL放入试管中,再向试管中加入1 mL的茚三酮显色剂[13],摇匀后盖塞,在沸水中加热16 min,取出后在20℃的水浴中冷却,再向试管中加入5 mL的KIO3稀释液,振荡摇匀,以蒸馏水作空白,测定样品在570 nm处的吸光值。以吸光度表示燕麦分离蛋白的酰化度,吸光度越高,酰化度越低。

1.2.6燕麦分离蛋白结构的测定采用荧光分光光度计测定,激发波长为280 nm,发射波长测定范围为300~450 nm。将样品稀释到OPI浓度为0.5%[14]。
1.3数据处理
原始数据的整理采用Microsoft Exce(lOffice 2003)完成;数据均为三组平行实验所得的平均值,数据以表示;采用Design-Expert中心组合及混合中心设计进行数据分析及方差分析。
2 结果与讨论
2.1OPI琥珀酰化条件单因素实验分析
2.1.1反应温度对OPI溶解度的影响如图1所示,在30~50℃这一区间内,溶解度随着温度的升高而升高,在50℃时达到最大值为66.2%。这是由于在一定温度范围内,反应温度升高,粒子运动速率就会增加,反应速度加快,琥珀酰化对OPI的改性程度增大,OPI的酰化度也随之升高,这样OPI引入亲水基团(琥珀羧基),消除了蛋白质中的氨基阳离子,增加了蛋白质分子的净负电荷,减弱了分子间聚集作用,从而提高了其亲水性。随着反应温度的继续升高,OPI的溶解度趋于稳定,而酰化度略有下降,这可能是由于,反应温度的升高导致粉末状的琥珀酸酐加速了使蛋白分子沉淀的现象,从而使酰化度有所降低。因此,50℃为适宜的反应温度。

图1 反应温度对琥珀酰化OPI溶解度的影响Fig.1 The effect of reaction temperature on the solubility of succinylated OPI
2.1.2pH对OPI的溶解度的影响如图2所示,琥珀酰化适宜在中性偏碱的条件下进行,当反应pH在7~8.5之间时,溶解度随着pH提高而增加;pH8.5达到最大值68.5%,而后pH增大溶解度略有下降。这是由于琥珀酰化时引入亲水基团,增加了蛋白质的净负电荷,pH的升高导致净负电荷更多,更易于分散,所以pH越高,溶解度越大,反应速度越快,进而琥珀酰化对OPI的改性程度增大,OPI的酰化度升高。但超过一定范围,pH越大,OH-浓度也越大,酰化副反应程度越高,从这方面讲,pH越高不利于酰化反应的进行,因此,选取8.5为适宜的pH。

图2 pH对琥珀酰化OPI溶解度的影响Fig.2 The effect of pH on the solubility of succinylated OPI
2.1.3琥珀酸酐添加量对OPI的溶解度的影响如图3所示,当琥珀酸酐添加量为小于10%时,溶解度随着琥珀酸酐添加量的增加而呈递增趋势,在琥珀酸酐添加量为10%时溶解度达到最大值为68.8%。当琥珀酸酐添加量继续增加时,溶解度将趋于平稳,酰化度也趋于平衡。这是因为当酰化度达到92.4%时,被修饰的ε-NH2残基基本反应完全,产物的溶解度随酰化度达到最大并趋于平衡,所以琥珀酸酐添加量并不是越大越好。所以,适宜的琥珀酸酐添加量为10%。
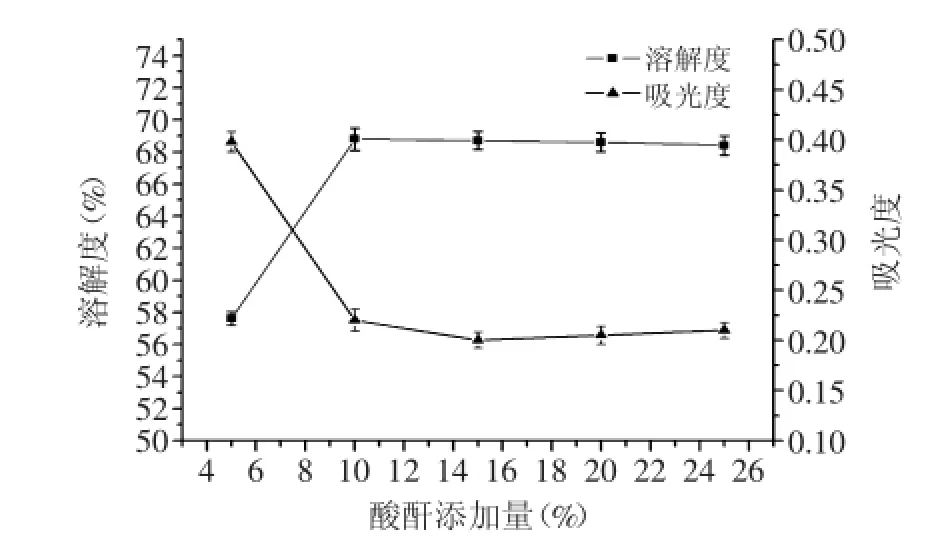
图3 琥珀酸酐添加量对琥珀酰化OPI溶解度的影响Fig.3 The effect of addition of succinic anhydride on the solubility of succinylated OPI
2.1.4蛋白浓度对OPI的溶解度的影响如图4所示,蛋白浓度较小时,溶解度随着蛋白浓度的增大而增加,当达到4%时,溶解度达到最大值67.4%,而后溶解度和酰化度不再增加均趋于平缓。原因是当燕麦分离蛋白浓度较低时,蛋白质分子处于溶解状态,与琥珀酸酐分子碰撞的几率大,所以酰化度增加;当蛋白浓度增加到4%时,许多蛋白分子呈非溶状态,
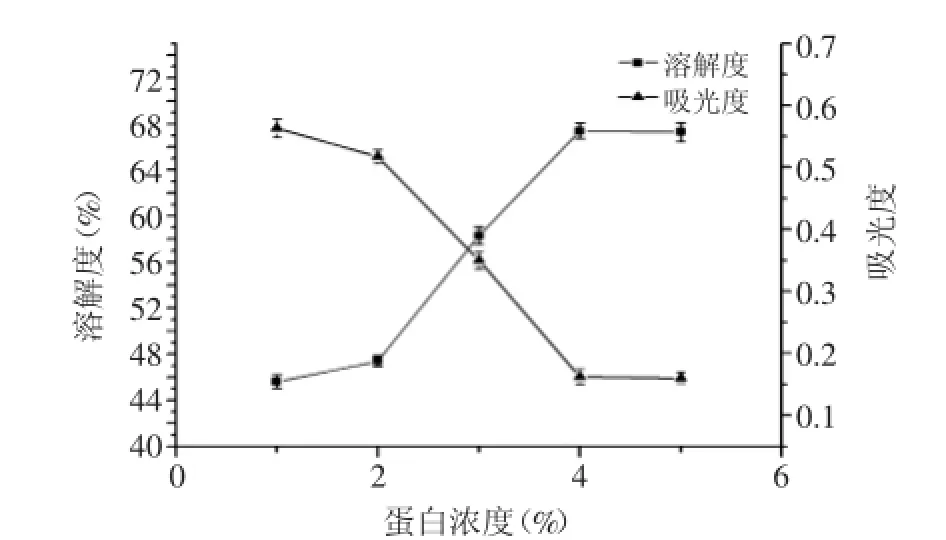
图4 蛋白浓度对琥珀酰化OPI溶解度的影响Fig.4 The effect of the concentration of OPI on the solubility of succinylated OPI
在反应体系中,不能再与琥珀酸酐分子发生有效碰撞,因此酰化度不再增大。燕麦分离蛋白的蛋白浓度不超过4%时,其酰化度越大,溶解度也越高,因为酰化度越大,引入亲水性琥珀酸酐基团越多,净负电荷越多,静电斥力越大,蛋白质与水的相互作用越强,溶解度提高。所以选取4%为适宜的蛋白浓度。
2.2OPI琥珀酰化条件响应面实验分析
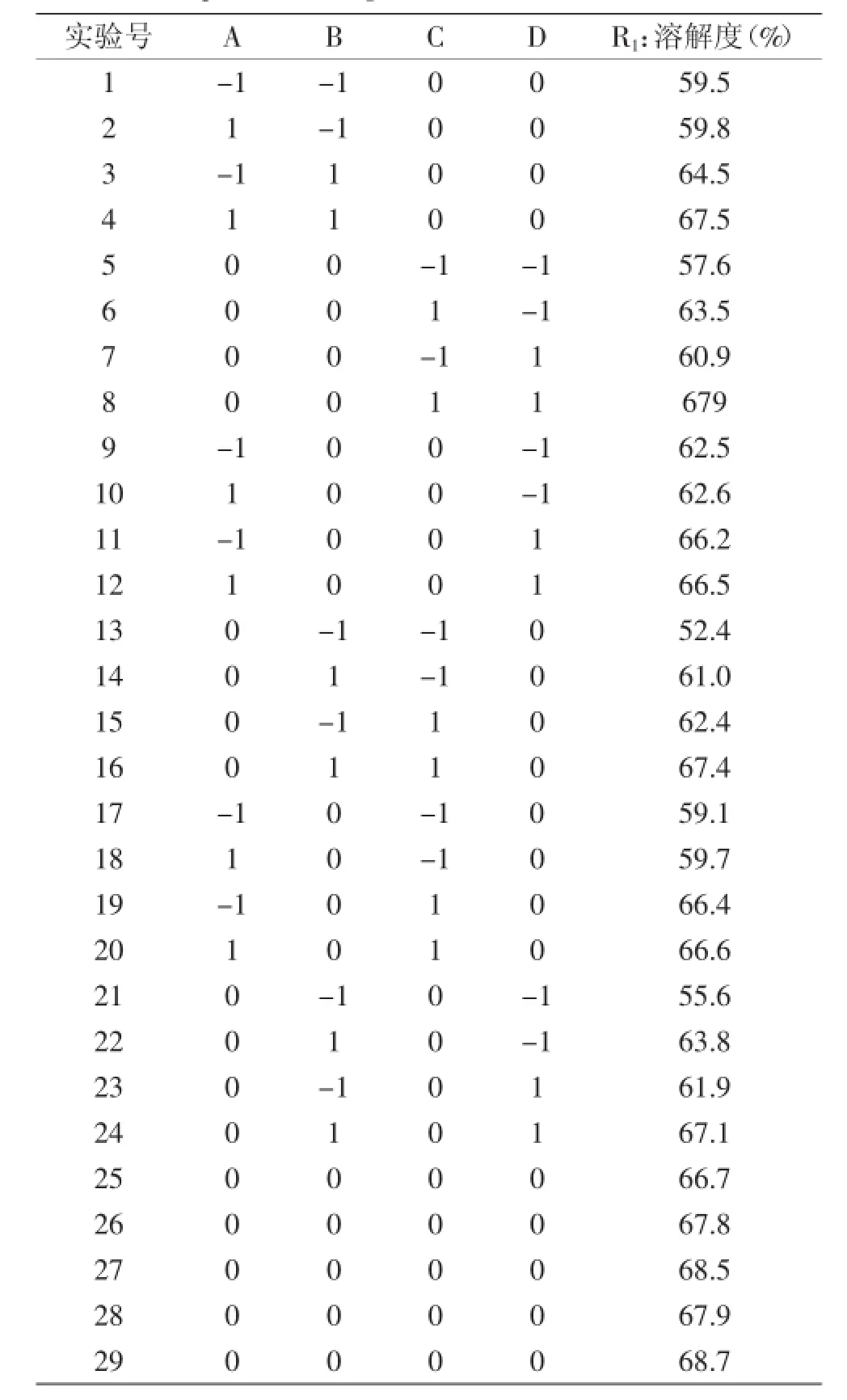
表2 Box-Behnken实验设计及结果Table 2 Experiment design and results table of Box-Behnken
在单因素实验的基础上,根据Box-Behnken中心组合实验设计原则,确定了响应面实验因素的0水平为:A反应温度为50℃、B pH为8.5、C琥珀酸酐添加量为10%和D蛋白浓度为4%。
响应面设计方案和实验结果见表2,利用Design-Expert 7.1软件对实验结果进行二次回归分析,计算OPI溶解性R1的回归方程并进行方差分析(见表3)。根据表3的方差分析对Box-behnken模型方程进行优化,剔除影响不显著项,得到优化后的回归模型为:R1=67.92+0.49A+3.34B+3.63C+1.99D-0.90BC-0.75BD-1.56A2-3.69B2-3.39C2-2.11D2

表3 方差分析结果Table 3 The test results of variance analysis
由表3可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(p<0.0001),失拟项不显著(p>0.05),并且该模型R2=0.9872,R2Adj=0.9744,说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,可以用于该反应的理论推测。由F检验可以得到因子贡献率为:C>B>D>A,即琥珀酸酐添加量>pH>蛋白浓度>反应温度。
由图5和图6可知,在固定两个因素(水平值为0)水平值时,其他两个因素的3D曲面图的总体形状较为相似,都是随着另一因素的变化一直升高后趋于平缓。综合上述图形等高线和方差分析结果,pH(B)和琥珀酸酐添加量(C)、pH(B)和蛋白浓度(D)的交互作用影响显著(p<0.05)。应用响应面优化分析方法对回归模型进行分析,并根据实际情况进行修正后得到OPI琥珀酰化最优条件为:反应温度为50℃、pH为8.5、琥珀酸酐添加量为10%、蛋白浓度为4%。按照最优工艺条件进行三次重复实验,得到琥珀酰化改性燕麦蛋白反应条件下溶解度为68.38%,与预测值68.62%的误差在±2%以内,预测值与实验值之间的良好拟合性证实了模型的有效性。表明所得出的回归方程可以很好的反映反应温度、pH、琥珀酸酐添加量、蛋白浓度与溶解度之间的关系,说明采用响应面法优化得到的工艺条件准确可靠,按照建立的模型进行预测实际实验是可行的。

图5 pH和琥珀酸酐添加量对OPI溶解性的影响Fig.5 Effect of pH and addition of succinic anhydrideon the solubility of OPI

图6 pH和蛋白浓度对OPI溶解性的影响Fig.6 Effect of pH and the concentration of OPI on the solubility of OPI
2.3琥珀酰化前后OPI的荧光光谱分析
蛋白质的荧光性由芳香族氨基酸如色氨酸、酪氨酸、苯丙氨酸引起的。色氨酸的荧光发射通常用作蛋白构想变化的指示器。因为它对局部环境的高灵敏性,因此,蛋白质的最大发射波长反映水相中暴露色氨酸残基的平均值[15]。图7显示改性前后OPI的荧光发射光谱。与OPI相比,琥珀酰化后的OPI的荧光强度增加。这可能由于琥珀酰化过程中蛋白质侧链展开,使更多的亮氨酸暴露出来,因此在347 nm处最大吸收峰增大,荧光强度增强。经琥珀酰化改性后,肽链伸展,空间结构发生变化,分子柔韧性提高,使得其溶解性大大提高。
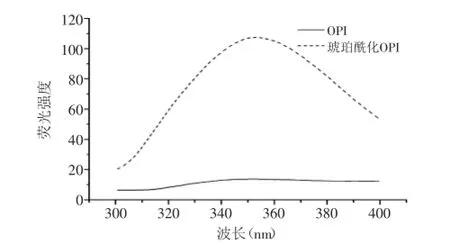
图7 OPI和琥珀酰化OPI的荧光光谱图Fig.7 Typical emission fluorescence spectra of untreated and succinylated OPI sample
3 结论
采用琥珀酰化法对燕麦分离蛋白进行改性,利用响应面法优化得到琥珀酰化OPI优化工艺条件为:反应温度50℃、pH8.5、琥珀酸酐添加量10%、蛋白浓度4%。该条件下制备的琥珀酰化OPI的溶解度为68.38%,预测值与实验值之间的良好拟合性证实了模型的有效性,说明利用本实验建立的模型的优化结果与实际情况吻合。琥珀酰化后OPI的荧光强度增强,可能是改性后侧链结构展开,更多的亮氨酸暴露出来引起的。经琥珀酰化改性后,肽链伸展,空间结构发生变化,分子柔韧性提高,使得其溶解性大大提高,为以后功能性质的深入研究及应用奠定了良好的基础。
[1]管骁,姚惠源,张鸣镝.燕麦麸分离蛋白的酶解对其功能性质的影响[J].农业工程学报,2006,22(11):217-221.
[2]李进.燕麦的营养价值与保健功效[J].新疆农业科技,1993 (5):38-39.
[3]李芳,刘刚,刘英.燕麦的综合开发和利用[J].武汉工业大学学报,2007,26(1):23-26.
[4]张红印,朱加进.小麦面筋蛋白琥珀酰化改性研究[J].中国农业科学,2003,36(3):313-317.
[5]姜绍通,唐文婷,潘丽军.小麦面筋蛋白琥珀酰化修饰研究[J].食品科学,2005,26(12):40-44.
[6]熊正俊,赵国华.酰化对大豆蛋白结构和功能性质影响[J].粮油与油脂,2001,9:5-7.
[7]Gruener L,Ismond M A H.Effects of acetylation and succinylation on the functional properties of the canola 12S globulin[J].Food Chemistry,1997,60:513-520.
[8]Dua S,Mahajan A.Improvement of functional properties of rapseed(Brassica campestris Var.Toris)preparations by chemical modification[J].J Agriculture and Food Chemistry,1996,44:706-710.
[9]Wanasundara,Shahidi F.Functional properties of acylated flax protein isolates[J].J Agriculture and Food Chemistry,1997,45:2431-2441.
[10]Lelia M,Mahdi K,Mohammad S.Effect of succinylation and deamidation on functional properties of oat protein isolate[J].Food Chemistry,2009,114:127-131.
[11]Lawal O S,Adebowale K O.Effect of acetylation and succinylation on solubility profile,water absorption capacity,oil absorption capacity and emulsifying properties of mucuna bean (Mucuna pruriens)protein concentrate[J].Nahrung/Food,2004,48(2):129-136.
[12]姚玉静,杨晓泉.乙酰化大豆分离蛋白的功能特性研究[J].中国调味品,2001(9):16-19.
[13]姚玉静,杨晓泉,唐传核,等.酰化对大豆分离蛋白水合性质的影响[J].食品与机械,2005,22(4):19-21.
[14]María J S,María J M,Ana M R P.Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein dextran systems[J].Food Hydrocolloids,2014,39:223-230.
[15]Broersen K,Voragen A G J,Hamer R J,et al.Glucoforms of β-lactoglobulin with improved thermostability and preserved structural packing[J].Biotechnology and Bioengineering,2004,86:78-87.
Optimization of preparation conditions and structural analysis of succinylated oat protein isolate
LIU Jin-yang1,ZHAO Cheng-bin1,CHEN Yang1,ZHANG Yao1,ZHANG Yang2,WU Fei1(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;
2.Heilongjiang Agricultural Engineering Vocational College,Harbin 150030,China)
In order to improve the solubility of oat protein isolate(OPI),succinylation was used to modify the proteins.The effects of the temperature of reaction,pH,the ratio of succinic anhydride,and the concentration of proteins on solubility were studied by single factor experiments.The changes of structure of OPI were analyzed by fluorescence emission spectra.Through the response surface methodology,the optimal conditions were as follows:the temperature of reaction 50℃,pH8.5,the ratio of succinic anhydride 10%and the concentration of proteins 4%.The solubility of OPI reaches to 68.38%in the optimal conditions.Fluorescence intensity of succinylated oat protein isolate increased,which was obtained by fluorescence emission spectra.The increasing of fluorescence intensity was due to more exposed leucine which were caused by the expanding of the structure of side chains.
oat protein isolate;succinylation;optimization;structure
TS201.1
B
1002-0306(2016)04-0294-05
10.13386/j.issn1002-0306.2016.04.050
2015-07-06
刘金阳(1991-),女,硕士研究生,研究方向:植物蛋白,E-mail:jinnyliu2011@163.com。
吴非(1968-),女,博士,教授,研究方向:植物蛋白,E-mail:wfneau@163.com。
黑龙江省科技攻关项目(GC13B213)。
