响应面优化西兰花中萝卜硫素复合提取工艺
2016-09-14胡翠珍马绍英曹宝臣赵生琴时振振苏利荣周文政甘肃省干旱生境作物学重点实验室甘肃农业大学生命科学技术学院甘肃兰州730070张掖汇通生物科技有限公司甘肃张掖743000甘肃顺意生物科技有限公司甘肃张掖743000
胡翠珍,李 胜,*,马绍英,曹宝臣,唐 斌,赵生琴,时振振,苏利荣,周文政(.甘肃省干旱生境作物学重点实验室,甘肃农业大学生命科学技术学院,甘肃兰州730070;2.张掖汇通生物科技有限公司,甘肃张掖743000;3.甘肃顺意生物科技有限公司,甘肃张掖743000)
响应面优化西兰花中萝卜硫素复合提取工艺
胡翠珍1,李胜1,*,马绍英1,曹宝臣1,唐斌1,赵生琴1,时振振1,苏利荣1,周文政2,3
(1.甘肃省干旱生境作物学重点实验室,甘肃农业大学生命科学技术学院,甘肃兰州730070;2.张掖汇通生物科技有限公司,甘肃张掖743000;3.甘肃顺意生物科技有限公司,甘肃张掖743000)
以西兰花鲜食部分绿色幼嫩花茎和花蕾为实验材料,利用响应面对添加剂和超声波辅助酶解西兰花提取萝卜硫素工艺进行优化。实验在单因素基础上选取四种添加剂抗坏血酸、EDTA、MgSO4、CaCl2,根据Central Composite中心复合实验设计原理采用四因素三水平的响应面分析法,确定各因素对萝卜硫素提取率的影响程度,获得该四因素最佳提取条件为:抗坏血酸4.659 mmol/L,EDTA 6 mmol/L,MgSO48.5 mmol/L,CaCl24.0 mmol/L,萝卜硫素理论最大提取率达1858.20 μg/g。经实验验证达1813.26 μg/g,其相对误差为2.48%,表明该提取工艺参数在西兰花中提取萝卜硫素是可行的。
萝卜硫素,酶解,添加剂,单因素,响应面
西兰花(Brassica oleracea L.ver.Italica Plenck),属十字花科(Cruciferae)芸薹属(Brassica)甘蓝种的一个变种[1]。其虽不是总硫代葡萄糖苷(Glucosinolates)含量最高的蔬菜,但其活性大的硫代葡萄糖苷含量较高[2]。
萝卜硫素(1-异硫氰酸-4-甲磺酰基丁烷)(Sulforaphane),分子式为:C6H11S2NO。萝卜硫素具有独特的抗癌功效[3]。它可以造成癌细胞的凋亡和细胞阻滞[4],同时可以诱导人体内的Ⅱ相解毒酶[5],同时抑制Ⅰ型酶的产生[6],最终通过多种酶体系排出致癌物和自由基等有害成分,同时,该成分不会在人体内残留,是一种新型的抗癌成分。
目前萝卜硫素制备方法主要有化学合成法[7]和酶法[8]。因为萝卜硫素具有旋光异构体,并且基团活性强,因此化学合成法过程虽简单却难以控制反应条件,并且成本高昂,实际生产中较少应用。十字花科植物中均含有硫代葡萄糖苷和其水解酶[9],但是其分布在植物的不同部位,前者一般贮存于植物细胞液中[10],而后者则位于特定的蛋白体中[11],当植株受到诸如咀嚼、研磨等而引起组织破坏时,原本存在于蛋白体中的芥子酶便得以释放[12],水解硫代葡萄糖苷,生成萝卜硫素的前体物质-异硫氰酸盐(Isothiocyanates)。黄肖钦等[13]、袁海娜等[14]和Yuan-feng Wu等[15]在萝卜硫素的提取研究中,均是利用十字花科植物自身芥子酶水解出萝卜硫素,但植物中芥子酶含量低,不能完全释放,导致酶解时间长,效率低,且实际生产操作中,易有微生物污染。本实验拟利用西兰花为原材料,通过添加外源芥子酶,提高酶浓度,酶解时添加不同添加剂,再借助超声波辅助有机提取法,利用响应面法优化酶解条件,建立高效的萝卜硫素提取方法,以期为西兰花中萝卜硫素的大量提取提供技术参考和理论依据。
1 材料与方法
1.1材料与仪器
新鲜采摘中青2号西兰花鲜食部分绿色幼嫩花茎和花蕾甘肃顺意公司提供;萝卜硫素标准品购于美国Sigma公司,纯度>98%;95%的乙醇(分析纯)、乙酸乙酯(分析纯)、甲醇(色谱纯) 均购于天津光复精细化工所。
RE-52型旋转蒸发仪上海亚荣生化仪器厂;DS-8510DTH型超声波振荡仪上海生析超声仪器有限公司;高效液相色谱仪系统(配有可变波长紫外检测器和岛津Lcsolution 15c色谱工作站)日本岛津公司。
1.2实验方法
1.2.1萝卜硫素提取工艺取80℃下脱水1 h,后在60℃下脱水至恒重的西兰花,粉碎,过60目筛,得西兰花干粉,称取干粉5 g置于三角瓶中待用。另取新收获芥籽,粉碎,过60目筛,称取0.5 g至三角瓶中,加25 mL蒸馏水,超声波振荡20 min,过滤除杂得粗酶液。根据李娟等[16]的方法描述改进,测得粗酶液的活性为0.934 μmol/(min·g)。向西兰花干粉中加入粗酶液25 mL,对照组以蒸馏水代替粗酶液,在酶解体系中加入不同浓度的添加剂(抗坏血酸、EDTA、MgSO4、CaCl2)。在不同温度下酶解一定的时间后,加入95%乙醇100 mL超声波辅助提取0.5 h,静置0.5 h,过40目筛子除去西兰花粉,65℃旋蒸浓缩至粘稠状,按体积比1∶1加入乙酸乙酯萃取3次,合并乙酸乙酯萃取液,60℃旋蒸浓缩至乙酸乙酯完全挥发,最后甲醇定容至25 mL,待测。
1.2.2萝卜硫素标准曲线的制备将萝卜硫素标准品配制成浓度为1.0 mg/mL的标准溶液,逐级稀释成浓度为100、75、50、25 μg/mL的标准溶液。进行HPLC色谱分析,以测定的萝卜硫素峰面积为横坐标(X),萝卜硫素提取率为纵坐标(Y)进行线性回归。
1.2.3萝卜硫素的HPLC分析取甲醇定容后的样液1 mL,稀释10倍,过0.22 μm有机系滤膜,进行高效液相色谱分析;色谱条件为:色谱柱:TP5-3260 (250 mm×4.6 mm,5 μm);流动相:V(甲醇)∶V(水)= 35∶65;流速:0.8 mL/min;柱温:30℃;检测波长:201 nm;进样量:20 μL。
1.2.4萝卜硫素提取率计算公式

式中:萝卜硫素浓度单位为μg/mL,萝卜硫素提取率单位为μg/g,定容体积单位为mL,原料质量单位为g。
1.2.5添加剂对萝卜硫素提取率影响的单因素实验
1.2.5.1抗坏血酸对萝卜硫素提取率的影响按照
1.2.1所述方法提取萝卜硫素,对照组以蒸馏水代替粗酶液。添加4 mmol/L的EDTA、4 mmol/L的MgSO4、4 mmol/L的CaCl2,酶解温度30℃,酶解时间60 min,研究不同添加量(0、2.25、4.5、6.75、9 mmol/L)的抗坏血酸,对萝卜硫素提取率的影响,每次实验重复三次。
1.2.5.2EDTA对萝卜硫素提取率的影响按照1.2.1所述方法提取萝卜硫素,对照组以蒸馏水代替粗酶液。添加4.5 mmol/L的抗坏血酸、4 mmol/L的MgSO4、4 mmol/L的CaCl2,酶解温度30℃,酶解时间60 min,研究不同添加量(0、2、4、6、8 mmol/L)的EDTA,对萝卜硫素提取率的影响,每次实验重复三次。
1.2.5.4MgSO4对萝卜硫素提取率的影响按照1.2.1所述方法提取萝卜硫素,对照组以蒸馏水代替粗酶液。添加4.5 mmol/L的抗坏血酸、4 mmol/L的EDTA、4 mmol/L的CaCl2,酶解温度30℃,酶解时间60 min,研究不同添加量(0、4、8、12、16 mmol/L)的MgSO4,对萝卜硫素提取率的影响,每次实验重复三次。
1.2.6酶解温度对萝卜硫素提取率的影响按照
1.2.1所述方法提取萝卜硫素,对照组以蒸馏水代替粗酶液。添加4.5 mmol/L抗坏血酸、6 mmol/L的EDTA、8 mmol/L的MgSO4、4 mmol/L的CaCl2,酶解时间60 min,研究不同酶解温度(20、30、40、50、60℃),对萝卜硫素提取率的影响,每次实验重复三次。
1.2.7酶解时间对萝卜硫素提取率的影响按照
1.2.1所述方法提取萝卜硫素,对照组以蒸馏水代替粗酶液。添加4.5 mmol/L抗坏血酸、6 mmol/L的EDTA、8 mmol/L的MgSO4、4 mmol/L的CaCl2,酶解温度30℃,研究不同酶时间(20、40、60、80、100 min),对萝卜硫素提取率的影响,每次实验重复三次。
1.2.8响应面法实验设计在单因素实验结果的基础上,根据Central Composite中心复合实验设计原理,选取四种添加剂影响最显著的因素为自变量,设计响应面实验,响应面实验因素水平如表1所示。

表1 响应面设计个因素水平Table 1 Factors and levels of RSM test
1.3数据统计分析
从历史文化传统的角度来看,我国自古就是一个刑法文化传统十分发达的国家。从汉朝刘邦的“约法三章”到形成达12篇30卷502条的中华法系代表性法典《唐律疏议》的发展过程表明,我国的刑法惩罚范围在不断扩张。在我国,国家早就习惯运用刑法手段实现对社会生活的管理和控制。经过数千年的积淀,国人也已经认同和接纳了“要用刑罚来处理坏人”的思维方式,并将其内化为中国人特有的社会心理。因此,降低起刑点,与我国的历史文化传统与国人的社会心理是能够保持一致的。
数据以(Mean±SD)表示,SPSS 19.0软件进行数据统计分析并采用Duncan’s新复极差法进行差异显著性检验(p≤0.05),用GraphPad Prism 6.0.1软件处理数据和绘图。
2 结果与分析
2.1萝卜硫素回归方程
进行HPLC色谱分析(萝卜硫素标准品和样品色谱分别见图1、图2,标准品在9.040 min处出现最高峰,样品在8.924 min处出现峰值),以测定的萝卜硫素峰面积为横坐标(X),萝卜硫素提取率为纵坐标(Y)进行线性回归,得回归方程:
Y=0.00003X-0.5104,R2=0.9999

图1 标准样品色谱图Fig.1 HPLC chromatogram of standard sample
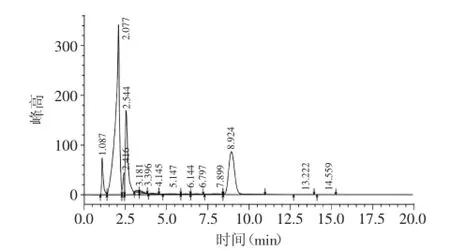
图2 样品色谱图Fig.2 HPLC chromatogram of sample
2.2添加剂对萝卜硫素提取率的影响
2.2.1抗坏血酸浓度对萝卜硫素提率的影响添加不同浓度的抗坏血酸实验结果如图3所示,萝卜硫素的提取率随着抗坏血酸浓度的升高而显著提高,实验组抗坏血酸浓度达到4.5 mmol/L时提取率最高(1447.81 μg/g),而后随着抗坏血酸含量的增高萝卜硫素提取率下降。抗坏血酸是芥子酶的非竞争性激化剂,抗坏血酸的添加有利于异硫氰酸盐的生成。实验结果表明,添加剂抗坏血酸浓度适宜,有利于萝卜硫素的提取,添加剂抗坏血酸浓度过高时,抑制萝卜硫素的提取。
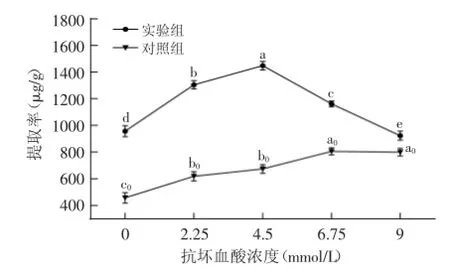
图3 不同抗坏血酸浓度对萝卜硫素提取率的影响Fig.3 Effect of different ascorbic acid concentrations on sulforaphane extraction rate
2.2.2EDTA浓度对萝卜硫素提取率的影响研究不同浓度的EDTA对萝卜硫素提取率的影响,由图4可知,添加EDTA提取率显著增高,说明添加EDTA可以提高萝卜硫素提取率。随添加EDTA浓度增大,萝卜硫素的提取率明显增加,实验组EDTA浓度达到6 mmol/L时提取率最高为1548.68 μg/g,而后随着EDTA含量的增高萝卜硫素提取率下降。

图4 不同EDTA浓度对萝卜硫素提取率的影响Fig.4 Effect of different EDTA concentrations sulforaphane on extraction rate
2.2.3不同浓度CaCl2对萝卜硫素提取率的影响添加不同浓度的CaCl2实验结果如图5所示,随添加CaCl2浓度的增加,萝卜硫素提取率显著增高,说明添加CaCl2可以提高萝卜硫素提取率。实验组CaCl2浓度达到4 mmol/L时提取率最高,为1447.667 μg/g,而后随着CaCl2浓度的增高萝卜硫素提取率下降。添加剂CaCl2浓度适宜,有利于萝卜硫素的提取,添加CaCl2浓度过高时抑制了萝卜硫素的提取。

图5 不同CaCl2浓度对萝卜硫素提取率的响Fig.5 Effect of different CaCl2concentrations on sulforaphane extraction rate
2.2.4不同浓度MgSO4对萝卜硫素提取率的影响由图6所示,随着MgSO4添加量的增大,萝卜硫素提取率显著增高,在MgSO4浓度达到8 mmol/L时提取率最高,达1490.923 μg/g,而后随着MgSO4浓度的增高萝卜硫素提取率下降。说明添加适宜浓度MgSO4有利于提高萝卜硫素的提取。

图6 不同MgSO4对萝卜硫素提取率的影响Fig.6 Effect of different MgSO4concentrations on sulforaphane extraction rate
2.3不同酶解时间对萝卜硫素得率的影响
在不同的酶解时间下提取萝卜硫素结果如图7所示。酶解时间小于60 min时,随酶解时间的延长,提取效率显著提高,实验组可达1447.867 μg/g,而后随着酶解时间的延长,提取得率反而下降。酶解时间过短,萝卜硫素提取不充分,提取率低,而达到适宜的酶解时间后,萝卜硫素充分提取,提取率高。酶解时间过长,可能萝卜硫素开始降解,从而导致萝卜硫素得率降低。

图7 不同酶解时间对萝卜硫素提取率的影响Fig.7 Effect of different enzymolysis time on sulforaphane extraction rate
2.4不同提取温度对萝卜硫素提取率的影响
在不同温度下提取萝卜硫素结果如图8所示。随温度升高,萝卜硫素提取率明显增加,当温度达30℃时提取率达到最高(实验组可达1447.867 μg/g),而后随着温度的升高,萝卜硫素提取率反而下降。在适宜的温度下,芥子酶活性高,有利于硫代葡萄糖苷的水解;当温度过高时,芥子酶活性大大降低;也可能是高温使萝卜硫素部分分解,从而导致提取率下降。

图8 不同温度对萝卜硫素提取率的影响Fig.8 Effect of different temperatures on sulforaphane extraction rate
2.5响应面优化酶解过程辅助因子的添加
2.5.1萝卜硫素提取率预测模型方程的建立及显著性分析各处理组合的实验结果见表2,用Design Expert 9.0软件对表2中的实验结果进行分析后得到二阶响应表面模型方程:
Y=1848.92-6.83A+37.08B+38.96C+8.64D+43.4AB-104AD-32.98BC-19.87BD-29.12CD-139.54A2-64.57B2-60.58C2-116.18D2
对回归方程进行方差分析,结果如表3所示。
从表3中可以看出,模型显著性检验p<0.05,表明该模型具有统计学意义。失拟项用来表示所用模型与实验拟合的程度,即二者差异的程度。从表3可以看出失拟项p=0.8468>0.05,表明失拟不显著。模型的校正决定系数R2adj=0.8995,说明该模型能解释约89.95%响应值的变化;决定系数R2=0.948,说明该模型拟和程度良好,实验误差小,该模型能够较好地描述各因素与响应值之间的真实关系。可以利用该回归方程确定最佳提取工艺条件。
通过该方程,各因素之间存在着一定的交互作用,其中AD、A2、B2、C2、D2均呈极显著影响(p<0.01),B、C、AB呈显著性影响(p<0.05),A、D、AC、BC、BD、CD均呈不显著。
从单因素水平观察,可以得出其影响顺序为:C(MgSO4)>B(EDTA)>D(CACl2)>A(抗坏血酸)。在有交互作用存在下,对西兰花中萝卜硫素提取的影响顺序为:AD>AB>BC>CD>BD>AC。
2.5.2响应面分析响应面图像曲线走势越陡,其影响越显著;走势越平滑,其影响越小。由实验各因素之间两两交互作用的响应面图像观察,图9、图11曲线走势陡峭,影响显著。由图9~图14响应面立体图可以看出,响应面存在极值,即响应面有最高点,进一步通过Design-expert 9.0软件分析计算可知,当抗坏血酸浓度为4.577 mmol/L,EDTA为6.232 mmol/L,MgSO4为8.534 mmol/L,CaCl2为3.971 mmol/L,萝卜硫素提取得率达到最大值为1858.20 μg/g。对实验结果进行实验验证,添加抗坏血酸浓度为4.659 mmol/L,EDTA为6 mmol/L,MgSO4为8.5 mmol/L,CaCl2为4.0 mmol/L,重复三次,得到萝卜硫素平均提取率为1813.26 μg/g,相对误差为2.48%,二者非常接近,说明该工艺稳定可行适合萝卜硫素的提取。

表2 响应面设计及实验数据Table 2 Program and results of RSM test
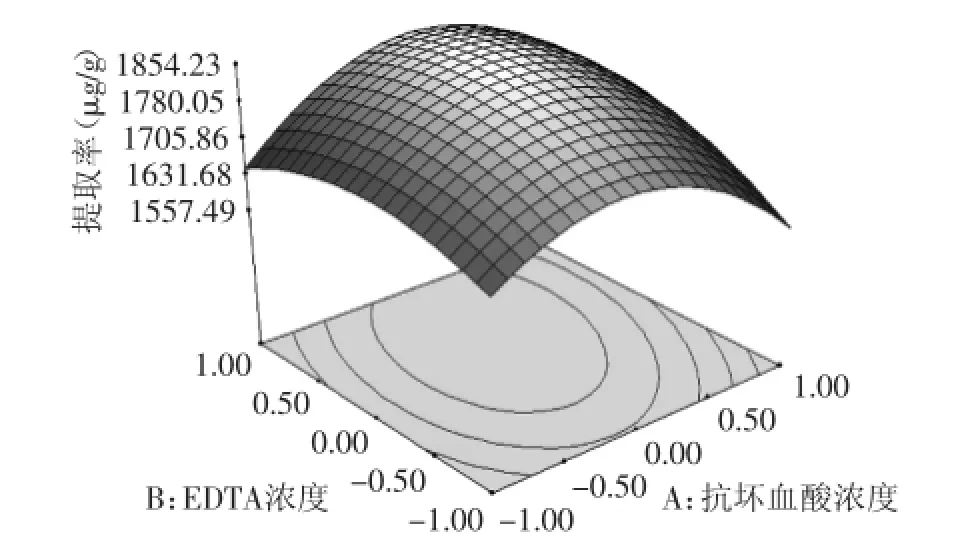
图9 Y=f(A,B)的响应面Fig.9 Responsive surface plot Y=f(A,B)

表3 提取率回归分析Table 3 Results of extraction rate regression analysis

图10 Y=f(A,C)的响应面Fig.10 Responsive surface plot Y=f(A,C)

图11 Y=f(A,D)的响应面Fig.11 Responsive surface plot Y=f(A,D)

图12 Y=f(B,C)的响应面Fig.12 Responsive surface plot Y=f(B,C)
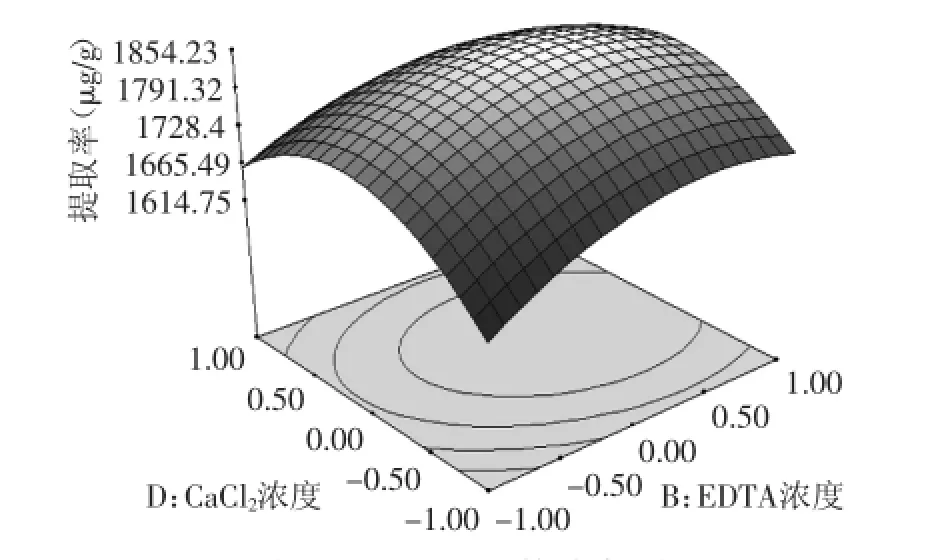
图13 Y=f(B,D)的响应面Fig.13 Responsive surface plot Y=f(B,D)

图14 Y=f(B,D)的响应面Fig.14 Responsive surface plot Y=f(B,D)
3 讨论
影响萝卜硫素提取关键的因素是酶解反应。西兰花的次生代谢产物硫代葡萄糖苷在芥子酶的水解下可生成一分子葡萄糖和一分子不稳定的糖苷配基,这个不稳定分子依赖金属离子浓度和抗坏血酸浓度重排形成不同的产物[16]—异硫氰酸酯、腈[17]、恶唑烷硫酮等物质,如图15所示。

图15 硫代葡萄糖苷水解示意图Fig.15 Hydrolysis of glucosinolates schematic
植物芥子酶的一个显著特征是:低抗坏血酸浓度能激活酶,而高抗坏血酸浓度却抑制酶,然而在缺乏抗坏血酸时芥子酶又完全无活性。添加4.5 mmol/L的抗坏血酸,萝卜硫素的提取率较未添加抗坏血酸时增加了1.5倍,与Maik等[18]研究低浓度的抗坏血酸能提高芥子酶活性一致。这是由于抗坏血酸盐的结合位点不同于葡萄糖结合位点[19],但与糖苷配基结合位点重叠,在硫代葡萄糖苷水解生成糖苷配基后,抗坏血酸使酶构像发生了轻微的改变,可能代替了芥子酶中的催化基团起作用,提高了芥子酶活性,从而促进了萝卜硫素的生成。在酶解过程中,抗坏血酸和CaCl2具有交互作用,同时添加提高了萝卜硫素的提取率,与Ludikhuyze等[20]实验抗坏血酸和钙离子结合增强芥子酶活性的研究一致。添加适量的EDTA提高了萝卜硫素的提取率,可能是EDTA作为金属离子螯合剂,消除了微量重金属导致的酶促化学反应中的抑制作用,具体作用机理还有待进一步研究。在本实验中,添加抗坏血酸、EDTA、MgSO4和CaCl2均能提高萝卜硫素的提取率,但提取率随着组合的不同而存在明显的差异,同时添加4.659 mmol/L的抗坏血酸,6 mmol/L的EDTA,8.5 mmol/L的MgSO4,4.0 mmol/L的CaCl2,有最高的提取率。
4 结论
实验结果表明添加剂抗坏血酸、EDTA、MgSO4、CaCl2各因素及其二项式对萝卜硫素提取率均有显著影响。综合考虑各方面的因素,添加外源芥子酶提取萝卜硫素的优化条件为抗坏血酸添加量为4.659 mmol/L,EDTA为6 mmol/L,MgSO4为8.5 mmol/L,CaCl2为4.0 mmol/L,在30℃下酶解60 min。萝卜硫素提取率理论得率达到最大值为1858.20 μg/g。经实验验证得1813.26 μg/g,其相对误差为2.48%,表明该提取工艺参数在西兰花中提取萝卜硫素是可行的。
[1]Madhu, AnitaK.Proximatecomposition, available carbohydrates,dietary fibre and anti-nutritional factors of Broccoli (Brassica oleracea L.Var.Italica Plenck)leaf and floret powder [J].Bioscience Discovery,2014,5(1):45-49.
[2]Meerte H,Peter M,Hilmer S,et al.Glucosinolates in broccoli stored under controlling Atmosphere[J].J Ameri Soc Hort Sci,1995,120(6):1069-1074.
[3]Yardfon T,Shyam S S,Naphaporn C,et al.Microwave-assisted extraction of Sulforaphane from white cabbages:Effects of extraction condition,solvent and sample pretreatment[J].Journal of Food Engineering,2013,117(1):151-157.
[4]Huang T Y,Chang W C,Wang M Y,et al.Effect of sulforaphane on growth inhibition in human brain malignant glioma GBM 8401 cells by means of mitochondrialand MEK/ERK-Mediated apoptosis pathway[J].Cell Biochem Biophys,2012,63:247-259.
[5]You Y R,Wu Y F,Mao J W,et al.Screening of Chinese brassica species for anti-cancer sulforaphane and erucin[J]. African Journal of Biotechnology,2008,7(2):147-152.
[6]Monia L,Carmela F,Patrizia H.Sulforaphane as a promising molecule for fighting cancer[J].Mutation Research/Reviews in Mutation Research,2014,159:207-223.
[7]王见冬,袁其朋,钱忠明.萝卜硫素研究进展[J].食品与发酵工业,2003,29(2):76-80.
[8]Han D D,Row K H.Separation and purification of sulforaphane from broccoli by solid phase extraction[J].International Journal of Molecular Sciences,2011,12:1854-1861.
[9]Luca L,Giovanna C,Onofrio L,et al.Effects of glucosinolates and their enzymatic hydrolysis products myrosinase on the rootknot nematode Meloidogyne incognita(Kofoid et White)Chitw[J]. Agriculture of Food Chemistry,2004,52(22):6703-6707.
[10]程坤,杨丽梅,方智远,等.十字花科植物中主要硫代葡萄糖苷合成与调节基因的研究进展[J].中国蔬菜,2010(12):1-6.
[11]Bones A,Slupphaug G.Purification,characterization and partial amino acid sequencing of β-thioglucosidase from Brassica napus L.[J].Journal Plant Physiology,1989,134(6):722-729.
[12]周晨光,朱毅,罗云波.十字花科蔬菜萝卜硫素含量的影响因素[J].食品工业科技,2013,34(12):371-381.
[13]黄肖钦,马朱莉,李娜,等.西兰花种子酶解生成萝卜硫素的条件研究[J].上海工程技术大学学报,2010,24(3):277-280.
[14]Yuan H N,Yao S J,You Y R,et al.Antioxidant activity of isothiocyanate extracts from broccoli[J].ChineseJournalof Chemical Engineering,2010,18(2):312-321.
[15]Wu Y F,Mao J W,You Y R,et al.Study on degradation kinetics of Sulforaphane in broccoli extract[J].Food Chemistry,2014,155:235-239.
[16]李娟,朱祝军.植物中硫代葡萄糖苷生物代谢的分子机制[J].细胞生物学杂志,2005,27:519-524.
[17]Ishikawa T,Okazaki K,Kuroda H,et al.Molecular cloning of Brassica rapa nitrilases and their expression during clubroot development[J].Molecular Plant Pathology,2007,8(5):623-637. [18]Maik K,Dirk S.A novel approach for reliable activity determination of ascorbic acid de pending myrosinases[J]. Journal of Biochemical and Biophysical Methods,2004,59(3):253-265.
[19]Burmeister W P,Cottaz S,Rollin P,et al.High resolution X-ray crystallography shows that is a cofactor for myrosinase and substitutes for the function of the catalytic base[J].Journal of Biological Chemistry,2000,275(50):39385-39393.
[20]Ludikhuyze L,Rodrigo L,Hendrickx M.The Activity of Myrosinase from Broccoli(Brassica oleracea L.cv.Italica):Influence of Intrinsic and Extrinsic Factors[J].Journal of Food Protection,2000,63(3):400-403.
Response surface optimizes the compound extraction process of sulforaphane from broccoli
HU Cui-zhen1,LI Sheng1,*,MA Shao-ying1,CAO Bao-chen1,TANG Bin1,ZHAO Sheng-qin1,SHI Zhen-zhen1,SU Li-rong1,ZHOU Wen-zheng2,3
(1.Gansu Provincial Key Lab of Arid land Crop Science,College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Lanzhou Huitong Bio-Technology Co.,Ltd.,Zhangye 743000,China;3.Gansu Shunyi Bio-Technology Co.,Ltd.,Zhangye 743000,China)
The green young stems and buds of broccoli were used as experimental material,the enzymolysis condition of sulforaphane extraction from broccoli was optimized by response surface method.According to central composite experiment design principle and using response surface analysis of four factors and three levels,four additives including ascorbic acid,EDTA,MgSO4,CaCl2were chosen on the basis of the single factor to determine the impact of various factors on the extraction rate of sulforaphane.The optimum extraction conditions were as follows:ascorbic acid 4.659 mg/g,EDTA 6 mmol/L,MgSO48.5 mmol/L,CaCl24.0 mmol/L. The theoretical maximum extraction rate of sulforaphane was 1858.20 μg/g,and the value reached 1813.26 μg/g in the experiment,the relative error was 2.48%,which indicated that the extraction process parameter above was feasible in sulforaphane extraction from broccoli.
sulforaphane;enzymolysis;additive;single factor;response surface
TS201.1
B
1002-0306(2016)04-0271-07
10.13386/j.issn1002-0306.2016.04.046
2015-06-15
胡翠珍(1989-),女,硕士研究生,研究方向:天然产物的提取与开发,E-mail:zhonglarkspur@163.com。
李胜(1970-),男,博士,教授,研究方向:植物细胞工程与次生代谢调控,E-mail:lish@gsau.edu.cn。
兰州市科技计划项目(2014-1-183);教育部新教师基金(20096202120008);国家大学生创新训练计划(201210733009);甘肃农业大学本科生科研训练计划(20140824,20140825);甘肃农业大学盛彤笙科技创新基金(2015)。
