基于二次通用旋转设计的蓝蛤ACE抑制肽酶解工艺模型
2016-09-14于志鹏蔡佳彣赵文竹张宏阳励建荣刘静波渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁锦州203吉林大学营养与功能食品研究室吉林长春30062
于志鹏,蔡佳彣,赵文竹,张宏阳,吴 雨,张 霜,励建荣,*,刘静波(.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州203;2.吉林大学营养与功能食品研究室,吉林长春30062)
基于二次通用旋转设计的蓝蛤ACE抑制肽酶解工艺模型
于志鹏1,蔡佳彣1,赵文竹1,张宏阳1,吴雨1,张霜1,励建荣1,*,刘静波2,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,
辽宁锦州121013;
2.吉林大学营养与功能食品研究室,吉林长春130062)
以蓝蛤蛋白为原料,选用Protamex蛋白酶进行酶解并以水解度作为测定指标,在单因素实验基础上进行二次通用旋转设计,对获得最优工艺参数进行验证,将获得的血管紧张素转化酶(ACE)抑制肽进行ACE抑制活性测定和傅立叶红外光谱分析。结果表明在底物浓度为10%,酶解pH为10,加酶量7%和酶解温度60℃为最优酶解条件,酶解1 h所得的蓝蛤蛋白水解度为30.1%,利用高效液相色谱法对蓝蛤活性肽进行体外ACE抑制活性测定表明其半抑制浓度为80 mg/mL,且活性肽溶液以无规卷曲空间构型为主。
蓝蛤,活性肽,酶解,血管紧张素转化酶,通用旋转设计
蓝蛤(Aloididae aloidis)是盛产于我国沿海的一种重要低值海洋贝类,蓝蛤中富含多种优质蛋白质,且含量高达60%,氨基酸组成全面,其氨基酸总量和必需氨基酸总量均与贻贝相当,并且精氨酸的含量较高[1]。蓝蛤由于个体较小,食用价值不大等诸多原因,多被作为对虾活饵料[1-2],造成丰富的蓝蛤资源未得到充分利用。基于陆地资源的有限性,海洋资源尤其是蓝蛤等低值贝类资源的高值化利用将有效解决当前优质蛋白资源紧缺所面临的难题。利用海洋蛋白资源开发活性肽备受关注,其中血管紧张素转化酶(ACE)抑制肽成为研究的热点之一。ACE抑制肽可以调节肾素血管紧张素系统-激肽释放酶激肽系统,ACE能够将无升压活性的血管紧张素Ⅰ转化为具有升高血压活性的血管紧张素Ⅱ,ACE抑制肽通过对ACE活性的抑制进而实现对高血压的缓解作用。有文献报道蓝蛤酶解产物具有血管紧张素转化酶抑制活性[3]。目前对于ACE抑制肽的制备多采用外源蛋白酶进行酶解[4-5],通过优化设计等手段获得最优酶解条件。本研究拟利用外源性蛋白酶酶解蓝蛤蛋白制备活性肽,酶解过程中实时监测反应体系水解度的变化,通过二次通用旋转设计建立外源酶制备蓝蛤活性肽的最优工艺,并采用高效液相色谱法测定蓝蛤活性肽的ACE抑制活性,同时利用傅立叶红外光谱对蓝蛤ACE抑制肽的空间结构进行了探索。
1 材料与方法
1.1材料与仪器
新鲜蓝蛤肉购于兴隆大家庭购物中心(锦州);血管紧张素转化酶(ACE)、卡托普利、马尿酰组氨酰亮氨酸(HHL)、马尿酸美国Sigma公司;Protamex®蛋白酶(活力1.5 AU-N/g)诺维信公司;乙腈、甲醇和三氟乙酸(TFA) 色谱纯,美国Thermo Fisher科技公司。
高效液相色谱仪美国安捷伦科技公司;HH-2数显恒温水浴锅金坛大地自动化仪器厂;ZD-2雷磁电位滴定仪上海雷磁仪器厂;JJ-1精密增力电动搅拌器江苏省金坛市自动化仪器厂;AG204型电子天平瑞士梅特勒-托利多公司;RE 52-86A旋转蒸发器上海亚荣生化仪器厂;KQ-100DB台式数控超声波清洗器成都一科仪器设备有限公司;IRPrestige-21傅里叶红外光谱岛津企业管理(中国)有限公司。
1.2实验方法
1.2.1蓝蛤蛋白活性肽的酶解工艺取一定量新鲜蓝蛤肉经绞肉机绞成肉糜,并制成一定浓度的蓝蛤肉糜水溶液转移到水解瓶中。将装有蓝蛤肉糜溶液的水解瓶置于恒温水浴锅调整至相应的底物浓度、加酶量、酶解温度和pH条件下,加入一定量的Protamex®蛋白酶启动水解。水解过程中不断搅拌,每隔30 min测定酶解液pH,并不断加入0.5 mol/L氢氧化钠溶液以维持pH在规定的范围内(±0.05),水解完成后经100℃灭酶10 min,9000×g离心10 min,取上清液冷冻干燥,保存备用。
1.2.2酶解蓝蛤蛋白制备活性肽的单因素实验以水解度为指标,经单因素实验初步考察酶解温度、加酶量、底物浓度和pH四个因素对复合蛋白酶水解蓝蛤蛋白制备活性肽的水解度的影响。
将蓝蛤肉糜水溶液调整pH分别在8、9、10、11条件下,并在底物浓度5%、加酶量5%和50℃情况下酶解1 h,研究pH对蓝蛤水解效果的影响。
设定蓝蛤肉糜水解温度分别为40、50、60、70、80℃,并在底物浓度5%、加酶量5%和pH10情况下酶解1 h,研究温度对蓝蛤水解效果的影响。
将加酶量分别设定为1%、3%、5%、7%、10%和12%,并在pH10、底物浓度5%和60℃情况下酶解1 h,研究pH对蓝蛤水解效果的影响。
将蓝蛤肉糜底物浓度分别配制为1%、5%、10% 和15%,并在pH10、加酶量5%和60℃情况下酶解1 h,研究pH对蓝蛤水解效果的影响。
1.2.3酶解蓝蛤蛋白制备活性肽二次通用旋转设计模型在单因素实验基础上,进行四元二次通用旋转设计优化,分别考察温度、加酶量、底物浓度和pH及其两两因素交互作用和因素二次项对水解效果的影响,因素水平见表1。
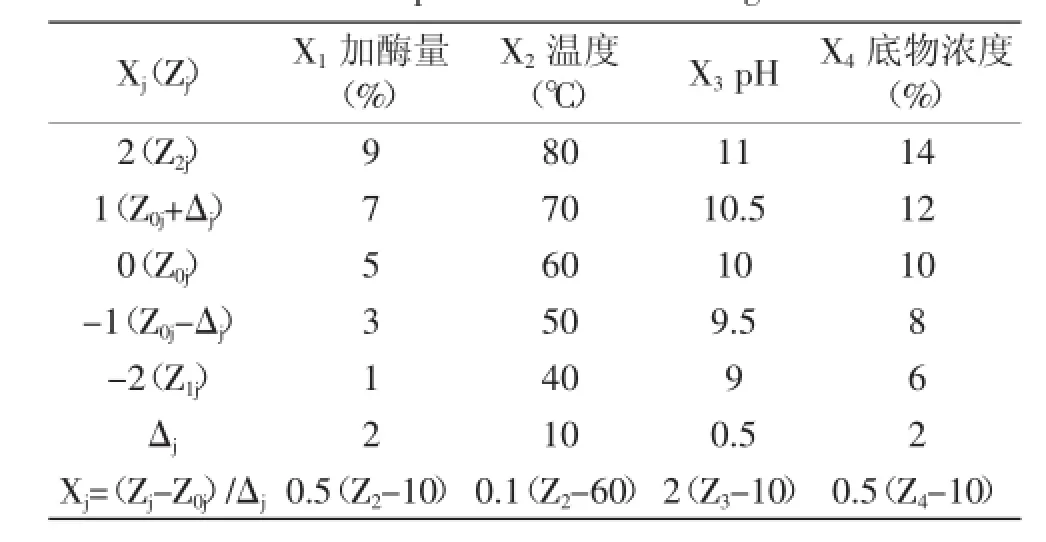
表1 因素水平编码表Table 1 Experiment factors coding table
1.2.4酶解蛋白质水解度(DH)的测定水解度测定采用pH-stat法[6]。
1.2.5血管紧张素转化酶抑制活性的测定采用高效液相色谱法,在Wu等[7]方法基础上进行了一些修改,取30 μL HHL底物液,加入10 μL抑制剂混合均匀,在(37±0.5)℃恒温水浴中预热3~5 min,然后加入20 μL ACE(2.0 U/mg protein)液充分混合,37℃保温30 min后,再加入60 μL的1 mol/L HCl终止反应,得到反应液,同时用10 μL pH为8.3的硼酸缓冲液替代抑制剂溶液作为空白对照组[8-10]。该反应液用0.45 μm滤膜过滤后直接用HPLC系统进行分析。色谱条件:Inertsil WP300 C18色谱柱(5 μm,125 mm×4.0 mm),柱温25℃,流速0.5 mL/min,流动相乙腈/水(0.05% TFA)比例为25/75等梯度洗脱,检测波长228 nm。
ACE抑制活性计算公式如下:
ACE抑制活性(%)=100×(M-N)/M
式中:M为空白对照组中马尿酸的峰面积;N为添加抑制剂组中马尿酸的峰面积。
配制不同浓度的蓝蛤蛋白ACE抑制肽的水溶液,按照血管紧张素转化酶抑制活性测定方法测定,进而获得不同浓度样品对ACE活性的抑制率,以抑制率对蓝蛤ACE抑制肽浓度(mg/mL)作图,根据趋势线获得抑制率为50%时,对应的蓝蛤蛋白ACE抑制肽的浓度,即为半抑制浓度(IC50)。
1.2.6傅里叶变换红外光谱分析(FTIR)采用KBr压片法进行红外光谱分析,具体操作:蓝蛤蛋白源ACE抑制肽粉末1 mg与干燥的KBr粉末100 mg(预先放置于马弗炉中200℃干燥10 h)混匀后置于玛瑙研钵中研磨过筛,过筛后的粉末在红外灯下压片,采用KBr压片法在波数为400~4000 cm-1范围,利用红外光谱仪IRPrestige-21进行测定,扫描方式采用透过率测定活性肽的红外光谱图。
1.2.7数据统计分析采用Microsoft Excel,SPSS以及Origin对数据进行处理分析,样品测定结果采用平均值±标准偏差表示。
2 结果与分析
2.1单因素实验结果
2.1.1pH对水解效果的影响水解度变化趋势见图1。图1表明pH在8~10时,水解度随pH的升高而增加;pH10条件下的水解度最高;pH在10~11时,水解度降低。在pH10条件下复合蛋白酶水解蓝蛤蛋白效果最佳,在此pH条件下蓝蛤蛋白可能与复合蛋白酶的活性位点更好的结合进而提高了酶解效果。因此复合蛋白酶酶解蓝蛤蛋白制备活性肽在pH10条件下进行后续的单因素实验。
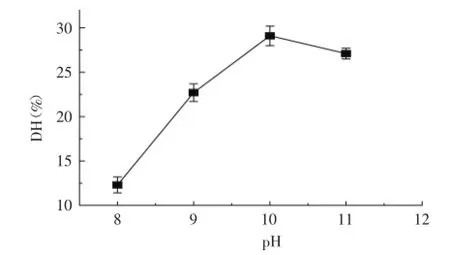
图1 pH对水解效果的影响Fig.1 Influence of pH on the degree of hydrolysis
2.1.2温度对水解效果的影响由图2可以看出,温度由40~60℃升高过程中,水解度逐渐升高;当酶解温度升高到70~80℃时,水解效果降低,因此可以初步得出60℃时蓝蛤肉糜水解效果较好。实验结果证明在一定温度范围内随着温度升高,酶促反应和一般化学反应一样反应速度加快;然而由于蛋白酶本质是蛋白质,当温度超过一定数值后,随着温度逐渐升高,蛋白酶因逐渐变性而失活,导致水解度降低。
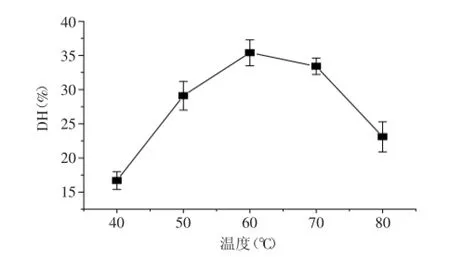
图2 温度对水解效果的影响Fig.2 Influence of temperature on the degree of hydrolysis
2.1.3加酶量对水解效果的影响酶的用量增加有利于提高对底物蛋白质的水解程度,但是从经济的角度讲,其成本过高,因此应当根据底物的情况来确定其合适的用量。加酶量对酶解效果的影响见图3,经单因素方差分析可知1%、3%、5%、7%、10%和12%加酶量组间水解度差异显著(p<0.05),对加酶量5%、7%、10%和12%进行单因素方差分析,结果表明组间差异不显著。由图3可知随着加酶量的增加,水解度随之升高,但在加酶量为5%时的水解度比加酶量3%时提高了5%,而比加酶量为12%时蓝蛤蛋白的水解度仅低2%,综合考虑初步选取加酶量为5%。
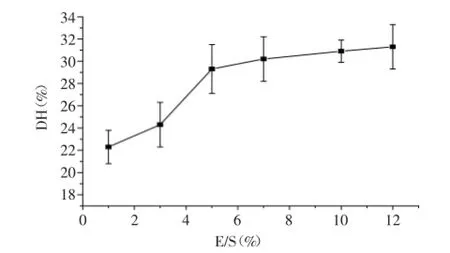
图3 加酶量对水解效果的影响Fig.3 Influence of enzyme addition on the degree of hydrolysis
2.1.4底物浓度对水解效果的影响蛋白酶必须溶解于水才能均匀分散于蓝蛤肉糜中,进而与底物接触并对其发生作用,实验结果如图4所示。底物浓度在1%~10%范围内,酶解1 h的水解度由31.7%降低到28.3%仅降低3.3%,而当底物浓度增加至15%时水解度为18.03%,与底物浓度为1%条件下的水解度相比降低了13.67%。因此考虑在较高底物浓度下且有较高的水解度,初步选择10%底物浓度为最佳条件。
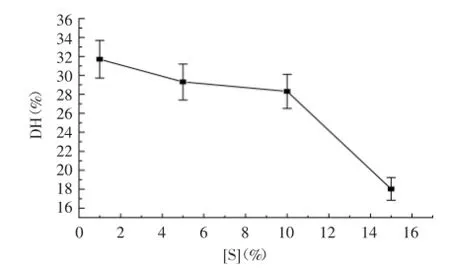
2.2二次通用旋转设计模型的建立
在单因素实验基础上进行了二次通用旋转设计,其结果见表2,并进行了回归系数的显著性检验、回归方程检验和失拟检验。
根据相关系数得到回归方程:Y=0.249+0.031X1-0.02X4-0.014X12-0.116X22-0.019X32+0.004X42
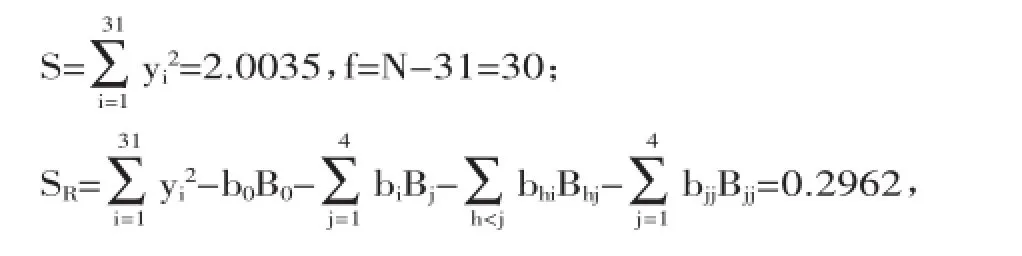
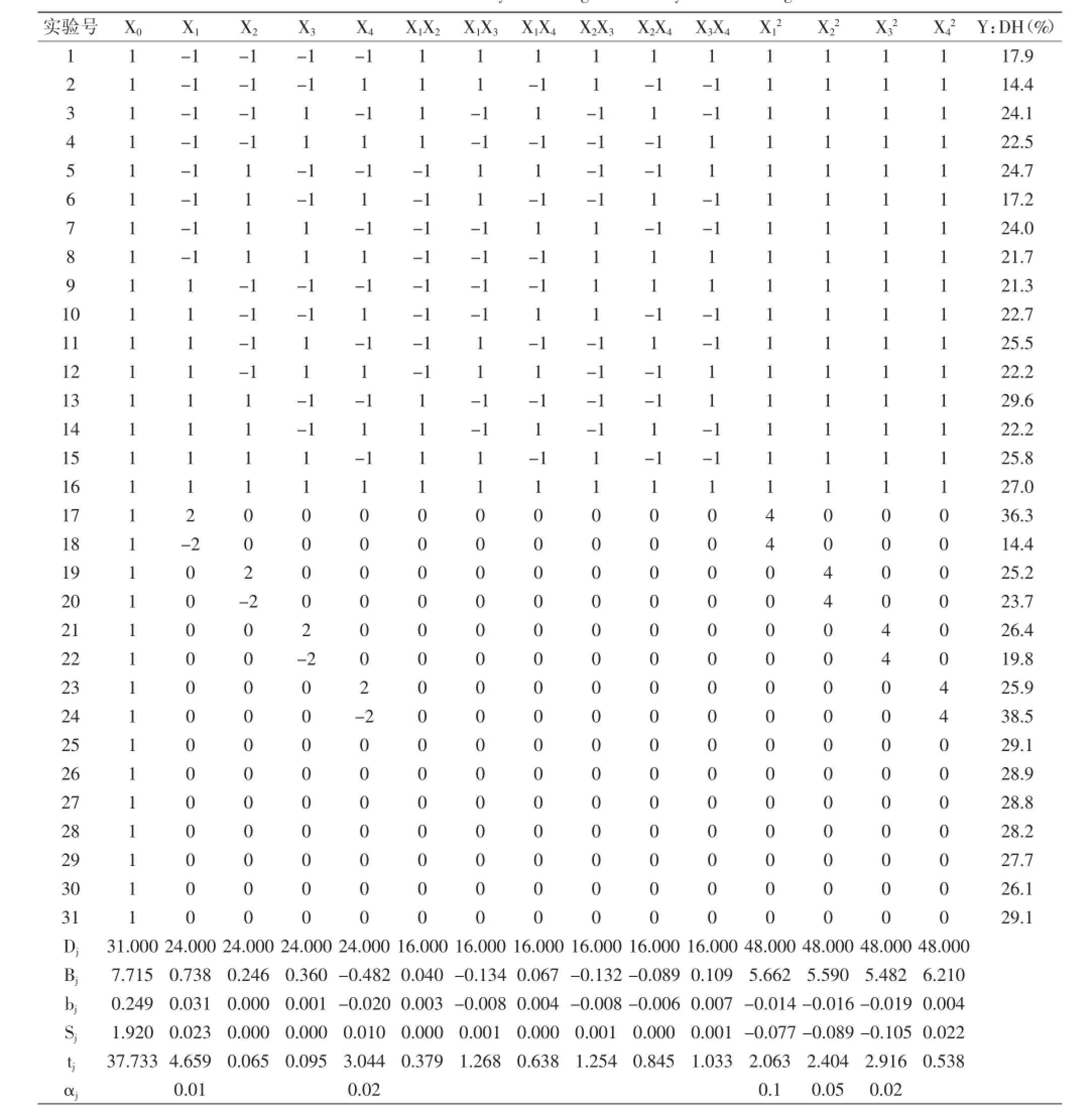
表2 二次通用旋转设计实验结果与分析Table 2 Results and analysis of the general rotary unitized design

表明方程在0.05水平下显著,且在中心处满足可见回归方程在实验中心处拟合得很好。

根据西尔维斯特不等式判别方程的极值[11]。设在稳点x0=(x01,x02,...x0p)处,计算y=xj(j=1,2,…,p)的各阶偏导数,并且定义行列式Dj,并对3个变量依次计算3个行列式:
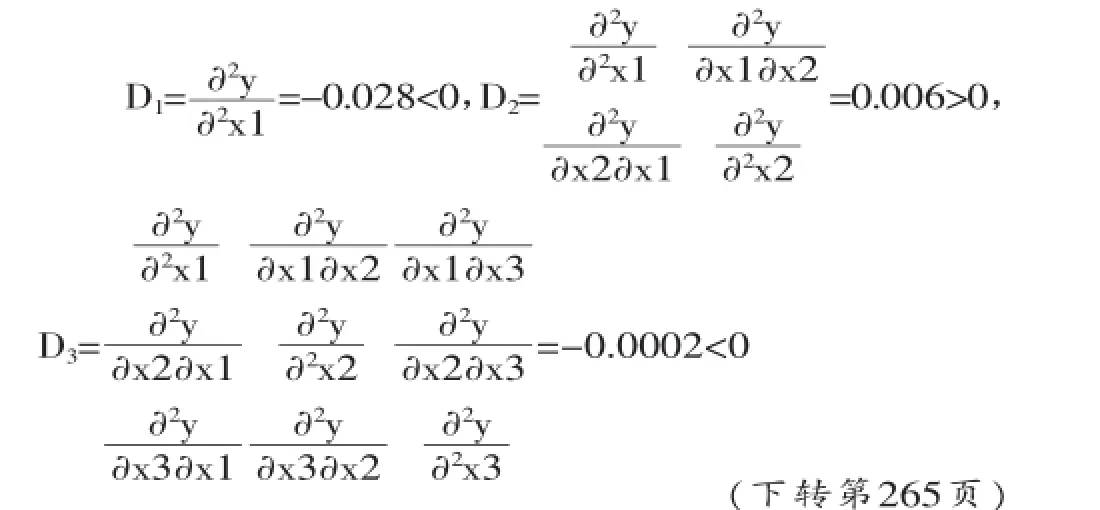
根据西尔维斯特不等式判别方程可以得出方程有极大值,利用求驻点方法求得当水解度取得极值时,X1=1,X2=0,X3=0,X4=0。通过回归系数检验(见表1)、回归方程检验F回=6.5887和失拟检验Flf<1,可以认为该方程为最优回归方程,将因素编码表代入方程中,即在底物浓度为10%,酶解pH为10,加酶量7%和酶解温度60℃条件下,酶解1 h所得的蓝蛤蛋白水解度为29.4%,并经实验验证(水解度为30.1%)与回归方程优化结果一致。
2.3蓝蛤活性肽ACE抑制活性及红外光谱分析
利用高效液相色谱法对蓝蛤活性肽进行体外ACE抑制活性测定,结果表明其半抑制浓度为80 mg/mL,与目前已经阐明其活性的酶解产物相比具有作为ACE抑制肽开发的潜力。通过傅里叶红外光谱分析蓝蛤ACE抑制肽的空间结构,其光谱图见图5,由图5可知蓝蛤ACE抑制肽在1668 cm-1有强吸收峰,而在1200~1330 cm-1波数无强吸收峰,证明存在无规卷曲结构,而未形成稳定的α螺旋、β转角和β折叠结构。
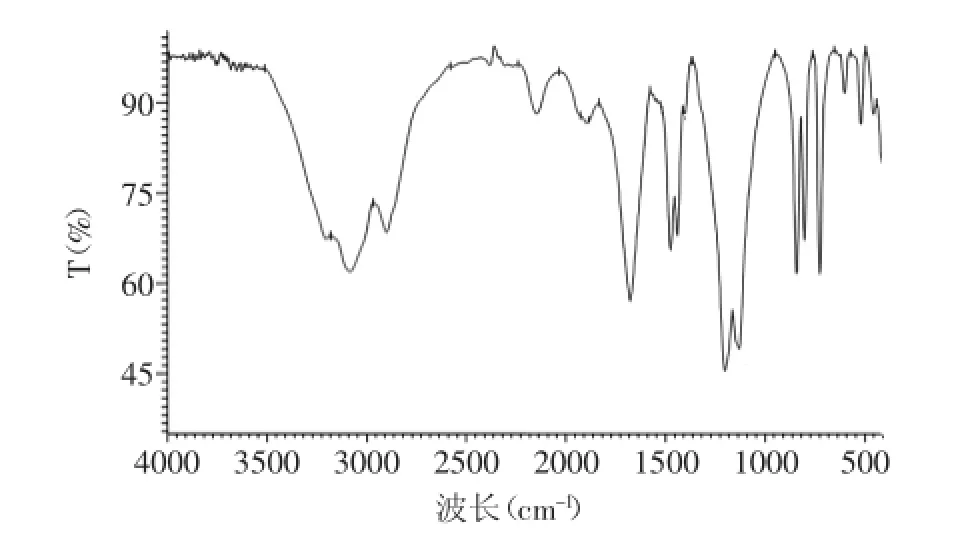
图5 蓝蛤ACE抑制肽红外光谱Fig.5 FTIR spectrum of ACE inhibitory peptides from blue calm
3 结论
以蓝蛤蛋白为原料,选用Protamex®蛋白酶进行酶解并获得最优酶解参数,即在底物浓度为10%,酶解pH为10,加酶量7%和酶解温度60℃条件下,酶解1 h所得的蓝蛤蛋白水解度为30.1%,利用高效液相色谱法对蓝蛤活性肽进行体外ACE抑制活性测定表明其半抑制浓度为80 mg/mL,且活性肽溶液以无规卷曲空间构型为主。
[1]吴海歌,刘发义,李光友.兰蛤营养成分的研究[J].黄渤海海洋,2001,19(3):82-86.
[2]肖如武,赵谋明.蓝蛤蛋白酶解液超滤分离特性的研究[J].食品与发酵工业,2010,36(5):23-27.
[3]于志鹏,赵文竹,密更,等.一种利用内源酶制备蓝蛤蛋白源ACE抑制肽:中国,201510074989.5[P].2015-05-26.
[4]Asoodeh A,Memarpoor Y M,Chamani J.Purification and characterisation of angiotensin I converting enzyme inhibitory peptides from lysozyme hydrolysates[J].Food Chemistry,2012,131:291-295.
[5]Jao C L,Huang S L,Hsu K C.Angiotensin-I-converting enzyme inhibitory peptides:inhibition mode,bioavailability,and antihypertensive effects[J].Biomedicine(Netherlands),2012,2:130-136.
[6]Liu Lijun,Zhu Chuanhe,Zhao Zheng.Analyzing molecular weight distribution of whey protein hydrolysates[J].Food and Bioproducts Processing,2008,86(C1):1-6.
[7]Wu JP,Aluko RE,Muir AD.Improved method for direct high-performance liquid chromatography assay of angiotensin convertingenzyme-catalyzedreactions[J].Journalof Chromatography A,2002,950:125-130.
[8]Liu J B,Yu Z P,Zhao W Z,et al.Isolation and identification of angiotensin-converting enzyme inhibitory peptides from egg white protein hydrolysates[J].Food Chemistry,2010,122(4):1159-1163.
[9]Yu Z P,Yin Y G,Zhao W Z,et al.Characterization of ACE-inhibitory peptide associated with antioxidant and anticoagulation properties[J].Journal of Food Science,2011,76(8):C1149-C1155.
[10]Yu Z P,Yin Y G,Zhao W Z,et al.Antihypertensive effect of angiotensin-converting enzyme inhibitory peptide rvpsl on spontaneously hypertensive rats by regulating gene expression of the renin-angiotensin system[J].Journal of Agricultural and Food Chemistry,2014,62:912-917.
[11]任露泉.实验优化设计与分析[M].北京:高等教育出版社,2003:440-442.
Enzyme hydrolysis preparation model of ACE inhibitory peptides from blue clam based on quadratic general rotation design
YU Zhi-peng1,CAI Jian-wen1,ZHAO Wen-zhu1,ZHANG Hong-yang1,WU Yu1,ZHANG Shuang1,LI Jian-rong1,*,LIU Jing-bo2,*
(1.College of Food Science and Engineering,Bohai University,National&Local Joint Engineering Research Center of Storage Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China;2.Lab of Nutrition and Functional Food,Jilin University,Changchun 130062,China)
Blue clam was hydrolyzed by protamex protease and measured by the degree of hydrolysis.The hydrolysis model of peptides from blue clam was established through quadratic general rotation design followed single factor experiment,subsequently ACE inhibitory activity and FTIR of blue clam-derived peptides was measured.The results showed that the equation for the optimal regression equation had a maximal value according to regression coefficient test,regression equation,and the lack of fit test.The optimal details of enzymatic hydrolysis was as follows:substrate concentration 10%,enzymatic hydrolysis pH value 10,the amount of enzyme 7%and hydrolysis temperature 60℃,and hydrolysis degree of blue clam protein was 30.1%in one hour.In vitro ACE inhibitory activity of bioactive peptides from blue clam was performed by high performance liquid chromatography,and the IC50value was 80 mg/mL.In addition,secondary structure of the blue calmderived peptides was random coil.
blue clam;bioactive peptide;enzymatic hydrolysis;angiotensin I-converting enzyme;general rotation design
TS201
A
1002-0306(2016)04-0250-05
10.13386/j.issn1002-0306.2016.04.042
2015-08-24
于志鹏(1984-),男,博士,讲师,研究方向:蛋白质及活性肽的功能研究与产品开发,E-mail:yuzhipeng20086@sina.com。
励建荣(1964-),男,博士,教授,研究方向:水产品加工,E-mail:lijr6491@163.com。刘静波(1962-),女,博士,教授,研究方向:营养与功能食品,E-mail:ljb168@sohu.com。
国家科技支撑课题(2012BAD00B03)。
