牡蛎肽锌螯合物的制备工艺研究
2016-09-14王海轩谷瑞增蔡木易中国食品发酵工业研究院北京市蛋白功能肽工程技术研究中心北京100015
刘 艳,鲁 军,陈 亮,王海轩,谷瑞增,蔡木易(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京100015)
牡蛎肽锌螯合物的制备工艺研究
刘 艳,鲁 军,陈 亮,王海轩,谷瑞增,蔡木易*
(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京100015)
分析牡蛎肽氨基酸组成及相对分子质量分布,并以牡蛎肽为原料、硫酸锌为锌源对牡蛎肽锌螯合物的制备工艺进行研究,通过测定锌离子螯合率和螯合物得率衡量螯合效果。结果表明,牡蛎肽相对分子质量小于1000 u的组分高达92.34%,富含谷氨酸和天冬氨酸这两种酸性氨基酸及其酰胺;保证螯合率及得率的最佳螯合条件为:肽与硫酸锌质量比为20∶1,肽浓度为0.06 g/mL,反应温度为50℃,沉淀剂乙醇为5倍反应液体积,pH5.33,反应时间60 min。在此条件下锌离子的螯合率为89.55%±0.23%,螯合物得率为56.64%±0.55%。
牡蛎,肽,锌,螯合物,制备工艺
锌是人体必需的微量元素之一,在人体生长发育、生殖遗传等重要生理过程中起到至关重要的作用。锌存在于DNA聚合酶、碱性磷酸酶等80多种代谢相关酶中,直接关系到核酸及蛋白质合成及代谢、细胞再生与分裂、细胞代谢[1]。人体缺乏锌元素时,会出现各种含锌酶活性及免疫功能降低的现象。我国居民普遍存在锌缺乏的问题,根据对19个省的调查表明,60%的学龄前儿童锌摄入量仅为正常值的50%左右,锌缺乏较为严重[2]。
近年来,以活性肽为原料,开发易于吸收利用、生理活性强的新型补锌剂,已成为热点研究问题。高红梅等[3]以小麦肽作为原料制备小麦肽锌螯合物,螯合率达84.25%;张全才[4]采用水解米蛋白肽作为原料制备补锌剂,螯合率达70.1%;Wang等[5]从芝麻蛋白水解物中鉴定出Ser-Met和Asn-Cys-Ser这两个活性肽段与锌离子以1∶1的比例结合为螯合物,并且证实水分子参与了螯合物的形成;Chen等[6]从牡蛎蛋白水解物中分离、鉴定出具有锌离子螯合能力的肽段结构HLRQEEKEEVTVGSLK。此外,研究表明肠道内存在特殊的肽的转运系统,其位于小肠上皮细胞的刷状缘膜[7]。与氨基酸相比,活性肽的吸收效率高且不易饱和[8]。
牡蛎肽是以牡蛎肉为原料,经过蛋白提纯、酶解、提纯等步骤加工制得,具有均衡的氨基酸组成的肽类混合物,其蛋白含量高、稳定性高、易于消化吸收。大量研究表明,牡蛎肽具有抗氧化[9]、抗菌[10]、降
血压[11]、免疫调节[12]等多种功能活性。
本研究首先对牡蛎肽原料组成进行分析,然后以硫酸锌作为锌源对牡蛎肽锌螯合物的制备工艺进行了研究,为新型活性肽补锌剂的开发以及牡蛎资源的利用奠定基础。
1 材料与方法
1.1 材料与仪器
牡蛎 市售;硫酸锌、硫脲、氟化氨、二甲酚橙、乙酸钠、冰醋酸、浓硫酸、抗坏血酸、乙二胺四乙酸二钠、无水乙醇、柠檬酸 北京化工厂,分析纯;木瓜蛋白酶、风味蛋白酶 诺维信生物技术有限公司;乙腈 美国Fisher公司,色谱纯;三氟乙酸 英国Alfa Aesar公司,分析纯;肽标准品 中国药品生物制品检定所。
AB104-N电子天平 梅特勒托利多公司;HW.SY21-KP4恒温水浴箱 北京市长风仪器仪表公司;S20P-K精密pH计 梅特勒托利多;3K-15离心机 德国Sigma公司;DHG-9075A电热恒温鼓风干燥箱 北京陆希科技有限公司;LC-20A高效液相色谱仪 日本岛津;氨基酸分析仪 德国Membrapure A300。
1.2 实验方法
1.2.1 牡蛎肽制备 将牡蛎去壳清洗,加水碾磨成牡蛎浆,去壳牡蛎与水的重量比为1∶1~1∶5;加入柠檬酸调整pH至5,在30℃条件下搅拌该牡蛎浆3 h,3000 r/min离心去除上清液,得到牡蛎渣料;将该牡蛎渣料以3∶1的水渣比加水进行混合、搅拌,调整pH 至8,加热至45℃,按每克牡蛎渣料加入50 U的风味蛋白酶和50 U的木瓜蛋白酶,酶解4 h,90℃加热灭酶15 min;将酶解液离心,转速为3000 r/min;然后对上清液进行蒸发浓缩,条件为蒸汽压(0.1±0.02)MPa,温度40~80℃、按照浓缩液总固含量10%~30%的比例加入活性炭粉进行脱色,并过滤、灭菌;用离心喷雾干燥器将上述脱色后的浓缩液进行干燥处理,条件为进口温度140~160℃,出口温度80~90℃,制成牡蛎活性肽粉。
1.2.2 氨基酸组成分析 依据GB/T 5009.124-2003《食品中氨基酸的测定》,使用氨基酸自动分析仪对牡蛎肽中的氨基酸组成进行分析。
1.2.3 相对分子质量分布分析 采用高效液相凝胶色谱法。样品用流动相溶解,经孔径为0.2 μm聚四氟乙烯膜过滤后进行液相检测。色谱条件:色谱柱:TSK gel G2000 SWXL 300 mm×7.8 mm;流动相:乙腈∶水∶三氟乙酸=45∶55∶0.1(体积比);检测波长:UV 220 nm;流速:0.5 mL/min;柱温:30℃;进样体积:10 μL;上样浓度:1 mg/mL。使用GPC软件进行数据处理。以五种肽标准品制作相对分子质量校正曲线,标准品为:乙氨酸—乙氨酸—乙氨酸(MW 189)、乙氨酸—乙氨酸—酪氨酸—精氨酸(MW 451)、杆菌酶(MW 1450)、抑菌肽(MW 6500)、细胞色素C (MW 12500)。
1.2.4 牡蛎肽锌螯合物的制备 称取一定质量的牡蛎肽粉和硫酸锌,分别用少量蒸馏水溶解后定容,得到一定浓度的牡蛎肽溶液和硫酸锌溶液。分别量取一定体积的两种溶液,混合均匀,并置于一定温度下反应至所需时间。冷却后,加入一定体积的无水乙醇,在7500 r/min的转速下离心15 min,除去上清液,并用无水乙醇洗涤离心1~2次。将沉淀物置于45℃电热鼓风干燥箱中烘干,得牡蛎肽锌螯合物。每组设置3个平行组,测定锌的螯合率及螯合物得率。
1.2.5 锌的螯合率及螯合物得率的测定计算 首先测定牡蛎肽锌螯合物中锌的质量,根据《GB 25579-2010食品安全国家标准食品添加剂硫酸锌》[13]中锌含量测定方法并进行改进。称取0.03~0.1 g牡蛎肽锌螯合物,置于50 mL锥形瓶中,加少量水润湿,滴加2滴50%(V/V)硫酸溶液溶解,加10 mL水、2 mL氟化氨饱和溶液、0.5 mL硫脲溶液(200 g/L)和0.04 g抗坏血酸,摇匀溶解后加入3 mL乙酸-乙酸钠缓冲溶液(pH5~6)和2滴二甲酚橙指示液(2 g/L),用乙二胺四乙酸二钠标准滴定溶液滴定由紫红色变为亮黄色为终点,同时做空白实验。
试样中锌质量X(g)按下式计算:

式中:V1—滴定试样溶液所消耗的乙二胺四乙酸二钠标准滴定溶液体积,mL;V2—滴定空白溶液所消耗的乙二胺四乙酸二钠标准滴定溶液体积,mL;C—乙二胺四乙酸二钠标准滴定溶液的浓度,mol/L;65.39—锌的相对分子质量。
锌的螯合率及螯合物得率按照以下公式计算。
锌的螯合率(%)=W1/W0×100
式中:W0—反应体系中锌的总质量,g;W1—螯合物中锌的总质量,g。
螯合物得率(%)=W3/W2×100
式中:W2—初始反应物的总质量,g;W3—反应后牡蛎肽锌螯合物的总质量,g。
1.2.6 单因素实验及正交实验 实验中对牡蛎肽与硫酸锌质量比、牡蛎肽浓度、反应温度、反应pH、反应时间、沉淀剂乙醇用量进行单因素实验。牡蛎肽与硫酸锌质量比对螯合反应的影响实验:质量比分别为1∶1、4∶1、8∶1、12∶1、16∶1、20∶1、24∶1、28∶1、32∶1,肽质量浓度0.04 g/mL,温度60℃,pH5.33,反应时间60 min,沉淀剂为反应液体积的1倍。牡蛎肽浓度对螯合反应的影响实验:肽质量浓度分别为0.02、0.04、0.06、0.08、0.1 g/mL,肽与硫酸锌质量比为20∶1,温度60℃,pH5.33,反应时间60 min,沉淀剂为反应液体积的1倍。温度对螯合反应的影响实验:反应温度分别为30、40、50、60、70℃,肽与硫酸锌质量比为20∶1,肽质量浓度0.04 g/mL,pH5.33,反应时间60 min,沉淀剂为反应液体积的1倍。pH对螯合反应的影响实验:反应pH分别为5.33、5、4、3,肽与硫酸锌质量比为20∶1,肽质量浓度0.04 g/mL,温度50℃,反应时间60 min,沉淀剂为反应液体积的1倍。时间对螯合反应的影响实验:反应时间分别为20、40、60、80 min,肽与硫酸锌质量比为20∶1,肽质量浓度0.04 g/mL,温度50℃,pH5.33,沉淀剂为反应液体积的1倍。沉淀剂乙醇用量对螯合反应的影响实验:乙醇用量分别为反应液体积的0、1、2、3、4、5、6倍,肽与硫酸锌质量比为20∶1,
肽质量浓度0.04 g/mL,温度50℃,pH5.33,反应时间60 min。
在单因素实验基础上确定正交实验的因素及水平,选用L9(34)正交表进行正交实验,实验设计见表1,确定最佳的螯合制备工艺。

表1 正交实验设计表Table1 Design of the orthogonal experiment
1.3 数据处理
实验数据使用SPSS 19.0软件进行统计处理,组间比较采用t检验,若p<0.05,两者有显著性差异;若p<0.01,两者有极显著性差异。
2 结果与分析
2.1 牡蛎肽成分分析
对按方法1.2.1制得的牡蛎肽进行氨基酸含量及相对分子质量分布分析,结果见表2和表3。

表2 牡蛎肽氨基酸含量Table2 Amino acid composition of oyster peptide
肽类与锌离子螯合能力与其氨基酸组成密切相关,Jiang等[14]指出酸性氨基酸含量较高的肽段与锌离子的结合能力更强。牡蛎肽氨基酸含量测定结果显示,谷氨酸、天冬氨酸这两种酸性氨基酸及其酰胺含量较高,其中谷氨酸及其酰胺(Gln+Glu)含量最高,占10.981%;天冬氨酸及其酰胺(Asp+Asn)占8.369%。

表3 牡蛎肽相对分子质量分布情况Table3 Relative molecular weight distribution of oyster peptide
表3结果表明,牡蛎肽主要由小分子肽段构成。相对分子质量小于1000 u的组分占92.34%,其中500~1000 u的组分占22.61%,140~500 u的组分占54.63%。按照氨基酸平均相对分子质量为137 u计算,牡蛎肽主要由八肽以下的小分子肽段构成,并且二肽和三肽所占比例最高。研究表明,小肽的吸收效率比氨基酸高,更容易被人体吸收利用,进而发挥其多种功能活性[15]。
2.2 牡蛎肽锌制备单因素实验
2.2.1 牡蛎肽与硫酸锌质量比对螯合反应的影响 由图1可知,牡蛎肽与硫酸锌的质量比对螯合反应的影响很大。在牡蛎肽与硫酸锌质量比为1∶1至32∶1范围内,锌的螯合率随质量比的增大而增大,当比值为20∶1时,螯合率达75.58%,比值继续增大时,螯合率达89%。螯合物得率测定结果显示,随牡蛎肽与硫酸锌质量比的增大出现下降的趋势,比值为8∶1至20∶1范围内,得率为17%~15%,当比值继续增大时,得率降低至13%以下。由上述结果可知,当肽与锌盐质量比过低时,锌离子的螯合率较低,造成锌源的浪费;比值过大时,螯合物的得率较低,造成牡蛎肽原料的浪费。因此,比值在20∶1左右比较合适,选择此质量比作为后续实验条件。
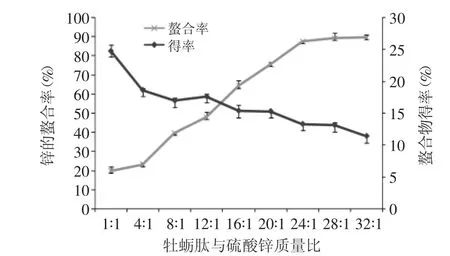
图1 牡蛎肽与硫酸锌的质量比对螯合反应的影响Fig.1 Effect of mass ratio of oyster peptide to ZnSO4on chelating reaction

图2 牡蛎肽浓度对螯合反应的影响Fig.2 Effect of the concentration of oyster peptide on chelating reaction
2.2.2 牡蛎肽浓度对螯合反应的影响 由图2可知,牡蛎肽浓度对螯合反应的影响较大。牡蛎肽浓度过
低或过高时,螯合率均较低,当浓度为0.04、0.06、0.08 g/mL时,螯合率分别为78.18%、75.23%、73.28%,此时得率分别为13.87%、13.92%、14.63%,为较合适的浓度范围。选择0.04 g/mL作为后续实验条件。
2.2.3 温度对螯合反应的影响 由图3可知,反应温度主要影响锌离子的螯合率,而对螯合物得率影响较小。在40、50、60℃下,螯合率较高,并且在50℃时,螯合率达到最高,为77.18%。螯合物得率检测结果显示,40、50、60℃下得率均在13%~14%范围内。选择螯合率最高的50℃进行后续实验。
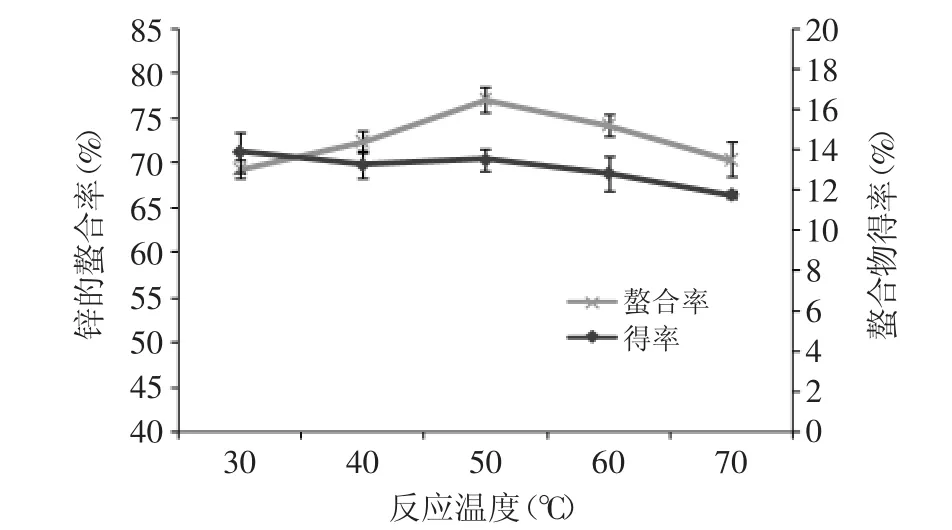
图3 反应温度对螯合反应的影响Fig.3 Effect of temperature on chelating reaction
2.2.4 pH对螯合反应的影响 在肽浓度为0.04 g/mL、肽与硫酸锌质量比为20∶1条件下,不经pH调节,反应液的pH为5.33。加碱会导致氢氧化锌沉淀生成,不利于螯合物的制备;pH太低,过多的氢离子会取代金属离子,影响螯合物的形成,此时螯合率及得率均较低。因此,将肽溶液与硫酸锌溶液混合后的pH即为反应适宜条件,不宜进行pH调节。

图4 反应pH对螯合反应的影响Fig.4 Effect of pH on chelating reaction
2.2.5 时间对螯合反应的影响 由图5可知,反应时间对锌离子的螯合率有显著影响,而对螯合物得率影响较小。在20~60 min内,随时间的增加锌的螯合率增加,在60 min时为77.14%,此时得率为13.65%。选择60 min作为后续反应时间。
2.2.6 沉淀剂乙醇用量对螯合反应的影响 在牡蛎肽与硫酸锌质量比为20∶1,牡蛎肽浓度为0.04 g/mL条件下,沉淀剂乙醇用量对锌离子螯合率及螯合物得率影响很大。由图6可知,随乙醇用量的增加螯合率及产物得率都随之增加,在乙醇用量为反应液体积的4倍、5倍及6倍时,锌离子螯合率分别为85.81%、86.53%、86.43%,产物得率分别为41.59%、45.48%、44.64%。选择螯合率及得率较高的沉淀剂乙醇用量(4、5、6倍)作为正交实验条件。
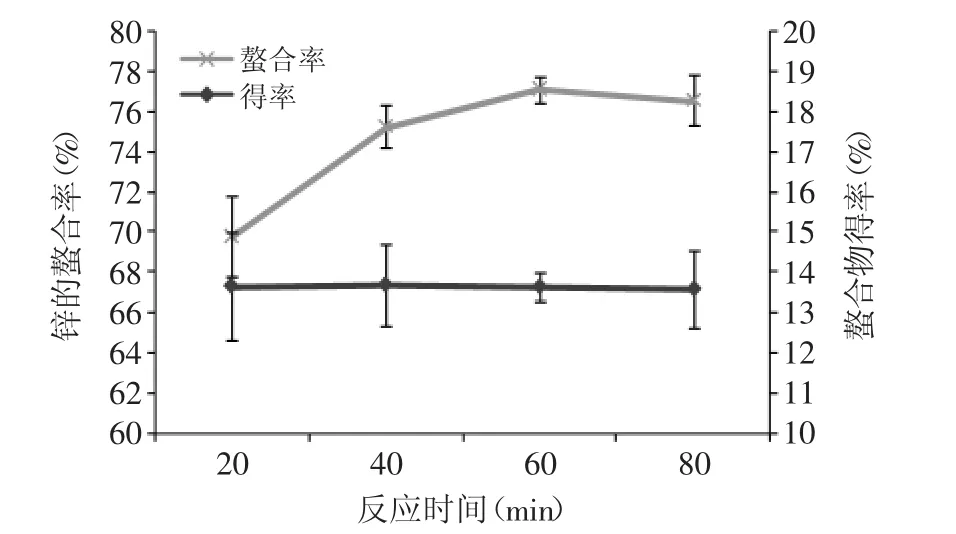
图5 反应时间对螯合反应的影响Fig.5 Effect of time on chelating reaction

图6 沉淀剂乙醇用量对螯合反应的影响Fig.6 Effect of the dosage of precipitating agent(ethanol)on chelating reaction
2.3 牡蛎肽锌制备正交实验
根据单因素实验结果,对牡蛎肽与硫酸锌质量比、牡蛎肽浓度、反应温度、沉淀剂乙醇用量这四个因素进行L9(34)正交实验,结果见表5。
由表5可知,影响锌的螯合率的因素主次顺序是A>D>B>C,即肽与硫酸锌质量比>沉淀剂乙醇用量>牡蛎肽浓度>反应温度;影响螯合物得率的因素主次顺序为D>B>A>C,即沉淀剂乙醇用量>牡蛎肽浓度>肽与硫酸锌质量比>反应温度。最佳实验方案是D2B2A2C2,即肽与硫酸锌质量比为20∶1,肽浓度为0.06 g/mL,反应温度为50℃,沉淀剂乙醇为5倍反应液体积,在此条件下锌离子的螯合率为89.55%±0.23%,得率为56.64%±0.55%。
3 结论
本研究结果表明,牡蛎肽属于小分子肽段混合物,其中相对分子质量小于1000 u的组分占92.34%,蛋白质含量高,富含酸性氨基酸。通过单因素实验及正交实验,确定保证螯合率和得率的适宜方案,即肽与硫酸锌质量比为20∶1,肽浓度为0.06 g/mL,反应温度为50℃,反应时间为60 min,沉淀剂乙醇为5倍反应液体积,在此条件下锌离子的螯合率为89.55%± 0.23%,得率为56.64%±0.55%。该制备工艺过程中无有害物质参加和产生、操作简单、成本低廉。
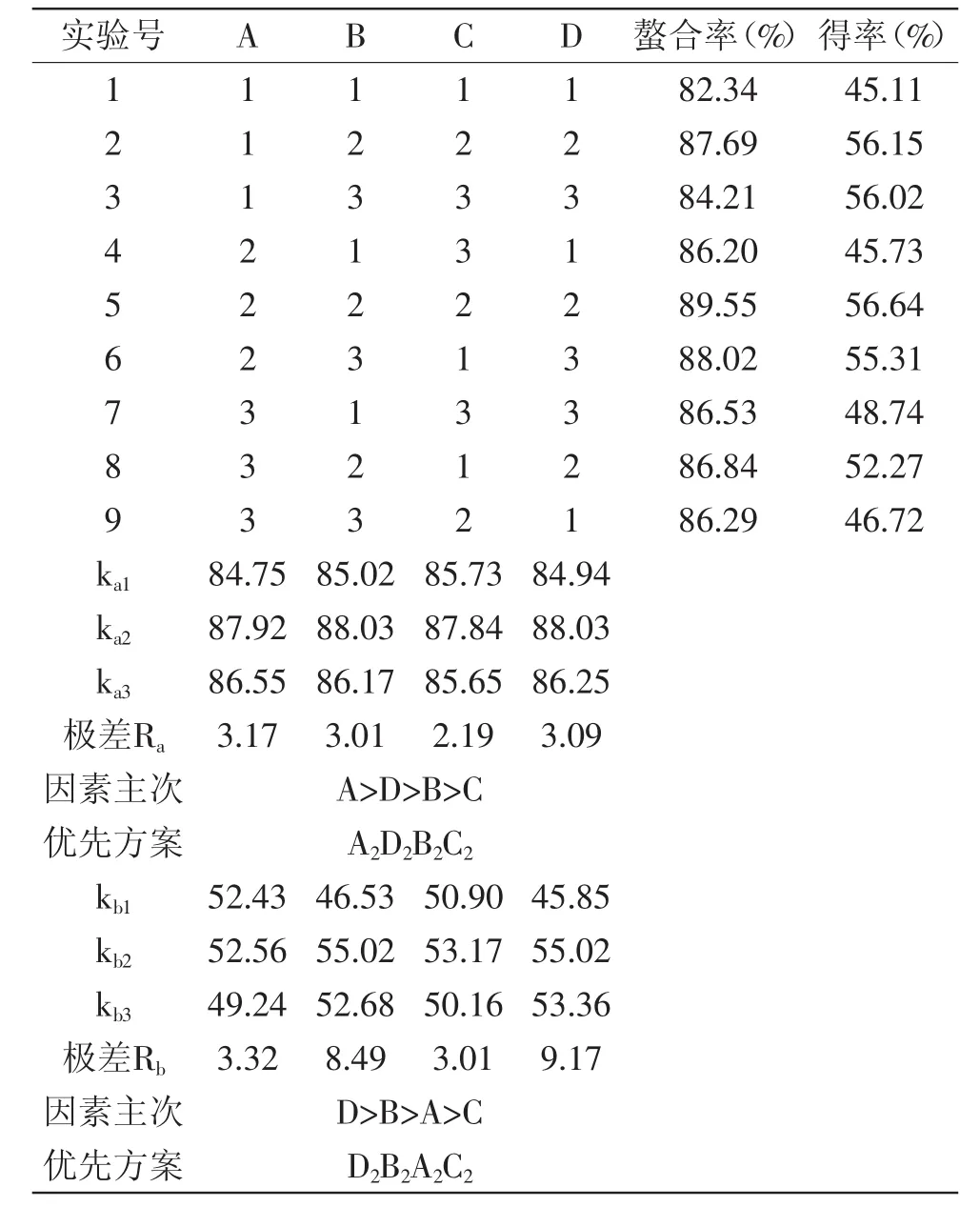
表5 正交实验结果Table5 Result of the orthogonal experiment
牡蛎肽螯合锌作为有机锌,相比无机锌具有高效、安全、稳定的特点,并且在补充微量元素的时候同时可补充具有多项功能的活性肽,全面强化牡蛎肽锌螯合物的生理功效,将具有良好的应用前景。今后,牡蛎肽锌螯合物的结构及生理功能还有待进一步研究。
[1]李青仁,周晓光,孙丽敏.锌的生理功能与人体健康的关系[C].中国微量元素科学研究会.中国微量元素科学研究会第三届会员代表大会暨第十一届学术研讨会会议论文集.海口:2004:12-16.
[2]曹继琼,何长华.锌缺乏对人体健康的影响[J].现代医药卫生,2014,30(7):1016-1019.
[3]高红梅,桑宏庆,李淑贤.小麦肽-锌螯合物的制备[J].饮料工业,2013,16(7):23-27.
[4]张全才.米蛋白肽锌的制备工艺及产品特性研究[D].南昌:南昌大学,2007.
[5]WANG Chan,LI Bo,LI Haixia.Zn(II)chelating with peptides found in sesame protein hydrolysates:Identification of the binding sites of complexes[J].Food Chemistry,2014,165:594-602.
[6]CHEN Da,LIU Zunying,HUANG Wenqian,et al.Purification and characterisation of a zinc-binding peptide from oyster protein hydrolysate[J].Journal of Functional Foods,2013,5(2):689-697.
[7]曹文红,章超桦.生物活性肽的吸收机制[J].药物生物技术,2006,13(5):384-388.
[8]HELLWIG M,GEISSLER S,PETO A,et al.Transport of free and peptide-bound pyrraline at intestinal and renal epithelial cells[J].Journal of Agricultural and Food Chemistry,2009,57 (14):6474-6480.
[9]WANG Qiukuan,LI Wei,HE Yunhai,et al.Novel antioxidative peptides from the protein hydrolysate of oysters(Crassostrea talienwhanensis)[J].Food Chemistry,2014,145:991-996.
[10]LIU Zunying,DONG Shiyuan,LIU Jie,et al.Production of cysteine-rich antimicrobial peptide by digestion of oyster (Crassostrea gigas)with alcalase and bromelin[J].Food Control,2008,19(3):231-235.
[11]WANG Jiapei,HU Jianen,CUI Jinzhe,et al.Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J].Food Chemistry,2008,111 (2):302-308.
[12]蔡冰娜,吴园涛,孙恢礼.牡蛎肽肠内营养制剂对小鼠免疫功能的影响[J].时珍国医国药,2010,21(11):2816-2818.
[13]GB 25579-2010,食品安全国家标准食品添加剂硫酸锌[S].
[14]JIANG Liangping,WANG Bo,LI Bo,et al.Preparation and identification of peptides and theirzinc complexes with antimicrobial activities from silver carp(Hypophthalmichthys molitrix)protein hydrolysates[J].Food Research International,2014,64:91-98.
[15]蔡木易.食源性肽研究进展[J].北京工商大学学报:自然科学版,2012,30(5):1-10.
Preparation of oyster peptide-zinc chelates
LIU Yan,LU Jun,CHEN Liang,WANG Hai-xuan,GU Rui-zeng,CAI Mu-yi*
(Beijing Engineering Research Center of Protein&Functional Peptides,China National Research Institute of Food and Fermentation Industries,Beijing 100015,China)
The oyster peptides were characterized according to their amino acid composition and molecular weight distribution,and the preparation conditions of the peptides-zinc chelates were analyzed.Oyster peptides and zinc sulfate were the raw materials,and chelating effect was determined by chelating ratio of zinc and the yield of the peptide-zinc chelates.The results revealed that oyster peptides were composed of 92.34% peptides with a molecular size under 1000 u,and rich in glutamic acid and glutamine,aspartic acid and asparagines.Moreover,the optimal condition of the chelating reaction was as follow:the mass ratio of peptides to ZnSO4was 20∶1,the concentration of peptides was 0.06 g/mL,the reaction temperature was 50℃,the dosage of precipitating agent(ethanol)was 5 times as much as reaction liquid,the pH value was 5.33,and the reaction time was 60 min.Under the optimal chelating conditions,the chelated zinc ratio reached 89.55%± 0.23%,and the productive index of the peptide-zinc chelates was 56.64%±0.55%.
oyster;peptide;zinc;chelate;preparation technology
TS202.1
B
1002-0306(2016)08-0257-05
10.13386/j.issn1002-0306.2016.08.045
2015-07-02
刘艳(1986-),女,硕士,工程师,研究方向:功能性食品,E-mail:liuyan39259@163.com。
*通讯作者:蔡木易(1962-),男,教授级高级工程师,研究方向:功能性食品,E-mail:caimuyi@vip.sina.com。
北京市科技计划项目(Z131100003113010);国家十二五科技支撑项目(2012BAD33B04-02);国家高技术研究发展计划(863计划)项目(2013AA102205-02);科技北京百名领军人才培养工程项目(Z131110000513026)。
