响应面法优化林蛙皮中透明质酸的提取工艺
2016-09-14袁海恋施溯筠延边大学药学院吉林延吉133002
袁海恋,施溯筠(延边大学药学院,吉林延吉133002)
响应面法优化林蛙皮中透明质酸的提取工艺
袁海恋,施溯筠*
(延边大学药学院,吉林延吉133002)
以中国林蛙皮为原料,用透明质酸提取得率作为衡量提取工艺的指标。在单因素实验的基础上,在料液比1∶40(g/mL)的条件下,利用Box-Benhnken中心组合设计原理和响应面分析法探索了双酶(碱性蛋白酶+胰蛋白酶)水解的酶解温度、酶解时间(h碱性蛋白酶=h胰蛋白酶)、加酶量(碱性蛋白酶∶胰蛋白酶=1∶1)3个因素作为自变量及其交互作用对响应值透明质酸得率的影响,模拟得到二次多项式回归方程的预测模型,并确定最佳提取工艺条件为加酶量55000 U/g、酶解时间14 h、酶解温度50℃,在此条件下,平均透明质酸提取得率为27.6839 mg/g,葡萄糖醛酸的含量为13.8420 mg/g,转化成百分含量为42.2%。说明响应面优化双酶法提取林蛙皮透明质酸条件准确可行。
林蛙皮,透明质酸,响应面分析法,酶解提取
透明质酸(hyaluronic acid,简称HA)又名玻璃酸,是一种线性大分子黏多糖,存在于动物的各种组织细胞间质中,该物质在1934年首次从牛眼玻璃体中分离出来[1]。早期用来提取HA的材料主要为牛玻璃体、脐带、公鸡鸡冠等,但由于其获取困难,使其生产成本增加,且近年来陆生生物不断发生各种疫情,如禽流感、疯牛病,使得利用这些生物组织为原料提取的HA在应用中存在一定风险。因此研究利用相对安全的两栖类生物组织作为提取HA的原料具有较大的实际价值。中国林蛙(Rana chensinensis David)是一种珍贵的两栖类药用经济动物,其中哈蟆油很早就收入中国药典,在民间利用历史悠久,有很高的药用、营养价值[2]。林蛙皮作为生产哈蟆油的副产品来源广泛,成本较低;而且与猪皮中粗脂肪含量达到
10%相比[3],林蛙皮中脂肪含量2.499%[4]明显较少,这使得前期处理相对简单,降低了成本。
HA水溶液所形成凝胶的独特网状结构和分子内羟基氢键使其具有极好的保水性和流变特性,因而被广泛应用于医学、化妆品等领域[5]。透明质酸的提取方法一般采用中性盐提取法和水提取法,但提取得率较低。目前,酶法提取因其高效性、温和性等优点广泛使用。因此,本实验以林蛙皮为原料,对酶解过程中的温度、时间、加酶量等条件进行研究,运用响应面分析法优化林蛙皮中透明质酸提取工艺。旨在为今后林蛙皮中透明质酸的大规模生产和其产品的深加工提供可行性依据,对林蛙皮的综合利用及新产品的开发提供基础研究资料。
1 材料与方法
1.1 材料与仪器
新鲜林蛙皮 长白山辉煌生物科技有限公司提供,于-80℃冷冻备用;碱性蛋白酶(20万U/g)、咔唑 上海源叶生物科技有限公司;胰蛋白酶 <5万U/g,国药集团化学试剂有限公司;氯化十六烷基吡啶(CP)、浓硫酸、四硼酸钠、无水乙醇、95%乙醇、氯化钠、盐酸、氢氧化钠 均为分析纯。
UV-2201型紫外-可见分光光度计 日本岛津公司;D2F-6090真空烘箱 上海精宏实验设备有限公司;HH-6型数显恒温水浴锅 金坛市科技仪器有限公司;FA-2004电子天平 上海良平仪器仪表有限公司;FA25高剪切分散乳化机 上海FLUKO弗鲁克流体机械制造有限公司;Z-36HK高速台式离心机 天津市医疗器械厂;雷磁PHSJ-4F型pH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 提取工艺 林蛙皮经过高剪切分散乳化机剪切后过60目筛,再与0.2 mol/L NaCl溶液以一定比例相溶,并将料液加热至95℃维持20 min后迅速冷却至室温。7000 r/min离心10 min取上清液,调pH为8.5[6]先加入碱性蛋白酶水解。酶解结束后,6000 r/min离心7 min取上清液,调pH为8.5再加入胰蛋白酶水解。6000 r/min离心7 min取上清液,再向其中加入等体积的1%氯化十六烷基砒啶(CP)[7],静置6~8 h,收集多糖与CP络合沉淀,并将其加入0.4 mol/L NaCl溶液中,搅拌均匀,解离6~8 h。调节解离液pH6.0~6.5,向其中加入3倍体积95%乙醇沉淀,充分搅拌促进沉淀反应的发生,待沉淀物充分集中后,7000 r/min离心10 min收集沉淀,用无水乙醇脱水3~5次,再进行真空干燥即得到HA精品。
1.2.2 透明质酸含量测定 采用Bitter-Muir咔唑法[8]测定葡萄糖醛酸的含量,葡萄糖醛酸在HA化合物中的含量为46.43%,通过换算,即可知最佳工艺得到的HA精品的含量。
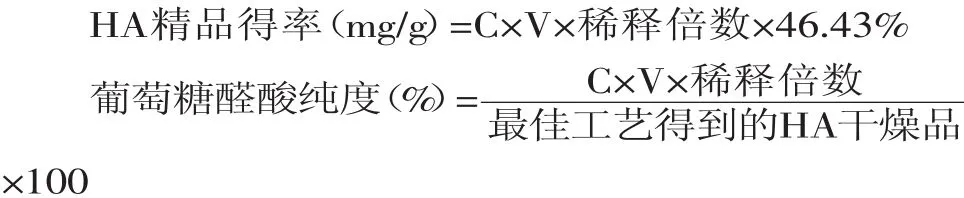
其中,C:经过标准曲线算得的葡萄糖醛酸的浓度,mg/g;V:测量吸光度时所用体积,mL。
1.2.3 单因素实验
1.2.3.1 料液比对HA得率的影响 在酶解温度50℃,酶解时间6 h+6 h,酶用量(胰蛋白酶∶碱性蛋白酶=1∶1)55000 U/g的条件下,在适宜的pH8.5的条件下进行,选取料液比为1∶10、1∶20、1∶30、1∶40、1∶50五个水平进行单因素实验,研究不同料液比对林蛙皮HA得率的影响,确定最佳料液比。
1.2.3.2 加酶量对HA得率的影响 在料液比1∶40,酶解温度50℃,适宜的pH8.5,酶解时间6 h+6 h,酶用量(胰蛋白酶∶碱性蛋白酶=1∶1)分别为25000、35000、45000、55000、65000 U/g的条件下进行实验,研究酶用量对林蛙皮HA得率的影响,确定最佳酶用量。
1.2.3.3 酶解时间对HA得率的影响 在料液比1∶40,酶解温度50℃,酶用量(胰蛋白酶∶碱性蛋白酶=1∶1)55000 U/g的条件并在适宜的pH8.5的条件下进行,两种酶水解时间比1∶1,选取水解总时间为6、8、10、12、14 h,研究酶解时间对林蛙皮HA得率的影响,确定最佳酶解时间。
1.2.3.4 酶解温度对HA得率的影响 在料液比1∶40,酶解时间6 h+6 h,酶用量(胰蛋白酶∶碱性蛋白酶=1∶1)55000 U/g的条件下,在适宜的pH8.5的条件下进行,选取酶解温度为30、40、50、60、70℃五个水平进行单因素实验,研究酶解温度对林蛙皮HA得率的影响,确定最佳酶解温度。
1.2.4 响应面实验 响应面实验因素水平表见表1。

表1 响应面分析因素及水平Table1 Factors and levels in the response surface experiments
1.3 数据处理
所有数据采用3次平行实验的平均值。响应曲面模型的回归方程式和显著性统计通过Design-Expert 8.0.6软件进行计算和分析处理[9-12],系数的显著性通过F检验和p值进行分析。
2 结果与分析
2.1 HA含量及纯度测定
图1所得标准曲线回归方程为:y=0.22x-0.0126,相关系数R2=0.9997,说明标准品葡糖醛酸在1.0~5.0 mg/mL浓度范围内具有良好的线性关系。
2.2 提取HA单因素实验
2.2.1 料液比单因素实验 如图2所示,在料液比1∶40之前,HA得率随着料液比的增大而增加;在料液比为1∶40时,得率最大达26.2 mg/g;随后得率变化趋于平缓,并伴有下降趋势。这可能是因为林蛙皮HA几乎被全部溶出后,过多加入的溶剂增大了其他杂质的大量溶出,还会使浓缩过程中HA损失增大,从
而导致HA得率有所降低,因此选取料液比为1∶40。

图1 葡萄糖醛酸的标准曲线Fig.1 Standard curve of glucuronic acid

图2 料液比对HA得率的影响Fig.2 The effect of ratio of liquid to solid on the yield of HA
2.2.2 加酶量单因素实验 如图3所示,随着加酶量的增加,HA得率呈逐渐上升趋势。加酶量小于55000 U/g时,得率随加酶量增加而增加,之后随加酶量的增大得率反而略有下降。这可能因为加酶量在55000 U/g条件下,酶浓度已趋于饱和,HA几乎完全被释放出来。继续增加酶量,由于酶的本质也是蛋白质,过多的酶可能会与融出的HA结合,反而使HA得率降低,因此选择酶用量为55000 U/g。

图3 加酶量对HA得率的影响Fig.3 The effect of total enzyme amount on the yield of HA
2.2.3 酶解时间单因素实验 如图4所示,随着酶解时间的增加,在低于12 h时HA的得率逐渐增加,当高于12 h后HA的得率呈现下降趋势。这可能是由于随着酶解时间的增加,HA有一部分开始降解,同时其他成分也可能开始溶出,因此选取酶解时间12 h。

图4 酶解时间对HA得率的影响Fig.4 The effect of enzyme hydrolysis time on the yield of HA

图5 酶解温度对HA得率的影响Fig.5 The effect of enzyme hydrolysis temperature on the yield of HA
2.2.4 酶解温度单因素实验 如图5所示,随着酶解温度的不断升高,酶促反应逐渐加快,当酶解温度为50℃时,达到林蛙皮HA的得率最高值为26.88 mg/g,之后随着酶解温度的进一步升高,HA得率反而降低。这是由于酶的本质是一种蛋白质,超过最适温度后会因逐渐变性而失去活性,所以导致林蛙皮HA的得率降低,因此选取提取温度为50℃。
2.3 响应面法提取HA条件的优化
2.3.1 响应面实验设计及结果 在单因素实验的基础上,确定提取料液比为1∶40。响应面实验结果见表2。
2.3.2 建立模型方程与显著性检验 对表2的数据进行处理,得到表3回归方程方差分析表,利用软件Design-Expert 8.0.6进行非线性回归的二次多项式拟合,得到预测模型如下:
Y=26.02+1.15A+0.33B+0.29C-0.24AB+0.32AC+0.16BC-5.14A2+1.06B2-7.98C2,其中Y为HA得率。
表3为回归分析结果,回归方差分析显著性检验表明,该模型回归显著(p<0.0001),失拟项p=0.7820>0.05不显著,并且该模型的总决定系数R2=0.9981,调整决定系数R=0.9956,说明该模型的拟合程度良好,实验误差小,自变量与响应值之间线性关系显著,因此该回归模型成立,可以用此模型对酶解提取林蛙皮中HA得率进行分析及预测。
各因素的p值可以反映出各因素对实验指标的重要性,p值越小,表明对实验指标的影响越大,即重要性越大。从方差分析表可知:加酶量(A)的p<0.0001达到极显著水平;酶解时间(B)的p=0.0273和酶解温度(C)的p=0.0472有统计显著性,即各因素对透明质酸提取得率的影响顺序:加酶量(A)>酶解时间(B)>酶解温度(C)。二次项中AB、AC、BC三项的p值均大于0.05,说明因素之间的交互作用不显著,表明各实验因素对响应值的影响不是简单的线性关系。而二次项中,A2、B2、C2三项的p值均小于0.001,说明三项的影响极显著。

表2 响应面实验设计及结果Table2 Response surface layout design and experimental result

表3 回归方程模型方差分析表Table3 Analysis of variance for the developed regression equation
2.3.3 响应面分析 根据回归方程,做出响应面分析图(见图6),考察所拟合的响应面曲面的形状,分析加酶量、酶解时间、酶解温度对HA得率的影响,各因素对响应值的影响可以通过各图直观反映出来。
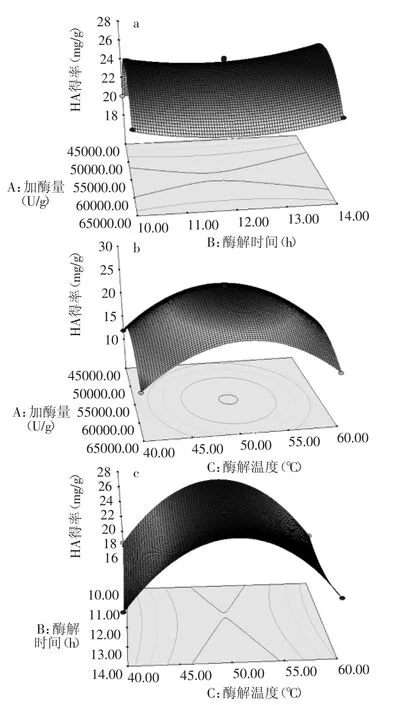
图6 加酶量、酶解时间和酶解温度对HA得率影响的响应面图Fig.6 Response surface maps of add enzyme amount,enzyme hydrolysis time,enzyme hydrolysis temperature on the yield of HA
如图6所示,从响应面的最高点可以看出在所选的范围内存在极值,A与B、A与C、B与C之间交互作用都不显著,它们对Y值的影响规律并不会随着另一因素的改变而有明显变化。三个因素对Y值的影响以及各因素之间的交互影响与表3方差分析结果一致。
2.3.4 最优条件的确定 根据所得到的模型,对响应面结果利用Design-expert 8.0.6软件进行优化分析,以HA得率为评价指标,得到相应的提取优化工艺条件:酶解时间14.00 h,酶解温度50.29℃,加酶量为55886.78 U/g。为检验响应面分析法所得结果的可靠性,采用上述优化条件进行林蛙皮HA的提取实验,考虑到实际情况,将修正后提取HA的最佳工艺条件定为加酶量55000 U/g,酶解时间14 h,酶解温度50℃,在此条件下,平行重复实验3次,得到HA平均得率为27.6839 mg/g(RSD=0.89%),与预测值27.4568 mg/g相对误差约为0.85%,与预测值非常接近,说明响应面优化双酶法提取林蛙皮透明质酸条件准确可行。此外,由Bitter咔唑法测得最佳工艺得到的HA精品中葡萄糖醛酸的吸光度为0.597,由标准曲线方程算得葡萄糖醛酸的含量为13.8420 mg/g,转化成百分含量为42.2%。
3 讨论与结论
以新鲜林蛙皮为原料,采用复合酶解法提取HA得率为27.6839 mg/g,与传统的水提醇沉法HA得率14.7 mg/g[3]及单酶提取法HA得率12 mg/g[13]相比,HA提取得率都有显著提高。本实验使用碱性蛋白酶和胰蛋白酶复合酶法提取HA,碱性蛋白酶的催化环境pH碱性较强,HA不断被分解,而胰蛋白酶的催化环境为中性,游离的HA不会被降解。尽管HA在碱性蛋白酶的催化环境中会分解,但胰蛋白酶催化能力较弱,单酶水解林蛙皮得到的HA仍然小于双酶法,所以先使用碱性蛋白酶初步水解林蛙皮,然后在中性pH下用胰蛋白酶进一步水解林蛙皮,则可获得更高得率的HA。
经过最佳工艺分离提取的HA精品中葡萄糖醛酸的含量为42.2%,目前国内外一般以葡糖醛酸含量表示HA的纯度,保健食品及化妆品级HA的葡糖醛酸含量为35%~45%,药用级为42%~48%[14]。本研究分离提纯的透明质酸其纯度完全达到了食品和化妆品的要求,该产品无毒无害,安全性高。
采用双酶酶解林蛙皮的方法提取透明质酸,通过单因素实验和Box-Behnken中心组合设计原理以及响应面分析法对提取工艺进行优化,拟合了加酶量、酶解时间、酶解温度这3个因素对HA得率的回归模型,经检验该模型合理可靠,能较好地预测林蛙皮中透明质酸的提取得率。又该模型确定的最佳工艺条件为加酶量55000 U/g,酶解时间14 h,酶解温度50℃,在此条件下,得到林蛙皮HA平均得率为27.6839 mg/g;通过模型系数显著性检验,得到因素的主效应关系为:加酶量>酶解时间>酶解温度。本工艺提高了HA的提取得率,而且与其他动物组织相比,从林蛙皮中提取的HA更加优良,为林蛙皮的进一步综合开发和利用提供新的参考依据。
[1]Meyer K,Palmer JW.The polysaccharide of the vitreous humor [J].Journal of Biological Chemistry,1934,107(3):629-634.
[2]胡鑫,刘成柏,陈晓平,等.林蛙油中主要营养保健成分含量的研究[J].吉林农业大学学报,2003,25(2):218-220.
[3]陈丽清,陈清,韩佳冬,等.猪皮超声波乳化脱脂工艺的研究[J].食品工业科技,2012,33(16):265-267,272.
[4]刘丹,姜大成.林蛙皮化学成分分析及抗氧化活性研究[D].长春:长春中医药大学,2013.
[5]Lapcik LJ,Lapick L,Demeeter J,et al.Hyaluronan:Preparation,Structure,Properties and Applications[J].Chemical Reviews,2002,8(98):2663-2684.
[6]沙坤,王大为.中国林蛙皮透明质酸提取技术的研究[D].长春:吉林农业大学,2004.
[7]皮钰珍,李佳音,贺亮.双酶复合法提取蛋壳膜中透明质酸的研究[J].食品与机械,2011,27(4):40-42,47.
[8]Bitter T,Muir HM.A modified uronic acid carbazole reaction [J].Analytical Biochemistry,1962,4(4):330-334.
[9]贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2011,32(2):79-83.
[10]徐逯,叶立斌,于平,等.东洋海参多糖酶解提取工艺优化[J].食品科学,2010,31(20):63-65.
[11]侯军,林晓民,李瑛,等.响应面法优化杏鲍菇菌糠多糖提取工艺[J].食品科学,2010,31(24):155-158.
[12]袁志发,周静芋.实验设计与分析[M].北京:高等教育出版社,2000:381.
[13]赵玉红,韩琳琳,迟玉杰.酶法提取鸡蛋壳膜中透明质酸的研究[J].食品研究与开发.2008,29(1):40-43.
[14]凌沛学.透明质酸[M].北京:中国轻工业出版社,2000:11-15.
Optimization of extraction process for hyaluronic acid from Rana chensinensis by response surface methodology
YUAN Hai-lian,SHI Su-yun*
(Collage of Pharmacy,Yanbian University,Yanji 133002,China)
With Rana chensinensis David skin as the research object,the hyaluronic acid(HA)rate was set as a measure indicator.Under the condition of solid-liquid ratio 1∶40(g/mL),three extraction parameters including enzyme temperature,enzyme hydrolysis time(time of double enzyme was equal)and enzyme amount(dosage ratio of double enzyme was 1∶1)of double enzyme(alkaline proteinase and trypsin enzyme)hydrolysis method as the respective variables and hyaluronic acid rate as response value were explored by using Box-Benhnken central composite design and response surface analysis theory based on single factor experiment,so as to study the interaction of the respective variables and their influence on the HA extraction rate and set up the simulated quadratic polynomial regression equation of prediction model.The optimum extraction condition was enzyme amount 55000 U/g under the optimal temperature 50℃for a duration of 14 h.Under these conditions,the average extraction yield of HA was up to 27.6839 mg/g,glucuronide content was 13.8420 mg/g,namely whose purity 42.2%in extraction.Besides,the response surface methods were also proved to be available to extract HA exactly.
Rana chensinensis David skin;hyaluronic acid;response surface analysis methodology;enzyme hydrolysis extraction
TS201.1
A
1002-0306(2016)08-0196-05
10.13386/j.issn1002-0306.2016.08.032
2015-08-17
袁海恋(1990-),女,硕士,研究方向:药物活性成分及美容保健品的研究与开发,E-mail:y15253090921@163.com。
*通讯作者:施溯筠(1972-),女,博士,副教授,研究方向:天然药物活性成分的研究,E-mail:shsy@ybu.edu.cn。
国家自然基金(81260251)。
