2种嵩草属牧草休眠期内生细菌多样性研究
2016-09-14杨成德王玉琴陈秀蓉张振粉薛莉王颖姚玉玲
杨成德,王玉琴,陈秀蓉,张振粉,薛莉,王颖,姚玉玲
(甘肃农业大学植物保护学院,甘肃 兰州 730070)
2种嵩草属牧草休眠期内生细菌多样性研究
杨成德,王玉琴,陈秀蓉*,张振粉,薛莉,王颖,姚玉玲
(甘肃农业大学植物保护学院,甘肃 兰州 730070)
采用稀释平板法从两种嵩草属牧草休眠期根和种子中分离到23株内生细菌,测定了其抑菌、溶磷、固氮和产IAA等生物学功能,并通过16S rDNA 基因序列分析进行了鉴定。结果表明,两牧草根和种子中内生细菌的数量和群落组成存在明显差异;线叶嵩草内生细菌的种类比矮生嵩草丰富;矮生嵩草根部内生细菌比种子中丰富,而线叶嵩草种子内生细菌较根部丰富;种子存放时间影响内生细菌数量;20株可继代培养内生细菌中具有抑菌、溶磷、固氮和产IAA生物功能的菌株分别占总菌株数的35%,55%,45%和25%。获得15株内生细菌的16S rDNA 基因序列,经同源性比较,其分别属于芽孢杆菌属(Bacillus)、叶杆菌属(Phyllobacterium)、葡萄球菌属(Staphylococcus)、类芽孢杆菌属(Paenibacillus)、微杆菌属(Microbacterium)、原小单孢菌属(Promicromonospora)和鞘氨醇盒菌属(Sphingopyxis),且芽孢杆菌属细菌为其优势种群。
嵩草属;内生细菌;鉴定;多样性;生物功能
几乎所有植物中都伴随有内生细菌[1-2],其与宿主植物在长期共同进化过程中形成密切关系,是植物微生物生态系统的主要成员[3]。随着植物内生细菌研究的不断深入,明确了其通过抑菌、溶磷和固氮等生物功能,增强了宿主植物的抗病性、抗旱性及生长竞争能力等[4-5],成为近年来研究的热点,特别是相关功能方面的研究报道较多。植物内生细菌可分泌吲哚乙酸(IAA)[6-7],促进植物根的生长及分布,有利于从土壤中吸收更多的营养物质;内生固氮菌生活在植物体内,避免了化合态氮的抑制及土著微生物的竞争,表现出更高的固氮效率[8-9];杨成德等[10]也从内生细菌中扩增出了nifH基因片段。关于内生细菌抑菌能力[11-17]和溶磷能力[7,11]方面的报道较多;另外,植物内生细菌具有激活植物基本抗病性或诱导植物系统抗病性的潜力[18],还可以提高植物抗重金属盐的能力[19];所以,植物内生细菌具有丰富的功能多样性,是植物病害生物防治、内生固氮菌筛选及抗病性诱导等功能的天然菌源,也是研究植物与微生物互作的良好材料,具有极高的理论研究价值和实际应用价值,也具有开发为微生物源农药或肥料的巨大潜力[20-21]。
植物内生细菌的数量和种类存在丰富多样性[22-23],且在不同宿主及不同器官的种类、数量、群落结构和多样性存在较大的差异[24-25]。矮生嵩草(Kobresiahumilis)和线叶嵩草(Kobresiacapillifolia)是高寒草地的多年生草本植物,草质柔软,抗逆性强,营养价值高,为高寒草地的优良牧草。目前,关于高寒草地嵩草属生长期内生细菌已有报道[6-7,15],但是,有关休眠期种子及根系内生细菌方面的研究未见报道。因此,为了明确休眠期内生细菌的多样性,本试验从2种嵩草属牧草种子及根系中分离纯化其内生细菌,研究其种类及抑菌、溶磷和产IAA等功能,以期为明确2种嵩草属牧草休眠期内生细菌的多样性提供依据,也为高寒草地特有植物内生细菌的开发和利用提供依据。
1 材料与方法
1.1试验地概况
位于甘肃省天祝县金强河甘肃农业大学高寒草原试验站前金杆沟山麓两侧,北纬37°11′-37°18′、东经102°23′-102°47′,海拔2900~3200 m,年均温-0.1 ℃,全年大于0 ℃年积温1380 ℃;无绝对无霜期,冷季长达7个月,植物生长季为120~140 d,年降水量416 mm,多为地形雨,集中于7-9月;10月底至第2年4月为降雪期;年蒸发量1592 mm;植被主要为草本植物。
1.2试验材料
供试内生细菌:分离自2011年11月进入休眠期的矮生嵩草和线叶嵩草的根系及2011年10月采集的种子,种子内生细菌分离时间为2011年12月和2012年12月。
供试病原菌:马铃薯枯萎病菌(Fusariumavenaceum)、马铃薯坏疽病菌(Phomafoveata)和马铃薯炭疽病菌(Colletotrichumcoccodes),均为甘肃农业大学植物病理实验室保存菌种。
供试培养基:肉汁胨培养基(NA)用于内生菌的活化和保存[26];马铃薯葡萄糖培养基(PDA)用于植物病原真菌的培养和对峙试验[26];金氏(King)培养基用于菌株产IAA的测定;Pikovaskaia培养基(PKO)用于菌株溶解无机磷的测定;蒙金娜培养基用于测定菌株溶解有机磷的能力[27];阿须贝无氮培养基用于固氮能力测定[28]。
1.3内生细菌的分离
将牧草的根和种子表面消毒,即对根用水冲洗干净后称取1 g,在无菌条件下依次用10% NaClO浸泡3 min,0.1%升汞浸泡10 min,处理间均用无菌水冲洗3~4 次;称取1 g种子,计算粒数后消毒方法同根。取最后1次无菌水冲洗液0.2 mL涂布NA 培养基,检验表面灭菌效果。将消毒后的材料置于无菌的盛有少量石英砂的研钵中磨碎(加入5 mL生理盐水),取上清液梯度稀释到浓度为10-1~10-3,取3个稀释度的菌悬液各0.2 mL涂布于NA平板上,重复3次,置于28 ℃恒温培养3~5 d,根据菌落形态分类划线纯化,将纯化后的菌种4 ℃保存于NA斜面上[29]。同时根据菌落数计算每g根和种子中的内生细菌总数及每粒种子带内生细菌数,利用新复极差法进行显著性分析。
1.4内生细菌的功能多样性
1.4.1拮抗能力测定采用平皿对峙法测定抑菌效果,即将经PDA培养基上活化的病原真菌打成直径6 mm的菌饼接种于PDA培养基平板中央,再将活化后的内生细菌点接于距菌饼2.5 cm处,每平板接4点,以点接无菌水为对照,重复3次,置25 ℃恒温培养箱中培养,对照满皿后测量抑菌圈(cm)并计算抑菌率[9-10]。
1.4.2溶磷能力测定将内生细菌接于Pikovaskaia培养基(PKO)或蒙金娜培养基平板上,每皿接5点,重复3次,置于28 ℃恒温培养箱培养,观察并测量菌株在培养基平板上形成的溶磷圈大小。根据溶磷圈直径/菌落直径(D/d值)确定内生细菌的溶磷能力[9-10]。
1.4.3固氮能力测定经活化的供试菌株用无菌生理盐水配制菌悬液,以200 μL分别接种于阿须贝无氮平板(涂布)和液体培养基内,3次重复,以接种无菌水为对照,28 ℃培养(液体振荡120 r/min),在第3和7天目测其生长状况,平板上有菌落和三角瓶内培养基变浑浊者为阳性[30]。
1.4.4产生 IAA能力测定标准曲线采用纯3-IAA制作。将经King培养液培养12 d的菌悬浮液和空白对照离心(4 ℃,10000 r/min,10 min),取上清液4 mL加等量比色液,在黑暗中静置30 min,立即测定OD530值,重复测3次,以加比色液的空白对照调零。根据标准曲线计算出内生细菌分泌IAA的量[30]。
1.516S rDNA基因序列分析鉴定
内生细菌16S rDNA基因序列扩增引物序列为:引物1:5′-CCG GAT CCA GAG TTT GAT CAT GGC TCA GCA-3′,引物2:5′-CGG GAT CCT ACG GCT ACC TTG TTA CGA CTT-3′,由上海生工生物工程技术服务有限公司合成;扩增和检测方法等具体参考文献[9]进行,与GenBank数据库 (http://www.ncbi.nlm.nihgov/blast.cgi) 中序列相似性比较,并用Clustal(1.8)软件进行多重序列比较和用Mega(4.0)软件邻接法构建系统发育树,确定其系统发育学地位。
2 结果与分析
2.1内生细菌数量多样性
休眠期根内生细菌分离结果表明,矮生嵩草2011年根中内生细菌有3个种类,分别命名为ASG1、ASG2和ASG3,内生细菌总数为3.5×105cfu/g;线叶嵩草2011年休眠期根内分离到5种内生细菌,分别命名为XSG1、XSG2、XSG3、XSG4和XSG5,多于矮生嵩草,但内生细菌数为0.5×105cfu/g(表1),显著低于矮生嵩草(P<0.05)。

表1 休眠期根和种子内生细菌
注:同列不同字母表示差异显著(P<0.05),下同。
Note:The different letters in the same column indicate significant differences atP<0.05 level, the same below.
矮生嵩草种子中2011年共分离到4种类型,分别命名为ASZ1、ASZ2、ASZ3和ASZ4,内生细菌数量为1.44×105cfu/g,低于根内,每粒种子带菌数为1.12×102cfu/粒;2012年种子中内生细菌分离到3个种类,分别命名为2ASZ1、2ASZ2和2ASZ3,内生细菌总数为0.13×105cfu/g,每粒种子带菌数为0.38×102cfu/粒(表1),显著低于2011年(P<0.05)。
线叶嵩草种子中2011年分离得到4个种类,分别命名为XSZ2、XSZ2′、XSZ3和XSZ4,内生细菌数为22.27×105cfu/g,显著高于根内数量,也显著高于矮生嵩草(P<0.05),每粒种子带菌数为19.39×102cfu/粒;2012年种子分离得到4个种类,与2011年没有变化,分别命名为2XSZ1、2XSZ2、2XSZ3和2XSZ4,内生细菌数为2.14×105cfu/g,每粒种子带菌数为2.37×102cfu/粒(表1),显著低于2011年,但显著高于矮生嵩草(P<0.05)。
2.2内生细菌功能多样性
在所分离得到的23株内生细菌中,有20株可以进行继代培养,并对其进行了抑菌、溶磷、固氮和产IAA功能测定。抑菌能力测定结果表明(表2),对马铃薯枯萎病菌、马铃薯坏疽病菌和马铃薯炭疽病菌有拮抗能力的菌株所占比例分别为35%,25%和30%;对马铃薯枯萎病菌和马铃薯坏疽病抑菌能力最好的菌株均为XSG4,抑菌率分别为70.93%和75.00%,对马铃薯炭疽病菌拮抗能力最好的菌株为2XSZ4,抑菌率为79.36%,且拮抗菌株对其抑菌效果较其他2种病原菌好,抑菌率多在70%以上;对3种病原菌均有拮抗作用的内生细菌分别为XSG4、ASZ4、2XSZ3、2XSZ4和2ASZ2,占总菌株的25%,特别是XSG4对3种病原真菌的抑菌率均在70%以上,表现出良好的抑菌活性。
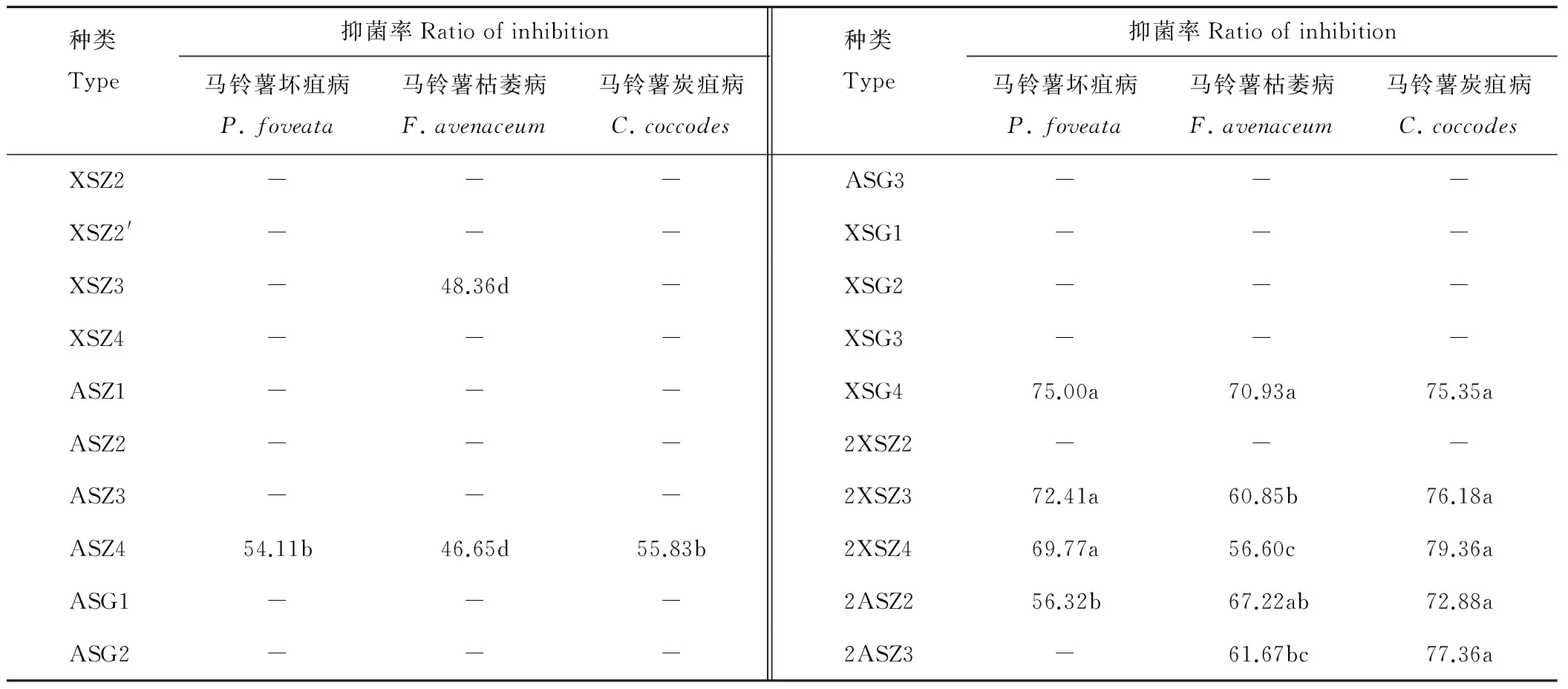
表2 牧草内生细菌抑菌能力测定
-:表明无抑菌能力或抑菌能力较弱Without antibacterial activity.
对内生细菌进行溶磷、固氮和产IAA能力测定结果表明(表3),有9个菌株具有固氮能力,占总菌株的45%;5个菌株具有溶解有机磷的能力,占总菌株的25%,10个菌株具有溶解无机磷的能力,占总菌株的50%,XSZ2、XSZ2′、ASZ1、XSG1和XSG4同时具有溶解有机磷和无机磷的能力,占总菌株的25%,特别是XSZ2′对两种磷溶解能力较强,XSZ3、ASZ2、ASZ4、ASG3、XSG2和XSG3具有溶解无机磷的能力,且溶磷能力较强;5株菌在含或不含色氨酸的培养基上均可分泌IAA,占总菌株的25%,其中ASZ2在含色氨酸的培养基上分泌IAA的量达4.52 mg/L。

表3 牧草内生细菌溶磷、固氮和产IAA能力测定
-:无功能Without biological function; +:有功能With biological function.
2.3内生细菌种类多样性
20株可培养内生细菌中有15株成功提取其基因组DNA并扩增出16S rDNA 序列。经16S rDNA序列相似性分析和构建系统发育分析(图1),表明2种嵩草属牧草分离到的内生细菌属于7个属8个种,且2XSZ2,2ASZ3和2XSZ4属于芽孢杆菌属,但种的分类地位有待于进一步研究,XSZ4和2ASZ1在属水平的分类地位待定。7个属分别为芽孢杆菌属(Bacillus)、叶杆菌属(Phyllobacterium)、葡萄球菌属(Staphylococcus)、类芽孢杆菌属(Paenibacillus)、微杆菌属(Microbacterium)、原小单孢菌属(Promicromonospora)和鞘氨醇盒菌属(Sphingopyxis),其中线叶嵩草中分离到5种,分别是B.amyloliquefaciens、Phyllobacteriumtrifolii、S.epidermidis、Paenibacilluspolymyxa和M.oxydans,矮生嵩草分离到6种,分别是B.amyloliquefaciens、B.thuringiensis、Paenibacilluspolymyxa、M.oxydans、Promicromonosporaumidemergens和S.bauzanensis。线叶嵩草根部内生细菌分别属于Phyllobacterium.trifolii、Paenibacilluspolymyxa和M.oxydans,种子内生细菌属于B.amyloliquefaciens、S.epidermidis和M.oxydans。矮生嵩草根部内生细菌分别属于Promicromonosporaumidemergens和S.bauzanensis,种子内生细菌属于B.amyloliquefaciens、B.thuringiensis、Paenibacilluspolymyxa和M.oxydans。该结果表明,牧草内生细菌种类丰富,具有丰富的遗传多样性,但在不同牧草或器官种类有差别。在上述15个内生细菌中,6株属于芽孢杆菌属细菌,说明芽孢杆菌属细菌为2种牧草内生细菌的优势菌群。

图1 牧草内生细菌的16S rDNA序列系统发育树Fig.1 Phylogenetic tree of endophytic bacteria isolated from pasture based on the 16S rDNA sequence
3 讨论与结论
植物内生菌的生境特殊性决定了其既有理论研究的广度和深度,又有广泛的应用潜力,是潜力巨大且尚待开发的微生物新资源。本文首次研究了线叶嵩草和矮生嵩草休眠期内生细菌在不同部位的多样性,矮生嵩草2011年根中内生细菌总数为3.5×105cfu/g,种子中内生细菌数量为1.44×105cfu/g;线叶嵩草2011年休眠期根中内生细菌总数为0.5×105cfu/g,明显低于矮生嵩草,种子中内生细菌数为22.27×105cfu/g,多于矮生嵩草,说明矮生嵩草根部比种子中内生细菌数量多,而线叶嵩草种子中内生细菌数量较根部多。Gagne等[31]曾认为由于大多内生细菌来源于根际土壤,所以根部的内生细菌含量最高,本研究中矮生嵩草与其观点一致,但是线叶嵩草种子内生细菌数量比根部数量多,这可能与牧草种类及不同器官存在差异有关[24-25]。另外,矮生嵩草2012年种子中内生细菌数为0.134×105cfu/g,线叶嵩草2012年种子内生细菌数为2.14×105cfu/g,2种牧草种子内生细菌的数量均显著低于2011年,说明种子存放时间影响其内生细菌数量。植物为内生细菌提供相对稳定的生存环境,而内生细菌可以通过抑菌、固氮、溶磷和产IAA等方式促进植物的生长。因此,利用内生细菌进行生物防治或作为生物肥料,较其他微生物制剂有显著的优势。本研究表明,嵩草属牧草内生细菌存在着抗马铃薯坏疽病、马铃薯枯萎病和马铃薯炭疽病3种病原真菌的抗菌资源,可用于马铃薯贮藏期病害防治的潜力。牧草中还存在溶磷、固氮和产IAA的内生细菌,这些菌株可能对牧草获得营养及抗逆方面具有重要的生物功能,且XSG4同时具有抑菌、溶磷、产IAA和固氮4种能力,ASZ4具有抑菌、产IAA和溶磷3种能力,ASZ2具有固氮、产IAA和溶磷3种能力,另外,有8株菌同时具有2种生物功能,这一结果表明内生细菌具有丰富的生物功能多样性,也在生产中具有开发为微生物肥料或农药的潜力。
本试验中多功能内生细菌XSG4和ASZ4属于类芽孢杆菌属的多粘类芽孢杆菌,ASZ2属于芽孢杆菌属,这两个属均为目前报道较多的内生细菌,且具有多种可利用的生物特性。如胡飞等[32]报道的多粘类芽胞杆菌DN-1 对水稻纹枯病有较好防治效果;陈雪丽等[33]报道了多粘类芽孢杆菌BRF-1和枯草芽孢杆菌BRF-2菌悬液及其无菌代谢物不仅对黄瓜和番茄枯萎病具有较好的防治效果, 且具有明显的促进生长作用;郭芳芳等[34]报道的多粘类芽孢杆菌对番茄猝倒病具有较好的防治效果。本研究结果与其一致。
本研究首次对2种嵩草属牧草休眠期内生细菌进行了16S rDNA 序列分析,结果表明,高寒草地内生细菌在不同的植物间存在差异,在同种植物的不同部位也存在差异。线叶嵩草分离到5种内生细菌,矮生嵩草分离到6种,线叶嵩草根部分离得到的内生细菌与矮生嵩草根部分离到的种不同,但是两牧草种子中分离到的内生细菌有两种是相同的。2种牧草的内生细菌分为7个属8个种说明嵩草属牧草内生细菌具有丰富的多样性,且芽孢杆菌属细菌是2种牧草内生细菌的优势菌群,与文献报道一致[14,17,22-23],这可能与芽孢杆菌属细菌抗逆性强有关;另外,内生细菌中有3个菌株在种水平及2个菌株在属水平的分类地位需进一步研究,说明该生境牧草内生细菌中有新的微生物种类。本研究中内生细菌所属的7个属中,只有芽孢杆菌是常见的内生细菌优势种群,其他6个属均为不常见属,这可能与本试验大多数菌株分离自高寒草地休眠期牧草根系和种子有关。本研究仅利用传统培养方法进行内生细菌的培养,但许多研究已证实通过传统的分离方法鉴定的微生物只占环境微生物总数的0.1%~10%[23],不能充分展示微生物的多样性状况,且一部分植物内生细菌由于人工环境不适宜而不能进行继代培养。因此,为了更全面地了解牧草内生细菌多样性的真实水平及其物种组成,有必要利用非培养方法对其组织内未培养微生物进行研究。另外,本试验仅利用16S rDNA 序列分析方法对内生细菌进行了鉴定,还需利用生理生化试验及(G+C)%等进一步鉴定。
References:
[1]Lin J H, Wang R Z, Ma F L,etal. The probiotic effects of endophyte probiotics on host plants and its applications. Chinese Journal of Biological Control, 2010, 26: 100-105.
[2]Dau C C,Yi B Y, Zhao Y T,etal. Correlation between inhibition activity of endophytic fungus from Euphorbia pekinensis and its host. Chinese Journal of Applied Ecology, 2005, 16(7): 1290-1294.
[3]Yuan H X, Zhou L L, Zhou J L,etal. Biological effect of endophytic bacteria in Fortunate Bamboo. Chinese Journal of Eco-Agriculture, 2005, 13(1): 95-97.
[4]Guo B, Wang Y, Sun X,etal. Bioactive natural products from endophytes: A review.Applied Biochemistry and Microbiology, 2008, 44(2): 136-142.
[5]Promputtha I, Lumyong S, Dhanasekaran V. A phylogenetic evaluation of whether endophytes become saprotrophs athost senescence. Microbial Ecology, 2007, 53(4): 579-590.
[6]Gao X X, Man B Y, Cheng X R,etal. Identification and determination of biological characteristics ofKobresiacapillifoliaendophytic bacteria X4 in the East Qilian Mountain Alpine grasslands. Acta Prataculturae Sinica, 2013, 22(4): 137-146.
[7]Yao Y L, Wang Y, Wang Y Q,etal. Identification of endophytic bacteria fromKobresiahumilisand determination of phosphate-solubilizing, IAA secretion and antagonistic capacity. Acta Agrestia Sinica, 2014, 22(6): 1252-1257.
[8]Dobereiner J. Nitrogen-fixing bacteria of the genusBeijerinckiaDerx in the rhizosphere of sugar cane. Plant and Soil, 1961, 15: 211-216.
[9]Zhang G X, Mao Q, He Z Y,etal. Detection of nitrogenase activity and phosphorus dissolving ability of endophytic isolates fromOryzarufipogonin Lingshui. Chinese Journal of Applied & Environmental Biology, 2006, 12(4): 457-460.
[10]Yang C D, Li Z D, Chen X R,etal. Identification and determination of inhibiting pathogen and fixing-nitrogen functions ofPolygonumviviparumendophytic bacteria Z19 on Alpine grassland. Microbiology China, 2014, 41(2): 267-273.
[11]Ardanov P, Ovcharenko L, Zaets I,etal. Endophytic bacteria enhancing growth and disease resistance of potato (SolanumtuberosumL.). Biological Control, 2011, 56(1): 43-49.
[12]Hakeem O S, Danve C M, Ross N N. Plant-endophyte interplay protects tomato against a virulentVerticillium. Planta, 2009, 229: 415-426.
[13]Wang Y Q, Yang C D,Wang Y,etal. Identification and determination of biological characteristics of endophytic bacteria 265ZY4 fromStipacapillatain the East Qinlian Mountain alpine grasslands. Microbiology China, 2015, 42(1): 101-109.
[14]Yang C D, Wang Y, Wang Y Q,etal. Identification and determination of biological functions of endophyte bacterium fromAchnatheruminebrianson East Qilian Mountains Alpine grassland. Acta Prataculturae Sinica, 2014, 23(5): 249-255.
[15]Wang Y, Wang Y Q, Yang C D,etal. Screening, identification and biological function evaluation of endophytic bacteria against potato storage disease. Acta Prataculturae Sinica, 2014, 23(3): 269-275.
[16]Chang T, Wang H Q, Yang C D,etal. Identification and evaluation of biocontrol capacity of B-401 of endophytic bacteria in grasses in alpine area. Acta Prataculturae Sinica, 2014, 23(3): 282-289.
[17]Dai J X, Wang Y J. Diversity and distribution of endophytic bacteria isolated fromCaraganamicrophyllagrown in desert grassland in Ningxia. Acta Ecologica Sinica, 2012, 32(20): 6300-6307.
[18]SturzA V, Christie B R, Norwak J. Bacterial endophytes: potential role in developing sustainable systems of crop production. Critical Reviews in Plant Sciences, 2000, 19(1): 1-30.
[19]Sun L N, Zhang Y F, He L Y,etal. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland. Bioresource Technology, 2010, 101(2): 501-509.
[20]Li Z D, Cheng X R, Yang C D,etal. Screening, identification and solubilizing properties of the endophytic phosphate-solubilizing bacteria isolated fromAnaphalislactea. Acta Prataculturae Sinica, 2013, 22(6): 150-158.
[21]Ohkama-Ohtsu N, Wasaki J. Recent progress in plant nutrition research: cross-talk between nutrients, plant physiology and soil microorganisms. Plant Cell Physiology, 2010, 51: 1255-1264.
[22]Zhang X B, Shi Y W, Zeng J,etal. Endophytic bacterial diversity inAchnatheruminebriansby culture-independent approach. Acta Ecologica Sinica, 2011, 31(8): 2178-2187.
[23]Chen Z B, Xia Z B, Leu L P,etal. Diversity of cultivable endophytic bacteria isolated from tobacco. Microbiology China, 2011, 38(9): 1347-1354.
[24]Lan J L, Liu B, Zhu Y J,etal. Community and diversity of endophytic bacteria inside eggplant. Ecology and Environmental Sciences, 2009, 18(4): 1433-1442.
[25]Che J M, Liu B, Zhang Y,etal. Distribution characteristics of endophytic bacteria isolated from forage grasses. Acta Prataculturae Sinica, 2010, 19(3): 124-131.
[26]Fang Z D. The Study Method of Plant Disease(the third)[M]. Beijing: China Agriculture Press, 1998: 110, 182-183.
[27]Xu A F, Wu Y X, Liu Y,etal. Screening of organic phosphate solubilizing entophytic bacteria ofCymbidiumgoeringiiroots. Journal of Anhui Agricultural Sciences, 2013, 41(4): 1515-1516, 1529.
[28]Xu L Q, Yao T, Yang J J,etal. Porperty of associative nitrogen-fixing bacteria producing IAA and its promoting growth of oat. Grassland and Turf, 2005, (4): 25-29.
[29]Man B Y, Chen X R, Li Z D. Optimization for isolation and culture conditions of endophytic bacteria in grasses in alpine area. Grassland and Turf, 2008, (5): 27-30.
[30]Xi L Q, Li D F, Wang J F,etal. Measurement of nitrogen fixation capability and excreted IAA capability of PGPB isolated from cottonRhizosphereinsalina. Arid Zone Research, 2008, 25(5): 690-694.
[31]Gagne S, Richard C, Rousseau H,etal. Xylem-residing bacteria in alfafa roots. Canadian Journal of Microbiology, 1997, 33(7): 996-1000.
[32]Hu F, Li C C, Zhou Z Y,etal. Preliminary study onPaenibacilluspolymyxaDN-1 controlling rice sheath blight in rice. Chinese Journal of Biological Control, 2015, 31(4): 524-528.
[33]Chen X L, Wang G H, Jin J,etal. Biocontrol effect ofPaenibacilluspolymyxaBRF-1 andBacillussubtilisBRF-2 on fusarium wilt disease of cucumber and tomato. Chinese Journal of Eco-Agriculture, 2008, 16(2): 446-450.
[34]Guo F F, Xie Z, Lu P,etal. Identification of a novelPaenibacilluspolymyxastrain and its biocontrol and plant growth-promoting effects. Chinese Journal of Biological Control, 2014, 30(4): 489-496.
[1]林吉恒, 王睿之, 马风兰, 等. 植物益生菌对植物的益生效应及其应用. 中国生物防治, 2010, 26: 100-105.
[2]戴传超, 余伯阳, 赵玉婷, 等. 大戟内生菌的抑菌活性及其与宿主相关性研究. 应用生态学报, 2005, 16(7): 1290-1294.
[3]袁红旭, 周立赖, 周锦兰, 等. 富贵竹内生细菌群落的生物效应研究. 中国生态农业学报, 2005, 13(1): 95-97.
[6]高晓星, 满百膺, 陈秀蓉, 等. 东祁连山线叶嵩草内生细菌X4的产吲哚乙酸、解磷、抗菌和耐盐特性研究及分子鉴定. 草业学报, 2013, 22(4): 137-146.
[7]姚玉玲, 王颖, 王玉琴, 等. 矮生嵩草内生细菌溶磷、抑菌和产IAA能力的测定及鉴定. 草地学报, 2014, 22(6): 1252-1257.
[9]张国霞, 茅庆, 何忠义, 等. 陵水普通野生稻(Oryzarufipogon)内生菌的固氮及溶磷特性. 应用与环境生物学报, 2006, 12(4): 457-460.
[10]杨成德, 李振东, 陈秀蓉, 等. 高寒草地珠芽蓼内生拮抗固氮菌Z19的鉴定及其固氮功能研究. 微生物学通报, 2014, 41(2): 267-273.
[13]王玉琴, 杨成德, 王颖, 等. 针茅内生细菌菌株265ZY4的鉴定及其生物学功能. 微生物学通报, 2015, 42(1): 101-109.
[14]杨成德, 王颖, 王玉琴, 等. 东祁连山高寒草地几株醉马草内生细菌的生物功能评价及鉴定. 草业学报, 2014, 23(5): 249-255.
[15]王颖, 王玉琴, 杨成德, 等. 马铃薯贮藏期主要病害拮抗内生细菌的筛选、鉴定及功能评价. 草业学报, 2014, 23(3): 269-275.
[16]畅涛, 王涵琦, 杨成德, 等. 高寒草地禾草内生细菌B-401的鉴定及生物防治潜力评价. 草业学报, 2014, 23(3): 282-289.
[17]代金霞, 王玉炯. 宁夏荒漠草原小叶锦鸡儿可培养内生细菌多样性及其分布特征. 生态学报, 2012, 32(20): 6300-6307.
[20]李振东, 陈秀蓉, 杨成德, 等. 乳白香青内生解磷菌的筛选鉴定及解磷特性研究. 草业学报, 2013, 22(6): 150-158.
[22]张雪兵, 史应武, 曾军, 等. 醉马草免培养内生细菌的多样性. 生态学报, 2011, 31(8): 2178-2187.
[23]陈泽斌, 夏振远, 雷丽萍, 等. 烟草可培养内生细菌的分离及多样性分析. 微生物学通报, 2011, 38(9): 1347-1354.
[24]蓝江林, 刘波, 朱育菁, 等. 茄子植物内生细菌群落结构与多样性. 生态环境学报, 2009, 18(4): 1433-1442.
[25]车建美, 刘波, 张彦, 等. 几种禾本科牧草内生细菌的分布特性. 草业学报, 2010, 19(3): 124-131.
[26]方中达. 植病研究方法(第 3版)[M]. 北京: 中国农业出版社, 1998: 110, 182-183.
[27]徐爱芳, 武永秀, 刘莹. 春兰根内生解有机磷细菌的筛选. 安徽农业科学, 2013, 41(4): 1515-1516, 1529.
[28]席琳乔, 姚拓, 杨俊基, 等. 联合固氮菌株分泌能力及其对燕麦的促生效应测定. 草原与草坪, 2005, (4): 25-29.
[29]满百膺, 陈秀蓉, 李振东. 高寒牧草内生细菌分离培养条件的优化. 草原与草坪, 2008, (5): 27-30.
[30]席琳乔, 李德锋, 王静芳, 等. 棉花根际促生菌固氮和分泌生长激素能力的测定. 干旱区研究, 2008, 25(5): 690-694.
[32]胡飞, 李昌春, 周子燕, 等. 多粘类芽胞杆菌DN-1防治水稻纹枯病初步研究. 中国生物防治学报, 2015, 31(4): 524-528.
[33]陈雪丽, 王光华, 金剑, 等. 多粘类芽孢杆菌BRF-1和枯草芽孢杆菌BRF-2对黄瓜和番茄枯萎病的防治效果. 中国生态农业学报, 2008, 16(2): 446-450.
[34]郭芳芳, 谢镇, 卢鹏, 等. 一株多粘类芽孢杆菌的鉴定及其生防促生效果初步测定. 中国生物防治学报, 2014, 30(4): 489-496.
Diversity of endophytic bacteria isolated fromKobresiaduring winter dormancy
YANG Cheng-De, WANG Yu-Qin, CHEN Xiu-Rong*, ZHANG Zhen-Fen, XUE Li, WANG Ying, YAO Yu-Ling
CollegeofPlantProtection,GansuAgriculturalUniversity,Lanzhou730070,China
Twenty three strains of endophytic bacteria were isolated from the roots and seeds of dormant plants in winter of two species ofKobresia, using the dilution plate method. The isolated bacteria were identified by sequence analysis of their 16S rDNA. Then their biological properties, including antimicrobial activity, phosphorus solubilisation, nitrogen fixation and production of IAA, were determined. There were significant differences in the number of endophytic bacteria and their community composition in the roots and seeds of the twoKobresiaspecies.Kobresiacapillifoliahad a higher species diversity of endophytic bacteria thanKobresiahumilis. Endophytic bacteria were more abundant in roots than in seeds forK.humilis, but the opposite was true inK.capillifolia. The amount of endophytic bacteria was affected by the seed storage time. Twenty strains among the isolated endophytic bacteria displayed biological activity. including antimicrobial properties, phosphorus solubilisation, nitrogen fixation and production of IAA. The, numbers of strains with these respective capabilities were 35%, 55%, 45% and 25%, respectively, of the total number of bacteria. Fifteen taxa were identified among the 16S rDNA gene sequences of the endophytic bacteria isolated. They included the generaBacillus,Phyllobacterium,Staphylococcus,Paenibacillus,Microbacterium,PromicromonosporaandSphingopyxis. Among these,Bacilluswas the dominant species.
Kobresia; endophytic bacteria; identification; diversity; biological function
10.11686/cyxb2015368http://cyxb.lzu.edu.cn
杨成德, 王玉琴, 陈秀蓉, 张振粉, 薛莉, 王颖, 姚玉玲. 2种嵩草属牧草休眠期内生细菌多样性研究. 草业学报, 2016, 25(8): 136-144.
YANG Cheng-De, WANG Yu-Qin, CHEN Xiu-Rong, ZHANG Zhen-Fen, XUE Li, WANG Ying, YAO Yu-Ling. Diversity of endophytic bacteria isolated fromKobresiaduring winter dormancy. Acta Prataculturae Sinica, 2016, 25(8): 136-144.
2015-07-20;改回日期:2015-10-12
国家自然科学基金项目(No. 31160122)资助。
杨成德(1975-),男,甘肃武都人,副教授,博士。E-mail: yangcd@gsau.edu.cn
Corresponding author. E-mail: chenxiurong@gsau.edu.cn
