曲酸发酵及生物合成途径研究进展
2016-09-14申敏娜陈建华
申敏娜,陈建华
(中国药科大学生命科学与技术学院,江苏 南京 210009)
曲酸发酵及生物合成途径研究进展
申敏娜,陈建华
(中国药科大学生命科学与技术学院,江苏 南京 210009)
简要介绍了曲酸发酵现状,综述了曲酸生物合成途径的研究手段和成果,包括常规手段同位素标记以及新兴的基因组学研究,总结了可能的曲酸生物合成途径以及相关合成与调节基因。
曲酸;发酵;生物合成;基因组学
曲酸(kojicacid)于1907年由斋藤首次分离得到;1913年,薮田将其命名为曲酸;1924年,首次确定曲酸的结构[1]。曲酸化学名为5-羟基-2-羟甲基-1,4-吡喃酮,主要来源于真菌发酵的次级代谢产物,纯品为无色柱状晶体,分子式C6H6O4,分子量142.1,熔点153~154 ℃,易溶于水、醇、丙酮,微溶于醚、乙酸乙酯、氯仿和吡啶,不溶于苯。曲酸具有微弱酸性,其分子上的每个位点都具有反应活性,5位上的侧链相当于一个伯醇,核上临近的氧原子能够提高其反应活性;曲酸与三氯化铁作用呈特殊的红色,可还原斐林试剂和银氨溶液[2]。
曲酸应用广泛。基于其酪氨酸酶抑制剂活性,在化妆品中作为美白成分,进入皮肤细胞后能够与细胞中的铜离子络合,改变酪氨酸酶的立体结构,抑制酪氨酸酶的活化,阻止皮肤黑色素的形成[3];基于其抗菌、抗氧化活性[4],在食品运输贮藏中作为防腐剂、护色剂,阻断多酚氧化酶的需氧途径。曲酸来源于微生物的次级代谢产物,无生理毒性,结构简单,但由于其烯醇式结构存在一定的不稳定性,常作为骨架进行修饰和衍生,如合成曲酸双棕榈酸酯、曲酸酯等[5-8],这些衍生物不仅提高了曲酸在油性化妆品中的溶解度和稳定性,而且生物活性也大幅提高。曲酸在不同领域中的应用如表1所示。
1 曲酸发酵研究现状
曲酸主要来源于某些丝状真菌或醋杆菌的次级代谢分泌,某些植物(如非洲吊灯树)也能产曲酸。目前,产曲酸菌株主要集中于米曲霉和黄曲霉,其中,黄曲霉为条件性致病菌。Manabe等[9]对149株米曲霉和46株黄曲霉进行研究时发现,黄曲霉全部产曲酸且有34株同时产黄曲霉毒素;而米曲霉只有105株产曲酸且全部不产黄曲霉毒素。因此选用黄曲霉作为产曲酸菌株时,需格外注意安全问题。
表1曲酸在不同领域中的应用

Tab.1 Applications of kojic acid in different fields
1955年,辉瑞公司最先将曲酸生产工业化[10]。为了提高曲酸产量,国内外学者进行了大量研究工作,主要包括菌株选育、发酵方法优化两方面。表2列出了近年来产曲酸菌株的选育研究成果。
从表2可知,曲霉属菌株作为曲酸生产菌,通过不同的物理及化学方法诱变,曲酸产量均有不同幅度的提升。但对比2007年赵新河等[18]的统计结果不难发现,通过诱变提高产量的效果已明显降低,这与理论推测一致。因为在菌株选育过程中,存在诱变方法随机、方向不易掌握、理想个体筛选困难等局限性,另外,多轮筛选造成菌株敏感性降低、耐受性提高。因此,提高曲酸产量需另辟蹊径。
2 曲酸生物合成途径研究
为了进一步提高曲酸产量,研究人员开始从分子水平阐述曲酸生物合成原理,尝试利用基因工程手段突破目前的瓶颈。
表2产曲酸菌株的选育研究成果
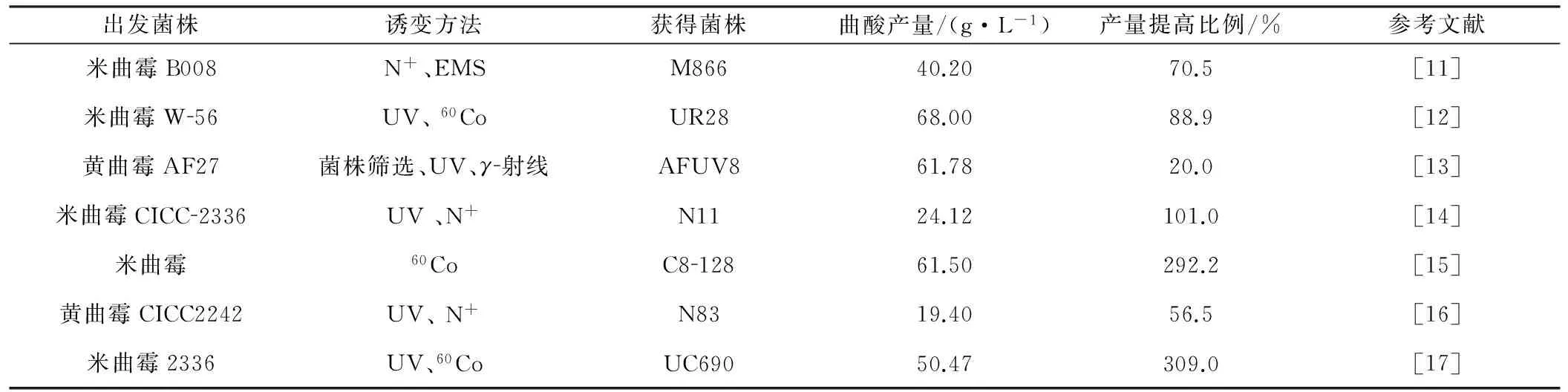
Tab.2 Research achievements of screening for kojic acid-producing strain
微生物次级代谢产物种类多(如抗生素、毒素、激素、色素等)且具有不同的生物活性。研究人员通过提高上调基因的表达或剔除负向调节基因来提高目标产物的产量,但需以生物合成途径的阐明为前提。常用的生物合成途径研究手段包括同位素示踪标记底物、分离并鉴定中间产物等传统方法。由于曲酸及转化底物结构简单,并且骨架相似,因此中间产物研究缺乏靶标性和唯一性。
近年来,基因组学和生物信息学的蓬勃发展为次级代谢产物的生物合成途径研究提供了新思路。目前,曲霉属已测序完毕,在NCBI数据库可查询的基因组序列包括黄曲霉NRRL3357、烟曲霉Af293、米曲霉RIB40等。次级代谢产物合成基因一般分为两类:一类是结构基因(structural genes),主要是一些催化次级代谢产物合成的酶类基因;另一类是调节基因(regulatory genes),主要参与调控次级代谢产物合成相关基因的转录。丝状真菌次级代谢产物结构基因通常成簇存在于染色体相邻的位置,形成基因簇(gene clusters)[19]。在一个基因簇中,除了多个编码酶的结构基因外,一般还包括编码转运蛋白的基因(负责将基因簇合成的次级代谢产物及时运出细胞)及编码转录因子的簇内调节基因(调节基因簇中其它基因的转录[20])。此外,甲基化酶、组蛋白去乙酰化酶以及信号转导蛋白等全局性调控因子(global regulators)也参与调节次级代谢产物的合成,属于簇外调节基因。
曲酸生物合成途径研究大致可分为底物同位素示踪法研究和基因组学研究2个阶段。
2.1底物同位素示踪法研究
底物同位素示踪法研究始于曲酸结构及生物合成途径的推测。由于米曲霉在产生曲酸时,既可利用己糖,也可利用C原子数目低于6的甘油、乙醇、二羟基丙酮等,因此形成了分裂说和分割说两派。20世纪50年代,Arnstein等[21-25]最早用底物同位素示踪法研究曲酸的生物合成,发现由葡萄糖转化为曲酸最多需要2~3种酶,而且不破坏吡喃糖环直接转化成曲酸;当标记底物为[1-14C]-D-葡萄糖时,产物曲酸的76.3%的放射性来自于C-1;当以[6-14C]-D-葡萄糖为标记底物时,产物曲酸的90.7%的放射性来自于C-6[26];当以[3-3H]-D-葡萄糖或[5-3H]-D-葡萄糖为标记底物时,产物曲酸只呈现微弱的3H放射性。
1981年,印度国家糖业研究所根据不同实验条件下酶活性和曲酸浓度的关系,确定葡萄糖脱氢酶和葡萄糖酸脱氢酶参与了曲酸的生物合成,并提出了曲酸生物合成的可能途径[27](图1)。至此,以葡萄糖为底物时,曲酸合成通过简单的氧化脱水反应而不破坏环结构这一理论基本得到证实。

图1 葡萄糖为底物时曲酸生物合成的可能途径
在以[2-14C]-二羟基丙酮为底物的同位素示踪实验中,C-2和C-5的放射性几乎相等,其它位上也有一定的放射性;在已生长的培养基(碳源为无放射性葡萄糖)中再加入[2-14C]-二羟基丙酮后培养相同时间,C-5的放射性(66.5%)强于C-2(12.7%),可能是由于加入的[2-14C]-二羟基丙酮与底物葡萄糖分解得到的丙糖或磷酸丙糖反应生成曲酸所致。在以[1-14C]-D-核糖为底物的同位素示踪实验中,放射性多分布在C-1、C-2、C-3,分别为36.7%、18.9%、24.5%,表明曲酸生成过程中有转醛醇酶、转酮醇酶等的参与[21-25]。由此看出,以不同的小分子糖为转化底物时,所需酶类截然不同,底物同位素示踪法并没有推测出完整的转化酶系,并且存在不小的出入,可能是因为曲霉属菌株产曲酸存在不同的生物合成途径。
2.2基因组学研究
基因组学研究始于21世纪初,随着基因组测序技术的发展,米曲霉RIB40首先完成测序,包括8条染色体,大小为37.6 Mb;与烟曲霉和构巢曲霉相比,米曲霉基因组要大25%~30%,大约包括2 000~3 000个基因,这些基因主要与代谢相关,尤其是与次级代谢产物相关[28],包括分泌型水解酶、转运蛋白等。
2.2.1合成基因簇kojA、kojR、kojT
2010年,日本金泽工业大学的基因组生物技术实验室和先进科学技术研究院通过调节曲酸生产的影响因素(氮源、发酵时间等)检测基因的转录水平;通过参数设置,运用反向遗传学方法和DNA微阵列技术鉴别和表征了与曲酸生物合成显著相关的基因,分别是AO090113000136(kojA)和AO090113000138(kojT),位于米曲霉菌的第五号染色体[29];通过保守结构域的注释,kojA主要负责编码FAD氧化还原酶,kojT主要负责编码转运蛋白超家族。将这2个基因敲除后向培养基中加入Fe3+检验(与曲酸反应呈红色),培养基几乎无色。
2011年,他们对kojA和kojT包夹的AO090113000137(kojR)进行研究时发现,kojR编码蛋白具有Zn2Cys6双核簇DNA结合域,15~58位氨基酸残基由6个半胱氨酸残基结合2个锌原子组成,这一保守蛋白是真核典型的转录激活调节因子,通常结合于目的基因的上下游形成簇状结构,如图2所示。
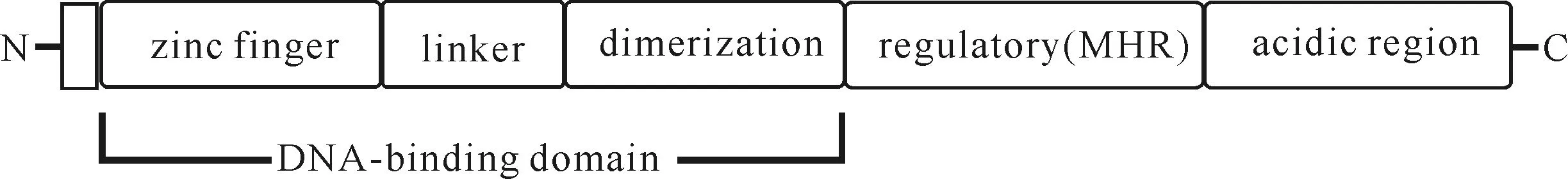
图2 Zn2Cys6调节因子的结构
通过构建米曲霉kojR缺失株(△kojR)及过表达株发现,kojR表达量与曲酸产量呈正相关,即△kojR中曲酸产量大幅降低,而过表达株曲酸产量升高,并且添加外源性的曲酸可以启动该基因。在此基础上,Marui等[30]推测出3个基因的相互作用机制为:kojR作为转录调控因子可正向调节kojA和kojT的表达,从而提高曲酸产量,如图3所示。

图3 kojR作用示意图
Yamada等[31]通过构建质粒在米曲霉RIB40中过表达转录因子kojR时发现,以葡萄糖为底物发酵12 d的曲酸产量从野生菌株的16.4 g·L-1升至26.4 g·L-1,提高了0.6倍;以淀粉为底物发酵18 d的曲酸产量从野生菌株的6.2 g·L-1升至19.4 g·L-1,提高了2.1倍,并且kojA、kojT转录水平也得到了大幅提高,上述推测得到证实。
2.2.2laeA
laeA基因是Bok等[32]于2004年首次从构巢曲霉中分离得到的新型丝状真菌次级代谢全局性调控基因,编码374个氨基酸,含有一个保守的与核蛋白甲基转移酶硫腺苷甲硫氨酸(S-adenosylmethionin,SAM)结合位点相同的结构域,SAM结合位点是laeA的关键功能域,对真菌次级代谢产物合成酶的调控主要表现为转录激活,比如,构巢曲霉中laeA可上调异青霉素N合成酶基因ipnA的mRNA水平,从而提高青霉素产量[33]。laeA及其同源类似物不仅存在于构巢曲霉中,同样也存在于许多其它的丝状真菌(如烟曲霉、黄曲霉等)中。
2011年,在已有的理论基础上,日本金泽工业大学基因组生物技术实验室通过构建米曲霉基因敲除模型对laeA进行敲除和回补,观察曲酸生物合成相关的基因表达及曲酸合成情况[34]。结果发现,laeA敲除后,kojA、kojR和kojT的表达量明显下降,发酵9 d后几乎没有曲酸积累,回补株则回到正常水平。表明,laeA在曲酸生物合成过程中起重要的调控作用。
2.2.3msnA
msnA及其同源基因编码一种C2H2型锌指调节蛋白,在多种应力调节反应中发挥作用。当微生物面临生长压力时,msnA可通过结合位于目标基因上游的应力调节元件的保守区域CCCCT,调控目标基因的转录和表达[35-36]。
为了研究msnA在菌株承受外界压力时对菌落表型、次级代谢产物等方面的调节作用,Chang等[37]将msnA敲除后发现,A.parasiticusBN9、A.parasiticusRH、A.flavusCA14发酵8 d后,曲酸产量较野生菌株分别下降了20倍、10倍和4倍,表明msnA在曲酸合成过程中具有一定的负向调节作用。
3 结语
目前,国内关于曲酸的研究主要集中在菌株筛选方面,水平远落后于日本。为了避免传统诱变育种的盲目性,需从分子水平进行突破。考虑到调节基因的范围广,有一定的研究基础,曲酸的生物合成研究更倾向于调节基因,但合成基因簇方面的研究自2010年一直停滞不前,未能揭示曲酸的生物合成途径。因此从分子水平上提高曲酸产量有待深入研究。
随着各类数据库以及生物信息学软件(如SMURF、KEGG等)的开发,真菌次级代谢产物的研究有了更加便捷的手段,但一般的次级代谢研究软件对次级代谢产物(如青霉素、黄曲霉毒素等)合成的研究是基于聚酮合酶(polyketide synthase,PKS)和非核糖体肽合成酶(nontibosomal peptide synthetase,NRPS)等骨架基因的发现,而曲酸结构简单,并不涉及这2种酶的利用,从而阻碍了生物信息学软件在曲酸生物合成途径研究中的应用。
综上,尽管普通的诱变育种可使曲酸产量较野生菌株大幅提高,但曲酸应用广泛,需求量大,为了进一步指导曲酸生产,研究方向应逐渐转到分子水平,致力于合成基因簇的界定及代谢途径的确定。尽管存在一定的困难,但以阐明合成途径为桥梁,以基因工程为手段进行诱变育种,具有更明确的靶向性及更广阔的发展前景。
[1]BEÉLIK A.Kojic acid[J].Advances in Carbohydrate Chemistry,1956,48(11):145-183.
[2]CREUGER W.Biotechnology:A Textbook of Industrial Microbiology[M].Sunderland:Sinauer Associates,Incorporated,1990:126-127.
[3]AZZAM O A,LEHETA T M,NAGUI N A,et al.Different therapeutic modalities for treatment of melasma[J].Journal of Cosmetic Dermatology,2009,8(4):275-281.
[4]SARUNO R,KATO F,IKENO T.Kojic acid,a tyrosinase inhibitor fromAspergillusalbus[J].Agricultural and Biological Chemistry,1979,43(6):1337-1338.
[5]BRTKO J,RONDAHL L,FICKOVA M,et al.Kojic acid and its derivatives:history and present state of art[J].Central European Journal of Public Health,2004,12(S):S16-S18.
[6]LEE Y S,PARK J H,KIM M H,et al.Synthesis of tyrosinase inhibitory kojic acid derivative[J].Archiv der Pharmazie,2006,339(3):111-114.
[7]KHAMARUDDIN N H,BASRI M,EE G C L,et al.Enzymatic synthesis and characterization of palm-based kojic acid ester[J].Journal of Oil Palm Research,2008,20(2):461-469.
[8]ASHARI S E,MOHAMAD R,ARIFF A,et al.Optimization of enzymatic synthesis of palm-based kojic acid ester using response surface methodology[J].Journal of Oleo Science,2009,58(10):503-510.
[9]MANABE M,GOTO T,TANAKA K,et al.The capabilities of theAspergillusflavus group to produce aflatoxins and kojic acid[J].Rep Natl Food Res Inst,1981,38:115-120.
[10]LIN M T,MAHAJAN J R,DIANESE J C,et al.High production of kojic acid crystals byAspergillusparasiticusUNBF A12 in liquid medium[J].Applied and Environmental Microbiology,1976,32(2):298-299.
[11]YAN S,TANG H,WANG S,et al.Improvement of kojic acid production inAspergillusoryzaeB008 mutant strain and its uses in fermentation of concentrated corn stalk hydrolysate[J].Bioprocess and Biosystems Engineering,2014,37(6):1095-1103.
[12]谢光蓉.曲酸生产菌的复合诱变选育[J].食品与发酵科技,2013,49(6):43-45.
[13]EL-AZIZ A B A.Improvement of kojic acid production by a mutant strain ofAspergillusflavus[J].Journal of Natural Sciences Research,2013,3(4):31-41.
[14]凌帅,刘咏,姚建铭,等.紫外线与N+注入复合诱变选育曲酸高产菌株[J].食品科学,2013,34(1):234-238.
[15]解西玉,曾柏全,周小芹,等.曲酸生产菌的60Co-γ射线诱变选育及表征[J].食品工业科技,2010,31(12):212-213.
[16]赵鑫,赵金,吴思国,等.曲酸高产菌株的诱变选育[J].激光生物学报,2010,19(4):542-545.
[17]董静,孟宪军,郑艳,等.复合诱变对米曲霉2336产酸量的影响[J].食品与发酵工业,2005,31(9):32-34.
[18]赵新河,李枚秋,钟秋平.曲酸及其衍生物的研究进展[J].中国酿造,2007,26(10):4-7.
[19]FOX E M,HOWLETT B J.Secondary metabolism:regulation and role in fungal biology[J].Current Opinion in Microbiology,2008,11(6):481-487.
[20]SHIMIZU T,KINOSHITA H,ISHIHARA S,et al.Polyketide synthase gene responsible for citrinin biosynthesis inMonascuspurpureus[J].Applied and Environmental Microbiology,2005,71(7):3453-3457.
[21]ARNSTEIN H R V,BENTLEY R.Kojic acid biosynthesis from 1-14C-glucose[J].Nature,1950,166(4231):948-949.
[22]ARNSTEIN H R V,BENTLEY R.The biosynthesis of kojic acid.Ⅰ.production from [1-14C] and [3∶4-14C2] glucose and [2-14C]-1∶3-dihydroxyacetone[J].Biochemical Journal,1953,54(3):493-508.
[23]ARNSTEIN H R V,BENTLEY R.The biosynthesis of kojic acid.Ⅱ.the occurrence of aldolase and triosephosphate isomerase inAspergillusspecies and their relationship to kojic acid biosynthesis[J].Biochemical Journal,1953,54(3):508-516.
[24]ARNSTEIN H R V,BENTLEY R.The biosynthesis of kojic acid.Ⅲ.the incorporation of labelled small molecules into kojic acid[J].Biochemical Journal,1953,54(3):517-522.
[25]ARNSTEIN H R V,BENTLEY R.The biosynthesis of kojic acid.Ⅳ.production from pentoses and methyl pentoses[J].Biochemical Journal,1956,62(3):403-411.
[26]KITADA M,FUKIMBAR A T.Studies on kojic acid fermentation.Ⅶ.the mechanism of the conversion of glucose to kojic acid[J].Journal of Fermentation Technology,1971,49(10):847-851.
[27]BAJPAI P,AGRAWALA P K,VISHWANATHAN L.Enzymes relevant to kojic acid biosynthesis inAspergillusflavus[J].Microbiology,1981,127(1):131-136.
[28]KOBAYASHI T,ABE K,ASAI K,et al.Genomics ofAspergillusoryzae[J].Bioscience,Biotechnology,and Biochemistry,2007,71(3):646-670.
[29]TERABAYASHI Y,SANO M,YAMANE N,et al.Identification and characterization of genes responsible for biosynthesis of kojic acid,an industrially important compound fromAspergillusoryzae[J].Fungal Genetics and Biology,2010,47(12):953-961.
[30]MARUI J,YAMANE N,OHASHI-KUNIHIRO S,et al.Kojic acid biosynthesis inAspergillusoryzaeis regulated by a Zn2Cys6transcriptional activator and induced by kojic acid at the transcriptional level[J].Journal of Bioscience and Bioengineering,2011,112(1):40-43.
[31]YAMADA R,YOSHIE T,WAKAI S,et al.Aspergillusoryzae-based cell factory for direct kojic acid production from cellulose[J].Microbial Cell Factories,2014,13(1):1-8.
[32]BOK J W,KELLER N P.laeA,a regulator of secondary metabolism inAspergillusspp.[J].Eukaryotic Cell,2004,3(2):527-535.
[34]ODA K,KOBAYASHI A,OHASHI S,et al.AspergillusoryzaeLaeA regulates kojic acid synthesis genes[J].Bioscience,Biotechnology,and Biochemistry,2011,75(9):1832-1834.
[35]SCHMITT A P,McENTEE K.Msn2p,a zinc finger DNA-binding protein,is the transcriptional activator of the multistress response inSaccharomycescerevisiae[J].Proceedings of the National Academy of Sciences,1996,93(12):5777-5782.
[36]TREGER J M,MAGEE T R,MCENTEE K.Functional analysis of the stress response element and its role in the multistress response ofSaccharomycescerevisiae[J].Biochemical and Biophysical Research Communications,1998,243(1):13-19.
[37]CHANG P K,SCHARFENSTEIN L L,LUO M,et al.Loss ofmsnA,a putative stress regulatory gene,inAspergillusparasiticusandAspergillusflavusincreased production of conidia,aflatoxins and kojic acid[J].Toxins,2011,3(1):82-104.
Research Progress on Fermentation and Biosynthesis Pathways of Kojic Acid
SHEN Min-na,CHEN Jian-hua
(SchoolofLifeScienceandTechnology,ChinaPharmaceuticalUniversity,Nanjing210009,China)
Thestatusofkojicacidfermentationwasintroducedinthispaper.Theresearchmeansandachievementsforbiosynthesispathwaysofkojicacidwerereviewed,includingtraditionalmeanisotopelabelingandemergingapproachgenomicanalysis.Thepossiblebiosynthesispathwaysofkojicacidandrelatedsynthesisandregulationgenesweresummarized.
kojicacid;fermentation;biosynthesis;genomics
10.3969/j.issn.1672-5425.2016.08.003
2016-04-06
申敏娜(1991-),女,河北石家庄人,硕士研究生,研究方向:微生物与生化药学,E-mail:minna910320@163.com;通讯作者:陈建华,教授,E-mail:chenjhnj@163.com。
TQ 921.7
A
1672-5425(2016)08-0010-05
申敏娜,陈建华.曲酸发酵及生物合成途径研究进展[J].化学与生物工程,2016,33(8):10-14.
