基于显微操作的高效细胞电融合芯片的设计
2016-09-14舒承松陈瑞华汝长海
舒承松,陈瑞华,汝长海,2
(1.苏州大学 江苏省先进机器人技术重点实验室,江苏 苏州 215123;2.苏州大学 苏州纳米科技协同创新中心,江苏 苏州 215123;3.苏州大学附属第一医院临床免疫研究所,江苏 苏州 215006)
基于显微操作的高效细胞电融合芯片的设计
舒承松1,陈瑞华3,汝长海1,2
(1.苏州大学 江苏省先进机器人技术重点实验室,江苏 苏州 215123;2.苏州大学 苏州纳米科技协同创新中心,江苏 苏州 215123;3.苏州大学附属第一医院临床免疫研究所,江苏 苏州 215006)
设计了一款基于显微操作的高效细胞电融合芯片,并针对该电融合芯片提出了一种快速、准确、灵活的细胞配对融合操作方法。芯片使用ITO玻璃作为基底,在ITO上覆盖一层2 μm厚的正光刻胶,并利用光刻加工技术在光刻胶上加工出直径25 μm的微孔电极。设计了不同电极间距的微孔电极阵列,与钨针电极构成电融合电极对进行了细胞电融合实验。结果表明,电极间距为10 mm的微孔电极阵列能够实现高效的细胞配对,在间距为0.5 mm的微孔电极阵列上未观测到细胞吸附现象。
显微操作;配对方法;电融合芯片;光刻;微孔电极
细胞电融合是一种发展迅速的细胞工程技术,被广泛应用于植物杂交[1]、抗肿瘤疫苗制备[2]和单克隆抗体制备[3]等领域。快速准确地实现待融合细胞的配对一直是细胞电融合的研究热点。国内外研究机构对目标细胞配对进行了大量研究,并利用现代微加工技术设计了很多高效的电融合芯片。
麻省理工研究团队设计了双面凹形的微陷阱阵列,通过控制融合芯片内部的液体流动,使体积相近的两种细胞准确快速地配对[4],后续通过改进陷阱的结构使体积相差较大的细胞也能排队融合[5-6]。重庆大学研究团队一直致力于高通量微电极阵列芯片的研究,通过优化电极的形状与位置,不断提高细胞电融合芯片的精度与效率[7-9]。这些芯片主要针对单克隆抗体或肿瘤疫苗制备等需进行大量细胞配对的场合;若细胞数量较少,易造成细胞丢失而导致细胞配对率低。如牛的体细胞核移植时,需将供体细胞与去核卵母细胞电融合。由于两种细胞体积相差较大,使用目前的电融合芯片难以准确配对。目前常选择人工操作微电极移动细胞进行配对,操作复杂,实验稳定性较差。
Clow等[10]针对这种情况,利用光刻胶覆盖一对交错的钛电极,设计了一款独特的微孔电极阵列芯片,将以前需人工操作的微电极固定,通过移液管将细胞搬运到电极附近,再使用介电泳力将细胞配对。这款芯片的优点是操作简单、易实现自动化,缺点是针对不同体积的细胞需要设计不同间距的电极,不够灵活。
相比于一对固定电极或者一对移动电极,一侧固定电极、一侧移动电极的设计能够很好地综合两者的优点,并且在最大程度上避免两者的缺点。作者将自制的微孔电极阵列芯片与一根尖端约20μm的钨针电极构成一对融合电极,进行了细胞电融合实验,并探讨了不同间距的微孔电极阵列对实验结果的影响。
1 细胞电融合原理
细胞电融合过程分为3步:第一步,细胞配对,使用物理或者化学方法使待融合细胞紧密接触,并沿电场线方向排列;第二步,细胞膜可逆性电穿孔,对待融合细胞施加高压电脉冲,使得细胞接触部分的细胞膜产生可逆性穿孔;第三步,细胞膜融合,继续保持细胞间的紧密接触直到细胞完成膜融合。细胞电融合过程如图1所示。
细胞配对细胞膜可逆性电穿孔细胞膜融合
图1细胞电融合过程示意图
Fig.1Schematic images of cell electrofusion process
由图1可知,在加入正弦交变电场后,电场中的细胞被极化形成电偶极子,并在介电泳力的作用下在电极上排队(图1a);细胞膜在高压电脉冲下出现可逆性电穿孔,电解液中溶质进入细胞使得细胞膜膨胀(图1b);继续保持正弦信号使得细胞依然紧密接触直至细胞完成膜融合(图1c)。
2 芯片的设计与制造方法
实验所用杂交瘤细胞直径在18~25 μm之间,因此将微孔电极直径设计为25 μm。
在最初的电极设计中,微孔电极阵列的电极间距为0.5 mm,实验时使用1滴融合液将电极全部覆盖,但在实验过程中未观察到微孔电极吸附细胞的现象,初步推测可能是多个电极在融合液滴中产生的电场相互干扰,减小了细胞受到的介电泳力。
因此,将电极间距改为10 mm,实验中每个微孔电极用1个微滴单独覆盖,并以0.5 mm间距的电极阵列作为对照。
图2为设计的掩模板(40 mm×40 mm)。

a.0.5 mm间距的电极阵列 b.10 mm间距的电极阵列 c.用于接出导线,连接融合信号发生器 d.无电极,在实验时放置待操作的细胞
在镀有氧化铟锡(ITO)薄膜(厚度约180 nm)的玻璃上旋涂一层厚度约为2 μm的正光刻胶RZJ-390PG。在100 ℃前烘90 s后盖上掩模板曝光5 s;120 ℃后烘120 s后,放入显影液中60 s。显影完毕后用去离子水清洗芯片,在显微镜下观察芯片是否加工完成。加工完成的电极芯片如图3所示。

电极芯片实物图0.5 mm间距的电极阵列
图3电极芯片
Fig.3Electrode chip
3 实验
3.1材料与仪器
杂交瘤细胞 pd1-612由苏州大学附属第一医院提供;电融合缓冲液(溶液成分0.3 mol·L-1甘露醇,0.1 mmol MgCl2,0.1 mmol CaCl2,37 ℃时电导率为80 μS·cm-1)。
TE2000型倒置显微镜,Nikon公司;定位运动平台,Prior公司;MP285型显微操作仪,Sutter公司;A601f型CCD摄像机,Basler公司; PHD ULTRATM4400型微量注射泵,Harvard公司;恒温热台,TOKAT HIT公司;自制电融合仪。
3.2实验准备
将自制30 μm内径的玻璃移液管与微量注射泵连接,安装在左操作手上,对细胞进行吸吐与搬运操作。将钨丝尖端磨至20 μm,装在右操作手上并与自制电融合仪相连。自制的电融合芯片放置在定位运动平台上,并与自制电融合仪连接。细胞电融合显微操作系统如图4所示。
在细胞配对与电融合实验中,由于细胞培养液中离子浓度很高,在外加电场下会产生明显的焦耳热现象,使液体产生对流影响细胞排队,同时较高的离子浓度也会降低溶液中的电场梯度,影响细胞电穿孔效果。因此实验开始前需将细胞离心,且用37 ℃的电融合缓冲液替换细胞培养液。
3.3细胞配对实验
(1)控制平台移动,在显微镜下找到电融合芯片上微孔电极的位置并记录。

图4 细胞电融合显微操作系统
(2)用移液枪在微孔电极上方滴加不含细胞的电融合液。用100 μL溶液覆盖0.5 mm间距电极阵列的整个区域;用4滴50 μL的溶液分别覆盖10 mm间距电极阵列中的4个微孔电极。
(3)用移液枪吸取适量含有细胞的电融合液加入到芯片上无电极区域。使用左操作手与微量注射泵控制玻璃移液管吸取少量细胞。
(4)将平台移动到微孔电极所在区域,控制右操作手带动钨针电极靠近微孔电极,并打开自制电融合仪,接通细胞配对信号(-2~2 V,1 MHz,正弦波)。
(5)控制左侧玻璃移液管在微孔电极附近吐出一个细胞。细胞将在重力与介电泳力的作用下吸附在底部微孔电极上。
(6)控制左侧玻璃移液管吐出第二个细胞,这次细胞吐出的位置应稍稍偏右,有助于细胞与上一个细胞形成细胞串。
(7)待细胞成串排列后,加入细胞电穿孔信号,完成电穿孔后,保持细胞配对信号30 s,等待细胞膜融合。
(8)待细胞完成膜融合后,移动平台到另一个微孔电极处,重复步骤(4)~(7)。
4 结果与讨论
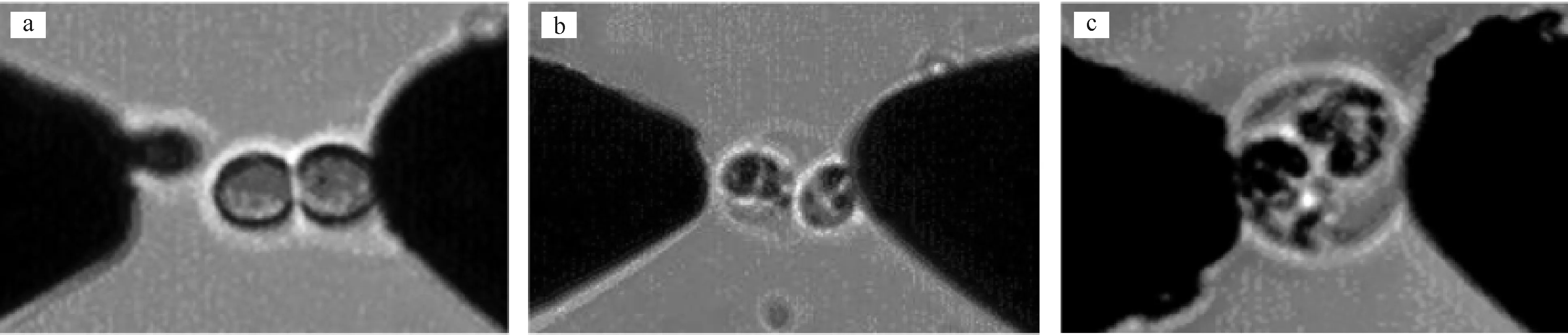
图5为电极间距为0.5 mm的电极阵列中细胞的运动过程。
图5a中,细胞位于微孔电极附近,但此时细胞并未在介电泳力的作用下向微孔电极移动。图5b中,控制右侧钨针电极靠近微孔电极后,细胞在介电泳力的作用下吸附到钨针电极上。
图6为电极间距为10 mm的电极阵列中细胞的配对过程。
图6a中,移液管吐出的细胞在介电泳力与重力的作用下被微孔电极吸附。图6b中,移液管吐出的两个细胞成串排列。

细胞位于微孔电极附近 细胞吸附到钨针电极上

单个细胞吸附两个细胞成串配对
图6细胞配对过程
Fig.6Cell paring process
结果表明,采用0.5 mm间距的电极阵列进行细胞配对实验时,由于一个微滴中有多个电极的存在,导致细胞受到的介电泳力减弱,细胞由于细胞膜粘附力的作用,附着在芯片上,没有发生移动。增大排队信号幅值或减小电极间距后,细胞向右侧钨针电极移动。
当电极间距为10 mm时,一滴50 μL的微滴仅覆盖了一个微孔电极,微滴中的电场分布情况简单,可以简化成两根针尖电极对细胞进行作用。在外加峰峰值为2 V、频率为1 MHz的正弦排队信号后,微孔边缘周边50 μm内的肿瘤细胞能以20 μm·s-1的速度向电极中心移动。
5 结论
所有的细胞核移植过程中都需要使待融合的细胞紧密接触,并且尽量使细胞对的长轴与电场线方向平行。由操作员手动调整待融合细胞的位置的方法难度较大,并且容易给实验带来干扰。
针对这种需要对少量细胞进行快速准确配对的细胞融合实验,设计了一种新的细胞电融合芯片,基于该芯片提出了一种细胞电融合显微操作方法。细胞配对实验结果表明,10 mm间距的微孔电极阵列能够高效地实现细胞排队。
该芯片制作简单、操作容易、适用于多种直径的细胞。与同领域的其它细胞电融合显微操作方法相比,本方法对人工操作精度的要求更低,更容易实现细胞配对的自动化。
[1]DAVEY M R,ANOTHONY P,POWER J B,et al.Plant protoplasts:status and biotechnological perspectives[J].Biotechnology Advances,2005,23(2):131-171.
[2]HAYASHI T,TANAKA H,TANAKA J,et al.Immunogenicity and therapeutic efficacy of dendritic-tumor hybrid cells generated by electrofusion[J].Clinical Immunology,2002,104(1):14-20.
[3]郭明霞,潘最,汪和睦.电融合方法建立抗结核杆菌单克隆抗体细胞株[J].微生物学报,1998,38(5):393-395.
[4]SKELLEY A M,KIRAK O,SUH H,et al.Microfluidic control of cell pairing and fusion[J].Nature Methods,2009,6(2):147-152.
[5]KEMNA E W M,WOLBERS E,VERMES I,et al.On chip electrofusion of single human B cells and mouse myeloma cells for efficient hybridoma generation[J].Electrophoresis,2011,32(22):3138-3146.
[6]DURA B,LIU Y P,VOLDMAN J.Deformability-based microfluidic cell pairing and fusion[J].Lab on A Chip,2014,14(15):2783-2790.
[7]HU N,ZHANG X L,YANG J,et al.A cell electrofusion microfluidic chip with micro-cavity microelectrode array[J].Microfluidics & Nanofluidics,2013,15(2):151-160.
[8]WANG Z Y,HU N,YEH L H,et al.Electroformation and electrofusion of giant vesicles in a microfluidic device[J].Colloids & Surfaces B:Biointerfaces,2013,110(10):81-87.
[9]ZHANG Y,ZHANG X F,BAI G H,et al.Preparation and experimental study on dielectrophoresis-based microfluidic chip for cell patterning[J].Chinese Journal of Analytical Chemistry,2014,42(11):1568-1573.
[10]CLOW A L,GAYNOR P T,OBACK B J.A novel micropit device integrates automated cell positioning by dielectrophoresis and nuclear transfer by electrofusion[J].Biomedical Microdevices,2010,12(5):777-786.
Design of an Efficient Cell Electrofusion Chip Based on Micromanipulation
SHU Cheng-song1,CHEN Rui-hua3,RU Chang-hai1,2
(1.JiangsuProvincialKeyLaboratoryofAdvancedRobotics,SoochowUniversity,Suzhou215123,China;2.CollaborativeInnovationCenterofSuzhouNanoScienceandTechnology,SoochowUniversity,Suzhou215123,China;3.InstituteofClinicalImmunology,TheFirstAffiliatedHospitalofSoochowUniversity,Suzhou215006,China)
Anefficientcellelectrofusionchipbasedonmicromanipulationwasdesigned.Afast,accurateandflexiblecellpairingmethodwasdevelopedforthiselectrofusionchip.Thechipprototypewasfabricatedonanindiumtinoxide(ITO)substratethatwassubsequentlycoveredbyapositivephotoresistfilmwiththethicknessof2μm.Microporeelectrodesmeasuring25μmindiameterwerefabricatedonthefilmbylithography.Microporeelectrodearrayswithdifferentspacingsweremanufacturedandpairedwithtungstenneedleforcellelectrofusionexperiment.Resultsshowedthatmicroporeelectrodearraywitha10mmspacingcouldpairthecellefficiently,howevercellsalignonthemicroporeelectrodearraywith0.5mmspacingwasnotobserved.
micromanipulation;pairingmethod;electrofusionchip;lithography;microporeelectrode
10.3969/j.issn.1672-5425.2016.08.015
国家重大科研仪器设备研制专项(61327811),国家自然科学基金资助项目(61174087,61233010),江苏省杰出青年基金资助项目(BK2012005)
2016-03-31
舒承松(1990-),男,湖北武汉人,硕士研究生,研究方向:显微操作系统,E-mail:sudamugong@163.com;通讯作者:汝长海,教授,E-mail:rzh@suda.edu.cn。
Q 813.2
A
1672-5425(2016)08-0063-04
舒承松,陈瑞华,汝长海.基于显微操作的高效细胞电融合芯片的设计[J].化学与生物工程,2016,33(8):63-66.
