羟自由基氧化系统对虾蛄盐溶蛋白结构和功能性的影响
2016-09-14周景丽张坤生任云霞天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室天津300134
周景丽,张坤生,任云霞(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
羟自由基氧化系统对虾蛄盐溶蛋白结构和功能性的影响
周景丽,张坤生*,任云霞
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
采用由0.01 mmol/L FeCl3、0.1 mmol/L抗坏血酸和不同浓度(0~20 mmol/L)H2O2组成的羟自由基氧化体系,对虾蛄盐溶蛋白分别氧化1、3、5 h后测定蛋白的羰基含量、巯基含量、二酪氨酸含量、蛋白表面疏水性、浊度及乳化性。结果表明:羟自由基氧化会引起虾蛄盐溶蛋白结构发生改变,表现在羰基含量增加、巯基含量减少、二酪氨酸含量增加、表面疏水性升高、浊度上升及乳化性下降。这些氧化引起的变化说明,虾蛄盐溶蛋白结构对羟自由基氧化体系有很大的敏感性。
虾蛄,盐溶蛋白,氧化,羟自由基
虾蛄是季节性极强的海产品[1],且消费者对其需求量日益增加,所以对虾蛄的研究具有十分重要的意义。虾蛄在加工、流通和贮藏过程中,不可避免地受到温度、光、射线、氧、水分和催化剂等外界环境的影响,导致脂肪和蛋白质等营养成分发生氧化[2]。研究表明,蛋白质氧化是导致肉类食品品质下降的重要原因[3]。氧化不仅可以降低肉的食用品质,如嫩度、多汁性、风味和色泽等,还会影响肉的功能性,如乳化性[4-5]。目前对肌肉蛋白质氧化的报道主要集中在畜肉和鱼类,虾蛄肉品质劣变是否与蛋白质发生氧化相关还未见报道。本实验采用羟自由基氧化体系对虾蛄盐溶蛋白进行氧化,通过测定羰基、巯基、二酪氨酸、表面疏水性、浊度及乳化性,探讨蛋白质发生氧化对虾蛄盐溶蛋白内部结构产生的影响。
1 材料与方法
1.1 材料与仪器
虾蛄 购买于天津金元宝滨海农产品交易市场;考马斯亮蓝G250、溴酚蓝(BPB) 天津市科密欧化学试剂开发中心;牛血清白蛋白(BSA)、EDTA Sigma试剂公司;无水乙醇、磷酸氢二钠、磷酸二氢钠、三氯化铁 天津市北方天医化学试剂厂;85%磷酸、30%过氧化氢、乙酸乙酯、盐酸 天津市风船化学试剂科技有限公司;抗坏血酸、KCl天津市赢达稀贵化学试剂厂;哌嗪-N,N—双(2-乙磺酸)(PIPES)、5,5'-二硫代双(2-硝基苯甲酸)(DTNB) 北京博奥拓达科技有限公司;2,4-二硝基苯肼、盐酸胍 天津市光复精细化工研究所;十二烷基硫酸钠(SDS) 北京鼎国生物技术有限责任公司;尿素、甘氨酸、Tris等化学试剂 均为分析纯。
A2004A电子天平 上海精天仪器有限公司;IKAT10高速组织匀浆机 德国IKA公司;Avanti J-E高效离心机 美国贝克曼库尔特有限公司;UV-7504紫外可见分光光度计 上海欣茂仪器有限公司;EL20实验室pH计 梅特勒-托利多仪器有限公司;磁力搅拌器 天津市欧诺仪器仪表有限公司;5J2-0004荧光分光光度计 日立高新技术公司
1.2 实验方法
1.2.1 虾蛄盐溶蛋白的提取 参考Sun[6]和邱春强[7]的方法,并结合前期实验结果做改进如下:取经过冷冻的虾蛄,在4℃下解冻24 h。将解冻后的虾蛄去头,去甲壳,去净肠腺及虾黄,称取虾蛄肉5 g,加入2.7倍体积的pH为6.46的磷酸盐缓冲液,并要求NaCl浓度0.10 mol/L。在10000 r/min的转速下用高速组织匀浆机均质30 s,并用磁力搅拌20 min。将匀浆液用纱布过滤,在10000 r/min的转速下离心10 min,收集上清液即为虾蛄盐溶蛋白。用去离子水稀释上清液后测定蛋白质含量,蛋白质含量的测定采用考马斯亮蓝法[8]。
1.2.2 虾蛄盐溶蛋白的氧化 参考Wu等[9]的方法构建以下模拟氧化体系:反应历程为,VC+Fe3+→Fe2+,Fe2++H2O2→·OH。本实验主要采用H2O2氧化体系,模拟体系中,虾蛄盐溶蛋白的浓度为5 mg/mL,FeCl3浓度为0.01 mmol/L,VC浓度为0.1 mmol/L,H2O2浓度分别为0.5、1、5、10、20 mmol/L。在4℃条件下氧化1、3、5 h用1 mmol/L EDTA终止。以上的氧化反应均在15 mmol/L哌嗪-N,N—双(2-乙磺酸)缓冲溶液(pH6.0,离子强度0.6 mol/L)中进行。空白对照为新鲜虾蛄中提取出来后,未加氧化剂直接于4℃放置1、3、5 h的虾蛄盐溶蛋白,每个处理设置3个重复。
1.2.3 羰基含量测定 参考 Levine等[10]测定羰基的方法,并稍作修改,方法如下:取10 mL的离心管中,加入1 mL浓度为5 mg/mL的蛋白溶液与1 mL 10 mmol/L 2,4-二硝基苯肼的2 mol/L HCl溶液,在25℃下反应1 h(每5 min旋涡振荡一次),添加1 mL 20%三氯乙酸,10000 r/min离心5 min,弃清液,蛋白沉淀用1 mL的乙醇-乙酸乙酯溶液(体积比为1∶1)洗涤3次,挥发完溶剂后将蛋白质悬浮于3 mL 6 mol/L盐酸胍溶液中,在37℃条件下水浴保温30 min,10000 r/min离心5 min。空白样品中加入1 mL不含2,4-二硝基苯肼的2 mol/L HCl溶液。以空白为对照370 nm下测吸光值,蛋白质羰基衍生物的含量(nmol/mg蛋白)使用摩尔吸光系数为22000 mol-1·L·cm-1计算。
1.2.4 巯基含量测定 总巯基的测定参考Simplicio等[11]使用Ellman试剂法稍作修改进行测定。方法如下:将1 mL 5 mg/mL蛋白溶液与8 mL Tris-甘氨酸溶液(pH=8,每升该溶液中含有10.4 g Tris,6.9 g甘氨酸,1.2 g EDTA,8 mol尿素)混合,将4.5 mL样品溶液加入0.5 mL 10 mmol/L Ellman试剂,30 min后在412 nm处测定吸光值,巯基浓度计算使用摩尔吸光系数13600 mol-1·L·cm-1计算。
1.2.5 二酪氨酸含量测定 参考Davies等[12]的方法并略加修改测定样品中二酪氨酸含量,取氧化后的虾蛄盐溶蛋白溶液1 mL,稀释10倍后用考马斯亮蓝法测定溶液的蛋白含量。用荧光光度法测定溶液中二酪氨酸含量,测定条件为:发射波长420 nm(狭缝5 nm),激发波长325 nm(狭缝5 nm)。测定结果用荧光强度除以稀释后蛋白浓度,表示为相对荧光值(Arbitrary Units,AU)。
1.2.6 蛋白表面疏水性的测定 参考孙为正[13]的方法,并稍作修改方法如下:用20 mmol/L磷酸盐缓冲液(pH6.46)将虾蛄盐溶蛋白溶液浓度调至2 mg/mL。取2 mL稀释蛋白液加入40 μL 1 mg/mL的溴酚蓝(BPB)溶液,充分混合。对照组处理为磷酸盐缓冲液中直接加入溴酚蓝溶液(不含虾蛄盐溶蛋白),其余操作同上。处理组和对照组在室温下振荡10 min,然后在4℃条件下4000 r/min离心15 min。磷酸盐缓冲液空白作为本底,上清液在595 nm处测定吸光度。用结合态的疏水溴酚蓝结合量(总溴酚蓝与游离溴酚蓝的差值)作为表面疏水性指数。表面疏水性用以下公式表示:
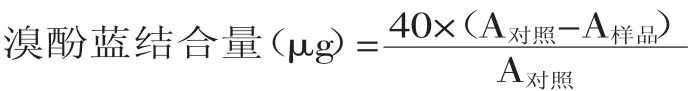
1.2.7 虾蛄盐溶蛋白浊度的测定 依据Benjakul[14]的方法测定虾蛄盐溶蛋白浊度。吸取蛋白浓度为1 mg/mL的虾蛄盐溶蛋白的溶液5 mL放入试管中,经过不同H2O2浓度羟自由基氧化系统氧化后,分别在30、40、50、60、70℃的水浴锅中水浴30 min后取出,冷却后以不加蛋白的溶液为空白,在600 nm处测定吸光值。
1.2.8 虾蛄盐溶蛋白乳化活力和乳化稳定性的测定
虾蛄盐溶蛋白的乳化性质的测定采用浊度法[15]。取质量浓度为1 mg/mL的磷酸化虾蛄盐溶蛋白8.0 mL 与2.0 mL的大豆油混合放入直径为2.5 cm的塑料离心管中用匀浆机高速匀浆1 min,立即从距离心管底0.5 cm的地方取匀浆液50 μL,加入到5 mL为0.1% (m/v)SDS溶液中,振荡混匀后在500 nm处测定吸光值记作A0,匀浆后10 min再次在相同的位置取匀浆液50 μL,加入到5 mL 0.1%SDS溶液中,振荡混匀后测定吸光值A10,用0.1%SDS溶液作空白对照。磷酸化虾蛄盐溶蛋白的乳化活力EAI(m2/g)和乳化稳定性ESI (%),分别用下面的公式来计算:
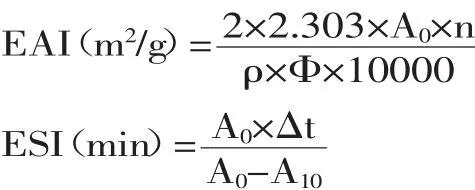
式中:EAI为乳化能力;ESI为乳化稳定性;n为稀释倍数;ρ为蛋白质质量浓度(g/mL);Φ为油相体积分数(v/v)(Φ=0.2);A0为均质结束后样品在波长500 nm处的吸光度;A10为均质10 min后的样品在波长500 nm处的吸光度;Δt为10 min。
1.2.9 数据处理 实验用设计分析软件为Design Expert 8.0,采用SPSS16.0对数据进行处理和分析。
2 结果与分析
2.1 自由基氧化体系对虾蛄盐溶蛋白中羰基含量的影响由图1可见,当氧化时间相同时,羰基含量随H2O2浓度的升高而增加,如在氧化5 h条件下,虾蛄盐溶蛋白经过0.5、1、5、10、20 mmol/L H2O2氧化后,与对照组相比,羰基含量分别增加了8.3%、23.8%、56.9%、86.7%、99.4%。当H2O2浓度相同时,羰基含量随氧化时间的延长而增加,如虾蛄盐溶蛋白经过1、3、5 h氧化后,当H2O2浓度增加至20 mmol/L时,与对照组相比,其羰基含量分别增加了54.2%、87.6%、99.4%。羰基的产生被作为蛋白氧化的重要指标之一,羰基含量越高表明蛋白质氧化程度越高[16-17]。羰基主要由氨基酸侧链(通常为易受自由基攻击的带有NH或者NH2的氨基酸残基)及肽键的氧化断裂产生[18],羰基含量的增加可能是由于羟自由基(·OH)对氨基酸侧链或肽链的氧化攻击造成[19]。

图1 自由基氧化体系对蛋白羰基含量的影响Fig.1 Effect of free radical generating system on carbonyl content of protein
2.2 自由基氧化体系对虾蛄盐溶蛋白中巯基含量的影响

图2 自由基氧化体系对蛋白巯基含量的影响Fig.2 Effect of free radical generating system on sulfhydryl content of protein
由图2可知,自由基氧化体系对巯基含量的影响与对羰基含量的变化趋势恰好相反,当氧化时间相同时,巯基含量随H2O2浓度的升高而减少,如在氧化5 h条件下,虾蛄盐溶蛋白经过0.5、1、5、10、20 mmol/L H2O2氧化后,与对照组相比,巯基含量分别减少了37.1%、42.9%、51.4%、52.8%、65.1%。当H2O2浓度相同时,巯基含量随氧化时间的延长而降低,如虾蛄盐溶蛋白经过1、3、5 h氧化后,当H2O2浓度增加至20 mmol/L时,与对照组相比,其巯基含量分别降低了59.6%、63.3%、65.1%。巯基含量的降低可能是由于羟自由基诱导的蛋白质氧化会导致蛋白质中巯基转化成二硫键,从而造成蛋白质巯基含量下降[20]。
2.3 自由基氧化体系对虾蛄盐溶蛋白中二酪氨酸含量的影响
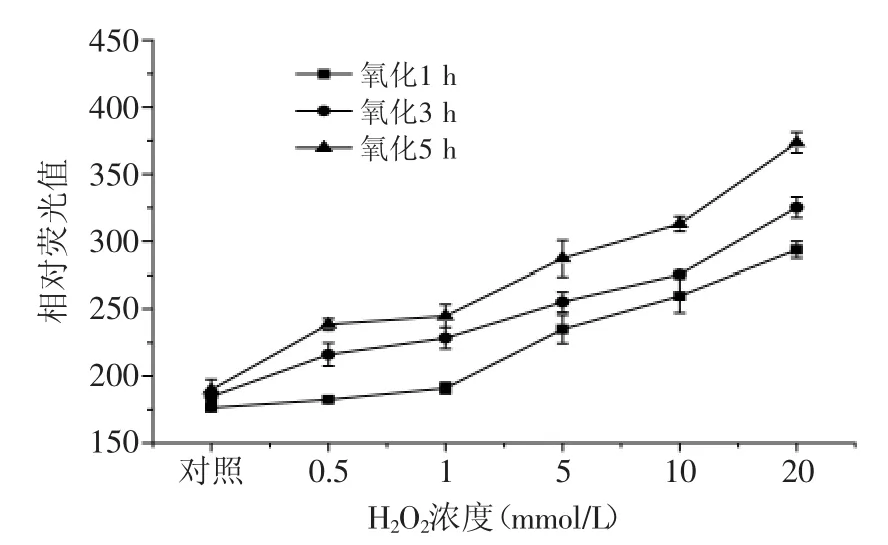
图3 自由基氧化体系对蛋白二酪氨酸含量的影响Fig.3 Effect of free radical generating system on bityrosine content of protein
由图3可知,自由基氧化体系对二酪氨酸含量相对荧光值的影响与对羰基含量的变化趋势相似,当氧化时间相同时,二酪氨酸含量相对荧光值随H2O2浓度的升高而增加,如在氧化5 h条件下,虾蛄盐溶蛋白经过0.5、1、5、10、20 mmol/L H2O2氧化后,与对照组相比,二酪氨酸含量相对荧光值分别增加了25.6%、29.1%、51.4%、65%、99.5%。当H2O2浓度相同时,二酪氨酸含量相对荧光值随氧化时间的延长而增加,如虾蛄盐溶蛋白经过1、3、5 h氧化后,当H2O2浓度增加至20 mmol/L时,与对照组相比,其二酪氨酸含量相对荧光值分别增加了62.9%、78%、99.6%。酪氨酸是易受活性氧自由基氧化攻击的敏感型氨基酸,氧化后生成二聚酪氨酸,其含量可作为分析蛋白氧化的另一个重要指标[12]。有研究报道,在氧化体系中,随着氧化剂浓度的升高,会有越来越多的酪氨酸自由基和酪氨酸残基产生,这些酪氨酸自由基和酪氨酸残基会相互结合生成二酪氨酸,导致二酪氨酸含量逐渐增加[21]。
2.4 自由基氧化体系对虾蛄盐溶蛋白表面疏水性的影响
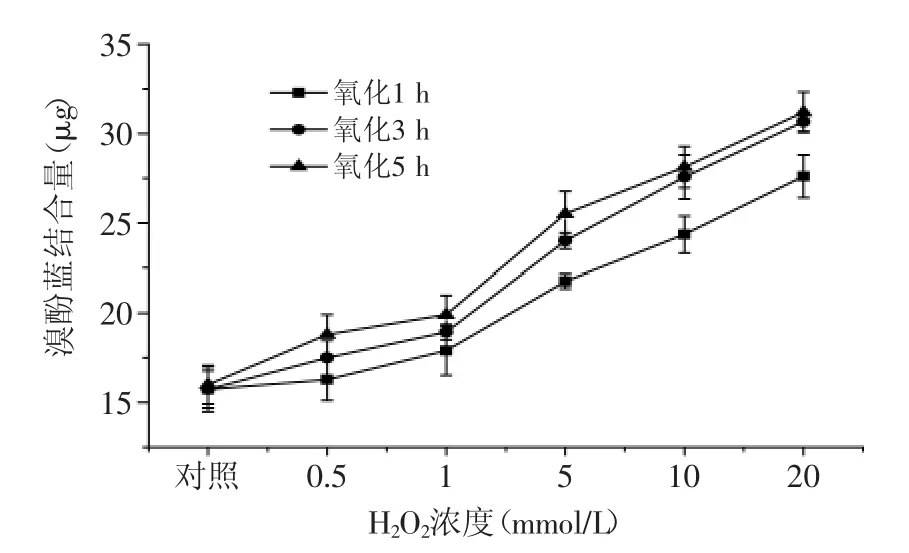
图4 自由基氧化体系对表面疏水性的影响Fig.4 Effect of free radical generating system on the surface hydrophobicity of protein
由图4可见,当氧化时间相同时,虾蛄盐溶蛋白结合溴酚蓝的量随H2O2浓度的升高而增加,如在氧化5 h条件下,虾蛄盐溶蛋白经过0.5、1、5、10、20 mmol/LH2O2氧化后,与对照组相比,结合溴酚蓝的量分别增加了17.5%、24.4%、59.4%、75.8%、95%。当H2O2浓度相同时,结合溴酚蓝的量随氧化时间的延长而增加,如虾蛄盐溶蛋白经过1、3、5 h氧化后,当H2O2浓度增加至20 mmol/L时,与对照组相比,其结合溴酚蓝的量分别增加了75.5%、94.9%、95%。通过测定蛋白质表面疏水性的变化可反映氧化引起的蛋白质的物理或化学特性的变化。蛋白氧化会导致蛋白质中疏水性氨基酸的暴露[22]。蛋白质疏水性残基可与溴酚蓝结合,从而可以通过测定蛋白质与溴酚蓝的结合量来反映蛋白质的表面疏水性[23]。
2.5 自由基氧化体系对虾蛄盐溶蛋白浊度的影响

图5 自由基氧化体系对蛋白浊度的影响Fig.5 Effect of free radical generating system on the turbidity of protein
由图5可见,虾蛄盐溶蛋白经氧化后,加热时样品的浊度表现出不同程度的变化。当氧化时间和加热温度相同时,蛋白浊度随H2O2浓度的升高而增加,如在氧化1 h,加热温度为70℃条件下,虾蛄盐溶蛋白分别经过0、0.5、1、5、10、20 mmol/L H2O2氧化后,蛋白浊度分别为0.292、0.523、0.546、0.618、0.707和0.762。当加热温度和H2O2浓度相同时,蛋白浊度随氧化时间的延长而增加,如加热温度为50℃,H2O2浓度为5 mmol/L条件下,虾蛄盐溶蛋白分别经过1、3、5 h氧化后,浊度分别为0.434、0.4394和0.494。当氧化时间和H2O2浓度相同时,蛋白浊度随加热温度的升高而升高,如在氧化3 h和H2O2浓度为5 mmol/L条件下,虾蛄盐溶蛋白分别经过30、40、50、60和70℃时,蛋白浊度分别为0.162、0.3505、0.4394、0.5785和0.698。出现这些趋势的原因可能是氧化和加热可以使蛋白质之间发生交联反应,而蛋白质分子发生交联会导致蛋白溶液光学密度增加[24],因此浊度可用于监测蛋白溶液在加热过程中蛋白质分子之间的交联程度[25]。
2.6 自由基氧化体系对虾蛄盐溶蛋白乳化活力和乳化稳定性的影响

图6 自由基氧化体系对蛋白乳化活性和乳化稳定性的影响Fig.6 Effect of free radical generating system on EAI and ESI of protein
由图6可见,当氧化时间相同时,乳化活力和乳化稳定性随H2O2浓度的升高而降低,如在氧化5 h条件下,虾蛄盐溶蛋白经过0.5、1、5、10、20 mmol/L H2O2氧化后,与对照组相比,乳化活力分别降低到0.00297、0.00283、0.00276、0.00247和0.00208 m2/g,乳化稳定性分别降低到96.747、54.186、37.882、30.461和19.191 min。当H2O2浓度相同时,乳化活力和乳化稳定性随氧化时间的延长而降低,如虾蛄盐溶蛋白经过1、3、5 h氧化后,当H2O2浓度增加至20 mmol/L时,与对照组相比,乳化活力分别降低到0.00232、0.00222和0.00208 m2/g,乳化稳定性分别降低到29.484、21.060和19.191 min。实验得出ESI和EAI有相同的下降趋势,这表明自由基氧化体系严重影响了虾蛄盐溶蛋白的乳化能力,这与前期研究得出蛋白质氧化后其表面疏水性的增加和巯基含量的下降的结果相一致。表明氧化破坏了蛋白结构的完整性,使其发生变性,蛋白不能再形成稳定的界膜,蛋白与脂肪交联能力下降,从而使其乳化活性和乳化稳定性下降[26]。
3 结论
虾蛄盐溶蛋白经过羟自由基氧化后,羰基含量随着氧化时间和羟自由基浓度的增加呈现增加趋势;二酪氨酸含量和表面疏水性也发生不同程度的增加,且氧化时间越长,与对照相比,增加越明显;巯基含量随氧化时间和羟自由基浓度的增加而下降,这些结果表明,羟自由基氧化会引起蛋白功能性质的降低,表现在蛋白浊度随加热时间、氧化时间和羟自由基浓度的升高而升高;蛋白的乳化活力和乳化稳定性随氧化时间和羟自由基浓度的升高下降。功能性的降低会破坏虾蛄肉的加工性能及食用品质,所以在虾蛄贮存及加工过程中应该防止虾蛄肉的氧化,减少虾蛄肉品质的劣变。
[1]郭文场,刘佳贺.中国沿海虾蛄的养殖与综合利用[J].特种经济动植物,2011(11):13-16.
[2]Johns A M,Birkshaw L H,Ledward D A.Catalysts of lipid oxidation in meat products[J].Meat Science,1989,25(3):209-220.
[3]胡忠良,严璐,邹玉峰,等.氧化对肌原纤维蛋白加工特性的影响[J].食品与发酵工业,2011,37(10):128-133.
[4]Xiong Y L,Blanchard S P,Ooizumi,et al.Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J].Journal of Food Science,2010,75(2):215-221.
[5]Lund M N,Heinonen M.Protein oxidation in muscle foods:a review[J].Molecular Nutrition and Food Research,2011,55(1):83-95.
[6]Jingxin Sun,Zhen Wu,Xinglian Xu,et al.Effect of peanut protein isolate on functional properties of chicken salt-soluble proteins from breast and thigh muscles during heat-induced gelation[J].Meat Science,2012,91:88-92.
[7]邱春强,张坤生,任云霞.超高压和瓜尔胶对鸡肉盐溶蛋白凝胶的影响[J].核农学报,2014,28(3):433-439.
[8]彭倩.猪血中血红蛋白的分离、磷酸化及其功能性的研究[D].天津:天津商业大学,2010.
[9]Wu M G,Xiong Y L,Chen J.Rheology and microstructure of myofbrillar protein-plant lipid composite gels:Effect of emulsion droplet size and membrane type[J].Journal of Food Engineering,2011,106(4):318-324.
[10]Levine R L,Williams J A,Stadtman E R,et al.Carbonyl assays for determination of oxidatively modified proteins[J].Methods Enzymol,1994,233:346-357.
[11]P Di Simplicio,K H Cheeseman,T F Slater.The reactivity of the SH group of bovine serum albumin with free radicals[J].Free Radical Research,1991,14(4):253-262.
[12]Davies K J A.Protein damage and degradation by oxygen radicals[J].Journal of Biological Chemistry,1987,262:9895-9901.
[13]孙为正.广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D].广州:华南理工大学,2011.
[14]Benjakul S,Visessanguan W,Ishizaki S,et al.Differences in gelation characteristics of natural actomyosin from two species of bigeyesnapper,PriacanthustayenusandPriacanthusmacracanthus [J].Journal of Food Science,2001,66(9):1311-1318.
[15]Kingsley K Agyare,Kwaku Addo,Xiong Y L.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2009,23(1):72-81.
[16]Liu G,Xiong Y L,Butterfield D A.Chemical,physical and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolates[J].Food Chemistry and Toxicology,2000,65 (5):811-818.
[17]Dean R T,Fu S L,Stocker R,et al.Biochemistry and pathology of radical-mediated protein oxidation[J].Biochemical Journal,1997,324:1-18.
[18]Stadtman E R.Protein oxidation and aging[J].Science,1992,257(5074):1220-1224.
[19]Butterfield D A,Stadtman E R.Protein oxidation processes in aging brain.Timiras P S,edit.Advances in Cell Aging and Gerontology[M].Netherlands:Elsevier Science Press,1997,2:161-191.
[20]Wang Y S,Xiong Y L,Rentfrow G K,et al.Oxidation promotes cross-linking but impairs film-forming properties of whey proteins[J].Journal of Food Engineering,2013,115:11-19.
[21]崔旭海,孔保华.自由基引起的氧化对牛乳清蛋白凝胶特性的影响[J].农业工程学报,2009,25(1):222-228.
[22]Sun W Z,Zhou F B,Sun D W,et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology,2013,6(7):1703-1712.
[23]Santé-Lhoutellier V,Aubry L,Gatellier P.Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins[J].Journal of Agricultural Food Chemistry,2007,55:5343-5348.
[24]Xia X F,Kong B H,Xiong Y L,et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Science,2010,85(3):481-486.
[25]李银.蛋白氧化对肌肉保水性的影响机制研究[D].北京:中国农业科学院,2014.
[26]李艳青,孔保华,夏秀芳,等.羟自由基氧化对鲤鱼肌原纤维蛋白乳化性及凝胶性的影响[J].食品科学,2012,33(9):31-35.
Protein oxidation-induced structure and function changes of the oratosquilla oratoria salt-soluble protein
ZHOU Jing-li,ZHANG Kun-sheng*,REN Yun-xia
(Tianjin Key Laboratory of Food Biotechnology,College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China)
The objective of this study was to investigate the content of carbonyl,sulfhydryl,bityrosine,the surface hydrophobicity,the turbidity and emulsifying of the oratosquilla oratoria salt-soluble protein treated by hydroxyl radical generating systems containing 0.01 mmol/L ferric trichloride,0.1 mmol/L ascorbic acid and 0~20 mmol/L hydrogen peroxide for 1,3 h and 5 h respectively.The results revealed that the carbonyl content,the bityrosine content,the turbidity and the sulfhydryl increased,while sulfhydryl content,emulsifying activity and emulsion stability decreased.These oxidation-induced structural changes revealed high susceptibility of the oratosquilla oratoria salt-soluble protein to oxidative stress.
oratosquilla oratoria;the salt-soluble protein;oxidation;hydroxyl radical
TS201.2
A
1002-0306(2016)02-0330-05
10.13386/j.issn1002-0306.2016.02.058
2015-04-20
周景丽(1990-),女,硕士研究生,研究方向:食品加工与贮藏,E-mail:zhoujingli1110@126.com。
*通讯作者:张坤生(1957-),男,博士,教授,研究方向:食品加工与贮藏,E-mail:zhksheng@tjcu.edu.cn。
国家科技支撑计划项目(2012BAD37B06-07)。
