星点设计-响应面法优化千斤拔黄酮-β-环糊精包合工艺
2016-09-14王慧竹钟方丽吉林化工学院化学与制药工程学院吉林吉林32022沈阳药科大学药学院辽宁沈阳006
陈 帅,王慧竹,姜 昆,钟方丽,*(.吉林化工学院化学与制药工程学院,吉林吉林32022;2.沈阳药科大学药学院,辽宁沈阳006)
星点设计-响应面法优化千斤拔黄酮-β-环糊精包合工艺
陈 帅1,2,王慧竹1,姜 昆1,钟方丽1,*
(1.吉林化工学院化学与制药工程学院,吉林吉林132022;2.沈阳药科大学药学院,辽宁沈阳110016)
本研究以优化千斤拔黄酮-β-环糊精包合工艺,并验证包合物的增溶作用为目的。在预实验基础上,利用红外分光光度法验证了千斤拔黄酮-β-环糊精包合物的形成,然后采用饱和水溶液法,在单因素实验基础上,以包合物得率和包合率总评归一值为考察指标,采用响应面法优化千斤拔黄酮-β-环糊精包合物的制备工艺。预实验结果表明千斤拔黄酮-β-环糊精包合物已经形成,响应面实验显示包合物的最佳制备工艺条件为:β环糊精与千斤拔黄酮投料比(质量比)5.5∶1、包合温度43℃、包合时间3.8 h,在此最佳工艺条件下,千斤拔黄酮-β-环糊精包合物的包合率为44.68%,包合物得率为73.12%,溶解度测定结果表明将千斤拔黄酮利用β环糊精包合后,可使千斤拔黄酮在水中溶解度由(22.86±0.62)mg提高到(106.58±0.95)mg。千斤拔黄酮与β环糊精可形成稳定的包合物,包合物的形成可使千斤拔黄酮在水中的溶解度显著提高,为千斤拔黄酮口服制剂的开发提供了理论依据。
千斤拔黄酮,β环糊精,包合工艺,星点设计,响应面法
千斤拔隶属于豆科(Leguminosac)蝶形花亚科(Papilionoideae),《中华人民共和国药典》一部中收载千斤拔为豆科植物蔓性千斤拔Moghania philippinensis (Merr.et Rolfe)Li、大叶千斤拔Moghania macrophylla (Willd.)O.Kuntze或锈毛千斤拔Moghania ferruginea (Wall.ex Benth.)Li.的干燥根[1],广泛分布于我国的东南、中南、西南地区,其中蔓性千斤拔在11个省区均有分布,大叶千斤拔在除湖北、湖南外的9个省区均有分布。《中药大辞典》记载“千斤拔味甘辛,微苦,性温平,无毒,具有祛风利湿、消瘀解毒之功效,可治疗风湿痹痛,慢性肾炎、跌打损伤、痈肿和喉蛾等症”[2]。国内外学者对千斤拔化学成分及生物活性的研究报道很多,其化学成分主要含有黄酮类、香豆素类、萜类、挥发油、甾醇类等,其中以黄酮类化合物为主[3-5],现代药理研究及临床实验表明千斤拔黄酮不仅对各种妇科炎症有显著疗效,还具有类雌激素作用、良好的抗血栓、抗炎镇痛、抗氧化的作用,对神经系统的损伤也具有一定的保护作用[6-7],但千斤拔黄酮(TFF)在水中溶解度差,限制了其在口服制剂中的应用。
β-环糊精(β-CD)是由7个葡萄糖残基单位以α-1,4-糖苷键连接为环形筒状结构,可将一些体积和形态合适的药物分子或部分基团借助范德华力包合于其中。难溶性药物被β-环糊精包合后,能增加药物的溶解度和溶出速度,改善药物的吸收和生物利用度等[8-11]。通过检索文献未见关于千斤拔黄酮-β-环糊精(TFF-β-CD)包合物的相关报道。为此本文采用饱和水溶液法对制备TFF-β-CD包合物的工艺进行了优化,利用红外分光光度法对包合物的形成进行了验证,并对TFF和TFF-β-CD包合物的溶解度进行了测定,以期为TFF在口服制剂中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
TFF 吉林化工学院天然产物化学研究室提供,产品符合中华人民共和国药品标准Ws3-001(Z-001)-98(Z);β-环糊精 天津市大茂化学试剂厂;其他试剂 均为分析纯,蒸馏水自制。
TU-1950型紫外-可见分光光度计 北京普析通用仪器有限公司;Nicolet 6700型傅立叶红外光谱仪 美国Thermo Fisher Scientific公司;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司;TG-18型高速台式离心机 湖南凯达科学仪器有限公司;SHZ-D型循环水式真空泵 巩义市予华仪器有限责任公司;AUY220型电子分析天平 日本岛津公司;DF-101S型集热式恒温磁力搅拌器 常州迈科诺仪器有限公司;DFZ-6050型真空干燥箱 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 TFF线性关系考察 精密称取干燥至恒重的TFF 10.0 mg置于50 mL容量瓶中,用60%乙醇定容,制成浓度为0.2 mg·mL-1的TFF对照液,精密移取上述对照液0.0、1.0、2.0、3.0、4.0、5.0 mL TFF对照溶液分别置于10 mL容量瓶中,以60%乙醇溶液定容,摇匀,以60%乙醇溶液为空白对照,采用紫外分光光度法,在339 nm处分别测定吸光度,以质量浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线[12],得回归方程为A=8.5038C-0.0054,r=0.9994,线性范围0.02~0.1 mg·mL-1。
1.2.2 TFF-β-CD包合物的制备 采用饱和水溶液法,按β-CD与TFF投料比(质量比)4∶1分别准确称取TFF和β-CD适量置烧杯中,TFF用少量60%乙醇溶解,将β-CD在40℃恒温条件下制成饱和溶液,然后将TFF溶液逐滴加入到β-CD饱和溶液中,在40℃恒温条件下按既定的时间进行包合,冷却,置4℃冰箱中冷藏12 h,抽滤,滤饼用少量60%乙醇洗涤3次,60℃真空干燥箱中干燥,即得TFF-β-CD包合物。
1.2.3 TFF-β-CD包合物的验证 用KBr将TFF、β-CD、TFF和β-CD物理混合物以及按1.2.2项下条件制备的TFF-β-CD包合物压片,设定测量参数为:扫描范围4000~650 cm-1,累加扫描次数20,分辨率8 cm-1,分别进行红外光谱分析,记录红外图谱[13]。
1.2.4 包合物得率与包合率的测定 取1.2.2项下制备的包合物,精密称重,按式(1)计算包合物的得率(Y2)。

另外精密称取TFF-β-CD包合物适量(约相当于TFF 32 mg)置于50 mL容量瓶中,用60%乙醇溶解,定容,摇匀,移取1 mL,置于10 mL容量瓶中,60%乙醇定容,在339 nm处测定样品吸光度,根据回归方程求得TFF浓度,从而计算出TFF-β-CD包合物中TFF的含量,按式(2)计算包合率(Y1)。

1.2.5 单因素实验
1.2.5.1 投料比对包合物得率和包合率的影响 准确称取5份TFF原料药,每份2.0 g,分别以少量乙醇溶解,然后分别按β-CD与TFF投料比(质量比)2∶1、4∶1、6∶1、8∶1、10∶1称取β-CD置于圆底烧瓶中,加入蒸馏水,在50℃下制成饱和溶液,然后将TFF缓慢加入到饱和溶液中,恒温条件下搅拌包合3 h,按1.2.2项下方法制备包合物,并根据1.2.1项下方法测定吸光度,计算包合物得率和包合率。
1.2.5.2 包合温度对包合物得率和包合率的影响 准确称取5份TFF原料药,每份2.0 g,分别以少量乙醇溶解,另取5份β-CD,每份12.0 g,置于圆底烧瓶中,加入蒸馏水,分别于30、40、50、60、70℃下制成饱和溶液,然后将TFF缓慢加入到饱和溶液中,搅拌包合3 h,按1.2.2项下方法制备包合物,并根据1.2.1项下方法测定吸光度,计算包合物得率和包合率。
1.2.5.3 包合时间对包合物得率和包合率的影响 准确称取5份TFF原料药,每份2.0 g,分别以少量乙醇溶解,另取5份β-CD,每份12.0 g,分别置于圆底烧瓶中,加入蒸馏水,50℃下制成饱和溶液,然后将TFF缓慢加入到饱和溶液中,恒温条件下分别搅拌包合1、2、3、4、5 h,按1.2.2项下方法制备包合物,并根据1.2.1项下方法测定吸光度,计算包合物得率和包合率。
1.2.6 包合物制备工艺最优参数的确定 以TFF包合物的得率(Y2)和包合率(Y1)为评价指标,在单因素实验的基础上,确定β-CD与TFF投料比(X1),包合温度(X2)及包合时间(X3)作为响应面实验的自变量,根据星点设计的原理,每个因素设3个水平,用代码值-1,0,1标识,代码值所代表的实际物理量如表1所示。
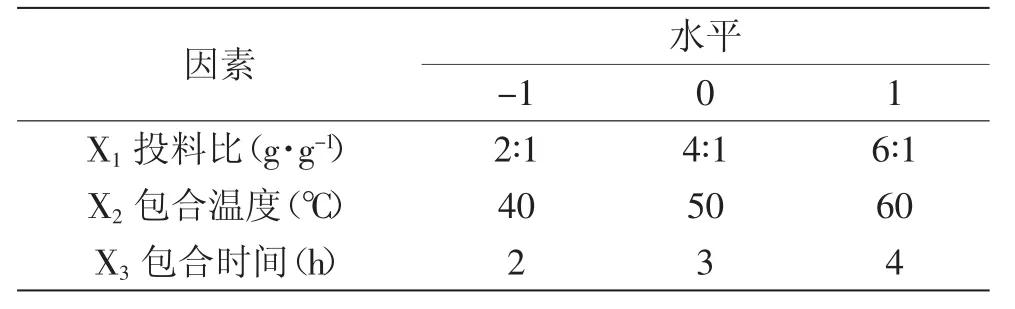
表1 实验因素水平表Table1 Table of experimental factors and levels
1.2.7 总评值OD的确定 利用SAS 9.4中的design experiment功能进行实验设计,为了将实验结果中的包合物的得率(Y2)和包合率(Y1)综合为一个能反映总体效应结果的值[14],数据处理采用归一化法,分别对Y2和Y1按式(3)进行数学转换,并按式(4)求“归一值”(OD):
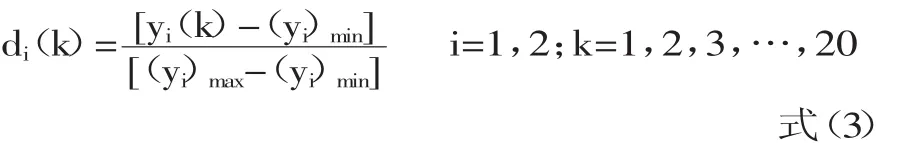
式中,k表示实验次数,di(k)表示第i个考察指标项下(Yi)各归一值,yi(k)表示第i个考察指标项下(Yi)具体数值,(yi)max表示第i个考察指标项下(Yi)各具体数值中最大者,(yi)min表示第i个考察指标项下(Yi)各具体数值中最小者。
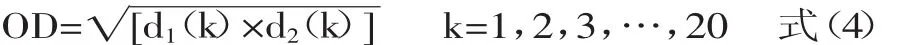
1.2.8 TFF-β-CD包合物增溶作用实验 25℃室温下,称取过量的TFF及其包合物各3份,分别置于100 mL容量瓶中,分别精密加入去离子水100 mL,称定重量,超声(300 W,50 kHz)溶解2 h,放冷,再称定重量,去离子水补足减失的重量,12000 r·min-1高速离心10 min,取上清液,0.8 μm微孔滤膜过滤,取续滤液1.0 mL,60%乙醇定容至10 mL,按1.2.1项下方法测定吸光度,按式(5)计算溶解度S,TFF和包合物的溶解度测定实验各重复6次。

式中,A为吸光度;V1为过滤后定容的溶液体积;V0为溶解样品的溶液体积。
1.2.9 数据统计分析 利用软件SPSS 22.0和Origin 8.5对单因素实验结果进行分析处理,单因素实验均重复3次。用SAS 9.4软件对响应面实验进行设计并处理相关数据,包合物增溶作用实验结果采用SPSS 22.0进行分析处理。
2 结果与分析
2.1 包合物验证结果
利用红外光谱法对TFF-β-CD包合物的形成进行验证,结果如图1所示。
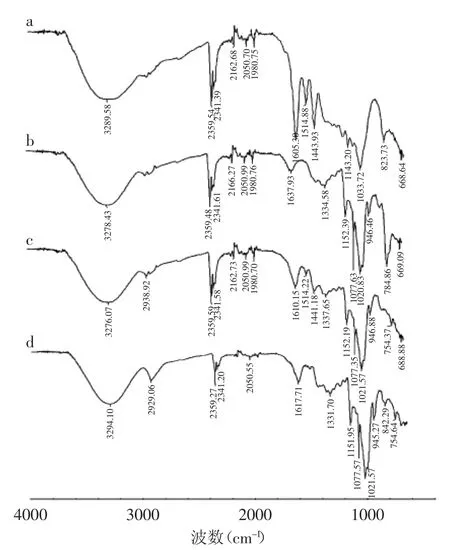
图1 TFF(a)、β-CD(b)、物理混合物(c)及其包合物(d)的红外光谱图Fig.1 IR spectra of TFF(a),β-CD(b),physical mixture(c),and inclusion complex(d)
从图1可以看出,在谱图a中,在1605.30 cm-1处存在一个羰基的特征吸收峰,对应着黄酮化合物芳环上的羰基伸缩振动,谱图c可以看成是TFF(a)和β-CD(b)红外光谱图吸收峰的叠加,但峰的吸收相对减弱,羰基的吸收峰位于1610.15 cm-1,谱图d相比谱图c有较大差别,其2938.92、2162.73、1980.70、1514.22 cm-1处的吸收峰消失,在2929.06 cm-1位置形成新的吸收峰,并且2359.59、2341.58、1610.15、1441.18 cm-1位置的吸收峰明显减弱,同时946.88、842.29 cm-1位置的吸收峰有所增强。结果进一步表明了新物相-包合物的形成。
2.2 单因素实验
2.2.1 投料比对包合物得率和包合率的影响 投料比对包合物得率和包合率的影响结果如图2所示。
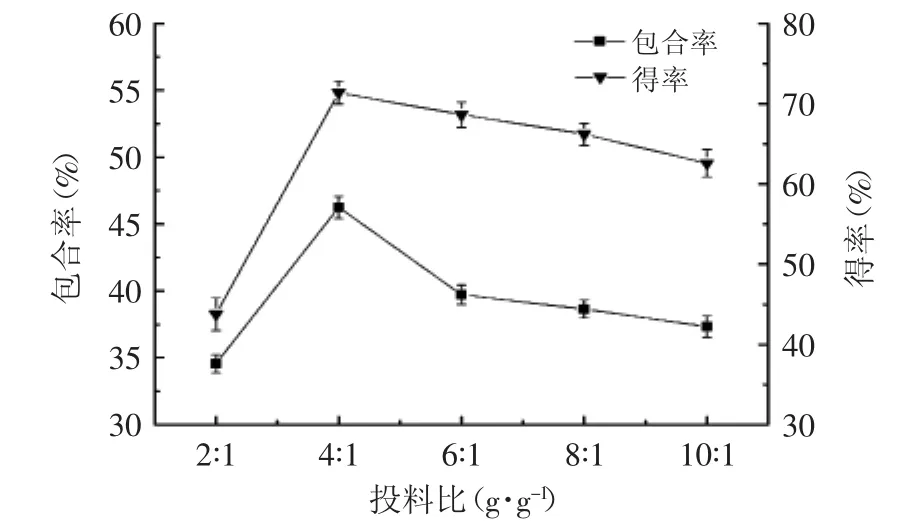
图2 投料比对包合物得率和包合率的影响Fig.2 Effect of feed ratio on inclusion rate and yield
从图2可以看出,包合率和得率开始时随投料比增大而增大,当投料比为4∶1时包合物的包合率和得率均达到最大值,之后随着投料比的继续增大,包合率和得率均呈现减小趋势。其原因可能是当β-CD与TFF投料比较小时,β-CD的量相对于TFF过少,β-CD不足以包裹所有的TFF,当β-CD与TFF投料比较大时,TFF的量相对β-CD较少,也不利于包合,并且β-CD投料量过大,还容易造成原材料的浪费。为了进一步考察投料比对包合率和得率的影响,分别选择投料比2∶1、4∶1、6∶1进行星点设计-响应面实验。
2.2.2 包合温度对包合率和包合物得率的影响 包合温度对包合率和包合物得率的影响结果如图3所示。
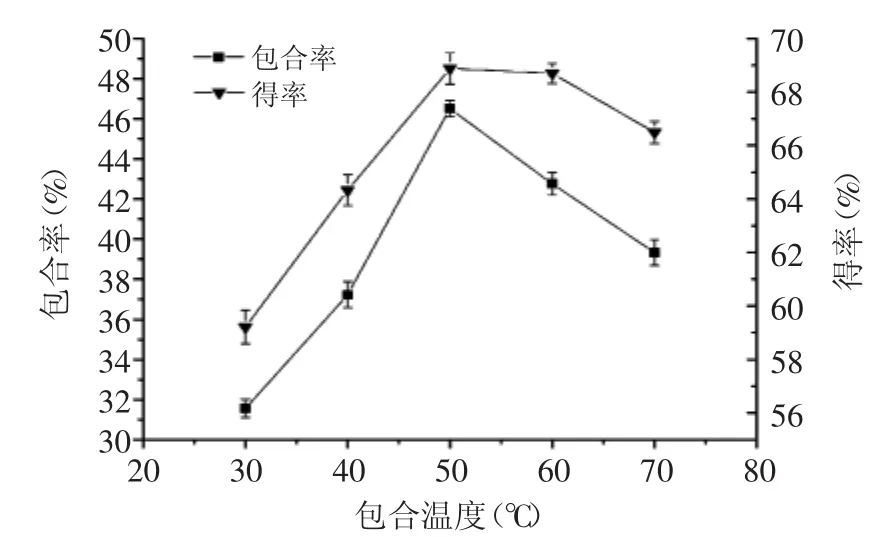
图3 包合温度对包合物得率和包合率的影响Fig.3 Effect of inclusion temperature on inclusion rate and yield
从图3可以看出,开始阶段随着包合温度的逐渐升高,包合率和得率逐渐增大,当包合温度升高至50℃时,包合率和得率均达到最大值,之后随温度的继续升高包合率和得率反而下降,可能是因为β环糊精与TFF包合与脱包合是动态平衡过程,适当的温度有利于主体分子与客体分子结合成包合物,温度太低,分子热运动较缓,包合过程发生较慢,温度太高则由于分子热运动加剧,导致包合物脱包合,重新恢复主客体分子单独运动的状态。为了进一步考察包合温度对包合率和得率的影响,选择40、50、60℃进行星点设计-响应面实验。
2.2.3 包合时间对包合率和包合物得率的影响 包合时间对包合率和包合物得率的影响结果如图4所示。
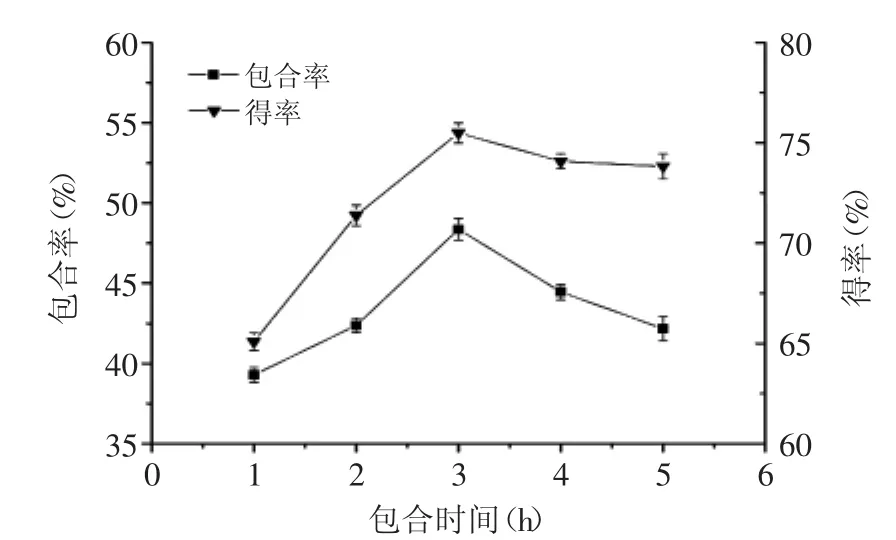
图4 包合时间对包合率和得率的影响Fig.4 Effect of inclusion time on inclusion rate and yield
从图4可以看出,包合率和得率随包和时间的延长逐渐增大,当包合时间为3 h时包合率和得率均达到最大值,之后随包合时间的继续延长,包合率略有下降而得率基本不再发生变化,可能是因为包合过程是客体分子进入到主体分子空腔内并以分子间氢键结合的过程,包合时间延长有利于主客体分子的充分接触,有利于包合的形成,但由于包合物形成为一动态过程,过长的时间会导致部分包合物脱包合。为了进一步考察包合时间对包合率和得率的影响,选择2、3、4 h进行星点设计-响应面实验。
2.3 响应面实验结果
2.3.1 响应面实验结果 如表2所示。
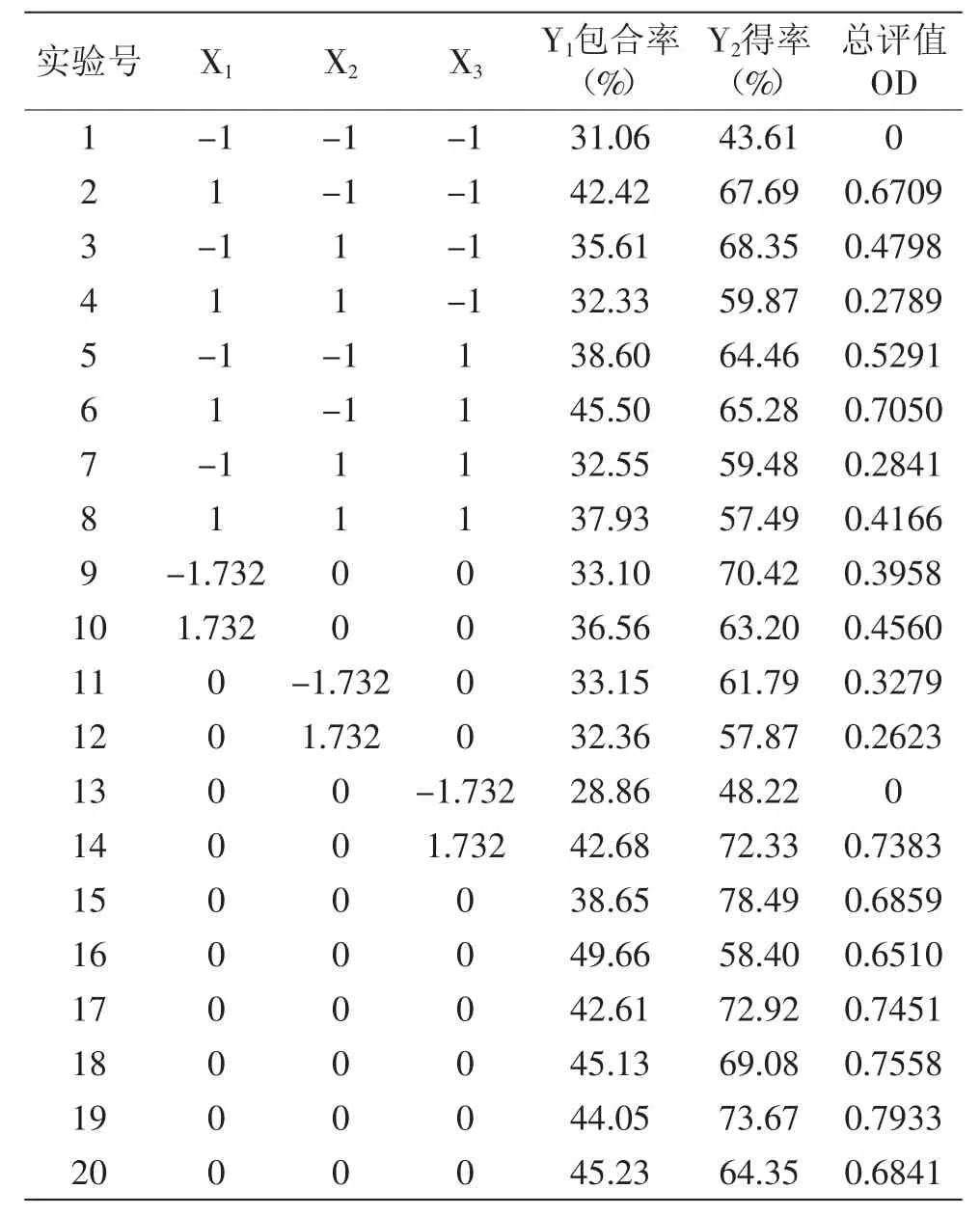
表2 星点实验设计及结果Table2 Result of central composite design
2.3.2 响应面分析 对表2中数据进行多元二次回归拟合,得回归方程:
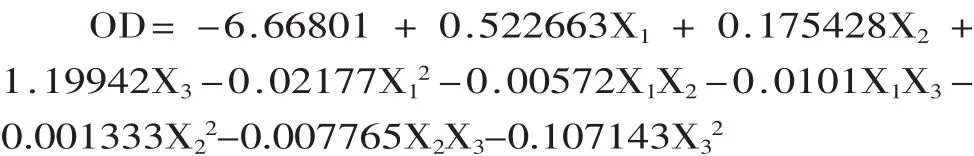
利用SAS 9.4软件对上述拟合方程进行系数显著性检验和方差分析,结果如表3和表4所示。
为了更加直观表达两个因素同时对总评值的影响,以回归方程为分析及预测模型,固定任意一个因素的值为代码0所对应的实际值,考察其他两个因素对总评值的影响,绘制响应曲面图[15-16],结果如图5(a~c)所示。
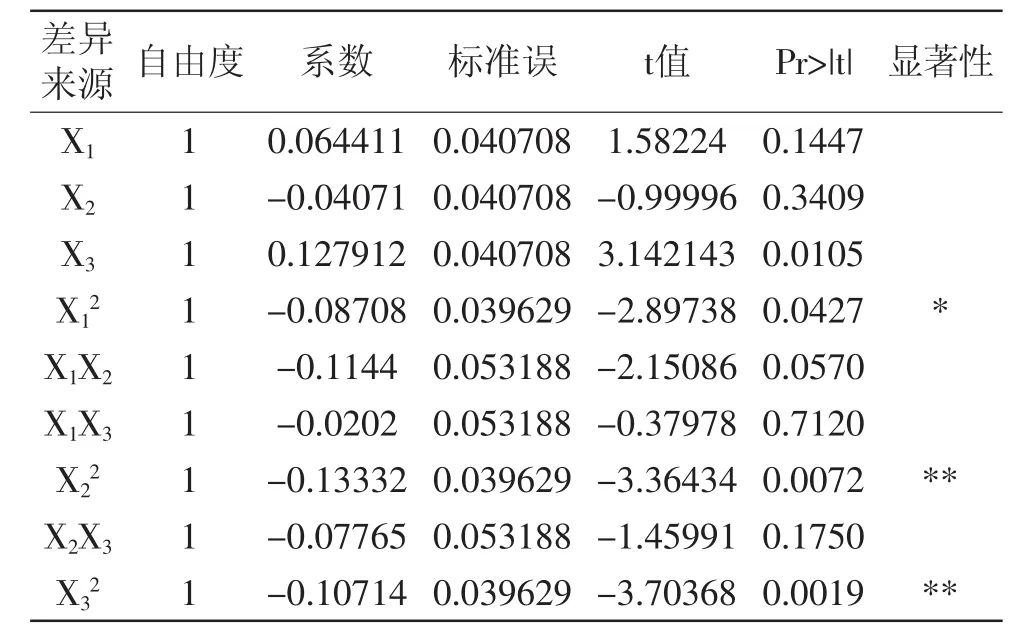
表3 回归系数显著性检验Table3 Test of significance of regression coefficient

表4 回归方程的方差分析Table4 Analysis of variance of regression model
图5(a)显示当固定包合时间时,随着投料比和包合温度的升高,总评值呈现先增大后减小的趋势,从等高线图可以看出,投料比相对包合温度对总评值的影响更大;图5(b)显示当包合温度固定时,随着投料比和包合时间的延长,总评值呈现先增大后减小的趋势,但从等高线图上可以看出包合时间相对投料比对总评值的影响更大;图5(c)显示固定投料比时,随着包合温度和包合时间的延长,总评值呈现先增大后减小的趋势,但从等高线图上可以看出包合时间相对包合温度对总评值的影响更大。
利用SAS软件分析,得到TFF-β-CD包合物制备的最佳工艺为:β-CD与TFF的投料比(质量比)为5.47∶1、包合温度43.04℃、包合时间3.779 h,在此工艺条件下包合率和得率的总评预测值分别为0.8035,考虑到实际的可操作性,将最佳工艺条件修正为投料比为5.5∶1、包合温度43℃、包合时间3.8 h。
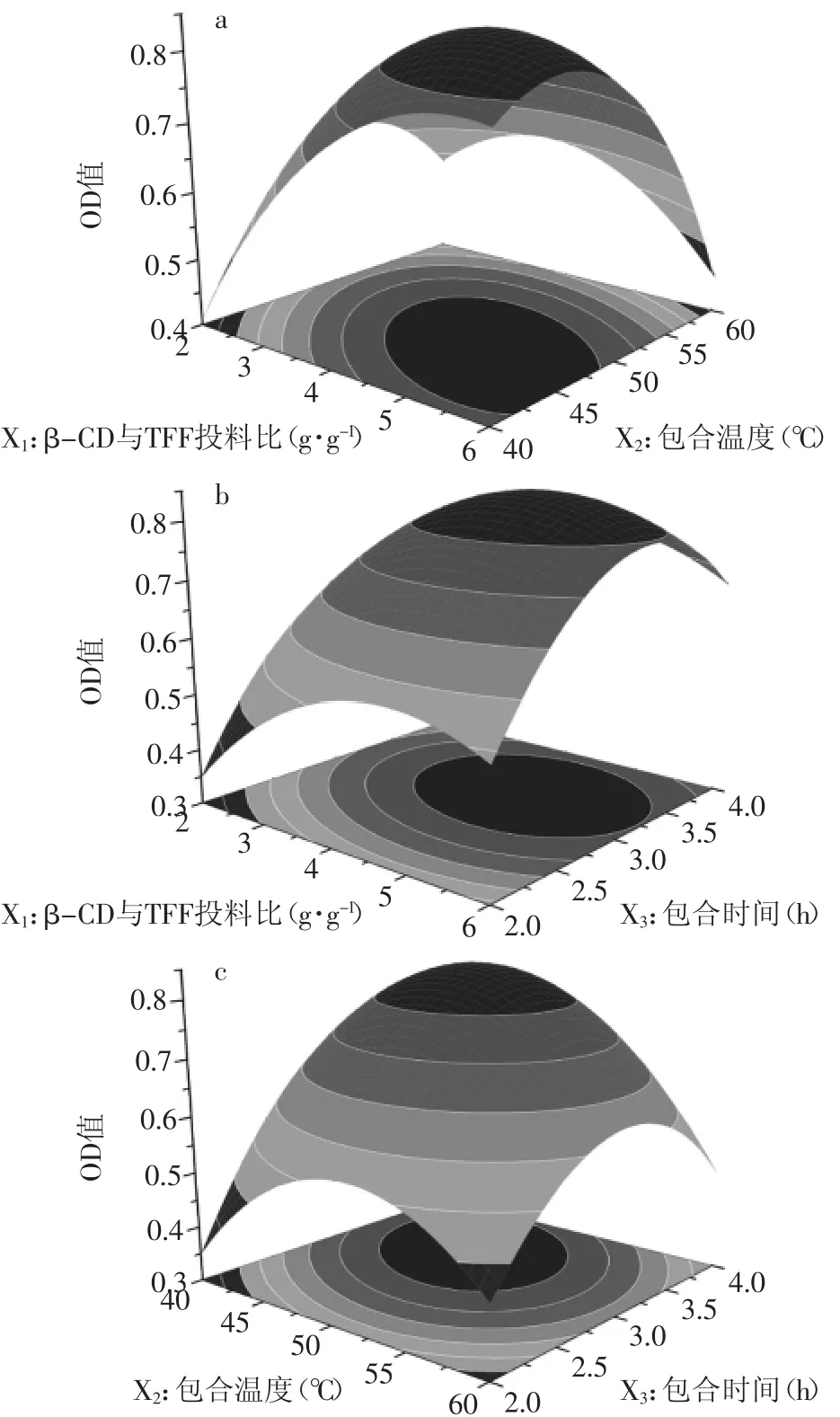
图5 两因素交互作用对总评值(OD)影响的响应面图Fig.5 Response surface plots of the effect of interaction of two factors on OD value
2.3.3 最佳工艺验证实验 按最佳工艺条件重复3次实验进行验证,结果显示平均包合率为44.68%,平均得率为73.12%,OD均值为0.8022,预测值为0.8035,偏差率为-0.16%,证明拟合模型较好地反映工艺中各因素与评价指标之间的关系,且稳定可靠。
2.4 TFF-β-CD包合物增溶作用实验结果
利用SPSS 22.0独立样本T检验功能对TFF和TFF-β-CD包合物的溶解度实验结果进行t检验统计分析,结果如表5所示。

表5 t检验分析结果Table5 Result of t test analysis
从表5中可以看出TFF和TFF-β-CD包合物在水中的溶解度(以100 mL水计)分别是(22.86±0.62)mg,(106.58±0.95)mg,并且Sig.(双侧)值为0,说明TFF和TFF-β-CD包合物的溶解度之间存在显著差异。
3 结论
本实验采用饱和水溶液法制备TFF-β-CD包合物,以包合率和包合物得率为考察指标,利用响应面分析法了确定了包合物的最佳制备工艺,结果表明TFF-β-CD包合物的最佳制备工艺条件为:β-CD与TFF的投料比为5.5∶1(质量比),包合温度为43℃,包合时间为3.8 h,此条件下的包含率为44.68%,得率为73.12%,OD值为0.8022。经红外光谱验证包合物已经形成,经验证本实验通过响应面优化出的千斤拔黄酮-β-环糊精包合物的最佳制备工艺稳定、可靠。TFF在水中溶解度非常小,将其制备成β-环糊精包合物后,溶解度显著增加。
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典(2010年版)[S].北京:人民卫生出版社,2010:附录22.
[2]宋立人,洪恂,丁续亮,等.中国中药学大辞典(上)[M].北京:人民卫生出版社,2001.
[3]李华,杨美华,斯建勇,等.千斤拔化学成分研究[J].中草药,2009,40(4):512.
[4]孙琳,李占林,韩国华.千斤拔化学成分研究[J].中国药物化学杂志,2009,19(5):364.
[5]任朝琴,戴先芝,刘圆.千斤拔药材资源开发与利用的调查报告[J].西南民族大学学报:自然科学版,2011,37(4):610-612.
[6]张丽霞,彭建明,马洁.千斤拔研究进展[J].中药材,2007,30(7):887-890.
[7]陈鹏,翁剑斌,殷虎,等.千斤拔属植物提取工艺及药理作用研究进展[J].陕西中医,2013,34(2):247-249.
[8]陆彬.药物新剂型与新技术.第二版[M].北京:人民卫生出版社,2005:26-41.
[9]黄晓华,陈静,吴双英,等.普通针毛蕨总黄酮包合物的制备及其生物利用度研究[J].中国医院药学杂志,2013,33(3):181-187.
[10]孟宪昉,白正晨,张树海,等.蜂胶黄酮醇与羟丙基-β-环糊精包合物及其表征[J].食品研究与开发,2013,34(6):56-59.
[11]章建芳,林燕飞,金圣煊,等.九里香叶总黄酮-羟丙基-β-环糊精包合物的制备、鉴定和热力学稳定性研究[J].中国现代应用药学,2010,27(9):821-825.
[12]程霜,杜凌云,牛梅菊,等.β-环糊精和染料木黄酮包合作用的研究[J].食品科学,2006,27(2):94-99.
[13]陈帅,王慧竹,钟方丽,等.响应面法优化白藜芦醇β环糊精包合物的制备工艺[J].食品工业科技,2015,36(9):255-260.
[14]徐春明,焦志亮,李丹,等.栀子黄色素β环糊精包合物制备及其稳定性研究[J].中国食品学报,2015,15(3):106-112.
[15]龚建平,刘慧莹,饶毅,等.效应面法优化枳术颗粒的提取工艺[J].中国实验方剂学杂志,2013,19(14):19-22.
[16]阮征,胡筱波,赖富饶,等.油菜花粉中黄酮类物质提取工艺的优化研究[J].食品科学,2007,28(7):133-137.
Optimization of the inclusion process of flemingia flavonoids withβ-cyclodextrin by central composite design and response surface methodology
CHEN Shuai1,2,WANG Hui-zhu1,JIANG Kun1,ZHONG Fang-li1,*
(1.School of Chemistry and Pharmaceutical Engineering,Jilin Institute of Chemical Technology,Jilin 132022,China;2.College of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China)
The aim of the experiment was to optimize the inclusion process of Flemingia flavonoids-β-cyclodextrin (TFF-β-CD)inclusion compound and identify its solubilization effect.On the basis of the pre-experiment,the formation of the inclusion compound was confirmed by infrared spectrophotometry.Using saturated aqueous solution method and the single factor test,response surface experiment was carried out to optimize the preparation process of TFF-β-CD inclusion compound with overall desirability of inclusion rate and yield as appraisement criteria.The result of pre-experiment showed that the TFF-β-CD inclusion compound had formed while the result of response surface methodology experiment showed that the optimum preparation process of TFF-β-CD inclusion compound was as follows:the feed ratio ofβ-cyclodextrin and TFF(mass ratio)5.5∶1,inclusion temperature 43℃,inclusion time 3.8 h and under the optimum conditions,the inclusion rate and the yield of the inclusion compound was 44.68%and 73.12%respectively.The solubility test showed that the solubility of TFF increased from(22.86±0.62)mg to(106.58±0.95)mg in water because of the preparation of TFF-β-CD inclusion compound.The TFF andβ-CD could form stable inclusion complexes,the formation of which could increase the solubility of TFF in water significantly.Moreover the results of experiment provided a theoretical basis for the development of the oral preparation of TFF.
Philippine flemingia;β-cyclodextrin;inclusion technology;central composite design;response surface methodology
TS202.1
B
1002-0306(2016)02-0281-06
10.13386/j.issn1002-0306.2016.02.048
2015-08-03
陈帅(1982-),男,硕士,讲师,研究方向:中药新剂型与新技术,E-mail:chenshuai2011@163.com。
*通讯作者:钟方丽(1970-),女,博士,教授,研究方向:天然产物化学开发及应用,E-mail:fanglizhong@sina.com。
吉林省教育厅科研基金资助项目(吉教科合字[2013]第470号);吉林化工学院科技项目(吉化院合字[2012]第051号)。
