基于文丘里管的水力空化降解壳聚糖的研究
2016-09-14许佳丽黄永春任仙娥广西科技大学生物与化学工程学院广西糖资源绿色加工重点实验室广西高校糖资源加工重点实验室广西柳州545006
许佳丽,黄永春,袁 媛,杨 锋,任仙娥,黄 琼(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室,广西柳州545006)
基于文丘里管的水力空化降解壳聚糖的研究
许佳丽,黄永春*,袁 媛,杨 锋,任仙娥,黄 琼
(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室,广西柳州545006)
本文应用一种新的方法——文丘里管空化法来降解壳聚糖。研究了壳聚糖溶液浓度、pH、反应温度、压力、空化时间等因素对基于文丘里管空化的壳聚糖降解过程的影响,以壳聚糖的特性粘度下降率来衡量壳聚糖的降解程度,并分别对壳聚糖原料及其降解产物使用FT-IR、XRD进行表征比较分析。结果表明:在溶液浓度为3 g/L的条件下,最佳的降解条件为pH4.4,温度60℃,入口压力0.4 MPa,空化时间120 min,粘度下降率达49%。说明基于文丘里管的水力空化法可有效降解壳聚糖。
文丘里管,水力空化,壳聚糖,降解
随着近年来的深入研究,壳聚糖在化工、环保、食品、印染、纺织、生物医药等方面展现出广泛而独特的应用价值。但壳聚糖分子量很大,且有紧密的晶体结构,只能在某些酸性介质中溶解,极大限制了壳聚糖的应用[1]。同大分子壳聚糖相比,低聚壳聚糖具有一些独特的功能性质,这些性质包括良好的水溶性、保湿性、抑菌抗菌作用等。壳聚糖降解制备低聚壳聚糖及更小分子量的水溶性壳聚糖是目前研究的热点之一[2]。目前,国内外学者提出的降解方法主要有化学降解、物理降解和生物降解三大类。化学降解主要包括NaNO2降解、酸水解、氧化降解;物理降解包括γ射线辐射降解、光降解、超声波降解等;生物降解则包括酶降解及人体内的降解。这些降解方法各有其优缺点,且由于低分子量壳聚糖价格比较昂贵,国内仅部分轻工行业有少量使用,还不能在所有的应用领域实现商品化,研究实用、高效的降解方法势在必行。本文提出了一种新的物理方法—基于文丘里管的水力空化法降解壳聚糖制备低聚壳聚糖,该法具有设备操作简单、成本低、不引入杂质、易于实现工业化等优点。
水力空化是当液体内某部分压力低于饱和蒸汽压时,液体内部产生大量气泡并随液体流动,当遇到压力增大时这些气泡会瞬间溃灭,并伴随有高温、高压及强烈的冲击波和微射流,从而产生复杂的物理、化学效应。水力空化是空化的一种类型,根据产生空化的方式不同,将水力空化分为射流空化和涡流空化[3]。文丘里管是射流空化发生器类型之一,当急速运动的流体经过文丘里管的喉部,此时压力低于气核稳定所需的必需压力,气核生长并迅速形成大的充满蒸气的空化气泡。空化气泡随流体流出这个区域时,由于压力突然增大,气泡溃灭,从而产生空化效应[4]。
本课题组研究表明,涡流空化和基于几何孔板的射流空化对壳聚糖具有明显的降解作用[5-6]。本文在前期工作的基础上,研究基于文丘里管的射流空化对壳聚糖的降解作用,进一步探索了壳聚糖降解的强化途径。
1 材料与方法
1.1 材料与仪器
壳聚糖 工业级,上海卡博工贸有限公司;冰醋酸 化学纯,成都市科龙化工试剂厂;三水合乙酸钠 分析纯,台山市粤侨试剂塑料有限公司。
BS224 S型分析天平 德国赛多利斯股份有限公司;JS-510机械秒表 上海星钻秒表有限公司;乌氏粘度计(0.57 mm) 上海良晶玻璃仪器厂;HK-1D型恒温水浴槽 南京物化智能设备有限公司;GM-0.33隔膜真空泵 天津市腾达过滤器建厂;文丘里管空化装置 本实验室自制;NICOLET 6700红外光谱仪 美国;D/MAX-3A X射线衍射仪 日本。
1.2 实验方法
1.2.1 实验设备及原理 文丘里管空化装置示意图如图1所示。

图1 空化装置示意图Fig.1 The abridged general view of cavitation equipment
如图1所示,当液体流经文丘里管时因管径的变化使得流速随之增大,形成低压,当压强低于液体蒸气压时形成空化气泡,当进入压力较高区域后由于压强突然变大而使气泡溃灭,从而产生空化效应。通过调节阀门的大小,可控制流量和文丘里管入口的压力。
文丘里管的结构如图2所示。
本实验中,文丘里管采用入口锥角α为30°,出口锥角β为25°,喉部半径r为1.6 mm,长度d为10 mm。入口直径D1为15 mm,出口直径D2为20 mm,腔体长度L为35 mm。
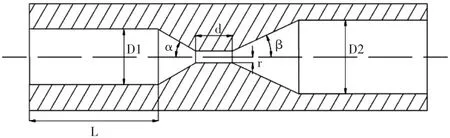
图2 文丘里管的几何结构Fig.2 The structure of venturi tube
1.2.2 降解实验 用乙酸-乙酸钠缓冲溶液配制壳聚糖溶液,通过文丘里管空化装置降解一段时间,考察壳聚糖溶液浓度、pH、温度、入口压力及空化时间等因素对降解效果的影响。
1.2.2.1 初始浓度对降解效果的影响 以乙酸-乙酸钠缓冲溶液为溶剂,调节pH为4.4,配制不同浓度(1、3、5、7、10 g/L)的壳聚糖溶液3 L,在0.4 MPa压力下,保持温度为40℃,通过空化装置循环30 min,测定空化前后壳聚糖溶液的特性粘度的变化(将壳聚糖溶液稀释5倍)并分析壳聚糖初始浓度对降解效果的影响。
1.2.2.2 溶液pH对降解效果的影响 以乙酸-乙酸钠缓冲溶液为溶剂,调节不同的pH(3.2、3.6、4.0、4.4、4.8),配制浓度为3 g/L的壳聚糖溶液3 L,在0.4 MPa压力下,保持温度为40℃,通过空化装置循环30 min,测定空化前后壳聚糖溶液的特性粘度的变化(将壳聚糖溶液稀释5倍)并分析pH对降解效果的影响。
1.2.2.3 溶液温度对降解效果的影响 以乙酸-乙酸钠缓冲溶液为溶剂,调节pH为4.4,配制浓度为3 g/L壳聚糖溶液3 L,在0.4 MPa压力下,调节不同温度(30、40、50、60、70℃),通过空化装置循环30 min,测定空化前后壳聚糖溶液的特性粘度的变化(将壳聚糖溶液稀释5倍)并分析溶液温度对降解效果的影响。
1.2.2.4 入口压力对降解效果的影响 以乙酸-乙酸钠缓冲溶液为溶剂,调节pH为4.4,配制浓度为3 g/L壳聚糖溶液3 L,在不同入口压力(0.1、0.2、0.3、0.4、0.45 MPa)下,保持温度为40℃,通过空化装置循环30 min,测定空化前后壳聚糖溶液的特性粘度的变化(将壳聚糖溶液稀释5倍)并分析入口压力对降解效果的影响。
1.2.2.5 空化时间对降解效果的影响 以乙酸-乙酸钠缓冲溶液为溶剂,调节pH为4.4,配制浓度为3 g/L壳聚糖溶液3 L,在0.4 MPa压力下,保持温度为40℃,通过空化装置循环120 min,每10 min测定一次特性粘度(将壳聚糖溶液稀释5倍)并分析空化时间对降解效果的影响。
1.2.3 特性粘度下降率的测定 采用特性粘度下降率来反映壳聚糖的降解率。在温度为(30±0.1)℃条件下,用乌式粘度计测定壳聚糖溶液的流出时间t和溶剂流出时间t0。由一点法经验公式,计算出特性粘度[η][7],计算公式如下。
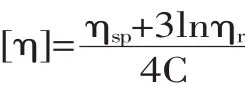
再根据特性粘度下降率[η]r,判断空化对壳聚糖溶液的降解效果,计算公式如下。
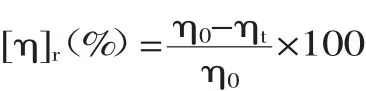
式中:η0,ηt分别为空化前和空化后溶液的特性粘度。
1.2.4 脱乙酰度的测定 在降解条件为壳聚糖溶液浓度3 g/L,pH4.4,温度40℃,压力0.4 MPa,空化时间30 min,采用酸碱滴定法[8]测定。
1.2.5 黏均分子量的测定 根据Mark-Houwink经验方程确定壳聚糖的黏均分子量[9]。
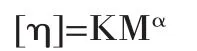
式中:[η]—特性粘度,mL/g;K—经验常数,K= 1.64×10-30×DD14,cm3/g;α—经验常数,α=-1.02×10-2×DD+1.82;DD—脱乙酰度,%;M—黏均分子量,kD。
1.2.6 结构分析
1.2.6.1 红外光谱分析 采用红外光谱仪对壳聚糖原料及降解产物进行红外光谱分析,红外光谱测定范围400~4000 cm-1。运用溴化钾压片法进行样品的制备:将KBr与壳聚糖样品干燥后放入研钵内一起研磨至完全混匀,压片,置于仪器中进行测试。
1.2.6.2 X射线衍射分析 采用X射线衍射仪分析壳聚糖原料及降解产物的结晶状态。测定条件:Cu靶Kα1射线,电压为40 kV,电流为40 mA,发散狭缝1/8°,防发散狭缝1/4°,防散射狭缝7.5 mm,2θ范围为5°~60°范围内,步长0.02°,每步停留时间40 s。
1.3 数据处理
运用SigmaPlot 12.5软件处理数据并进行绘图。
2 结果与分析
2.1 降解效果
2.1.1 初始浓度对降解效果的影响 溶液的初始浓度对壳聚糖降解效果的影响结果如图3所示。
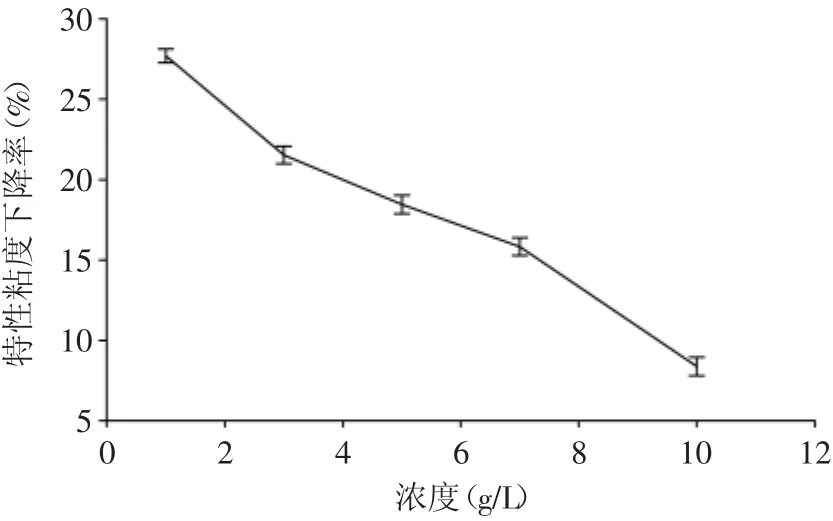
图3 壳聚糖浓度对降解效果的影响Fig.3 Effect of chitosan concentration on the degradation of chitosan
由图3可见,壳聚糖溶液初始浓度对降解效果的影响较明显,壳聚糖的降解速率随着浓度的增大而降低。当溶液浓度为1 g/L时,粘度下降率为28%,当溶液浓度为10 g/L时,粘度下降率只有8%左右。这是因为溶液浓度越大,溶液的粘度越大,表面张力越大,空泡膨胀所需克服的液体分子间力越大,因而空化核难以产生且空化振幅减小,空化强度减弱;另外,溶液浓度降低,分子链的数量变少,分子链间的相互缠绕也减少,分子内和分子间的氢键作用力进而减小,使得羟基自由基进攻壳聚糖的概率增大,从而提高降解效果。所以,在实验考察的浓度范围内,壳聚糖溶液浓度越低,越有利于水力空化降解。
2.1.2 溶液pH对降解效果的影响 溶液pH对壳聚糖的降解效果的影响结果见图4。

图4 pH对降解效果的影响Fig.4 Effect of pH on the degradation of chitosan
从图4可以看到,壳聚糖溶液的pH对降解效果有比较大的影响。pH在3.2至4.0之间,特性粘度下降率随pH的升高增加的较为缓慢,即当氢离子浓度大时降解率降低,这是由于随着氢离子浓度的增加,溶液中阴离子的浓度也增加,使得壳聚糖分子形成的盐键也增多,从而增加了糖苷键断裂的位阻,降低了分子的降解速度[10]。pH在4.0~4.4之间,粘度下降率升高幅度突然增大,在pH4.4时达到最大,这可能是因为在此范围内,壳聚糖的分子状态最有利于空化降解。当pH大于4.4时,粘度下降率逐渐缓慢降低,这是因为壳聚糖降解首先是酸催化反应,必须在酸性条件下才能进行,而且pH较低时有利于壳聚糖的溶解;另外较高的pH抑制了·OH的产生,减少了·OH与壳聚糖分子基团发生反应的概率,导致空化效果提高不显著,因此本实验得到的最佳pH为4.4。
2.1.3 溶液温度对降解效果的影响 溶液温度对壳聚糖的降解效果的影响结果如图5所示。
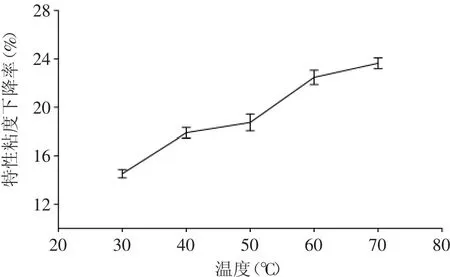
图5 溶液温度对降解效果的影响Fig.5 Effect of solution temperature on the degradation of chitosan
由图5可以看出,温度对降解效果的影响较大。在其他条件相同的情况下,当溶液温度为30℃时,空化后特性粘度下降了14%左右,而随着温度的升高,特性粘度下降率也随之升高,当反应温度为70℃时,粘度下降率达到了24%左右。可见,在一定范围内,溶液温度越高,特性粘度下降率越大,空化效果越好。一方面,温度的升高,溶液粘度降低,表面张力降低,空化变得容易,空化强度增大,且壳聚糖分子运动加快,反应速度也随着加快;另一方面,随着温度的升高,分子热运动加剧,溶液中的氢键和盐键逐渐被破坏,位阻消失,壳聚糖的糖苷键变得容易断裂[11]。当温度高于60℃以后,粘度下降率变化趋于平缓,这可能是因为温度达到一定程度之后,空化虽然容易发生,但由于溶液对应的蒸汽压升高,空化泡溃灭时产生的空化效应增强不明显,从而降解作用表现为变化不显著。
2.1.4 入口压力对降解效果的影响 入口压力对壳聚糖降解效果的影响结果见图6。

图6 压力对降解效果的影响Fig.6 Effect of pressure on the degradation of chitosan
由图6可以看出,在降解的反应中,壳聚糖溶液特性粘度下降率随着入口压力的增大而增大。这是因为入口压力的增大使得液体流速加快,空化数下降,空化发生容易,空泡数量增加,空泡溃灭机率增大,从而降解效果提高。但从图6中可以发现,在0.4 MPa和0.45 MPa条件下的降解率相近,甚至在0.45 MPa条件下降解率低于0.4MPa条件下降解率,这是因为,当压力进一步增大超过一定界限后,空化数提高,空化困难[12]。并且压力的影响整体不是很大,考虑到实际操作中的成本及损耗,压力不宜选取过大。本实验中最佳压力条件为0.4 MPa。
2.1.5 空化时间对降解效果的影响 空化时间对壳聚糖降解效果的影响结果如图7所示。
由图7可以看出,在空化降解的反应中,壳聚糖溶液特性粘度下降率随着空化时间的延长而增大。时间对文丘里管水力空化降解壳聚糖的影响较为明显,随着空化时间的延长,壳聚糖的降解率增加,120 min为最佳。
2.2 结构分析
2.2.1 黏均分子量的分析 壳聚糖原料及其降解产物的黏均分子量与c之间的关系见图8。
从图8中可以看出,壳聚糖原料及降解产物的特性粘度分别为:249.25、176.23 cm3/g。另外,壳聚糖原料及降解产物的脱乙酰度为90.19%、89.90%。根据Mark-Houwink经验方程可以确定壳聚糖原料及降解产物的黏均分子量分别为221、152 kb。结果表明,基于文丘里管的水力空化能够有效降解壳聚糖,且壳聚糖在经过降解后脱乙酰度与未降解的相比基本没有变化,即在降解过程中壳聚糖分子链上的氨基没有被破坏,氨基和它的相邻键没有发生断裂。

图7 空化时间对降解效果的影响Fig.7 Effect of cavitation time on the degradation of chitosan
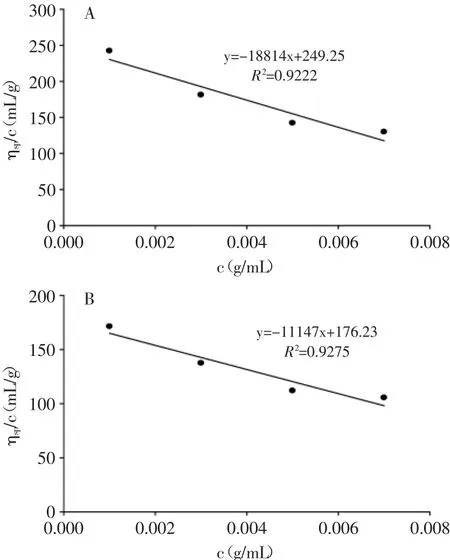
图8 壳聚糖原料(A)、降解产物(B)的c与ηsp关系图Fig.8 Relationship between the c and ηspof initial chitosan(A)and degraded chitosan(B)
2.2.2 红外光谱分析 未降解壳聚糖及降解产物样品红外光谱图如图9所示。
如图9所示,3367 cm-1附近的强而宽的吸收峰是O-H伸缩振动吸收峰和N-H伸缩振动吸收峰重叠所得的多重吸收峰[13];1660、1573和1333 cm-1附近的吸收峰分别是酰胺I带、酰胺II带和酰胺III带的特征吸收峰[14];2909 cm-1附近的吸收峰为壳聚糖主链环状结构上的C-H伸缩振动吸收峰[15];1169、1082 cm-1附近的吸收峰分别为C-O-C和C-O伸缩振动吸收峰[16];908 cm-1附近的吸收峰为壳聚糖β-构型糖苷键的特征吸收峰[17];在1660 cm-1与1900 cm-1之间没有发现吸收峰,说明不存在羧基或羰基[18],证实了该降解反应是以开裂壳聚糖的β-(l,4)-糖苷键来进行,说明降解前后壳聚糖糖环结构没有改变[19]。与原料壳聚糖的吸收峰相比,降解产物的吸收峰强弱发生了变化,但吸收峰的位置基本不变,说明水力空化降解并没有发生壳聚糖衍生化反应,产物的官能团和主链结构并未遭到破坏,只是壳聚糖分子间和分子内的氢键发生改变[20]。

图9 壳聚糖原料及降解产物的红外谱图Fig.9 FT-IR spectra of initial chitosan and degraded chitosan
2.2.3 XRD分析 壳聚糖原料及降解产物的X射线衍射图谱如图10所示。

图10 壳聚糖原料及降解产物的X射线衍射谱图Fig.1 0 X-ray diffraction pattern of initial chitosan and degraded chitosan
由图10可知,原料壳聚糖在2θ=9.59、20.09°处有2个特征衍射峰,降解产物在2θ=8.84、20.47°处有2个特征衍射峰。降解后壳聚糖的特征峰变弱,这表明壳聚糖降解产物的分子间的氢键被破坏,分子间氢键作用力减弱,结晶程度较原壳聚糖降低。
3 结论
通过实验研究了不同溶液浓度、pH、温度、入口压力、空化时间对基于文丘里管的水力空化降解壳聚糖的影响,结果表明:随着溶液浓度的增大,壳聚糖降解率逐渐降低;随着pH及入口压力的增大,壳聚糖降解率均先升高后降低;随着溶液温度和空化时间的增加,壳聚糖降解率均逐渐上升。在溶液浓度为3 g/L的条件下,最佳的降解条件为pH4.4,温度60℃,入口压力0.4 MPa,空化时间120 min,粘度下降率达49%。
壳聚糖降解前后脱乙酰度及红外光谱的分析表明壳聚糖分子的糖环结构基本未遭到破坏;XRD分析表明降解后的晶体结晶度比降解前有所下降,分子间的氢键遭到破坏,壳聚糖由长链大分子变为了短链的小分子。
[1]李治,刘晓非,杨冬芝,等.壳聚糖降解研究进展[J].化工进展,2000(6):20-23.
[2]马庆双.低聚壳聚糖的制备及应用研究[D].南京:南京理工大学,2004.
[3]徐美娟,王玉恒,王启山.多孔板水力空化器的优化和应用[J].南开大学学报:自然科学版,2010,43(6):9-13.
[4]葛强,李晓红,卢义玉,等.空化射流处理有机废水的机理[J].重庆大学学报:自然科学版,2007,30(5):19-22.
[5]HUANG Yongchun,WU Yu,HUANG Weichun,et al.Degradation of chitosan by hydrodynamic cavitation[J].Polymer Degradation and Stability,2013,98(1):37-43.
[6]WU Yu,HUANG Yongchun,ZHOU Ying,et al.Degradation of chitosan by swirling cavitation[J].Innovative Food Science& Emerging Technologies,2014,23(6):188-193.
[7]范金石,陈国华,孙明昆,等.壳聚糖特性粘度的快速测定[J].青岛海洋大学学报,2002,32(2):296-300.
[8]RENATA C B,DIANA J,BOZENA R,et al.Determination of degree of deacetylation of chitosan-comparision of methods[J].Progress on Chemistry and Application of Chitin and Its Derivatives,2012,17:5-20.
[9]Wang Wei,Bo Shuqin,Li Shuqing,et al.Determination of the Mark-Houwink equation forchitosanswith different degrees of deacetylation[J].International Journal of Biological Macromolecules,1991,13(5):281-285.
[10]张卫国,周永国,杨越冬,等.有机酸及降解条件对壳聚糖降解速度的影响[J].河北科技师范学院学报,2006,20(1):32-34.
[11]陈春刚,韩芬霞.不同因素影响壳聚糖降解速度的研究[J].安徽农业科学,2006,34(6):1052-1056.
[12]Braeutigam P,Wu Z L,Stark A,et al.Degradation of BTEX in aqueous solution by hydrodynamic cavitation[J].Chemical Engineering Technology,2009,32(5):745-753.
[13]HUANG Qunzeng,ZHUO Lihong,GUO Yingchen.Heterogeneous degradation of chitosan with H2O2catalysed by phosphotungstate[J].CarbohydratePolymers,2008,72(3):500-505.
[14]WANG Weiping,DU Yumin,QIU Yanlin,et al.A new green technology for direct production of low molecular weight chitosan [J].Carbohydrate Polymers,2008,74(1):127-132.
[15]周今朝.高压均质技术在壳聚糖降解中的应用研究[D].南京:南京理工大学,2008.
[16]GU Zhiming,CAI Quanyuan,HE Yun,et al.Degradation of hyaluronan by an electrochemicalprocess[J].Carbohydrate Polymers,2010,82(2):521-523.
[17]YUE Wu,HE Rian,YAO Pingjia,et al.Ultraviolet radiationinduced accelerated degradation of chitosan by ozone treatment [J].Carbohydrate Polymers,2009,77(3):639-642.
[18]黄群增,王世铭,王琼生,等.UV/H2O2降解壳聚糖的研究[J].福建师范大学学报:自然科学版,2005,20(4):63-67.
[19]冯小强,李小芳,杨声,等.壳聚糖抑菌性能影响因素,机理及其应用研究进展[J].中国酿造,2009,28(1):19-23.
[20]胡伟.氨基酸离子液体体系下电催化降解壳聚糖研究[D].南京:南京理工大学,2012.
Study on the degradation of chitosan with hydrodynamic cavitation based on the venturi tube
XU Jia-li,HUANG Yong-chun*,YUAN Yuan,YANG Feng,REN Xian-e,HUANG Qiong
(Department of Biological and Chemical Engineering,Guangxi University of Science and Technology,Guangxi Key Laboratory of Green Processing of Sugar Resources,Guangxi Higher Education Institutes,Liuzhou 545006,China)
A new cavitation method of venturi tube was applied to degrade chitosan in this paper.The effect of chitosan concentration,pH,temperature,inlet pressure and cavitation time on the degradation of chitosan by venturi tube were studied,with the intrinsic viscosity reduction rate of chitosan as a measure indicator.The structures of initial chitosan and the degradation product were characterized by Fourier-transform infrared spectroscopy and X-ray diffraction.The results showed that under the condition of solution concentration at 3 g/L,the optimum degradation condition for pH4.4,temperature 60℃,inlet pressure 0.4 MPa,cavitation time of 120 min,the intrinsic viscosity reduction rate reached 49%.It illustrated that hydrodynamic cavitation based on the venturi tube could degrade chitosan effectively.
venturi tube;hydrodynamic cavitation;chitosan;degradation
TS244
B
1002-0306(2016)02-0244-05
10.13386/j.issn1002-0306.2016.02.041
2015-07-02
许佳丽(1990-),女,硕士研究生,研究方向:生物资源化工,E-mail:571308863@qq.com。
*通讯作者:黄永春(1974-),男,博士,教授,研究方向:生物资源化工,E-mail:huangyc@yeah.net。
国家自然科学基金项目资助(31160348);广西高等学校高水平创新团队及卓越学者计划资助(桂教人〔2014〕7号)。
