不同条件下萃取花生蛋白前后AOT/异辛烷反胶束粒径与萃取率相互关系变化的研究
2016-09-14王丽敏陈复生刘昆仑殷丽君河南工业大学粮油食品学院河南郑州450001
王丽敏,陈复生,刘昆仑,殷丽君(河南工业大学粮油食品学院,河南郑州450001)
不同条件下萃取花生蛋白前后AOT/异辛烷反胶束粒径与萃取率相互关系变化的研究
王丽敏,陈复生*,刘昆仑,殷丽君
(河南工业大学粮油食品学院,河南郑州450001)
研究了在不同条件下萃取花生蛋白前后丁二酸二异辛酯磺酸钠(AOT)/异辛烷反胶束粒径变化及前萃率和后萃率变化,考察了反胶束粒径变化与前萃率和后萃率之间相互关系的变化规律。结果表明,KCl浓度增加,使粒径减小,前萃率也相应降低;在0.04~0.09 g/mL范围内,AOT浓度越大,空胶束及实胶束粒径越大,但是前萃率降低,而后萃率则相反;缓冲液pH对空胶束粒径影响不显著,但通过静电相互作用影响实胶束粒径和萃取率;不同的离子种类对反胶束粒径及花生蛋白的萃取影响差异显著,其中含MgCl2的缓冲溶液在添加量为0.03 mL/mL前萃率达到最大值98.55%±0.60%。反胶束粒径与萃取率之间的关系会受到许多因素的影响,不同因素影响下,二者之间的关系不同;并得出反胶束前萃花生蛋白的模型符合“水壳模型”。
反胶束,花生蛋白,粒径,前萃率,后萃率
反胶束是表面活性剂在有机溶剂中形成的自组装聚集体,水溶解在极性核中形成纳米级的“水池”。大部分椭球形的反胶束表面活性剂含量<10%,水含量0~10%,有机溶剂含量80%~90%,因此反胶束又称为油包水微乳液[1]。又由于反胶束是胶体溶液,因此具有热力学稳定性、自发形成、低界面张力、光学透明、比表面积大、粘度与纯有机溶剂相当、动态平衡等特点。胶束与胶束之间不断地碰撞与融合,在此过程中融合的表面活性剂分子和反胶束内核的物质偶尔会发生交换[2]。
Leser[2]探索了用丁二酸二异辛酯磺酸钠(AOT)反胶束从富含油脂的菜籽中分离蛋白,分离的过程分为两个步骤,即前萃和后萃。前萃通过调整实验条件促进蛋白进入有机相,后萃则是从反胶束溶液中回收蛋白和油脂。由于花生是生产食用油的重要油料作物,因此反胶束同时分离蛋白和油脂是非常具有吸引力的。反胶束同时分离蛋白和油脂是一个较为复杂的过程,受到温度、振荡作用、萃取时间及反胶束自身性质等[3]因素的影响。Gochman-Hecht等[4]提出了蛋白质进入反胶束后的3种模型:A.水壳模型,该模型表示蛋白质分子的溶解导致反胶束尺寸的增大;B.诱导契合模型,该模型表示当蛋白分子尺寸大于反胶束微粒时,表面活性剂可在蛋白质分子诱导下重新分配,形成更大聚集数的胶束,使蛋白质溶于其中;C.固定大小模型,该模型表示蛋白质分子等于或小于反胶束微粒尺寸时,溶解后反胶束尺寸不变。
目前,已有学者对反胶束粒径进行研究,而反胶束粒径及对花生蛋白溶解特性影响的研究较少,布冠好等[5]研究了反胶束体系中表面活性剂浓度和含水量对反胶束体系特性的影响,并得出含水量增加反胶束直径也增加,且蛋白萃取率随着反胶束直径的增大而增加。本文以全脂花生粉为原料,考察缓冲溶液的盐浓度、AOT浓度、pH、离子种类、缓冲溶液添加量等因素对反胶束萃取花生蛋白粒径及萃取率的影响,研究反胶束粒径及与花生蛋白萃取率的关系,实验结果将对生产实践提供重要的理论参考。
1 材料与方法
1.1 材料与仪器
全脂花生粉 河南帝鑫食品有限公司;AOT 上海海曲化工有限公司;异辛烷 分析纯,天津市博迪化工有限公司;KCl、NaCl、NaOH、Na2HPO4、KH2PO4、KNO3分析纯,洛阳市化学试剂厂;MgCl2、K2SO4分析纯,天津市科密欧化学试剂有限公司;浓H2SO4分析纯,洛阳昊华化学试剂有限公司;LiCl分析纯,天津市瑞金特化学品有限公司。
BS210S型分析天平 德国Sartorius公司;KJELTEC 2300型全自动凯氏定氮仪 瑞典福斯特卡托公司;Zetasizer Nano ZS90激光粒度分析仪 英国马尔文仪器公司;GL-20C型高速冷冻离心机 上海安亭科学仪器有限公司;pH211型pH计 意大利HANNA公司;SHZ-82型数显水浴恒温振荡器 常州博远实验分析仪器厂。
1.2 实验方法
1.2.1 原料成分测定 全脂花生粉中蛋白质含量的测定采用国家标准GB/T 5009.5-2010;水分含量的测定采用国家标准GB/T 5009.3-2010;粗脂肪含量的测定采用国家标准GB/T 5009.6-2003。
1.2.2 反胶束体系的制备 称取一定量AOT置于100 mL锥形瓶中,加入异辛烷,配制一定浓度的AOT/异辛烷反胶束溶液。用振荡器振荡至AOT完全溶解,加入含有一定浓度KCl的KH2PO4-Na2HPO4缓冲溶液(0.02~0.20 mL/mL),放入振荡器中振荡至溶液透明,静置12 h。此体系尚未萃取蛋白,反胶束水核中不含蛋白,因此定义为空胶束。
1.2.3 指标的测定
1.2.3.1 蛋白质前萃率的测定 在1.2.2配制的溶液中加入浓度为0.015 g/mL的全脂花生粉(过40目筛),将锥形瓶置于数显恒温水浴振荡器中,控制水浴温度为30℃,萃取30 min后,4000 r/min离心20 min,取上层清液为前萃液。此体系中的反胶团中包裹有蛋白质,定义为实胶束。根据1.2.1测定前萃液中蛋白质含量。

1.2.3.2 蛋白质后萃率的测定 取20 mL前萃液加入等体积缓冲溶液,将锥形瓶置于恒温水浴振荡器中,控制温度为40℃,萃取40 min后,5000 r/min离心40 min,分层后取下层水相,即得到花生蛋白后萃液。根据1.2.1测定后萃液中花生蛋白的含量。

1.2.3.3 反胶束前萃液粒径测定方法 本实验利用动态光散射的原理用Malvern zetasizer nano ZS-90激光粒度分析仪测定前萃液粒径。在样品池中加样1 mL左右,设定分散剂为异辛烷,粘度参数为0.47 Cp,折光率为1.389,温度25℃,之后开始进行测定,机器自动取三次平行,之后重复上述步骤一次,得到前萃液粒径分布及平均粒径,其中平均粒径六次测量结果的平均值将作为最终粒径。
1.2.4 KCl浓度的研究 当KCl浓度为变量时,控制AOT浓度为0.06 g/mL,KH2PO4-Na2HPO4缓冲溶液的pH为8.5,缓冲液的添加量为0.10 mL/mL,考察KCl的浓度分别为0.05、0.10、0.15、0.20、0.25、0.30 mol/L时空胶束粒径、实胶束粒径、前萃率、后萃率的变化。
1.2.5 AOT浓度的研究 当AOT浓度为变量时,控制KCl浓度为0.25 mol/L,KH2PO4-Na2HPO4缓冲溶液的pH为8.5,缓冲液的添加量为0.10 mL/mL,考察AOT的浓度分别为0.04、0.05、0.06、0.07、0.08、0.09 g/mL时空胶束粒径、实胶束粒径、前萃率、后萃率的变化。
1.2.6 缓冲液pH的研究 当控制缓冲溶液pH为变量时,控制AOT浓度为0.06 g/mL,KCl浓度为0.25 mol/L,缓冲液添加量为0.10 mL/mL,考察缓冲溶液pH分别为6.5、7.0、7.5、8.0、8.5、9.0时空胶束粒径、实胶束粒径、前萃率、后萃率的变化。
1.2.7 缓冲溶液的研究 控制离子种类为变量时,控制AOT浓度为0.06 g/mL,KCl浓度为0.25 mol/L,缓冲溶液的pH为8.5,考察缓冲溶液的添加量分别为0.03、0.07、0.11、0.15、0.19 mL/mL时空胶束粒径、实胶束粒径、前萃率、后萃率的变化。
1.2.8 离子种类的研究 选取阳离子(KCl、NaCl、MgCl2、LiCl)和阴离子(KCl、K2SO4、KNO3),控制AOT浓度为0.06 g/mL,KCl浓度为0.25 mol/L,缓冲溶液的pH为8.5,考察添加不同离子、不同缓冲溶液添加量(0.02、0.03、0.07、0.11、0.15、0.19 mL/mL)对空胶束粒径、实胶束粒径、前萃率、后萃率的影响。
1.3 数据分析
本实验采用Microsoft Excel软件计算、分析和绘图,萃取花生蛋白的实验均至少重复三次,计算平均值和标准偏差,图中用误差线体现。
2 结果与分析
2.1 原料成分测定结果
全脂花生粉的主要成分测定结果如表1。

表1 全脂花生粉的主要成分及质量分数Table1 The main components of full-fat peanut powder
表1为全脂花生粉主要成分的测定结果,其中蛋白质的干基含量为23.18%±0.08%,粗脂肪干基含量为45.26%±0.31%。
2.2 单因素实验
2.2.1 KCl浓度对反胶束粒径及萃取率的影响 KCl浓度对萃取花生蛋白前后反胶束粒径的影响如图1所示,随着KCl浓度的增加,空胶束及实胶束的粒径均呈现降低趋势,且浓度在0.05~0.15 mol/L范围内降低最快,之后粒径逐渐趋于平稳,这说明KCl浓度对空胶束及实胶束粒径影响主要集中在0.05~0.15 mol/L。KCl浓度为0.05 mol/L时,空胶束和实胶束的粒径均达到最大,分别为(11.01±0.12)、(44.10±1.12)nm。KCl浓度对前萃率及后萃率的影响如表2所示,与前萃率的变化趋势不同,后萃中随着KCl浓度的增加,后萃率呈现先降低后显著增加的趋势,这说明KCl浓度不仅对前萃过程有影响,对后萃过程也产生了一定的影响。

图1 KCl浓度对粒径的影响Fig.1 Effect of molarity of KCl on reverse micelles sizes
随着KCl浓度的增加,空胶束和实胶束的粒径均显著减小,一方面是由于盐浓度通过影响胶束粒径从而影响前萃率,盐浓度的增加使增溶于反胶束的水减少[6],出现盐析效应,使增溶于反胶束中的蛋白质减少;另一方面是“尺寸位阻效应”[7]的影响,增溶的蛋白减少,实胶束的粒径及前萃率也相应地降低。而后萃中盐浓度的增加降低了表面活性剂极性头之间的排斥力,有利于蛋白从胶束中释放出来,在静电引力的作用下进入水相的蛋白含量相对较高,因此后萃率逐渐升高。图1中实胶束粒径大于空胶束粒径,因此不符合固定大小模型。
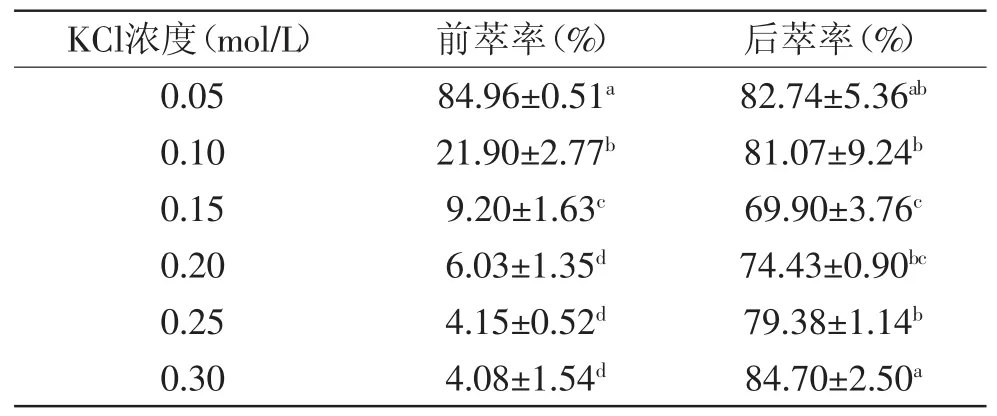
表2 KCl浓度对萃取率的影响Table2 Effect of molarity of KCl on extraction rates
2.2.2 AOT浓度对反胶束粒径及萃取率的影响 AOT浓度对空胶束及实胶束粒径的影响如图2所示,随着AOT浓度的增加,空胶束及实胶束粒径呈现增加的趋势,在所测范围内,浓度为0.09 g/mL时,空胶束粒径达到最大(11.05±0.44)nm,当AOT浓度为0.08 g/mL时,实胶束粒径达到最大(44.51±1.96)nm。而表3中AOT浓度对前萃率和后萃率也有显著性影响,随着AOT浓度的增加,前萃率逐渐降低,后萃率先下降后上升,AOT浓度为0.04 g/mL时,前萃率最高,达到97.61%±1.72%,后萃率在AOT浓度为0.08 g/mL时,达到最高95.26%±0.86%,与AOT浓度为0.09 g/mL时的萃取率94.01%±3.11%差异不显著。
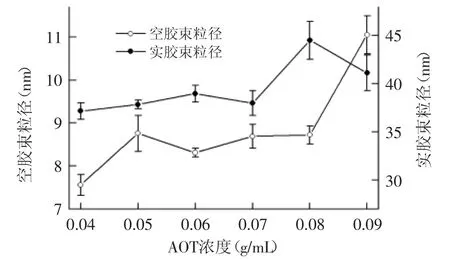
图2 AOT浓度对粒径的影响Fig.2 Effect of concentration of AOT on reverse micelles sizes

表3 AOT浓度对萃取率的影响Table3 Effect of concentration of AOT on extraction rates
由图2和表3中能看出AOT浓度增加,空胶束和实胶束的粒径均增加,但前萃率却降低,推测蛋白进入反胶束后,使反胶束体积变大,但是由于反胶束体系的动态平衡这一性质,萃取振荡过程中反胶束之间碰撞增加导致胶束结构被打破重新形成新的胶束[8],数目变少,总体上进入反胶束的蛋白减少,因此前萃率降低。后萃中,萃取率逐渐升高说明有更多的蛋白进入水相[9],这可以从花生蛋白与缓冲溶液氢键的作用来解释,花生蛋白与水中氢键增强,促进蛋白进入水相,后萃率升高。
图2和表3可知,反胶束粒径增大,前萃率降低,二者之间的关系受到AOT浓度的影响。从图2中反胶束的粒径在萃取蛋白后增大的变化趋势可以看出,萃取不符合固定大小模型,有可能为水壳模型或者诱导契合模型。
2.2.3 缓冲液pH对反胶束粒径及萃取率的影响 缓冲液pH对空胶束及实胶束的影响如图3所示,pH对空胶束粒径的影响不显著,随着pH从6.5增加到9.0,空胶束粒径在(9.06±0.20)~(9.25±0.27)nm范围内,且差异不显著,而对实胶束粒径的影响显著,实胶束粒径随着pH的增加呈现波浪线的趋势,但在pH8.5时,粒径最大,为(39.70±0.66)nm。表4中是缓冲液pH对前萃率及后萃率的影响。前萃率总体呈现先增加后减小的趋势,后萃率呈现先减小后增大再减小的趋势,pH为7.5时前萃率最大为91.80%±1.00%,pH为8.5时后萃率最大为94.16%±2.26%。
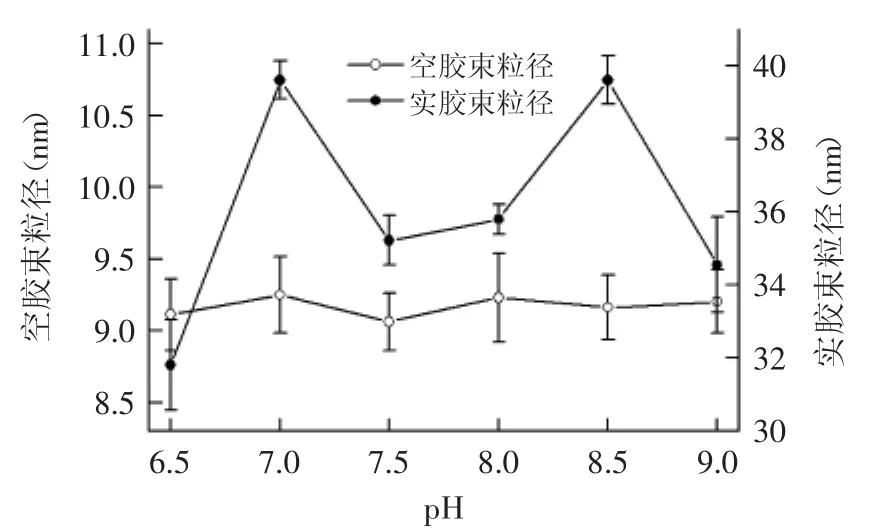
图3 pH对粒径的影响Fig.3 Effect of pH on reverse micelles sizes

表4 pH对萃取率的影响Table4 Effect of pH on extraction rates
pH能够调节蛋白与反胶束之间的静电相互作用[10],因此调节pH就能够使增溶于反胶束的蛋白含量发生变化。AOT是阴离子表面活性剂,表面活性剂的极性头带负电荷。花生蛋白的等电点为pH4.5左右[11],当体系pH高于4.5,蛋白带负电荷,由于与反胶束之间的疏水相互作用而促进了蛋白的增溶,而当pH高于7.5,增溶于反胶束的蛋白含量降低,可以从反胶束与花生蛋白相互作用的最适pH来解释这个现象。这一结果与杨趁仙等[12]得出的结果相吻合,由于花生蛋白在pH过高或者过低时,溶解性均会减小,因此与反胶束相互作用的环境需要最佳pH,而pH7.5为反胶束与花生蛋白作用的最佳pH,无论高于或者低于此值,均不利于花生蛋白的萃取,因此前萃率均会降低。在前萃的基础上,后萃条件一致,但是后萃率却发生了显著变化,pH8.5时后萃率最高,说明pH通过前萃过程间接地影响后萃。
由图3和表4可以得出,与其他因素的作用不同,pH不能通过影响空胶束的粒径对前萃率产生影响,而是通过调节胶束内表面的电荷从而影响蛋白与反胶束之间的静电作用影响萃取过程。
2.3 离子种类对反胶束粒径及萃取率的影响规律研究
离子种类和缓冲溶液添加量对空胶束和实胶束粒径的影响如图4、图5所示,对萃取率的影响如表5、表6所示。从实验结果可以看出,离子种类不仅可以影响反胶束粒径,也直接地影响萃取率。
2.3.1 阳离子种类及缓冲溶液添加量对反胶束粒径及萃取率的影响规律研究 图4中随着缓冲溶液添加量的增加,含四种阳离子的空胶束粒径均呈现先显著增加后趋于平稳的趋势,其中含LiCl的缓冲液添加量为0.19 mL/mL时,空胶束粒径最大,为(16.41± 0.49)nm;实胶束粒径则先显著增加后显著降低然后趋于稳定,且含四种盐的实胶束粒径均在缓冲溶液添加量为0.03 mL/mL时达到最大。
如表5所示,含不同盐的反胶束前萃率大小各不相同,但是总的来看,随着缓冲溶液添加量的增加,前萃率均呈现先增加然后降低的趋势。其中含MgCl2的缓冲溶液在添加量为0.03 mL/mL达到最大值98.55%±0.60%。结合图4中空胶束和实胶束粒径变化,对于同一种盐,缓冲液添加量高于0.03 mL/mL时,胶束粒径继续增加但不显著,说明增溶于胶束的水接近极限,继续添加缓冲液,不能促进水的增溶,而实胶束粒径在振荡萃取后,由于表面活性剂重新组装成新的包裹蛋白的反胶束,随着缓冲液的增加,实胶束分散成粒径相对较小的胶束,且数目变多,虽然粒径在0.03 mL/mL达到最大,但由于反胶束数目相对较少,因此前萃率不能达到最大值;对于不同阳离子,前萃率的大小不同,但总体上前萃率MgCl2>NaCl>KCl>LiCl,这个现象可以从两个方面考虑:一方面,Mg2+、Na+均为容易与水结合的离子[13],使增溶于反胶束的水增加,粒径增大,带正电荷的阳离子降低AOT反胶束内表面的负电荷,从而在蛋白与反胶束静电引力的作用下促进蛋白进入胶束,提高萃取率;另一方面,从离子半径的角度考虑[14],离子半径对反胶束与蛋白之间的作用力具有一定的影响,因此能间接地影响前萃率。
与前萃率的变化显著不同,四种阳离子之间的后萃率差异显著,KCl>NaCl>MgCl2>LiCl。而对于同一种盐,随着缓冲液添加量的增加,NaCl呈现逐渐增加的趋势,KCl则呈现先增加后减小然后再增加的趋势,最大后萃率分别达到54.81%±0.39%和96.75%±0.11%,MgCl2和LiCl后萃率呈现先降低后逐渐增加的趋势,最大萃取率分别仅为16.84%±1.74%和10.08% ±1.57%。首先,离子尺寸对静电作用也有影响,K+离子半径大,与蛋白的静电作用较强,使进入水相的蛋白含量最大,Na+、Mg2+则次之,进入水相的蛋白含量相对较低[13];其次,水相的离子强度与带电表面的静电屏蔽效应密切相关,小尺寸的阳离子如Li+由于水合作用而产生微弱的静电屏蔽效应,导致水相离子强度降低而减少了蛋白的溶解,更多的蛋白进入有机相而不是水相。
由图4中反胶束粒径的变化可以看出前萃不符合“固定大小模型”,且实胶束粒径大于空胶束粒径可以看出,蛋白进入胶束后,实胶束重新分布成了粒径较大的胶束,因此不符合“水壳模型”,而是符合“水壳模型”。
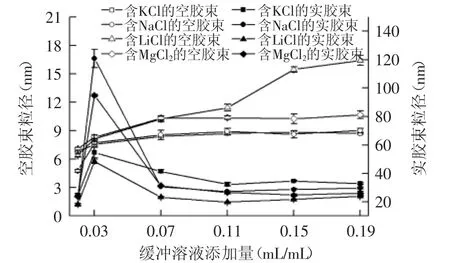
图4 阳离子种类对反胶束粒径的影响Fig.4 Effect of cation species on reverse micelles sizes
2.3.2 阴离子种类及缓冲溶液添加量对反胶束粒径及萃取率的影响规律研究 图5中,与含阳离子盐的反胶束粒径变化趋势相近,但含阴离子的空胶束和实胶束粒径总体上均小于阳离子;缓冲液添加量为0.03 mL/mL时,含KNO3的实胶束粒径最大,为(60.56± 1.42)nm。结合前萃率的变化,可以从离子所带电荷来解释萃取率较低的现象,胶束中的阴离子与内表面相互作用[16],加剧了反胶束内表面的静电斥力,而与高于等电点的带负电荷的蛋白质相互排斥,不利于蛋白进入胶束中,从而导致较小的实胶束粒径和前萃率。由表6的后萃率可以看出,总体上后萃率KCl>K2SO4>KNO3,极为反常的是含KNO3的反胶束后萃率出现负值,对于后萃水相中NO3-凯氏定氮过程与其他不同的是,硝化过程中有棕红色烟生成,猜测在此过程中,KNO3在浓硫酸与硫酸铜的作用下,与蛋白质作用生成NO2气体[17],致使蛋白不能转化成铵盐而被蒸馏,导致测得的值低于仪器测得的空白值而得到负值。
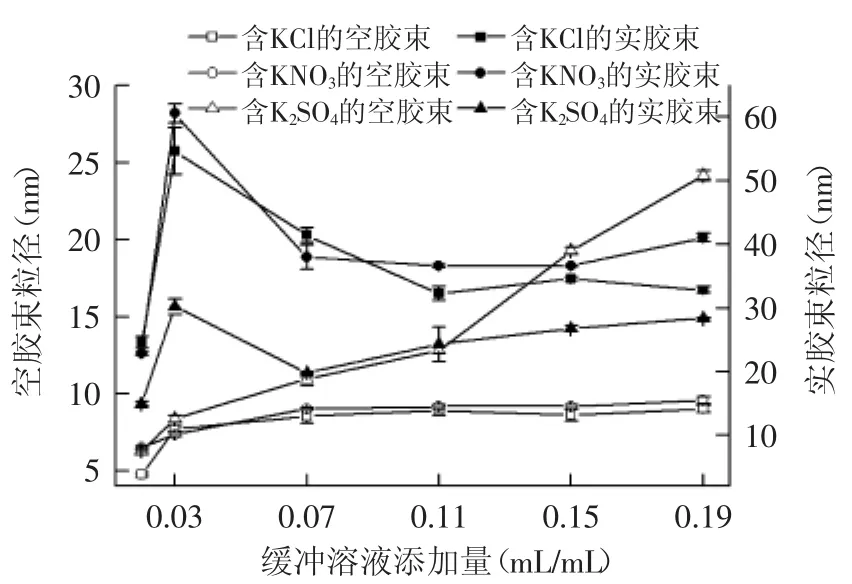
图5 阴离子种类对反胶束粒径的影响Fig.5 Effect of anion species on reverse micelles sizes
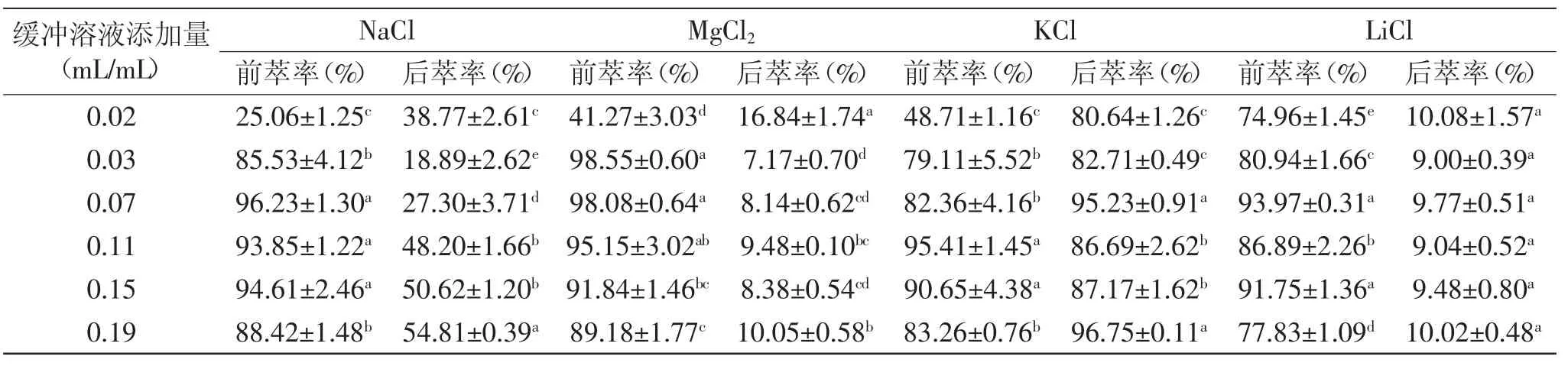
表5 阳离子种类对萃取率的影响Table5 Effect of cation species on extraction rates
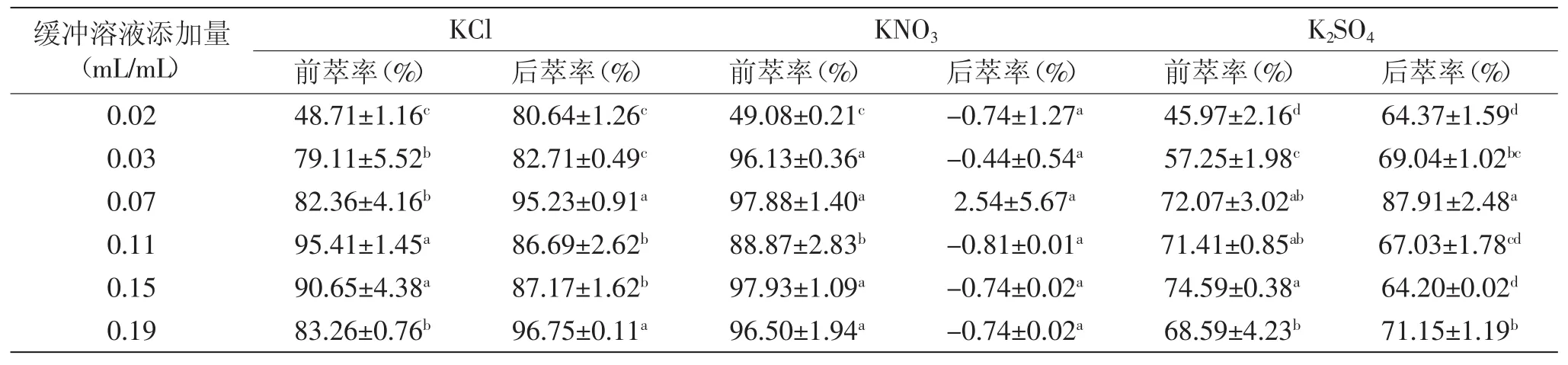
表6 阴离子种类对萃取率的影响Table6 Effect of anion species on extraction rates
由以上结果可以看出不同离子对反胶束萃取花生蛋白的影响不同,整体上阳离子种类对空胶束和实胶束粒径以及萃取率的影响大于阴离子,增加缓冲溶液添加量不能使反胶束粒径持续增加;不同的离子种类,胶束粒径与前萃率和后萃率的关系也不同,当实胶束粒径最大时,萃取率不一定最大。
3 结论
本文研究了不同条件下反胶束萃取花生蛋白前后粒径变化与萃取率之间的关系,考察了缓冲溶液中KCl的浓度、AOT浓度、缓冲溶液的pH、缓冲液添加量、离子种类等条件对AOT反胶束萃取花生蛋白粒径及萃取率的影响。结果表明,KCl浓度增加,使粒径减小,前萃率也相应降低;在0.04~0.09 g/mL范围内,AOT浓度越大,空胶束及实胶束粒径越大,但是前萃率降低,而后萃率则相反,说明粒径大的胶束萃取率不一定高;缓冲液pH对空胶束粒径影响不显著,但通过静电相互作用影响实胶束粒径和萃取率;不同的离子种类对反胶束粒径及花生蛋白的萃取影响差异显著,其中含MgCl2的缓冲溶液在添加量为0.03 mL/mL前萃率达到最大值98.55%±0.60%,含KCl的缓冲溶液在添加量为0.19 mL/mL后萃率达到最大值96.75% ±0.11%。结合得出的结果,反胶束粒径与萃取率之间的关系会受到许多因素的影响,不同因素影响下,得出的关系不同,得出反胶束前萃花生蛋白的模型为“水壳模型”。
[1]LIU Yang,D X a S Y.New Development of Reverse Micelles and Applications in Protein seperation and refolding[J].Chinese Journal of Chemical Engineering,2008,16(9):949-955.
[2]Leser M E,Luisi P L,Paimieri S.The use of reverse micelles for the simultaneous extraction of oil and proteins from vegetable meal[J].Biotechnology and Bioengineering,1989,34(9):1140-1146.
[3]Guanhao B.Effects of different factors on the forward extraction of soy protein in reverse micelle systems[J].African Journal of Biotechnology,2012,11(28):7247-7257.
[4]Gochman-Hecht H,Bianco-Peled H.Structure modifications of AOT reverse micelles due to protein incorporation[J].Journal of colloid and interface science,2006,297(1):276-283.
[5]布冠好,刘海远,陈复生,等.AOT/异辛烷反胶束体系特性及萃取大豆蛋白的研究[J].河南工业大学学报:自然科学版,2012,33(6):7-12.
[6]刘晓燕,闫杰.反胶束体系在蛋白质萃取中应用的研究进展[J].食品工业科技,2010(4):374-376.
[7]Zhao X,Wei Z,Du F,et al.Effects of surfactant and salt species in reverse micellar forward extraction efficiency of isoflavones with enriched protein from soy flour[J].Applied biochemistry and biotechnology,2010,162(7):2087-2097.
[8]蔡宝玉,许林妹,彭远宝.反胶束萃取大豆蛋白的研究[J].中国油脂,2004,29(6):37-39.
[9]磨礼现,陈复生,杨宏顺.反胶束溶液萃取大豆蛋白前萃工艺的研究[J].食品科学,2004,25(3):93-96.
[10]Koyamatsu Y,Hirano T,Kakizawa Y,et al.pH-responsive release of proteins from biocompatible and biodegradable reverse polymer micelles[J].Journal of Controlled Release,2014,173 (2):89-95.
[11]韦一能,陈元发,陈全斌,等.花生蛋白质的主要种类和等电点的研究[J].广西科学,1995,2(4):1-5.
[12]杨趁仙,陈复生,刘昆仑,等.含酶反胶束体系后萃花生蛋白工艺优化研究[J].粮食与油脂,2014,27(8):41-44.
[13]赵涛涛,宫厚健,徐桂英,等.阴离子表面活性剂在水溶液中的耐盐机理[J].油田化学,2010,27(1):112-118.
[14]滕弘霓,王飞,孙美娟,等.盐对正负离子表面活性剂双水相性质的影响[J].化学学报,2005,63(17):1570-1574.
[15]Nishii Y,Kishi Y,Ito M,et al.Effect of cation species on equilibrium of reversed micellar extraction of lysozyme[J].Separation and Purification Technology,2004,37(2):161-167.
[16]Kinugasa T,Kondo A,Mouri E,et al.Effects of ion species in aqueous phase on protein extraction into reversed micellar solution[J].Separation and Purification Technology,2003,31 (3):251-259.
[17]牛巍,侯彩云,祝晓芳,等.三氯乙酸沉淀法与硫酸铜沉淀法在液态奶蛋白质检测中适用性研究[J].中国乳品工业,2008,36(9):59-61.
Changes of relationship between the sizes of reverse micelles before and after extraction of peanut protein and their extraction rates
WANG Li-min,CHEN Fu-sheng*,LIU Kun-lun,YIN Li-jun
(College of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
This study evaluated the sizes of reverse micelles before and after the extraction of peanut protein by AOT/isooctane reverse micelles and investigated the relationship between the size change and extraction rates.The results showed that increasing the concentration of KCl,the particle sizes and forward extraction rates decreased.And increasing the concentration of AOT in the range of 0.04~0.09 g/mL,the empty reverse micelles and full reverse micelles increased,forward extraction rates increased,while the backward extraction rates were on the contrary.The pH had no significant influence on empty reverse micelles,but could influence full reverse micelles sizes and extraction rates by electrostatic interaction.The ion species had significant effects on the sizes of reverse micelles and extraction of peanut protein,when the addition amount of buffer solution containing MgCl2was 0.03 mL/mL,the forward extraction rate reached the peak of 98.55%±0.60%.The relationship between reverse micelles sizes and extraction rates could influenced by many factors,and their relation varied under different conditions.The model of the forward extraction process was“water-shell model”.
reverse micelle;peanut protein;size;forward extraction rate;backward extraction rate
TS201.1
B
1002-0306(2016)02-0228-06
10.13386/j.issn1002-0306.2016.02.038
2015-07-21
王丽敏(1989-),女,硕士研究生,研究方向:食品蛋白质资源开发及利用,E-mail:wanglm2000@126.com。
*通讯作者:陈复生(1963-),男,教授,研究方向:食品蛋白质资源开发与利用,E-mail:fushengc@aliyun.com。
国家自然科学基金项目(21176058);863项目(2013AA102208);郑州市创新型科技人才队伍建设工程(ISTTCPZZC);河南省成果转化资金项目(132201610014)。
