高产信号分子AI-2乳酸菌的筛选及鉴定
2016-09-14燕彩玲贾原博贺银凤内蒙古农业大学食品科学与工程学院内蒙古呼和浩特010018
李 博,顾 悦,燕彩玲,贾原博,贺银凤(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
高产信号分子AI-2乳酸菌的筛选及鉴定
李 博,顾 悦,燕彩玲,贾原博,贺银凤*
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
通过V.harveyi BB170生物学方法检测分离自内蒙古锡盟地区的8株乳酸菌产生群体感应信号分子AI-2的情况,筛选出高产信号分子AI-2的菌株进行分子生物学鉴定,并探究信号分子AI-2变化规律。结果表明:8株乳酸菌均能够分泌具有活性的信号分子AI-2,其中,菌株2-1产信号分子AI-2的能力显著优于其他7株乳酸菌(p<0.05);高产AI-2的乳酸菌菌株2-1经鉴定为发酵乳杆菌(Lactobacillus fermentum);随着2-1菌体的生长信号分子AI-2的浓度也随之增大,并且信号分子AI-2浓度在稳定期初期达到最大值。
群体感应,乳酸菌,信号分子AI-2
群体感应(QS)系统,指细菌在生长过程中一般可以自发地释放一些特定的自诱导信号分子(AIs),当这些信号分子被自身或环境中的其他个体感知到时,会通过改变自身某些基因的表达而作出反应,从而调节特定的生理功能,协调群体行为。QS系统由自诱导分子、感应蛋白及其下游调控蛋白组成。根据细菌合成感应机制和信号分子种类的不同,QS系统主要分为三类:革兰氏阴性菌(G-)的AHL-LuxI/LuxR系统,由寡肽介导的革兰氏阳性菌(G+)双组分感应系统,LuxS/AI-2介导的QS系统[1]。
LuxS/AI-2介导的QS系统是Bassler等[2]在哈氏弧菌(Vibrio harveyi,V.harveyi)的生物发光现象中首次发现的,它可以分泌两种自体诱导分子AI-1和AI-2,并且均可控制相关基因的表达[3]。实验中用到的指示菌株V.harveyi BB170是标准菌株V.harveyi BB120的定向突变菌株,其信号分子AI-1的感受器是缺失的,故只能对信号分子AI-2发生反应并发光。V.harveyi BB170产生信号分子AI-2的luxS基因是完整的,在菌体密度达到一定程度时,可自行产生信号分子AI-2。V.harveyi BB170是目前国际上通用的、便捷高效的检测信号分子AI-2的指示菌株[4]。
目前发现,LuxS/AI-2介导的QS系统存在于多种革兰氏阳性菌及革兰氏阴性菌中,不同菌种间其表达的蛋白质同源性也较高,其分泌的信号分子AI-2的结构也相似,信号分子AI-2可以引起种间信息的交流[5],所以LuxS/AI-2介导的QS系统可能主要用于不同菌种间交流。研究表明,LuxS/AI-2介导的QS系统对乳酸菌的酸耐受能力、抑制病原微生物、对肠表皮细胞的黏附性、生物膜的形成以及在动物消化道中的存活性等具有介导作用[6-11]。
1 材料与方法
1.1 材料与仪器
8 株实验菌株 均分离自内蒙古锡盟地区酸马奶酒中,由内蒙古传统乳制品中乳酸菌与酵母菌互生机理课题组提供;V.harveyi BB170 购自ATCC;MRS液体培养基 按照文献[12]方法配制;AB培养基 按照文献[13]方法配制;细菌基因组提取试剂盒 北京天根公司。
HZQ-C气浴恒温振荡器 精达公司;SW-CJ-1FD超净工作台 苏州智净公司;高压灭菌锅 日本HIRAYAMA公司;SK-1快速混匀器 武汉格莱莫公司;LG10-24A离心机 湘潭离心机有限公司;核酸电泳仪 美国伯乐公司;GelDoc XR+凝胶成像仪 美国伯乐公司;快速梯度PCR仪 美国ABI公司;Thermo Scientific Multiskan FC酶标仪 美国Thermo公司;VICTOR X3 Multilabel Plate Reader 美国Perkin Elmer仪器有限公司;恒温培养箱 上海精密仪器有限公司。
1.2 菌种保藏和活化
将8株乳酸菌分别接种于灭菌后的MRS液体培养基中,于37℃活化培养三代,在第三代生长到对数期的发酵液中加入20%甘油,分别装入2 mL离心管置于-80℃冰箱进行保藏。每次使用按2%的接种量接种于新鲜MRS培养基中,每代于37℃培养24 h,连续培养三代即可用于实验。
V.harveyi BB170使用AB培养基活化三代,在第三代生长到对数期的发酵液中加入20%甘油,分装入2 mL离心管置于-80℃冰箱进行保藏。每次使用按2%的接种量接种于新鲜AB培养基中,每代于30℃振荡培养13 h,连续培养三代即可用于实验。
1.3 高产信号分子AI-2乳酸菌的筛选
1.3.1 乳酸菌上清液的制备 将8株乳酸菌按2%接种至灭菌后的液体MRS培养基中,37℃继续培养19 h后,将菌液移入灭菌的10 mL离心管中6000 r/min离心10 min,弃去菌泥,上清液用0.22 μm的灭菌滤菌器过滤至2 mL离心管中,得到各乳酸菌的无菌上清液;按相同方法收集30℃振荡培养13 h的V.harveyi BB170无菌上清液,作为阳性对照;用0.22 μm灭菌滤菌器分别过滤灭菌的AB培养基和MRS培养基,作为阴性和介质对照。无菌上清液分别贮藏于-80℃冰箱。
对比组患者二尖瓣瓣膜病变检出率为25%,主动脉瓣膜病检出率为50%,其他病变检出率为25%,研究组检出率分别为22.22%、44.44%、33.33%,试验组检出率分别为20%、80%,具体构成情况见表。
1.3.2 上清液中信号分子AI-2的生物学检测 发光检测实验方法参考文献[13]。将V.harveyi BB170按 2%接种于灭菌后的AB培养基,转速90 r/min,30℃培养12 h左右至培养基混浊(OD600 nm为0.7~1.2),然后用新鲜的AB培养基以1∶5000稀释V.harveyi BB170培养液,随后充分振荡混匀备用。分别将各乳酸菌、V.harveyi BB170、AB培养基和MRS培养基滤过的无菌上清液作为待测样品、阳性、阴性和介质对照,按体积比1∶100与上述稀释过的V.harveyi BB170培养液混合,置于30℃继续振摇培养。在1~6 h内,每30 min取200 μL/孔至96孔黑色酶标板中,用多功能酶标仪的化学发光模式检测其荧光强度值,以时间为横坐标,相应时间点的荧光强度为纵坐标绘制曲线。样品与对照均取复孔,每次实验重复两次。在1~6 h内,以阴性对照组荧光强度值降到最小时的时间点为基准(在3 h左右),信号分子AI-2的浓度用相对荧光强度表示,计算公式如下[14]。
阳性对照组相对荧光强度=阳性对照的荧光强度值/阴性对照的荧光强度值
待测组相对荧光强度=待测样品的荧光强度值/介质对照的荧光强度值
1.4 高产信号分子AI-2乳酸菌的分子生物学鉴别
1.4.1 细菌总DNA的提取及PCR产物的检测 使用细菌基因组提取试剂盒对高产信号分子AI-2乳酸菌的基因组进行提取,提取方法详见试剂盒说明书。实验菌株16S rRNA序列PCR扩增引物F:5'-AGAGTTTG ATCCTGGCTCAG-3′R:5′-CCGTCAATTCCTTTGAGT TT-3′,参照文献[15]中所提供的引物。PCR扩增片段约为900 bp。PCR扩增体系为50 μL,其中模板DNA 2 μL、上下游引物各2 μL、DreamTaq Green PCR Master Mix 25 μL、加无菌水补至50 μL。PCR条件参数为:预变性94℃、3 min,变性94℃、30 s,退火57.4℃、30 s,延伸72℃、90 s,35个循环,最后末端延伸72℃、5 min。取5 μL实验菌株PCR扩增产物与1 μL 6×Loading Buffer混匀,用1%琼脂糖凝胶电泳检测,110 V、30 min,凝胶成像系统观察条带。PCR产物送上海生工测序。
1.4.2 同源性分析与系统发育树的构建 利用BLAST (http://www.ncbi.nlm.nih.gov/BLAST),将所测定菌株的16S rDNA序列,与GenBank数据库中已知细菌的16S rDNA序列进行比较鉴定,寻找与目的基因序列同源性最高的已知分类地位的菌种。然后用DNA star软件以Mega 5.2.2进行校准排齐,绘制系统发育树。
1.5 信号分子AI-2与OD595 nm值的关系
将高产信号分子AI-2乳酸菌株2-1按2%接种至灭菌后的MRS液体培养基中,于37℃继续培养4、7、10、13、16、19、22、25 h后,分别测定不同时间点OD595 nm值。不同时间点上清液的提取和信号分子AI-2的测定方法同1.3.1和1.3.2。
1.6 数据处理
数据采用SPSS软件11.0版本,在显著水平为0.05下进行单因素方差分析。
2 结果与分析
2.1 高产信号分子AI-2乳酸菌的筛选
由图1可知,介质对照、阴性对照、阳性对照的荧光强度在1~2.5 h随着孵育时间的延长而下降,在2.5 h阳性对照荧光强度降到最低,之后其荧光强度上升。而介质对照和阴性对照由于信号分子AI-2的浓度较低,荧光强度一直降到3 h,在3 h降到最低点,随后介质对照和阴性对照的荧光强度开始呈上升趋势,由于阴性对照只含有由AB培养基稀释后的指示菌,表明在培养过程中由指示菌V.harveyi BB170产生的AI-2浓度达到诱导其发光的阈值的时间为3 h,故以3 h作为基准点来计算相对荧光强度。
依据文献[16-17]和实验室前期研究,大量乳酸菌产生信号分子AI-2的最大值均出现在对数期末期或稳定期初期,故选择对8株乳酸菌培养19 h上清液进行荧光检测,以孵育3 h的荧光强度作为基准点,比较其相对荧光强度,见图2。由图2知,八株乳酸菌的相对荧光强度差异性较大,且均显著高于阴性对照(p<0.05),说明8株乳酸菌均可以产生信号分子AI-2,并且菌株1-3-2、2-1、5-2-1的相对荧光强度均显著高于其他5株菌(p<0.05),其中菌株1-3-2和5-2-1相对荧光强度与阳性对照相当,2-1相对荧光强度显著高于阳性对照(p<0.05),达到阳性对照的1.5倍,故后续实验选取菌株2-1。
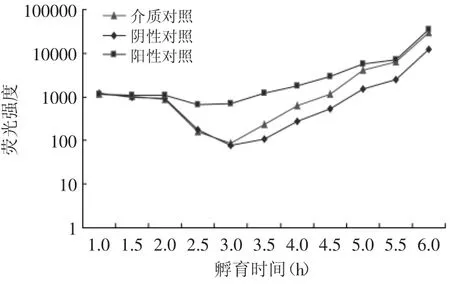
图1 不同孵育时间各样品的荧光强度值Fig.1 The luminescence of different incubation time of samples
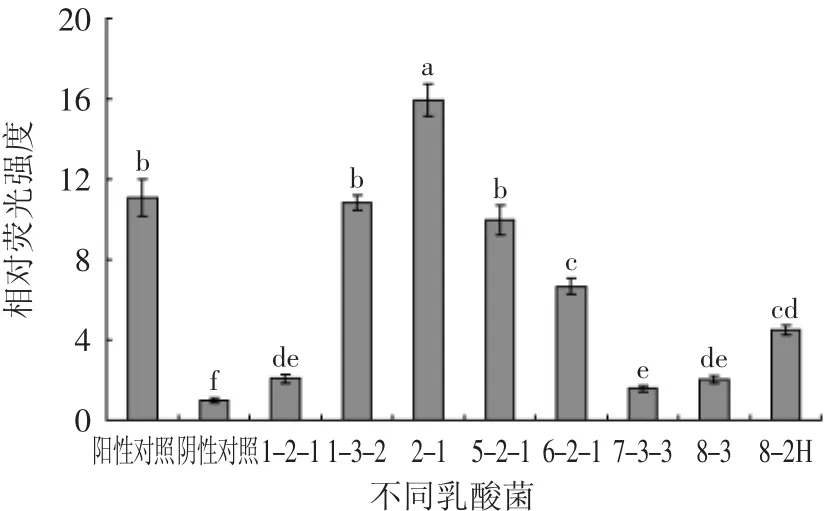
图2 各乳酸菌培养19 h上清液的相对荧光强度Fig.2 The relative luminescence of lactic acid bacteria in incubation time 19 h
2.2 高产信号分子AI-2乳酸菌的分子生物学鉴定
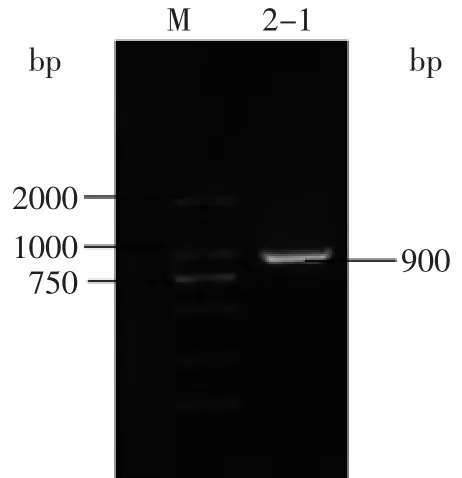
图3 16S rDNA基因PCR产物电泳图Fig.3 Electrophoresis of 16S rDNA gene amplified by PCR
乳酸菌菌株2-1的16S rDNA基因PCR产物电泳结果见图3,由图3可见菌株2-1 PCR的16S rDNA产物大约在900 bp的位置。菌株2-1的16S rRNA序列与GenBank中已知菌株的基因序列进行同源性比较,系统发育树结果见图4。

图4 菌株2-1与其他乳酸菌的系统发育树Fig.4 Phylogenetic tree of 2-1 to other lactic acid bacteria
由系统发育树可直观地看出乳酸菌菌株2-1和已知菌株的亲缘关系,2-1与菌株Lactobacillus fermentum strain CIP 1029和Lactobacillus fermentum strain NBRC 158在同一分支,且同源性最高,都达到99.8%,由此可判定这菌株2-1为发酵乳杆菌(Lactobacillus fermentum)。
2.3 信号分子AI-2与发酵乳杆菌2-1菌体密度之间的关系
以孵育3 h为基准点,计算发酵乳杆菌2-1不同培养时间的相对荧光强度。以培养时间为横坐标,不同培育时间菌体的OD595 nm值和相对荧光强度为纵坐标,绘制曲线,探讨菌体密度与信号分子AI-2的关系,见图5。由图5知,在4~16 h,随着培养时间的延长,发酵乳杆菌2-1的OD595 nm值逐渐增大,相对荧光强度也在逐渐上升,并在19 h达到最大值,且显著高于其他时间点的相对荧光强度(p<0.05),这表明信号分子AI-2与乳酸菌2-1菌体密度在一定范围内呈正相关。目前文献[13]中报道,当菌体密度过大,会造成荧光强度的降低。在本实验中,当培养时间超过19 h后,随着培养时间的延长,OD595 nm值不再变化,而相对荧光强度开始下降,这可能是由于菌体重新将信号分子AI-2吸收入菌体内,来调控某些重要生理功能[18]。
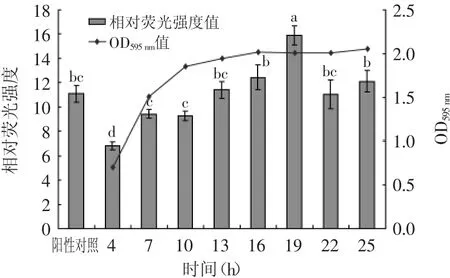
图5 发酵乳杆菌2-1上清相对荧光强度与OD595 nm的关系Fig.5 The relationship between the relative luminescence and OD595 nmabs
3 结论
利用V.harveyi BB170检测系统,检测8株乳酸菌均可以产生信号分子AI-2,但是差异性较大,其中菌株2-1、1-3-2、5-2-1产信号分子AI-2的能力明显高于其他5株乳酸菌,尤其以菌株2-1最为突出。乳酸菌2-1经过16S rDNA分子生物学鉴定,确定其为发酵乳杆菌(Lactobacillus fermentum)。发酵乳杆菌2-1可以分泌具有活性的信号分子AI-2,随着菌体密度的增加,信号分子AI-2的浓度逐渐增加,并在19 h达到峰值,之后随着培养时间继续延长,信号分子AI-2的浓度下降。
[1]邵长林,孙忠科,廖祥儒,等.群体感应与病原菌致病性研究进展[J].生物技术通讯,2011,22(3):445-448.
[2]Bassler B L.How bacteria talk to each other:regulation of gene expression by quorum sensing[J].Current Opinion in Microbiology,1999,2(6):582-587.
[3]Bassler B L,Greenberg E P,Stevens A M.Cross-species induction of luminescence in the quorum-sensing bacterium Vibrio harveyi[J].Journal of Bacteriology,1997,179(12):4043-4045.
[4]Kordel M,Schüller F,Sahl H G.Interaction of the pore forming-peptide antibiotics Pep 5,nisin and subtilin with nonenergized liposomes[J].FEBS Letters,1989,244(1):99-102.
[5]Schauder S,Bassler B L.The languages of bacteria[J].Genes &Development,2001,15(12):1468-1480.
[6]Moslehi-Jenabian S,Gori K,Jespersen L.AI-2 signalling is induced by acidic shock in probiotic strains of Lactobacillus spp [J].International Journal of Food Microbiology,2009,135(3):295-302.
[7]Moslehi-Jenabian S,Vogensen F K,Jespersen L.The quorum sensing luxS gene is induced in Lactobacillus acidophilus NCFM in response to Listeria monocytogenes[J].International Journal of Food Microbiology,2011,149(3):269-273.
[8]朱晶.产肠毒素大肠杆菌,肠上皮细胞和乳酸菌相互关系的研究[D].上海:上海交通大学,2011.
[9]Buck B L,Azcarate-Peril M A,Klaenhammer T R.Role of autoinducer-2 on the adhesion ability of Lactobacillus acidophilus [J].Journal of Applied Microbiology,2009,107(1):269-279.
[10]Lebeer S,Claes I J J,Verhoeven T L A,et al.Impact of luxS and suppressor mutations on the gastrointestinal transit of Lactobacillus rhamnosus GG[J].Applied and Environmental Microbiology,2008,74(15):4711-4718.
[11]Park H,Yeo S,Ji Y,et al.Autoinducer-2 associated inhibition by Lactobacillus sakei NR28 reduces virulence of enterohaemorrhagic Escherichia coli O157∶H7[J].Food Control,2014,45:62-69.
[12]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:228-232.
[13]Taga M E,Xavier K B.Methods for analysis of bacterial autoinducer-2 production[J].Current Protocols in Microbiology,2005,1:1C.1.1-1C.1.15.
[14]廉雪花.酸马奶酒中酵母菌对乳酸菌产AI-2信号分子影响的初步研究[D].呼和浩特:内蒙古农业大学,2013.
[15]李少英.奶牛源性双歧杆菌和孔杆菌的分离鉴定及耐药性研究[D].呼和浩特:内蒙古农业大学,2008.
[16]Gori K,Moslehi-Jenabian S,Purrotti M,et al.Autoinducer-2 activity produced by bacteria found in smear of surface ripened cheeses[J].International Dairy Journal,2011,21(1):48-53.
[17]Moslehi-Jenabian S,Gori K,Jespersen L.AI-2 signalling is induced by acidic shock in probiotic strains of Lactobacillus spp[J].International Journal of Food Microbiology,2009,135(3):295-302.
[18]张腾,贺银凤.坚强肠球菌SQ-3-2基于LuxS群体感应系统信号分子AI-2的检测及方法优化[J].食品与发酵工业,2013,39(2):169-173.
Screening and identification of AI-2 high-producing lactic acid bacteria
LI Bo,GU Yue,YAN Cai-ling,JIA Yuan-bo,HE Yin-feng*
(College of Food Science and Engineering,Inner Mongolia Agricultural University,Hohhot 010018,China)
The V.harveyi bioassay method was carried out to explore that 8 lactic acid bacteria which isolated from koumiss of Ximeng region in Inner Mongolia produced the quorum-sensing signal autoinducer-2(AI-2)and found the production pattern.AI-2 high-producing strain was screened for molecular biological identification and relationship between AI-2 and bacterial density was further studied.The results showed that all strains could produce AI-2,among of which the ability of AI-2 production of strain 2-1 was superior(p<0.05)and identified as a Lactobacillus fermentum.The concentration of AI-2 increased with bacterial density and the largest amount of AI-2 was observed in the early stationary phase in the culture of strain 2-1.
quorum sensing;lactic acid bacteria;signal autoinducer AI-2
TS201.3
A
1002-0306(2016)02-0185-04
10.13386/j.issn1002-0306.2016.02.029
2015-07-02
李博(1991-),男,硕士研究生,研究方向:乳品微生物,E-mail:libo910208@126.com。
*通讯作者:贺银凤(1960-),女,教授,研究方向:食品生物技术,E-mail:heyinf6468@yahoo.com.cn。
国家自然科学基金资助项目(31360396)。
