阿魏菇子实体多糖的结构及其抗氧化活性研究
2016-09-14陈庆庆许程剑石河子大学食品学院新疆石河子市832000
陈庆庆,陈 帅,李 峰,许程剑(石河子大学食品学院,新疆石河子市832000)
阿魏菇子实体多糖的结构及其抗氧化活性研究
陈庆庆,陈 帅+,李 峰,许程剑*
(石河子大学食品学院,新疆石河子市832000)
以从阿魏菇子实体中分离纯化得到的多糖-阿魏菇多糖(Pleurotus ferulae Lenzi polysaccharides,PFLPs)作为研究对象,对其化学结构、链构象以及抗氧化活性进行了研究。实验结果表明,PFLPs含有鼠李糖、木糖、甘露糖、葡萄糖和半乳糖五种单糖,摩尔比为1∶1.26∶0.85∶12.40∶4.31,并且糖链内具有β-D-葡聚糖结构。链构象分析表明PFLPs是一种具有三股螺旋结构的多糖。体外抗氧化活性实验表明,PFLPs具有较高的DPPH自由基、ABTS+自由基和羟自由基清除活性,适度的超氧阴离子自由基清除活性,还原力活性的和Fe2+的螯合活性。结果表明,PFLPs是一种很有潜力的天然抗氧化剂。
阿魏菇多糖,结构表征,链构象,抗氧化活性
多糖在生物体中不仅起到提供和存储能量的功能,还具有多种生物活性[1],如抗肿瘤、抗癌、抗真菌、抗氧化以及免疫调节作用。就整体而言,不同的食用菌的多糖其生物活性与其结构和链构象密切相关,大部分食用菌多糖是β-葡聚糖,具有1→3、1→6型糖苷键连接的构型。据报道,裂褶菌多糖的抗肿瘤活性与其三股螺旋结构的比例相关,香菇多糖的抗肿瘤活性和糖链构象之间的关系表明单柔性链的抗肿瘤活性远低于三螺旋链[2]。人体自由基的过量产生会对机体内的大分子造成损害,并导致各种相关的疾病[3]。此外,活性氧自由基也是食品加工和贮存中导致食品腐败的的主要因素之一。然而,合成的抗氧化剂在食品安全方面会导致许多严重的问题,并对人体健康具有显著的副作用,例如导致肝损伤和致癌[4]。因此,开发天然抗氧化剂是一项具有显著意义的研究。
阿魏菇(Pleurotus ferulae Lenzi)从属担子菌亚门层菌纲伞菌目侧耳科侧耳属,是干旱草原上极具代表性的蕈菌之一,同时也是中国新疆维吾尔自治区的特产菌类。阿魏菇是中国传统的食用和药用真菌,具有美味的口感和较高的营养价值。目前为止有关新疆阿魏菇多糖结构或生物活性的研究报道较少。在本次研究中,从阿魏菇子实体中分离纯化出阿魏菇多糖(PFLPs),通过红外光谱法,高效气相色谱法对PFLPs的化学结构进行分析。通过刚果红实验和流变仪对PFLPs的链构象进行分析。此外,对PFLPs的抗氧化活性,包括还原力,Fe2+的螯合能力,超氧阴离子自由基、DPPH自由基、羟自由基和ABTS+自由基清除活性也进行了测试。
1 材料与方法
1.1 材料与仪器
阿魏菇 采至新疆清河县;单糖标准品木糖、甘露糖、鼠李糖、半乳糖、葡萄糖和阿拉伯糖 北京鼎国生物技术有限责任公司;其他试剂 国产分析纯或色谱纯。
ENK-PRO型酶标仪 美国Bioteck公司;旋转蒸发仪 上海亚荣生化仪器公司;Ultrospec-5300型紫外分光光度仪 美国Amersham公司;DHR-3型流变仪 美国TA公司;真空冷冻干燥系统、GC-14C气相色谱系统、IRPrestige-21型傅里叶变换红外光谱仪日本SHIMADZU。
1.2 实验方法
1.2.1 PFLPs的分离和纯化 参考文献中多糖提取方法[1],并做出一定修改。阿魏菇子实体干燥之后粉碎,称取100 g,无水乙醇浸泡24 h脱脂,用60目双层纱布过滤。残留物45℃干燥,之后用蒸馏水85℃浸提3 h,重复浸提三次,计算多糖产率。随后,室温下用5 L,1.25 mol/L的NaOH/0.05%NaBH4溶液浸泡并洗涤残留物两次,合并上清液,用乙酸中和,离心(4000 r/min,15 min,4℃)去沉淀,旋转蒸发浓缩,Sevag法去蛋白。然后,将等体积的丙酮缓慢加入上清液中,离心(8000 r/min,10 min,50℃),收集沉淀,之后沉淀用透析袋进行透析(截留分子量3500),冷冻干燥之后得阿魏菇纯多糖PFLPs,计算PFLPs产率。之后将PFLPs配制成浓度为500 mg/mL的溶液,在波长200~400 nm的范围内扫描其紫外光谱,检测PFLPs的纯度。
1.2.2 单糖组成分析 称取PFLPs样品5 mg进行水解,加2 mol/L的三氟乙酸4 mL,120℃水解5 h,N2吹干。向PFLPs的水解物和单糖标准品中分别加入盐酸羟胺10 mg、吡啶0.5 mL和内标肌醇8 mg,90℃水浴30 min并振荡,冷却至室温,加入醋酸酐0.5 mL,继续90℃水浴30 min,N2吹干,加入乙醇,反复吹干3次后,2 mL三氯甲烷萃取,过滤之后得到的糖醇乙酸酯衍生物进行GC分析。
色谱条件:GC-14C,毛细管管柱(OV-1701,30 mm×0.32 mm);膜厚0.25 μm;进样量1 μL。程序升温:初始柱温为160℃,以6℃/min升至190℃,保持5 min,以8℃/min升至230℃,保持5 min;进样口温度为250℃,检测器温度为270℃。
1.2.3 傅立叶变换红外光谱(FT-IR)分析 精确称取 PFLPs样品1 mg,与KBr研磨混合压片,在4000~400 cm-1的范围内进行红外光谱扫描。
1.2.4 刚果红分析 称取PFLPs样品4 mg,加蒸馏水2.0 mL,80 μmol/L的刚果红试剂2.0 mL,加1.0 mol/L 的NaOH,使NaOH的浓度由0 mol/L逐渐升至0.5 mol/L,蒸馏水无添加PFLPs作为对照,用紫外可见光谱仪扫描,测得在不同NaOH溶液浓度下的最大吸收波长。以NaOH浓度作为横坐标,最大吸收波长作为纵坐标,绘制曲线。
1.2.5 动态温度扫描 储能模量(G′)和损耗模量(G″)的变化作为温度的函数。使用流变仪对其进行研究(直径为60 mm的平行板几何板)。从0~50℃,在中粘弹线性区对G′和G″进行测量。
1.2.6 还原力测定 根据现有的方法[5],在2.5 mL pH6.6的磷酸缓冲溶液中加分别入PFLPs标准溶液(0.6 mg/mL):0、0.05、0.10、0.15、0.20、0.25、0.3 mL,双蒸水0.00、0.95、0.90、0.85、0.80、0.75、0.70 mL,再加入铁氰化钾(1%,1 mL),混合物50℃加热20 min。急速冷却,加10%的三氯乙酸2.5 mL,离心(5000 r/min,15 min)。取上清液2.5 mL、双蒸水2.5 mL,再加0.1% 的FeCl3(0.1%,0.5 mL),混合均匀,25℃静置10 min,之后在波长700 nm处测定吸光度值,绘制曲线。反应混合液的吸光度值随着还原力的增加而增加,抗环血酸(VC)作为阳性对照。
1.2.7 Fe2+螯合活性测定 根据Manivasagan等的方法测定[5]。不同浓度的1 mL样品溶液依次与氯化亚铁(2 mmol/L,0.05 mL)、Ferrozine溶液(5 mmol/L,0.2 mL)、双蒸水(2.75 mL)混合。混合物25℃反应10 min,之后在波长562 nm处测定吸光度值,绘制曲线。双蒸水作对照,乙二胺四乙酸二钠(EDTA-2Na)溶液作为阳性对照。Fe2+的螯合能力的计算公式如下:Fe2+的螯合活性(%)=(A0-A1+A2)/A0×100,其中A0是对照组的吸光度值(双蒸水代替PFLPs),A1是样品在反应体系过程中的吸光度值,A2是样品的最终吸光度值。
1.2.8 超氧阴离子自由基清除活性测定 根据已报道的方法[6],在本实验中进行一些修改,不同浓度0.5 mL的样品溶液依次与Tris-HCl溶液(50 mmol/L,2 mL)、双蒸水(2mL)和邻苯三酚溶液(25 mmol/L,0.5 mL)混合。混合物25℃反应5 min。之后用盐酸终止反应,在波长560 nm处测定吸光度值,绘制曲线。双蒸水作对照,VC作为阳性对照。计算公式如下:超氧化物阴离子自由基清除活性(%)=(A0-A1+A2)/A0×100,其中A0是对照组的吸光度值(双蒸水代替PFLPs),A1是样品在反应体系过程中的吸光度值,A2是样品的最终吸光度值。
1.2.9 羟自由基清除活性测定 依据已报道的方法[7],不同浓度的1 mL的样品溶液与硫酸亚铁溶液(9 mmol/L,1 mL)、水杨酸-乙醇溶液(9 mmol/L,1 mL)和H2O2溶液(9 mmol/L,1 mL)混合。混合物37℃反应30 min。在波长510 nm处测定吸光度值,绘制曲线。双蒸水作对照,VC作为阳性对照。计算公式如下:超氧化物阴离子自由基清除活性(%)=(A0-A1+A2)/A0×100,其中A0是对照组的吸光度值(双蒸水代替PFLPs),A1是样品在反应体系过程中的吸光度值,A2是样品的最终吸光度值。
1.2.10 DPPH自由基清除活性测定 依据已报道的方法[8],不同浓度的2.0 mL样品溶液与DPPH溶液(100 μmol/L,2.5 mL)混合。混合物在25℃平衡30 min。双蒸水作对照,VC作为阳性对照。在波长510 nm处测定吸光度值,绘制曲线。计算公式如下:DPPH自由基清除活性(%)=(A0-A1+A2)/A0×100,其中A0是对照组的吸光度值(双蒸水代替PFLPs),A1是样品在反应体系过程中的吸光度值,A2是样品的最终吸光度值。
1.2.11 ABTS+自由基清除活性测定 依据已报道的方法[9],用pH7.4的PBS配制成5 mmol/L的ABTS+储液,与MnO2反应,用0.2 μm的PVDF膜过滤,再用pH7.4的PBS稀释,直至在波长735 nm处测定吸光度值为0.70±0.02,-20℃保存备用。不同浓度的50 μL样品液与3 mL的ABTS+溶液混合,混合液摇匀25℃避光静置6 min。双蒸水作对照,VC作为阳性对照。在波长734 nm处测定吸光度值,绘制曲线。计算公式如下:ABTS+自由基清除活性(%)=(A0-A1+A2)/A0×100,其中A0是对照组的吸光度值(双蒸水代替PFLPs),A1是样品在反应体系过程中的吸光度值,A2是样品的最终吸光度值。
1.2.12 数据分析 本文实验进行三次平行实验,数据值为平均值±标准偏差(SD)。数据分析采用Origin 8.0软件。
2 结果与讨论
2.1 PFLPs的分离纯化

图1 阿魏菇(a)和PFLPs(b)Fig.1 Pictures of the Pleurotus ferulae Lenzi(a)and the PFLPs(b)
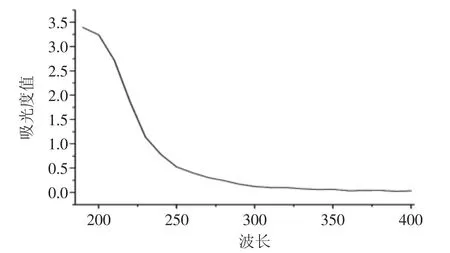
图2 PFLPs紫外光谱图Fig.2 The UV spectrum of mushrooms PFLPs
脱脂浸提提取之后水溶性多糖的产率为12.41%,脱蛋白纯化后PFLPs的产率10.13%。如图1所示,新鲜阿魏菇子实体圆润饱满,无机械损伤。提取纯化得到多糖PFLPs颜色雪白,质地均匀。
由于多糖的纯度对后后续实验具有一定的影响,因此对多糖纯度的鉴定是必要的。如图2所示,PFLPs溶液在260nm没有峰值,说明纯化的PFLPs中没有核酸;在280nm处也没有吸收峰,说明PFLPs中也没有蛋白质等杂质,呈现出典型的多糖光谱[10]。表明纯化得到的多糖纯度很高,杂质极少。
2.2 PFLPs的结构表征

图3 单糖标准品(a)和PFLPs(b)的气象色谱图Fig.3 Gas chromatograms of standard monosaccharide(a)and PFLPs(b)

图4 PFLPs的红外光谱图Fig.4 FT-IR spectrum of PFLPs
通过GC分析PFLPs的单糖组成如图3所示,与标准的单糖相比,气相色谱分析表明,PFLPs为杂多糖,含鼠李糖、木糖、甘露糖、葡萄糖和半乳糖,摩尔比为1∶1.26∶0.85∶12.4∶4.31。
图4为PFLPs的在4000~400 cm-1的范围的傅里叶红外吸收光谱。在3410 cm-1处的宽峰是多糖中O-H的伸缩振动;在2917 cm-1处的吸收峰是C-H伸缩振动的特征吸收;在1762 cm-1处有吸收,这是-CHO的C=O伸缩振动,是肽键上的酰胺碳基吸收峰,表明样品是含有蛋白质的糖缀合物[10];在1516 cm-1和1061cm-1处的特异性条带,这是吡喃糖环上的两种C-O伸缩振动,表明其为吡喃环结构[11];在809 cm-1处有吸收峰表明存在,这是C-H面外弯曲振动,表明PFLPs存在有β-D-葡聚糖[12]。
2.3 链构象分析
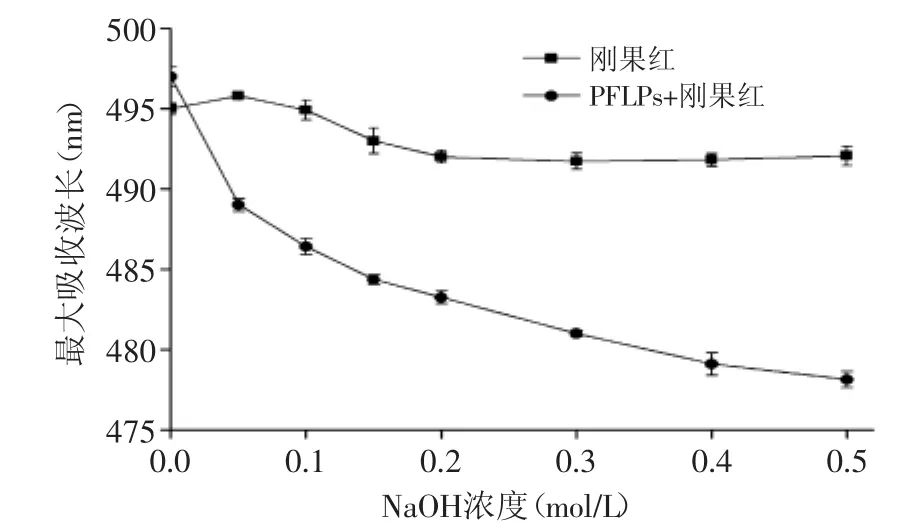
图5 PFLPs-刚果红复合物最大吸收波长Fig.5 Maximum absorption of PFLPs-Congo red complex

图6 储能模量(G′)和损耗模量(G″)随温度变化图Fig.6 G′and G″dependence of temperature in aqueous solution
刚果红试剂是一种酸性染料,可以与具有三股螺旋链构象的多糖发生反应形成络合物,其最大吸收波长(λmax)将会发生红移,在一定范围浓度的NaOH溶液中,λmax会发生特征性变化(颜色变成红紫色),当NaOH溶液的浓度大于0.3 mol/L时,λmax快速下降。如图5所示,以不添加PFLPs的纯刚果红溶液为空白对照,随着NaOH溶液的浓度升高,纯刚果红溶液的λmax先略微增加随后减小至恒定,PFLPs-刚果红络合物的λmax下降的很快,表明PFLPs中高度有序的螺旋结构正在发生解离,转变成自由卷曲的结构,因此导致其λmax下降[14],最后PFLPs的螺旋结构基本完全解离,络合物被完全破坏,λmax趋于稳定。
如图6所示,储能模量(G′)和损耗模量(G″)随着温度的变化而变化,图的变化特征与已报道的研究变化特征类似[8],据此可以保证数据的可靠性。G′在10~15℃这个狭小的范围迅速下降,这种现象与一些研究人员已经发现了三螺旋多糖的现象类似,如裂褶菌多糖[8]。
根据刚果红实验和流变学分析,可以得出结论,PFLPs具有三螺旋链构象。
2.4 抗氧化活性分析
2.4.1 还原力 因为抗氧化活性与还原力关系密切,因此还原力可以作为衡量潜在抗氧化活性的的一个指标[8]。如图7所示,还原力随着PFLPs浓度的增加而增加,说明PFLPs具有一定程度的还原力,浓度在5 mg/mL,PFLPs的还原力为0.26。然而,PFLPs的还原力在所有的测试浓度均小于VC。
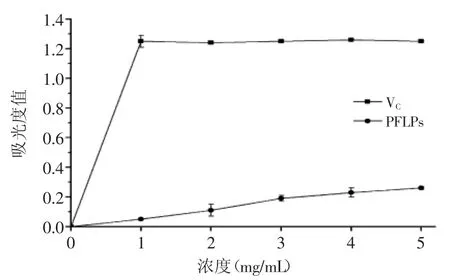
图7 还原力Fig.7 Reducing power
2.4.2 Fe2+螯合活性 铁是生长代谢和许多生化反应所必需的一种微量元素,但是铁元素过剩会催化氧化蛋白质,脂质和其他物质,从而导致氧化损伤和细胞损伤[5]。PFLPs的Fe2+的螯合能力如图8所示,螯合活性随着PFLPs的浓度增加而增加。在5 mg/mL的浓度下,PFLPs螯合效果是28.06%,而EDTA-2Na在浓度为1 mg/mL即具有将近99%的螯合效果,相比之下,PFLPs的Fe2+螯合能力较低。
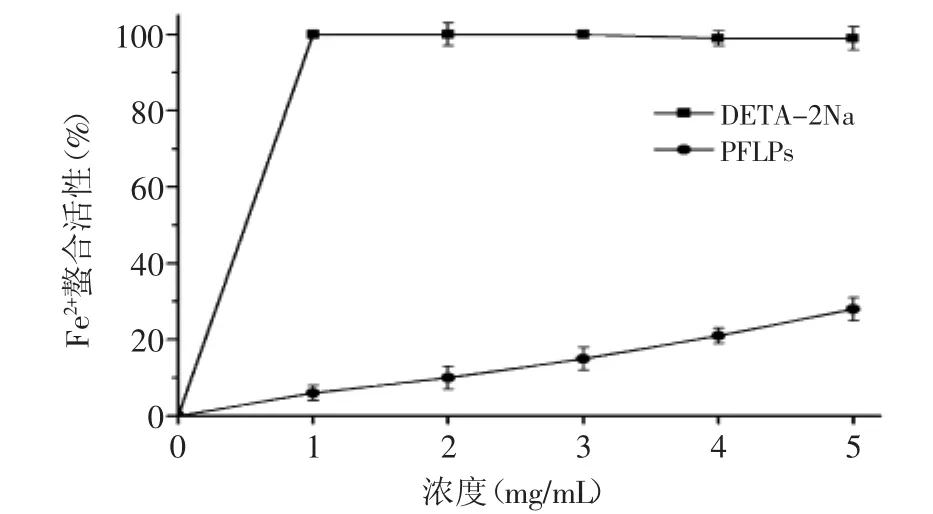
图8 Fe2+螯合活性Fig.8 Fe2+chelating activity

图9 超氧阴离子自由基清除活性Fig.9 Superoxide anion radical scavenging activity
2.4.3 超氧阴离子自由基清除活性 超氧阴离子自由基被认为是羟基自由基的前体。在本实验中,超氧阴离子自由基通过邻苯三酚在碱性条件的自氧化作用产生[6]。如图9所示,PFLPs和VC的超氧阴离子自由基的清除活性随着浓度的增加而增加。在5 mg/mL的浓度下,PFLPs超氧阴离子自由基的清除率为44.21%。虽然PFLPs的IC50(半抑制率)值无法在测试的剂量范围内确定,然而可知VC在浓度为1 mg/mL时,超氧阴离子自由基的清除率为98%。相比之下,PFLPs的超氧阴离子自由基清除活性显得较低。
2.4.4 羟自由基清除活性 羟基自由基可以很容易地穿过细胞膜与大多数生物分子,如糖类、脂类、蛋白质和DNA发生反应,并引起细胞死亡,甚至组织损伤[9]。PFLPs的羟基自由基清除活性测试如图10所示,PFLPs对羟基自由基的清除作用与浓度呈正相关,PFLPs的浓度为5 mg/mL时,其羟自由基清除活性为55.30%。在测试的剂量范围内,PFLPs的IC50值为4.48 mg/L,结果分析,PFLPs具有较强的羟自由基清除能力。

图10 羟自由基清除活性Fig.1 0 Hydroxyl radicalscavenging activity
2.4.5 DPPH自由基清除活性测定 因其方便性和可重复性,DPPH自由基被广泛地应用于测定各种天然化合物的自由基清除能力[13]。如图11所示,随着PFLPs和VC含量的增加,两者的DPPH自由基清除活性也增加。PFLPs和VC的浓度为5 mg/mL时,清除率分别为90.26%和94.72%。在测试的剂量范围内,PFLPs 的IC50值为1.57 mg/L。显然,PFLPs具有很强的DPPH自由基清除活性。

图1 1DPPH自由基清除活性Fig.1 1 DPPH radical scavenging activity
2.4.6 ABTS+自由基清除活性测定 ABTS+自由基的清除活性,依据吸光值的变化来表征,这种方法已经被广泛地用来测定化学成分的抗氧化活性[14]。由图12可知,PFLPs具有ABTS+自由基清除活性,并呈剂量依赖性,表明其对ABTS+自由基清除具有较好的效果。当PFLPs的浓度为5 mg/mL时,其清除活性为68.52%。在测试的剂量范围内,PFLPs的IC50值为2.91 mg/L。表明其具有较强的ABTS自由基清除活性。

图12 ABTS+自由基清除活性Fig.1 2 ABTS+radical scavenging activity
3 结论
多糖PFLPs具有三股螺旋结构,其为杂多糖,含有β-(1→6)-葡糖基,单糖组成为鼠李糖、木糖、甘露糖、葡萄糖和半乳糖,摩尔比为1∶1.26∶0.85∶12.4∶4.31。抗氧化活性分析的结果表明,PFLPs具有较高的DPPH自由基活性(90.26%,5 mg/mL),ABTS+自由基清除活性(68.52%,5 mg/mL)和羟自由基清除活性(55.30%,5 mg/mL),适度的超氧阴离子自由基清除活性(44.21%,5 mg/mL),适度的还原力活性的和Fe2+的螯合活性。综合分析,PFLPs是一种很有潜力的抗氧化剂。以上研究一方面对于阿魏菇子实体多糖产品的开发和利用提供了一定的理论依据,另一方面为活性多糖的构效关系研究以及通过人工分子改造提高其生物活性奠定了基础。而对于其取代基团位置,侧链单糖的位置、排序和糖环的大小、连接方式等更深层次结构的表征,以及多糖的结构和活性之间的深层次关系还有待进一步研究。
[1]Villares A,Laura M V,Guillamon E.Structural features and healthy properties of polysaccharides occurring in mushrooms[J].Agriculture,2012,2(4):452-471.
[2]ZHANG Li-na,LI Xue-lian,XU Xiao-jun,et al.Correlation between antitumor activity,molecular weight,and conformation of lentinan[J].Carbohydrate Research,2005,340(8):1515-1521.
[3]Fridovich I.The biology of oxygen radicals[J].Science,1978,201(4359):875-880.
[4]L.Soubra,D.Sarkis,C Hilan,et al.Hilan dietary exposure of children and teenagers to benzoates,sulphites,butylhydroxyanisol (BHA)and Butylhydroxytoluen(BHT)in Beirut(Lebanon)[J].Regulatory Toxicology and Pharmacology,2006,47(1):68-77.
[5]Manivasagan P,Sivasankar P,Venkatesan J,et al.Production and characterization of an extracellular polysaccharide from streptomyces violaceus MM72[J].International Journal of Biological Macromolecules,2013,59:29-38.
[6]WANG Zhan-yong,WANG Chen-yu,QUAN Yue.Extractionof Polysaccharides from Phellinus nigricans mycelia and their Antioxidant Activities in Vitro[J].Carbohydrate Polymers,2014,99:110-115.
[7]GAO Chan-juan,WANG Yan-hua,WANG Chen-yu,et al.Antioxidant and immunological activity in vitro of polysaccharides from Gomphidius rutilus mycelium[J].Carbohydrate Polymers,2013,92(2):2187-2193.
[8]LI Jing-en,CUI Steve W,NIE Shao-ping,et al.Structure and biological activities of a pectic polysaccharide from Mosla chinensis Maxim.cv.Jiangxiangru[J].Carbohydrate Polymers,2014,105:276-284.
[9]CHENG Hao-ren,FENG Shi-lin,JIA Xue-jing,et al.Structural characterization and antioxidant activities of polysaccharides extracted from Epimedium acuminatum[J].Carbohydrate Polymers, 2013,92(1):63-68.
[10]陈云龙.细茎石斛多糖的一级结构表征及生物活性[D].杭州:浙江大学食品科学,2003.
[11]陈建,向莹.滑子菇多糖的结构分析[J].现代食品科技,2013,29(7):1544-1550.
[12]DENG Chao,HU Zhun,FU Hai-tian,et al.Chemical analysis and antioxidant activity in vitro of a β-D-glucan isolated from Dictyophora indusiata[J].International Journal of Biological Macromolecules,2012,51(1-2):70-75.
[13]Leong L P,SHUI G.An investigation of antioxidant capacity of fruits in Singapore markets[J].Food Chemistry,2002,76(1):69-75.
[14]LI X,HAN W,MAI W,et al.Antioxidant activity and mechanism of Tetrahydroamentoflavone in Vitro[J].Natural Product Communications,2013,8(6):787-789.
Structural analysis and antioxidant activities of polysaccharides from the fruiting bodies of Pleurotus ferulae Lenzi
CHEN Qing-qing,CHEN Shuai+,LI Feng,XU Cheng-jian*
(College of Food Sciences,Shihezi University,Shihezi 832000,China)
A polysaccharide fraction PFLPs was isolated and purified from the fruiting body of Pleurotus ferulae Lenzi.The chemical structure,chain conformation and antioxidant activities of PFLPs were investigated.The results indicated that PFLPs was mainly composed of Rhamnose,Xylose,Mannose,Glucose and Galactose with a molar ration of 1∶1.26∶0.85∶12.4∶4.31,and indicated the presence of β-D-glucan in the PFLPs.The chain conformation analysis showed that PFLPs was a triple helical polysaccharide.The antioxidant activity test in vitro revealed that PFLPs exhibited high DPPH radical,ABTS+radical and hydroxyl radical scavenging activities,moderate superoxide radical scavenging activities,reducing power and Fe2+chelating activities.The results suggested that PFLPs could be used as a potential natural antioxidant.
Pleurotus ferulae Lenzi polysaccharides;structural characterization;chain conformation;antioxidant activities
TS201.2
A
1002-0306(2016)02-0108-06
10.13386/j.issn1002-0306.2016.02.013
2015-04-17 +同为第一作者
陈庆庆(1994-),女,大学本科,研究方向:食品科学与工程,E-mail:1049077091@qq.com。
陈帅(1990-),男,硕士研究生,研究方向:天然产物制备与功能活性研究,E-mail:chenshuaifood@126.com。
*通讯作者:许程剑(1978-),男,博士,副教授,研究方向:天然产物制备与功能活性研究,E-mail:xuchengjianfood@yahoo.com。
国家自然科学基金青年科学基金项目(31101256);国家大学生研究训练计划项目(SRP2015178)。
