内生黏质沙雷氏菌LIEH 92对向日葵菌核病的防治效果及其防病机制研究
2016-09-14苏志芳李亚珍王海伟郑喜清
王 靖, 苏志芳, 李亚珍, 王海伟, 郑喜清, 邸 娜
(内蒙古河套学院农学系, 巴彦淖尔 015000)
内生黏质沙雷氏菌LIEH 92对向日葵菌核病的防治效果及其防病机制研究
王靖*,苏志芳,李亚珍,王海伟,郑喜清,邸娜
(内蒙古河套学院农学系, 巴彦淖尔015000)
本研究评价了从向日葵列当体内分离筛选得到的内生黏质沙雷氏菌(Serratiamarcescens)LIEH 92对向日葵菌核病进行盆栽与大田防效评价,并测定了该菌株的生理特性和其在根际土与向日葵体内的定殖情况。结果表明,LIEH 92发酵液对向日葵菌核病的室内盆栽防效达73.35%,对大田根腐型菌核病和盘腐型菌核病防效分别达53.48%和38.64%。菌株LIEH 92可产生几丁质酶,并能在根际土和向日葵根、茎、叶内定殖与传导,定殖菌量达102~106cfu/g。其在向日葵植株的根内定殖数量最大,茎中次之,叶中最少。在灭菌土中LIEH 92在根际土和向日葵根部的定殖菌量小于在自然土中其在相应部位的定殖菌量,而灭菌土中LIEH 92在向日葵茎部和叶部的定殖菌量则大于自然土中相应的定殖菌量。LIEH 92处理可提高向日葵植株PAL、POD 和PPO等防御酶活性,从而诱导向日葵对菌核病的抗性。LIEH 92对向日葵菌核病具有生防潜力。
向日葵菌核病;黏质沙雷氏菌;防病效果;定殖动态;防御酶活性
向日葵菌核病导致葵花籽空壳率增加、籽仁含油率及蛋白质含量下降,油质变苦,品质严重下降。向日葵整个生育期均可受到核盘菌的侵染,根据其侵染和发病部位不同可分为根腐型、茎腐型、叶腐型、盘腐型4种,内蒙古河套地区以根腐型和盘腐型为主。根腐型植株受病菌侵染后,形成水渍状病斑,随病情发展病部产生白色菌丝体,后期菌丝体相互纠结缠绕产生硬度较大的黑色菌核,严重者整株萎蔫枯死。盘腐型一般发生于向日葵开花末期,造成花盘变软、腐烂。
植物内生细菌一方面靠宿主提供生存繁殖所需的养分和空间,另一方面可通过自身复杂的新陈代谢或借助信号转导等作用对植物体产生影响,反作用于宿主,表现出一些特殊的生物学功能,例如营养传递功能(固氮菌)、分解功能(溶磷菌)、促生功能(分泌植物激素的微生物)以及生物防治(增强宿主对病、虫及不良环境的抗性)等[1]。植物内生细菌具有良好的生防潜力,是生物菌剂的重要来源和微生态研究的重要对象。植物内生菌在植物体内生活,受外界环境影响小,通过分泌抑菌物质、营养竞争、生态位排斥、诱导系统抗性(ISR)、增强寄主化感作用等机制促进植物生长、抑制病害发生,一种内生菌可同时具有几种作用机制。
生防菌能否在靶标植物体内及其根际适应并定殖存活是筛选、评价土传病害生防菌的重要指标。生防细菌的定殖能力与其生防效果成正比,定殖能力越强,生防细菌环境适应性越强、防效越稳定[2-5]。徐大可等[6]报道双抗生素标记的黏质沙雷氏菌(Serratiamarcescens)菌株可在越橘体内定殖,其对菜豆炭疽病病原真菌(Colletotrichumlindemuthianum)抑菌率达70.5%,对2种越橘叶斑病病原菌拟盘多毛孢菌(Pestalotiopsissp.)和柯氏帚梗柱孢霉(Cylindrocladiumcolhounii)的抑制率分别达68.6%和57.7%。龙良鲲等[7]报道内生细菌01-144通过浸种和灌根处理后可在番茄根茎内定殖,定殖数量呈“由增到减”趋势,且在根部定殖能力大于茎内。李术娜等[8]报道棉花黄萎病拮抗细菌2-70施入土壤5个月后仍可在棉花根内保持菌量达103cfu/g。胡小加等[9]研究表明枯草芽胞杆菌Tu-100在油菜体内定殖30 d后在根内仍保持菌量1.3×102cfu/g。
本研究以发生普遍且危害严重的向日葵菌核病菌为靶标,利用从向日葵列当体内分离筛选得到的内生黏质沙雷氏菌LIEH 92对向日葵菌核病进行盆栽与大田防效评价,测定该菌株的生理特性,以利福平作为标记、测定菌株LIEH 92在向日葵体内的定殖情况,并研究其抗病机理,以丰富新型高效生物农药和生物菌肥开发所需的菌株资源,为向日葵列当内生细菌的开发利用提供理论依据,同时为内生生防细菌的大田应用及新型生物制剂的研发奠定基础。
1 材料与方法
1.1供试菌株
黏质沙雷氏菌(Serratia marcescens)LIEH92分离自内蒙古巴彦淖尔市双河镇黄河滩地向日葵种植区的向日葵列当茎部,由河套地区绿色农产品安全生产与预警控制实验室提供。
向日葵菌核病菌(Sclerotinia sclerotiorum)分离自巴彦淖尔市临河区向日葵菌核病自然发病株茎基部,于4℃保存。
1.2供试向日葵品种
供试向日葵品种为‘星火’(食用向日葵,内蒙古杭锦后旗绿源种子公司),高感菌核病。
1.3供试药剂
50%腐霉利可湿性粉剂(日本住友化学株式会社)。抗重茬菌剂(北京中农绿康生物技术有限公司),葵花专用生物菌剂。
1.4向日葵列当内生细菌LIEH 92发酵液和菌悬液制备
将活化好的菌株LIEH92接入肉汁胨液体培养基(牛肉膏3g,酵母浸膏1g,蛋白胨5g,葡萄糖10g,水1 000mL,pH7.0),置于28℃的摇床中160r/min振荡培养48h,制成108cfu/mL的黏质沙雷氏菌株LIEH92发酵液。菌株发酵液在8 000r/min离心15min后弃上清,沉淀用无菌水稀释至浓度108cfu/mL,即得到菌悬液。
1.5LIEH 92对向日葵菌核病盆栽防效试验
将土壤高温灭菌后装入27.5cm×20cm的盆钵内,每盆土表均匀撒菌核20g后再覆土2cm。将食用向日葵品种‘星火’用内生细菌LIEH92发酵液(108cfu/mL)浸泡24h后播种。分别在播种时、播种后10d和25d用LIEH92发酵液灌根,每盆100mL。待向日葵出苗后每盆留苗5株,每处理3盆,共15株。以50%腐霉利可湿性粉剂1 500倍液和清水代替LIEH92发酵液作为药剂对照和空白对照。待清水对照发病后,调查各处理的发病率和防病效果。
1.6LIEH 92对向日葵菌核病大田防效试验
试验地设在内蒙古巴彦淖尔市干召庙镇东风三社向日葵菌核病重病田,‘星火’用LIEH92发酵液(108cfu/mL)浸泡3h后播种。试验区随机区组排列,每小区面积30m2(长25m,宽1.2m),播种80 株,株距60cm,四周设保护行,3次重复。分别在播种时、播种后10d和25d用内生细菌LIEH92发酵液灌根,每株100mL,其他田间管理同常规生产。以清水为空白对照,向日葵抗重茬菌剂为药剂对照。由于当地向日葵菌核病以根腐型和盘腐型为主,待向日葵开花末期分别调查根腐型和盘腐型菌核病发病情况。
向日葵根腐型菌核病分级标准[10]:0级,无任何症状;1级,发病轻,叶枯萎;2级,植株萎蔫,茎基部水渍状病斑大于3cm;3级,整株死亡。
向日葵盘腐型菌核病分级标准[11]:0级,无症状;1级,花盘背面病斑占花盘总面积的比例为0~25%;2级,花盘背面病斑面积占花盘总面积的比例为26%~50%;3级,花盘背面病斑面积占花盘总面积的比例为51%~75%;4级,花盘背面病斑面积占花盘总面积的比例大于75%。
病株率(%)=发病株数/总株数×100;
病情指数=Σ(发病级代表值×各级病株数)/(调查总株数×最高病级代表值)×100;
防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100。
1.7LIEH 92生理特性测定
1.7.1生长曲线测定
取100μL培养24h的LIEH92发酵液加入装有10mLNB培养液(牛肉膏3g,蛋白胨10g,NaCl5g,水1 000mL,pH7.0)的试管,置 28℃摇床中160r/min振荡培养,每隔4h取样1次,24h后每隔12h取样1次,至 96h结束,测定A600(以肉汁胨培养液为对照),并绘制生长曲线。
1.7.2最适pH测定
将NB培养液用1mol/LHCl和1mol/LNaOH分别调整pH至4.0、5.0、6.0、7.0、8.0、9.0、10.0,取100μL培养24h的LIEH92发酵液加入装有10mLNB培养液的试管,28℃ 160r/min恒温振荡培养48h,测定A600。
1.7.3耐盐性测定
将NB培养液中NaCl浓度分别调至0、0.5%、1.5%、3%、5%、7%、9%、11%,取100μL培养24h的LIEH92发酵液加入装有10mLNB培养液的试管,28℃振荡培养48h,测定A600。
1.8LIEH 92产几丁质酶检测
几丁质平板(胶体几丁质2.5g,K2HPO40.7g,KH2PO40.3g,MgSO4·7H2O0.5g,FeSO4·7H2O0.01g,琼脂15g,蒸馏水1 000mL,pH7.0)中央放置5mm灭菌滤纸片,并在滤纸片上滴加10μL向日葵列当内生细菌LIEH92发酵液(108cfu/mL),28℃培养3~7d,观察接菌滤纸片周围有无透明圈产生。
1.9向日葵列当内生细菌LIEH 92定殖能力测定
1.9.1抗利福平(Rif)LIEH92突变菌株的筛选
取培养24h的LIEH92发酵液10mL接种在含5μg/mLRif的NB培养液中(装液量100mL/250mL)。28℃,160r/min振荡培养至NB培养液变混浊,吸取10mL接入Rif浓度为10μg/mL的100mLNB培养液中,以后每次更换的新鲜NB培养液中Rif的浓度均增加20μg/mL,直到标记至300μg/mL。然后用含300μg/mLRif的NA平板检测并挑取能稳定生长,且拮抗能力、菌落形态变化不大的突变菌株。采用平板对峙法检测突变菌株对向日葵菌核病菌的拮抗能力。将突变菌株在不含Rif的NB培养液中连续培养10代,取适量涂布在含300μg/mLRif的NA固体培养基上观察其是否能正常生长,以检测突变菌株的遗传稳定性。选择遗传性稳定、抗菌能力不变的抗利福平突变菌株用于定殖试验。
1.9.2LIEH 92在向日葵根际土和植株体内的定殖
抗利福平突变菌株菌悬液以灌根的方式施入。将‘星火’种子在50℃水中浸泡20min,期间不断搅拌,然后降至室温,用l%次氯酸钠表面消毒10min,无菌水漂洗数次后播种至27.5cm×20cm的盆钵中。设置自然土(取自向日葵田)和灭菌土(121℃湿热灭菌2h)2个处理。向日葵出苗后每盆留苗5株,每处理10盆。待向日葵苗长出第4叶时,往向日葵苗根部土壤注入108cfu/mL突变菌株菌悬液,每株10mL,同时以清水代替菌悬液灌根作为对照。从处理后第5天开始,每隔5d分离向日葵苗内(根、茎和叶)和根际土的抗利福平突变标记菌,计算每克根、茎、叶和根际土中的标记菌含量。
根际土中抗利福平突变标记菌的分离采用稀释涂平板法。土壤溶液经梯度稀释后,取10-4、10-5、10-6浓度的土壤稀释液进行平板涂布。向日葵根、茎、叶内标记菌株的分离,各称取1g根、茎、叶组织,分别放入70%乙醇中浸泡1min,随即浸入2%次氯酸钠溶液中消毒3min,然后用70%乙醇处理30s,最后无菌水反复漂洗4次。分别将经表面消毒的根、茎、叶置于研钵中,并加10mL无菌水进行研磨,研磨液静置15min后,取100μL上清液涂抹于含300μg/mL利福平的NA平板上,置于28℃恒温箱中培养48h,检测是否有待测菌生长,同时采用平板对峙法测定回收菌的抑菌效果。
1.10向日葵列当内生细菌LIEH 92对向日葵植株防御酶系的诱导
将‘星火’种子表面消毒后播种于装有灭菌土的27.5cm×20cm盆钵中。向日葵出苗后每盆留苗5株,每处理10盆。待向日葵苗长至4叶时,往向日葵苗根部土壤注入108cfu/mLLIEH92发酵液,每株10mL,对照用清水代替发酵液。从处理后第1天起,每隔2d随机取植株叶片1次,直至13d,分别研磨后测定过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)活性[12-13]。
试验设4个处理:处理1(清水灌根,未接核盘菌菌核,对照),处理2(土壤接种核盘菌菌核),处理3(细菌LIEH92发酵液灌根,未接核盘菌菌核),处理4(土壤接入核盘菌菌核,并用细菌LIEH92发酵液灌根)。
2 结果与分析
2.1向日葵列当内生细菌LIEH 92对向日葵菌核病的防治效果
用内生菌株LIEH92的发酵液处理向日葵植株,室内盆栽和大田试验均表明其菌核病的发病率和病情指数明显低于清水对照,且低于药剂对照(50%腐霉利1 500倍液和向日葵抗重茬菌剂)。菌株LIEH92对向日葵菌核病的室内盆栽防效达73.35%(表1),对大田根腐型菌核病和盘腐型菌核病防效分别达53.48%和38.64%(表2)。LIEH92的室内盆栽防效高于大田防效,对根腐型菌核病的防效大于盘腐型。

表1 内生细菌LIEH 92对向日葵菌核病的室内盆栽防效1)Table 1 Control efficacy of endophytic bacterium LIEH 92 against Sclerotinia sclerotiorum in pot experiments
1) 表中数据均为平均值±标准误,同列数据后不同字母表示经Duncan氏新复极差法检验在0.05水平差异显著。下同。
Datainthetablearemeans±SE.Datafollowedbydifferentlettersinthesamecolumnaresignificantlydifferentatthe0.05levelbyDuncan′snewmultiplerangetest.Thesamebelow.
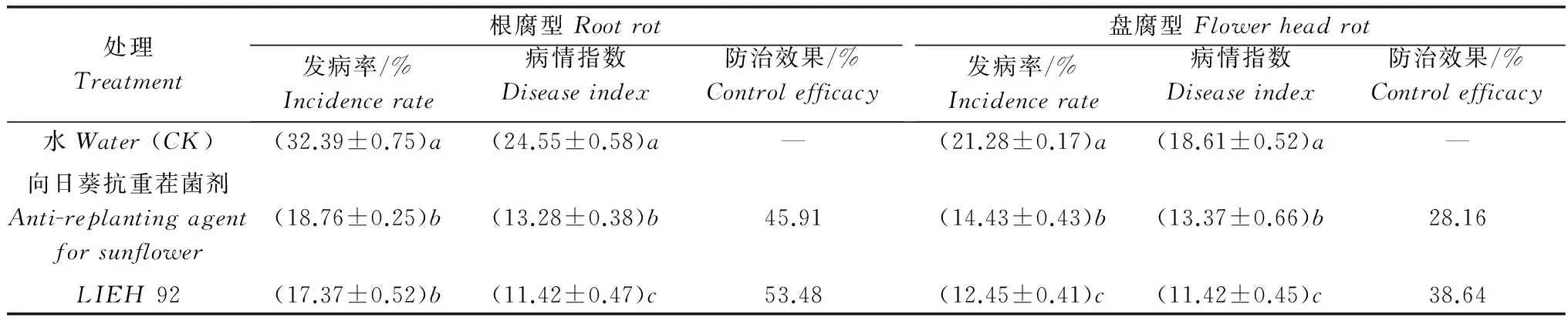
表2 内生细菌LIEH 92对向日葵菌核病的大田防效Table 2 Control efficacy of endophytic bacteria LIEH 92 against Sclerotinia sclerotiorum in field plot experiments
2.2向日葵列当内生细菌LIEH 92生理特性测定
从绘制的内生细菌LIEH92生长曲线(图1)可以看出,菌株LIEH92在发酵培养16h后进入对数生长期,菌液浓度迅速增加,24~48h菌株处于稳定生长期,在36h菌液浓度达到最大值。48h后,菌株生长进入衰亡期。
菌株LIEH92在pH4~10的范围内均能生长,pH6~8时生长旺盛,期间菌液浓度达到最大值(图2)。在pH<5 时菌体生长慢,菌液浓度低;当pH>8 时,菌体生长缓慢,菌液浓度开始下降。
LIEH92在NaCl浓度0~9%时均可生长。NaCl浓度在0~0.5%之间时菌体生长旺盛,盐浓度在0.5%时菌体浓度达最大值(图3)。当NaCl浓度大于0.5%时,随着盐浓度增加,菌体生长呈现下降趋势。当NaCl浓度大于10%时,菌株生长基本停滞。
2.3向日葵列当内生细菌LIEH 92产几丁质酶的测定
将内生菌株接于几丁质平板培养4d后,平板上出现了明显的透明圈,说明菌株LIEH92能产生几丁质酶。
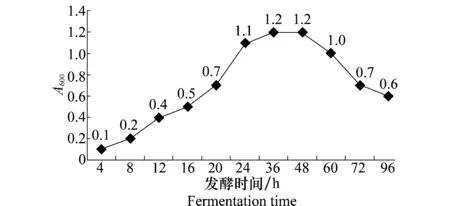
图1 内生细菌LIEH 92生长曲线Fig.1 Growth curve of endophytic bacteria LIEH 92
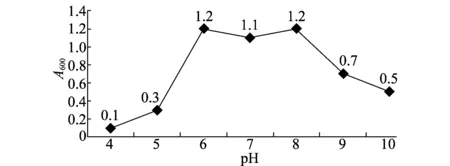
图2 内生细菌LIEH 92生长适宜pH测定Fig.2 Optimized pH of endophytic bacteria LIEH92

图3 内生细菌LIEH 92耐盐性测定Fig.3 Effects of the NaCl concentration on growth of endophytic bacteria LIEH 92
2.4向日葵列当内生细菌LIEH 92的定殖能力
用108cfu/mL抗生素标记的内生细菌LIEH92突变菌株菌悬液灌根处理向日葵苗5d后即可在根际土壤和植株体内分离到标记的突变菌株,30d时仍能在向日葵根、茎部回收到突变菌株。而使用清水代替菌悬液处理的对照向日葵根际和体内均未分离到标记的突变菌株,说明菌株LIEH92能在根际土壤和向日葵根、茎、叶内定殖并传导。
2.4.1LIEH 92在向日葵根际土的定殖
根际土中所测得的内生菌LIEH92突变菌株菌量均小于其菌悬液浓度108cfu/mL,且25d前在灭菌土中该菌株的定殖菌量小于在自然土中的定殖菌量(图4)。自然土中,LIEH92突变菌株定殖菌量在10d时达到最大,为10.33×106cfu/g,之后开始下降,20d后定殖菌量开始急剧下降。而在灭菌土中,LIEH92突变菌株定殖菌量在15d时达到最大,为9.17×106cfu/g,之后开始下降。这可能和土壤中微生物之间的相互作用有关,灭菌土土壤结构和微生物遭到破坏,可能不利于生防菌株定殖。

图4 内生细菌LIEH 92在向日葵根际土的定殖动态Fig.4 Colonization dynamics of endophytic bacteria LIEH 92 in rhizosphere soil of sunflower
2.4.2LIEH 92在向日葵体内的定殖
无论是自然土还是灭菌土,内生细菌LIEH92突变菌株在向日葵植株根内的定殖数量最大,茎中次之,叶中最少,推测内生细菌由植株根部进入体内,并从下向上进行传导运输。
整个检测过程中,在灭菌土中LIEH92突变菌株在向日葵根部的定殖菌量均小于在自然土中向日葵根部的定殖菌量(图5),这与根际土中的定殖菌量变化规律基本保持一致。在向日葵根部,自然土中LIEH92突变菌株定殖菌量在10d时达到最大,为1.76×105cfu/g,15d后定殖菌量开始急剧下降;而在灭菌土中,LIEH92突变菌株定殖菌量在15d时达到最大,为1.63×105cfu/g。推断自然土中存在的某些微生物可能利于LIEH92突变菌株的定殖,这也反映了该菌株有较好的环境适应能力。

图5 内生细菌LIEH 92在向日葵根部的定殖动态Fig.5 Colonization dynamics of endophytic bacteria LIEH 92 in sunflower roots
当LIEH92突变菌株进入植株根部后,受外界因素的干扰变小,出现了在灭菌土中向日葵茎部、叶部LIEH92的定殖菌量大于在自然土中定殖菌量的现象。在向日葵茎部,自然土中LIEH92突变菌株定殖菌量在20d时达到最大,为2.33×104cfu/g;而在灭菌土中,LIEH92突变菌株定殖菌量在15d时达到最大,为2.55×104cfu/g(图6)。在向日葵叶部,自然土和灭菌土中LIEH92定殖菌量均在15d时达到最大,分别为2.83×103cfu/g和3.44×103cfu/g(图7)。

图6 内生细菌LIEH 92在向日葵茎部的定殖动态Fig.6 Colonization dynamics of endophytic bacteria LIEH 92 in sunflower stems

图7 内生细菌LIEH 92在向日葵叶部的定殖动态Fig.7 Colonization dynamics of endophytic bacteria LIEH 92 in sunflower leaves
2.5向日葵列当内生细菌LIEH 92对向日葵植株防御酶系的诱导
清水灌根对照各防御酶活性变化不大。仅用内生菌LIEH92发酵液灌根的向日葵植株叶片中PAL、POD和PPO活性均高于清水对照,PAL和PPO活性峰均出现在处理后第7天,而POD则在处理后第5天、第9天出现了2次活性峰。仅接核盘菌时,向日葵叶片PAL、POD和PPO各活性峰分别出现在第5、9和5天。
接核盘菌的同时用菌株LIEH92发酵液灌根后,从第1天开始各防御酶的活性便持续快速增加,PAL、POD和PPO活性峰分别出现在第5、7和 9天,其中POD活性峰出现时间比仅接核盘菌时提前了2d。除第9天单独施用菌株LIEH92发酵液的向日葵植株叶片中POD活性略高外,其余情况下,既接种核盘菌又使用菌株LIEH92发酵液灌根的处理向日葵叶片PAL、POD和PPO各防御酶活性均高于其他3种处理(图8~10)。说明在核盘菌和菌株LIEH92的共同作用下,向日葵叶片各防御酶活性显著升高,迅速激活向日葵植株体内防御酶系,提高向日葵的抗病性。

图8 内生细菌LIEH 92和核盘菌处理对 向日葵PAL酶活性的影响Fig.8 Impact of endophytic bacteria LIEH 92 and Sclerotinia sclerotiorum on sunflower PAL enzyme activity

图9 内生细菌LIEH 92和核盘菌处理对 向日葵POD酶活性的影响Fig.9 Impact of endophytic bacteria LIEH 92 and Sclerotinia sclerotiorum on sunflower POD enzyme activity
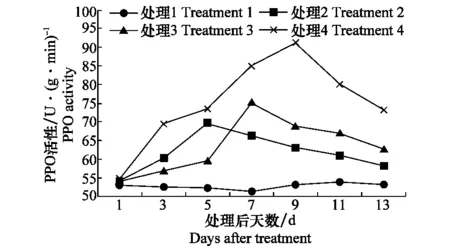
图10 内生细菌LIEH 92和核盘菌处理对 向日葵PPO酶活性的影响Fig.10 Impact of endophytic bacteria LIEH 92 and Sclerotinia sclerotiorum on sunflower PPO enzyme activity
3 讨论
由于拮抗细菌在田间应用时可能受到外界复杂环境因素(温度、湿度等)、土壤性状、微生物间相互作用的影响,因此本研究利用向日葵列当内生细菌LIEH92进行向日葵菌核病防治试验时,室内盆栽防效高于大田。根腐型菌核病在向日葵整个生育期内均可发生,而盘腐型菌核病通常在向日葵开花末期开始出现。而本试验仅在播种时、播种后10d和25d用细菌LIEH92发酵液灌根,结果表明该菌株对大田根腐型菌核病防效大于盘腐型。盘腐型菌核病发生时,菌株LIEH92的防效较低。说明随施用时间延长,该生防菌株的作用逐渐减弱,应该增加施药次数来提高防效。
病原真菌细胞壁主要成分为几丁质,向日葵列当内生黏质沙雷氏菌LIEH92可分泌几丁质酶来水解向日葵菌核病菌的细胞壁,从而抑制核盘菌生长。
抗生素标记是研究细菌定殖最常用的方法。本研究利用抗生素利福平来标记内生菌株LIEH92,获得突变菌株,采用灌根法分别在灭菌土和自然田土的盆栽中接种,结果表明菌株LIEH92在向日葵体内和土壤中均能成功定殖。到第30天时,LIEH92突变菌株在向日葵根、茎、叶中的定殖量仍保持较高水平,叶中最低也达102cfu/g。同时30d时,其在土壤中的定殖量达106cfu/g,说明菌株LIEH92能适应向日葵体内外的生态环境,应用潜力较大。
当受到病原物侵染或其他诱导因子作用时,植物体内与抗病性相关的防御酶(苯丙氨酸氨解酶PAL、过氧化物酶POD、多酚氧化酶PPO等)会发生变化,从而提高自身的免疫力[14]。PAL是该代谢途径中的关键酶和限速酶,能催化L-苯丙氨酸形成反式肉桂酸,控制植物体内多种次生酚类化合物(类黄酮、酚类物质、木质素、植保素、花青素等)的合成。POD是一类氧化还原酶,能催化脂肪族、芳香族和酚类物质的氧化,水解细胞毒性物质过氧化氢,参与木质素的沉积。PPO参与酚的氧化和木质素的合成,可将细胞代谢产物中的酚类物质氧化为醌类来杀死细胞,或使细胞壁增厚以抵御病菌的入侵和扩展。
许英俊等[15]报道,链霉菌属的3株放线菌对草莓有促生作用,且能够提高草莓根系PPO活性,对增强抵抗草莓根系根区病原菌侵染有一定效果。陈刘军等[16]报道蜡质芽胞杆菌AR156可提高水稻植株SOD、PAL、POD和CAT等防御酶活性,用菌株AR156预处理水稻植株后接种立枯丝核菌(Rhizoctonia solani)HNW-21,其SOD和PAL分别提前 4d和2d出现活性峰,诱导水稻对纹枯病的抗性。Lavania等[17]研究表明黏质沙雷氏菌NBRI1213可诱导PAL、POD、PPO等防御酶活性来提高植物抗烟草疫霉菌(Phytophthora nicotianae)所引起根腐病的能力,且促生增产作用明显。Press等[18]报道黏质沙雷氏菌能诱导黄瓜和烟草产生抗性而抵御多种真菌、细菌及病毒的侵染。本研究中内生细菌LIEH92对向日葵的防御酶系具有诱导作用,能提高植株自身的免疫力。
内生细菌的作用机制主要包括两方面,一是对病原菌的直接抑制,如产生几丁质酶(溶解病原真菌的细胞壁)、纤维素酶、淀粉水解酶、蛋白酶、嗜铁素(螯合铁离子),固氮作用,产生抗生素、合成ACC-脱氢酶、吲哚-3-乙酸(IAA)及铁载体等;另一方面是增强寄主植物自身的抗性,如激发诱导抗性、分泌促生物质等。
综合各方面研究,向日葵列当内生黏质沙雷氏菌LIEH92防治向日葵菌核病的作用机制包括产生几丁质酶、在向日葵体内定殖、诱导向日葵植株的防御酶系等,菌株LIEH92的抑菌作用可能是这些机制共同作用的结果。生产上要将内生细菌LIEH92真正用于向日葵菌核病的生物防治,还需进行该菌株活性物质的提取与鉴别、发酵工艺、制剂研发、应用方式等方面的深入研究。
[1]HallmannJ,Quadt-HallmannA,MahaffeeWF,etal.Bacterialendophytesinagriculturalcrops[J].CanadianJournalofMicrobiology, 1997, 43(10): 895-914.
[2]刘庆丰, 熊国如, 毛自朝, 等. 枯草芽胞杆菌XF-1的根围定殖能力分析[J]. 植物保护学报, 2012, 39(5): 425-430.
[3]LiFangliang,LiuMing,LiZhongpei,etal.Changesinsoilmicrobialbiomassandfunctionaldiversitywithanitrogengradientinsoilcolumns[J].AppliedSoilEcology,2013,64:1-6.
[4]RyanRP,GermaineK,FranksA,etal.Bacterialendophytes:recentdevelopmentsandapplications[J].FEMSMicrobiologyLetters, 2008, 278(1): 1-9.
[5]FakhroA,Andrade-LinaresDR,vonBargenS,etal.ImpactofPiriformospora indicaontomatogrowthandoninteractionwithfungalandviralpathogens[J].Mycorrhiza, 2010, 20(3): 191-200.
[6]徐大可, 夏秀英, 魏立君, 等. 1株产几丁质酶的越橘内生拮抗细菌的研究[J]. 浙江大学学报(农业与生命科学版), 2009, 35(4): 395-400.
[7]龙良鲲, 肖崇刚. 内生细菌01-144在番茄根茎内定殖的初步研究[J]. 微生物学通报, 2003, 30(5): 53-56.
[8]李术娜, 王全, 郭慧娟, 等. 棉花黄萎病拮抗细菌2-70 (Bacillus subtilis)菌株定殖能力的研究[J]. 中国农学通报, 2009, 25(15): 26-30.
[9]胡小加, 江木兰, 刘胜毅, 等. 枯草芽胞杆菌在油菜根茎叶的定殖动态和生防作用研究[J]. 中国油料作物学报, 2009, 31(l): 61-64.
[10]王春, 王芊. 黑龙江向日葵菌核病拮抗菌株的分离与筛选[J]. 中国农学通报, 2013, 29(33): 346-350.
[11]孟庆林,马立功,刘佳,等.向日葵菌核病田间接种方法及品种抗病性研究[J].中国油料作物学报,2014,36(1):113-116.
[12]刘萍,李明军.植物生理学实验技术[M].北京:科学出版社,2007.
[13]张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011.
[14]刘雪锋,张建华,赵永秀,等.β-氨基丁酸诱导向日葵抗菌核病的研究[J].内蒙古农业大学学报,2012,33(5/6):129-132.
[15]许英俊,薛泉宏,邢胜利,等.3株放线菌对草莓的促生作用及对PPO活性的影响[J].西北农业学报,2008,17(1):129-136.
[16]陈刘军,俞仪阳,王超,等.蜡质芽胞杆菌AR156防治水稻纹枯病机理初探[J].中国生物防治学报,2014,30(1):107-112.
[17]LavaniaM,ChauhanPS,ChauhanSV,etal.Inductionofplantdefenseenzymesandphenolicsbytreatmentwithplantgrowth-promotingrhizobacteriaSerratia marcescensNBRI1213 [J].CurrentMicrobiology, 2006, 52(5): 363-368.
[18]PressCM,WilsonM,TuzunS,etal.SalicylicacidproducedbySerratia marcescens 90-166isnottheprimarydeterminantofinducedsystemicresistanceincucumberortobacco[J].MolecularPlant-MicrobeInteractions, 1997, 10(6): 761-768.
(责任编辑:杨明丽)
Control effect of antagonistic endophyticSerratiamarcescensLIEH 92 on sunflower sclerotinia rot and its antifungal mechanism
Wang Jing,Su Zhifang,Li Yazhen,Wang Haiwei,Zheng Xiqing,Di Na
(Department of Agronomy, Hetao College, Bayannur015000, China)
SerratiamarcescensLIEH 92 was obtained fromOrobanchecumana. The control efficacy of LIEH 92 against sunflower sclerotinia rot were evaluated in pot experiments and field plot experiments. The physiological characteristics of LIEH 92 and its colonization in rhizosphere soil and sunflower plants were determined. The results showed that the control efficacy of fermented liquid from LIEH 92 against sunflower sclerotinia rot was 73.35% in pot experiments, 53.48% for sunflower sclerotinia root rot and 38.64% for sunflower sclerotinia head rot in field plot experiments. The chitinase-producing by LIEH 92 could colonize and transmit in rhizosphere soil and roots, stems, leaves of sunflowers. The quantity of LIEH 92 reached 102-106cfu/g, and the most was observed in roots, followed by stems and leaves. The colonizing bacterial quantity of strain LIEH 92 from rhizosphere soil and roots in sterile soil was lower than that in natural soil, while the colonizing bacterial quantity from stems and leaves in sterile soil was higher than that in natural soil. Strain LIEH 92 increased the activities of defensive enzymes PAL, POD and PPO in sunflowers, and the resistance of the plants toSclerotiniasclerotiorumwas induced. LIEH 92 has great potential for bio-controlling sunflower sclerotinia rot.
Sclerotiniasclerotiorumof sunflower;Serratiamarcescens;control efficacy;colonization dynamics;defense enzyme activity
2014-12-22
2015-02-02
内蒙古自治区高等学校科学技术研究一般项目(NJZY12277);河套学院引进人才科研启动项目(HYRC2014001);河套学院科学技术研究自然科学重点项目(HTXYZZ13001)
E-mail:304081257@qq.com
S 435.655
A
10.3969/j.issn.0529-1542.2016.01.013
