一个水稻褐飞虱为害诱导型启动子的克隆
2016-09-14关丽梅马伟华林拥军
关丽梅, 马伟华, 林拥军, 陈 浩*
(1.华中农业大学作物遗传改良国家重点实验室, 武汉 430070;2.江西省科学院, 南昌 330029)

一个水稻褐飞虱为害诱导型启动子的克隆
关丽梅1,2,马伟华1,林拥军1,陈浩1*
(1.华中农业大学作物遗传改良国家重点实验室, 武汉430070;2.江西省科学院, 南昌330029)
目前组成型启动子在基因工程中的应用最为广泛,然而驱动外源基因在各组织中持续恒定地表达可能引起植物发育迟缓等问题。诱导型启动子能够在特定条件下实现目的基因定时优势表达,最大限度减少由于非必需蛋白在转基因植物内的积累对其造成的伤害。依据基因芯片数据并通过定量RT-PCR验证,找到了一个受水稻褐飞虱(Nilaparavatalugens)为害诱导表达基因(LOC_Os01g73940)。用PCR技术从籼稻品种‘TN1’的基因组中获得Os01g73940上游1 953 bp的启动子片段,命名为BPHIP。将BPHIP连接到带有β-glucuronidase(GUS) 报告基因的植物表达载体上,通过农杆菌介导转化水稻品种‘中花11’。通过GUS组织化学染色法及定量RT-PCR检测证明,BPHIP是一个受褐飞虱为害和茉莉酸处理诱导上调的启动子。利用此类启动子在基因工程中可以减少对水稻生理方面产生的副作用,对抗虫转基因水稻具有良好的应用价值。
水稻;诱导型启动子;褐飞虱;抗虫;基因工程
近几年,全国病虫草鼠害年均发生面积达4.67亿hm2,虽然通过各种防治手段挽回大量经济损失,但是每年仍损失粮食达4 000万t。农作物病虫害除了造成产量损失外,还能造成农产品品质下降,出现腐烂、霉变等,甚至产生对人体有毒、有害的物质。一些主要病、虫害对作物生产具有严重威胁,例如,稻飞虱、螟虫等虫害以及水稻稻瘟病、水稻白叶枯病、水稻纹枯病、小麦条锈病、白粉病、赤霉病、油菜核菌病、棉花枯萎病等。因此,防治植物病虫害,对保障国家经济发展、提高人民生活水平具有重大意义。随着遗传转化技术的日益发展,基因工程技术被越来越广泛地应用于农作物品种的改良。
启动子是基因工程中构建表达载体的重要组成部分,它可以控制外源基因表达的起始、表达部位与强度。目前,转基因植物中所使用的启动子一般为组成型启动子,其驱动外源基因在植物体内持续大量地表达,打破了植物原有的代谢平衡,增加了植株的代谢负担,造成了物质和能量上的浪费,而且还可能影响食物的安全性[1-2]。而诱导型启动子则可以较好地避免上述问题,比如水稻褐飞虱为害诱导型启动子,当褐飞虱刺吸水稻时,启动子被诱导使相应的基因高效表达,进而达到改良水稻相应性状的目的[3-4]。
1 材料与方法
1.1植物材料与菌种
用于提取DNA和RNA的籼稻品种‘TN1’和
‘RH’,转化受体粳稻品种‘中花11’均由华中农业大学徐才国教授提供;启动子的克隆载体为DX2181b,由本室叶荣建博士改造;用于构建载体的大肠杆菌菌株为TOP10;转化所用农杆菌菌株为EHA105;两种菌株为本实验室保存。
1.2启动子的克隆及植物表达载体的构建
利用本实验室水稻接种褐飞虱诱导的基因表达芯片数据,挑选褐飞虱为害诱导表达基因。结合RiceXPro 3.0数据库(http:∥ricexpro.dna.affrc.go.jp/),挑选出在‘TN1’和‘RH’品种中均受褐飞虱为害诱导表达,且在胚乳中表达量极低的水稻基因LOC_Os01g73974。通过芯片的杂交信号值对其表达量的高低进行一个粗略的估计,预测此基因上游序列为褐飞虱诱导表达启动子。设计引物BPHIP-F和BPHIP-R,并在引物的5′端引入Hind Ⅲ和PstI酶切位点(引物序列见表1)。利用‘TN1’的基因组DNA,对该基因翻译起始位点上游约2 kb的启动子区段进行扩增,所获得的启动子片段命名为BPHIP。PCR反应体系为:100 ng/μL基因组DNA 1 μL,10×buffer 2 μL,2 mmol/L dNTPs 4 μL,10 μmol/L BPHIP-F 0.2 μL,10 μmol/L BPHIP-R 0.2 μL,5 U/μLTaqDNA 聚合酶 0.2 μL,ddH2O 12.4 μL。反应程序为:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 2 min,30 个循环;72℃ 延伸10 min。
PCR产物用Hind Ⅲ和PstI酶切后,连接到植物表达载体DX2181b相应的酶切位点之间获得重组质粒,命名为DX2181-BPHIP(图1),测序验证。
当主电源接入24 V时,高于23 V的标准工作电压,此时E1使能,控制G1产生下拉电流,Q1导通,此时V1=Vs>V2,G2产生上拉电流,Q2、Q3截止,避免产生逆向电流;当主电源接入电压低于21 V时,E2使能,控制G2产生下拉电流,Q2、Q3导通,此时V2=Vs>V1,G1产生上拉电流,Q1截止,避免产生逆向电流.
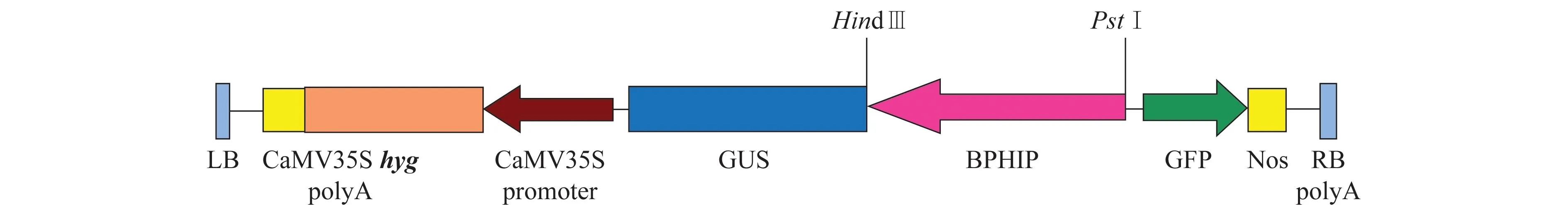
图1 终表达载体DX2181-BPHIP的T-DNA区域示意图Fig.1 Schematic diagram of the T-DNA region of the final expression vector DX2181b-BPHIP
1.3农杆菌介导的遗传转化
利用本实验室建立的水稻农杆菌介导的遗传转化法[7],以粳稻品种‘中花11’成熟种子的胚诱导后产生的愈伤组织为转化受体,用带有表达载体的根癌农杆菌EHA105进行侵染,侵染后用含有50 mg/L的潮霉素培养基筛选2次,每次2周,获得抗性愈伤组织,经分化、生根得到转基因植株。
取转基因植株幼苗叶片提取基因组DNA,以其作为模板进行PCR检测,扩增报告基因GUS的部分片段(引物为GUS-F和GUS-R,序列见表1),预期PCR产物大小为699 bp。

表1 本研究中所涉及的引物1)Table 1 PCR primers used in this study
1) 下画线代表该引物所加酶切位点。
The underlined letters indicate the restriction enzyme site.
PCR反应体系:100 ng/μL 模板1 μL,10×buffer 2 μL,2 mmol/L dNTPs 4 μL,10 μmol/L GUS-F 0.2 μL,10 μmol/L GUS-R 0.2 μL,ddH2O 12.4 μL,TaqDNA 聚合酶0.2 μL。反应程序为:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,28 个循环;72℃ 延伸8 min。PCR扩增呈阳性的植株保留,阴性植株去除。
1.4褐飞虱为害处理及JA处理
取不同水稻材料种子去壳,用1.5%升汞表面消毒后,在1/2 MS培养基上发芽生长约10 d。每个材料挑选6株长势健康且相近的水稻植株移栽,其中3株移栽一盆准备进行接虫处理,另3株移栽一盆不做任何处理作为对照。移栽后待水稻幼苗长至三叶一心阶段,进行褐飞虱接虫处理。平均每株接种约10头2龄褐飞虱若虫,然后每盆均用纱网罩住防止若虫逃逸。接虫6 h或24 h后对地上部分进行取样,样品用于GUS组织化学染色分析或RNA提取和定量PCR检测。
茉莉酸(JA)处理的前期准备同褐飞虱为害处理,只是水稻植株进行水培液培养[8]。水培液加入JA (100 μmol/mL,Sigma-Aldrich)进行培养,且每隔2 h用含有相同浓度JA的水培液喷洒水稻叶片1次,共喷施3次。JA处理24 h后取水稻幼苗根部以上部分进行分析,其中少量叶片和叶鞘样品进行GUS组织化学染色分析,其余样品用于RNA提取和定量PCR检测。
1.5GUS组织染色
将叶片和叶鞘样品剪成合适大小,浸没于GUS染色液中,抽真空后置于37℃恒温培养箱内染色过夜。随后,用无水乙醇脱色2次,每次1 h,最后用75%乙醇脱色至叶片绿色脱尽,然后用莱卡解剖镜观察拍照。
1.6定量RT-PCR检测
采用TriZol Reagent (Invitrogen)试剂盒提取总RNA。具体操作步骤参照试剂盒说明书。RNA反转录步骤简述如下,取2 μg 总RNA至Rnase-free 1.5 mL离心管中,加入1 μL DNase I,1 μL 10×缓冲液,加DEPC处理过的水至总体积10 μL,混匀后短暂离心,25℃(室温)孵育15 min。加入1 μL 0.5 mol/L EDTA,混匀后短暂离心,65℃水浴10 min灭活DNase I。加入1 μL oligo d(T)18, dNTPs 1 μL,65℃水浴10 min,然后立即置冰上3 min,短暂离心。加入5×First strand buffer 4 μL,DTT 1 μL,反转录酶M-MLV 1 μL,RRI 1 μL混匀后短暂离心,于50℃水浴反应2 h。75℃水浴灭活15 min。加水适当稀释反转录得到的cDNA。
实时荧光定量PCR使用ABI7500 (Life TechnologiesTM)检测系统,使用试剂盒为FastStart Universal SYBR Green Master (ROX) (Roche)。反应体系:100 ng/μL cDNA 1 μL,Mixture 5 μL,10 μmol/L左右引物各0.2 μL(所有引物序列见表1),ddH2O 3.6 μL。反应程序为:95℃ 10 min;95℃ 10 s,60℃ 36 s,40个循环。
2 结果与分析
2.1Os01g73940基因表达模式分析
根据本实验室李昌焱等的褐飞虱接虫诱导全基因组表达芯片分析的数据,不论是敏感品种‘TN1’还是高抗品种‘RH’,Os01g73940基因均受褐飞虱为害特异性诱导上调表达,且在‘TN1’中上调表达的幅度高于‘RH’。此外,在未处理或用针刺模拟褐飞虱为害处理中,Os01g73940基因表达量无显著变化,说明Os01g73940是一个褐飞虱为害诱导特异性表达的基因(图2a)。为了验证基因芯片的数据是否可靠,我们利用定量RT-PCR方法对Os01g73940基因在褐飞虱为害条件下表达变化进行了检测。无论是‘TN1’还是‘RH’,褐飞虱接种6 h后,Os01g73940基因表达水平仅有轻微上升;褐飞虱接种24 h,Os01g73940基因表达水平显著上升,其中‘TN1’中表达上调6倍以上,而在‘RH’中表达上调5倍以上(图3)。定量RT-PCR分析结果与基因芯片分析结果基本一致,证明基因芯片分析的结果是可靠的。

图2 Os01g73940基因在褐飞虱接种和JA处理下表达量的变化Fig.2 Expressional pattern of Os01g73940 gene under brown planthopper infection and JA treatment

图3 定量RT-PCR验证Os01g73940基因在褐飞虱为害6 h和24 h后的表达模式Fig.3 Validation of the expression pattern of Os01g73940 gene 6 h and 24 h after brown planthopper infection by real-time RT-PCR
根据http:∥ricexpro.dna.affrc.go.jp/下载的基因芯片数据分析,Os01g73940基因的表达还受植物激素JA的诱导(图2b)。Os01g7390基因在JA处理0.5 h后就有轻微上调表达,处理3 h后表达上调明显,处理6 h后表达进一步升高。根据http:∥ricexpro.dna.affrc.go.jp/GGEP下载的全生育期各种组织器官基因表达芯片数据分析,Os01g73940基因的表达主要集中在叶片、叶鞘和茎秆等绿色组织中,而在根、花特别是胚乳中表达量很低(图4)。
2.2启动子克隆、表达载体构建及转化
以‘TN1’总DNA为模板,采用PCR的方法克隆出Os01g73940的上游长度为1 953 bp的启动子区段,命名为BPHIP。将BPHIP启动子构建于GUS报告基因上游,并利用农杆菌介导的转化法,将融合的GUS报告基因导入粳稻品种‘中花11’中,获得的转基因植株通过PCR验证,共获得31株T0阳性独立转化植株。
2.3褐飞虱接种和JA处理24 h后GUS组织化学染色分析
T0代阳性植株的种子在含有潮霉素的1/2 MS培养基上发芽,筛选阳性T1代植株3个家系进行接褐飞虱及JA处理,24 h后进行GUS组织化学染色分析。以野生型‘中花11’作为阴性对照。本实验室先前转化得到一个CaMV35S启动子与GUS报告基因构建的融合基因的转基因家系,该转基因家系中GUS报告基因组成型表达,作为本研究的阳性对照。GUS组织化学染色结果显示,启动子BPHIP在水稻苗期的叶片和叶鞘部分均有一定的本底表达,在褐飞虱接种及JA处理24 h后GUS活性似乎有所上升,但无论褐飞虱接种或JA处理的前后,BPHIP启动子驱动GUS基因表达的活性显著低于组成型的CaMV35S启动子(图5)。

图4 Os01g73940在水稻各组织的表达谱(根据http:∥ricexpro.dna.affrc.go.jp/GGEP下载的数据制作)Fig.4 Expression profile of Os01g73940 in various rice tissues

图5 GUS组织化学染色分析Fig.5 GUS histochemical staining analysis
2.4褐飞虱接种及JA处理后GUS基因表达量的定性分析
为了对BPHIP启动子的表达活性进行定量分析,我们对经过褐飞虱接种和JA处理24 h后,转基因家系GUS基因的转录本用定量RT-PCR进行了定量分析。由于处理褐飞虱接种和JA处理过程较为繁琐,我们从31个独立的阳性转基因植株中随机挑选3个转基因植株家系作为代表进行了检测(图6)。结果表明,褐飞虱接种及JA处理24 h后GUS基因的表达量均有上调,与芯片数据预测的结果基本一致。褐飞虱接种24 h后3个转基因家系GUS转录本平均上调2.78倍,最高上调倍数为4.38倍。与CaMV35S启动子相比较,在未处理的条件下,GUS基因平均表达水平是CaMV35S启动子的1/27;接虫诱导24 h后平均表达水平可达CaMV35S启动子的1/7。JA激素处理24 h后比未处理24 h平均上调倍数为2.68倍,最高上调倍数为3.17倍。与CaMV35S启动子相比较,在未处理的条件下,GUS基因平均表达水平是CaMV35S启动子的1/30;JA处理24 h后平均表达水平可达CaMV35S启动子的1/7。

图6 BPHIP启动子驱动GUS基因的表达量检测Fig.6 Detection of the expression of GUS report gene derived by BPHIP promoter
3 讨论
在李昌焱等的芯片数据中,我们发现了数十个褐飞虱诱导上调表达基因,其中上调幅度最大的基因在褐飞虱接虫诱导24 h后,表达上调可达90倍以上。但是,诱导上调幅度大的基因通常表达的本底水平低,即使经过褐飞虱诱导后的基因表达水平仍然很低。部分这类基因的启动子克隆后,接GUS报告基因转化水稻,即使褐飞虱为害诱导24 h后,在转基因水稻中利用GUS组织化学染色甚至检测不到明显的GUS染色活性表达。此外,我们还发现一些褐飞虱诱导型基因仅在特定基因型如抗性品种中,才有基因诱导表达效应。我们将一些这类基因的启动子克隆后,与GUS基因融合导入褐飞虱敏感水稻品种‘中花11’中,发现这些启动子在敏感品种中诱导表达效果远不如原始基因那么强,甚至没有明显的诱导表达效果,说明这样的启动子的诱导依赖特异性的基因组背景,而不具有普遍适用性。
虽然,Os01g73940基因受褐飞虱为害诱导的上调表达的幅度并不是很大(5~6倍),但无论是褐飞虱敏感品种背景还是褐飞虱抗性品种背景,该基因均可受褐飞虱为害诱导,说明该基因启动子的诱导效果不受水稻品种基因型的限制,具有普遍性。此外,根据表达芯片数据预测,Os01g73940的启动子具有一定的组织特异性,表达主要集中在茎叶等绿色组织,而在水稻害虫不直接为害的花和种子中基本没有表达。因此BPHIP启动子是一个诱导型兼组织特异性启动子。在NCBI网站(http:∥www.ncbi.nlm.nih.gov/)上检索Os01g73940基因的同源蛋白,几乎没有相关研究,其基因功能未知。该基因推测的蛋白产物分子量较小,据预测可能是信号受体或膜蛋白。
本研究所得到的BPHIP启动子不仅受到褐飞虱为害诱导,还受JA处理诱导。据报道,昆虫接触植物后首先给植物造成不同程度的机械损伤,引起植物体内JA和过氧化氢等信号分子积累水平的改变并激活防御反应化合物如蛋白酶抑制基因的表达[9-10]。此外,不同口器类型(如咀嚼式或刺吸式)的昆虫对激活植物体内的防御信号也不同[11]。表明JA信号途径广泛参与植物应答虫害的抗性反应,已经鉴定出水稻中OsERF是可以通过调控JA的合成来调节植物应对虫害的免疫反应[12]。褐飞虱取食水稻后,体内激素信号会相应改变,从而引起一些基因表达模式的相应变化。因此,对于某些基因来说,褐飞虱取食和激素处理都可能会引起其表达量的改变。
本文所得到的启动子BPHIP是一个新的褐飞虱诱导表达的启动子,水稻的叶片和叶鞘又是许多病虫害发生部位,该启动子经过优化改造后,非常有望应用于抗虫或抗病水稻的研究中。后续将此启动子进行缺失分析,进而鉴定其核心功能元件的大致范围,还需通过凝胶阻滞试验等鉴定方法,找出该启动子中与褐飞虱诱导相关的顺式作用元件,分析其在转录调控中的分子作用机理,使其能够在农业生产上得以有效利用。
[1]Kasuga M, Liu Q, Miura S, et al. Improving plant drought, salt, and freezing tolerance by gene transfer of a single stress-inducible transcription factor [J].Nature Biotechnology, 1999,17(3):287-291.
[2]Moreno A B, Peas G, Rufat M, et al. Pathogen-induced production of the antifungal AFP protein fromAspergillusgiganteusconfers resistance to the blast fungusMagnaporthegriseain transgenic rice[J]. Molecular Plant-microbe Interactions, 2005, 18(9): 960-972.
[3]Li Changyan, Wei Jing, Lin Yongjun, et al. Gene silencing using the recessive rice bacterial blight resistance genexa13 as a new paradigm in plant breeding [J]. Plant Cell Reports, 2012, 31(5):851-862.
[4]姚秋林,林拥军.一个水稻根时空差异表达启动子的克隆及功能分析[J].农业生物技术学报,2011, 19(2): 214-220.
[5]Sato Y, Antonio B, Namiki N, et al. RiceXPro:a platform for monitoring gene expression in japonica rice grown under natural field conditions [J].Nucleic Acids Research,2011,39:1141-1148.
[6]Sato Y, Takehisa H, Kamatsuki K, et al. RiceXPro version 3.0:expanding the informatics resource for rice transcriptome[J]. Nucleic Acids Research, 2013, 41: 1206-1213.
[7]林拥军.根癌农杆菌介导的水稻基因转化研究[D].武汉:华中农业大学,2002.
[8]Yoshida S, Forno D A, Cock J H, et al. Laboratory manual for physiological studies of rice [M]. 3rd edn. Los Banos: International Rice Research Institute, The Philippines, 1976: 61-66.
[9]Peiffer M,Tooker J F,Luthe D S,et al. Plants on early alert: glandular trichomes as sensors for insect herbivores[J]. New Phytologist, 2009, 184(3): 644-656.
[10]Erb M, Meldau S,Howe G A,et al. Role of phytohormones in insect-specific plant reactions[J].Trends in Plant Science, 2012,17(5): 250-259.
[11]Diezel C,von Dahl C C,Gaquerel E, et al. Different lepidopteran elicitors account for cross-talk in herbivory-induced phytohormone signaling [J].Plant Physiology,2009, 150(3): 1576-1586.
[12]Lu Jing, Ju Hongping, Zhou Guoxin, et al. An EAR-motif-containing ERF transcription factor affects herbivore-induced signaling, defense and resistance in rice [J].The Plant Journal,2011,68(4): 583-596.
(责任编辑:田喆)
Cloning of a brown planthopper (Nilaparavatalugens) infection inducible promoter in rice
Guan Limei1,2,Ma Weihua1,Lin Yongjun1,Chen Hao1
(1.National Key Laboratory of Crop Genetic Improvement, Huazhong Agricultural University,Wuhan430070, China; 2.Jiangxi Academy of Sciences, Nanchang330029, China)
The constitutive promoters are widely applied in plant genetic engineering. However, it may cause growth retardation and other adverse effects due to the constant expression of exogenous genes in transgenic plants. The inducible promoters can control the expression of target genes more economically and minimize the possible harms to transgenic plants due to the accumulation of non-essential proteins. Based on the analysis of DNA microarray and quantitative RT-PCR, we found the expression of a rice gene (LOC_Os01g73940) could be induced by brown planthopper infection. The 1 953 bp upstream region ofOs01g73940 gene was isolated from the indica rice variety ‘TN1’ by PCR, which was referred to as brown planthopper induced promoter (BPHIP). BPHIP was ligated with aβ-glucuronidase(GUS) report gene to construct a fusion gene, and then transformed into a japonica rice variety ‘Zhonghua 11’. The results of GUS histochemical staining and quantitative RT-PCR confirmed that BPHIP is a promoter induced by brown planthopper infection and jasmonic acid treatment. This inducible promoter may mitigate the possible adverse effects of constitutive promoters in genetic engineering and has enormous application potential in insect-resistant transgenic breeding.
Oryzasativa;inducible promoter;Nilaparavatalugens;insect-resistance;genetic engineering
2014-11-23
2015-01-07
转基因生物新品种培育重大专项(2014ZX0810-002)
E-mail:chenhaoxy2003@126.com
S 435.112.3
A
10.3969/j.issn.0529-1542.2016.01.004
