水稻稻瘟病拮抗细菌WH1G的筛选鉴定及其抑菌活性
2016-09-14谷春艳张爱芳严丹侃王学峰
谷春艳, 张爱芳, 杨 雪, 严丹侃, 陈 雨, 王学峰
(安徽省农业科学院植物保护与农产品质量安全研究所, 合肥 230031)
水稻稻瘟病拮抗细菌WH1G的筛选鉴定及其抑菌活性
谷春艳,张爱芳,杨雪,严丹侃,陈雨,王学峰*
(安徽省农业科学院植物保护与农产品质量安全研究所, 合肥230031)
采用平板对峙法,从安徽水稻根际土壤样品中筛选对稻瘟病菌具有较强抑菌活性的拮抗细菌,通过菌落形态观察、生理生化特征、gyrB基因序列分析对该菌株进行鉴定,测定抑菌谱,对其抑菌机制进行初步研究。结果表明,拮抗菌株WH1G对稻瘟病菌具有较强的抑制作用,抑制率达91.79%,经鉴定为解淀粉芽胞杆菌(Bacillusamyloliquefaciens)。该菌可产生蛋白酶和纤维素酶,不产生几丁质酶和β-1,3-葡聚糖酶;用代谢产物无菌滤液处理稻瘟病菌,可造成孢子萌发率降低,菌丝扭曲异常、分支明显减少并产生大量泡囊。该菌对常见的20种植物病原真菌及细菌均具有不同程度的拮抗作用,表现出广谱抗菌活性。
稻瘟病菌;解淀粉芽胞杆菌;鉴定;抑菌活性
稻瘟病是由稻瘟病菌(Magnaportheoryzae)引起的一种真菌性病害,是世界性稻作病害,是影响水稻高产最严重的威胁之一,全球每年因稻瘟病造成的水稻产量损失达11%~30%[1-2],因此稻瘟病的防治成为水稻生产中的重要问题。
目前,稻瘟病的防治主要是采用栽培水稻抗瘟性品种和利用化学农药防治,但因抗病品种的单一化、化学农药的危害以及病原菌抗药性的产生,使水稻稻瘟病的防治受到一定的限制[3-4]。因此,生物防治越来越受到人们的关注。张芬等[5]从水稻根际土壤分离获得对稻瘟病具有高效抑菌活性的枯草芽胞杆菌T429(BacillussubtilisT429)和伯克霍尔德菌属真菌T392(Burkholderiasp. T392);刘诗胤等[6]分离获得对稻瘟菌具有一定防效的枯草芽胞杆菌(Bacillussubtilis)、短小芽胞杆菌(B.pumilus)和链霉菌(Streptomycessp.);温小红等[7]、周华强等[8]、Kuo等[9]、Tendulkas等[10]分别获得对稻瘟病有一定防效的假交替单胞菌(Pseudoalteromonas)、多黏类芽胞杆菌(Paenibacilluspolymyxa)、绿脓假单胞菌(Pseudomonasaeruginosa)和地衣芽胞杆菌(Bacilluslicheniformis)。
解淀粉芽胞杆菌是一种与枯草芽胞杆菌亲缘性很高的细菌,在自然界中分布广泛,其生长过程中可以产生一系列具有广泛抑制真菌和细菌活性的代谢产物[11], 因此,在生物防治方面具有广阔的应用前景,已逐步成为具有生物农药开发潜力的微生物。目前已有报道利用解淀粉芽胞杆菌防治水稻纹枯病、水稻细菌性条斑病、水稻恶苗病的研究[12-15],但是利用解淀粉芽胞杆菌防治水稻稻瘟病菌的研究国内外还未有报道。
本研究从水稻根际土壤中分离筛选出1株对水稻稻瘟病具有强烈抑制作用的拮抗菌株WH1G,通过形态观察、生理生化特征、gyrB基因序列分析对该菌株进行了鉴定,测定了其抑菌谱,并进行了胞外酶活性检测,研究了其代谢产物对稻瘟病菌菌丝生长及孢子萌发的影响,对其抑菌机制进行初步研究,这将为开发、研制相应的生防菌剂奠定基础。
1 材料和方法
1.1供试菌株
拮抗菌株WH1G为本研究小组从安徽省水稻根际土壤中分离筛选得到;供试水稻稻瘟病菌及用于抑菌谱测定的其他常见的植物病原真菌和细菌(表1,表2)均由安徽省农业科学院植物保护与农产品质量安全研究所分离和保藏。
1.2培养基
拮抗细菌分离、培养及供试细菌培养所用培养基为改良的NA培养基(牛肉浸膏 1.0 g,蛋白胨5.0 g,酵母膏5.0 g,NaCl 5.0 g,蔗糖10.0 g,琼脂20.0 g,蒸馏水1 000 mL,pH 6.8~7.0),病原真菌培养及拮抗谱测定采用PDA培养基,胞外酶活力测定采用选择性培养基[16-18]。
1.3拮抗细菌的分离、纯化及筛选
1.3.1拮抗细菌的分离、纯化
在水稻生长季节,从安徽省水稻田采集水稻根际土壤,采用5点法采样,每点各收集土样200 g,装入无菌保鲜袋,记录编号,保存备用。
拮抗细菌分离采用平板稀释法[19],称取土样10 g,放入100 mL无菌水中,摇床上振荡30 min,静置至澄清。用无菌枪头吸取上清液100 μL加入900 μL无菌水中,用无菌水依次稀释制备10-4、10-5、10-6、10-7和10-8土壤稀释液,各吸取稀释液100 μL 涂布于改良的NA分离培养基平板上,28℃恒温培养48 h,挑取形态、颜色等培养性状不同的细菌单菌落画线培养、纯化并保存。
1.3.2拮抗细菌的筛选
采用平板对峙法[20]测定分离的细菌对水稻稻瘟病菌的抑制活性。取新鲜的稻瘟病菌5 mm菌饼接于PDA培养基平板中央,在距离中心3 cm处呈对角线放置3个直径5 mm的滤纸片,每个滤纸片接种2 μL的待测细菌菌悬液,设无拮抗细菌处理为对照,每处理重复3次,置于28℃恒温箱内培养,及时观察、记录抑菌现象,测量菌落直径,计算抑制率,抑制率(%)=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-原菌碟直径)×100。挑选抑菌圈直径大,抑制率高,且拮抗作用持久的菌株进行复筛。
将初筛的拮抗菌株分别接种于5 mL改良的NA液体培养基,置28℃摇床180 r/min培养36 h后,10 000 r/min离心10 min,取上清用0.45 μm细菌过滤器过滤,得到代谢产物的无菌滤液。将代谢产物与PDA培养基混合后倒平板,然后在平板中央接种5 mm稻瘟病菌菌碟,以不加代谢产物的PDA培养基为对照,28℃恒温箱内培养5 d,用十字交叉法测量病原菌菌落直径,计算菌丝生长抑制率。
1.4拮抗细菌的抑菌谱测定
采用对峙培养法和滤纸片扩散法对常见的19种病原真菌及细菌进行抑菌谱测定。(1)对12种病原真菌的抑菌活性测定:采用平板对峙法,测量菌落直径,计算菌丝生长抑制率,方法同1.3.2;(2)对7种病原细菌的抑菌活性测定:分别将7种病原细菌接入改良的NA培养基中,置于180 r/min、28℃摇床内培养36 h,按1‰的体积比混入改良的NA固体培养基中倒平板,对峙三点放入5 mm无菌滤纸片,吸取2 μL拮抗细菌发酵液于滤纸片上,置于28℃恒温箱内培养。每处理重复3次,待病原菌长满平板时,测量抑菌带宽度。
1.5拮抗细菌的鉴定
1.5.1培养性状的观察
将筛选出的拮抗细菌接种于改良的NA平板上28℃恒温培养,观察其菌落形态、颜色、质地等。
1.5.2拮抗细菌的生理生化测定
参照《常见细菌系统鉴定手册》[21]进行,测定的生理生化指标见表2。
1.5.3gyrB基因序列分析鉴定
采用常规方法提取拮抗菌株的基因组DNA[22]。gyrB基因扩增引物为:UP1 (5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′);UP2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCN-ACRTCNGCRTCNGTAT-3′)[23]。PCR扩增条件:96℃预变性5 min;96℃变性1 min,62℃退火 1 min,72℃延伸 1.5 min,35 个循环;72℃延伸7 min。PCR 产物经电泳、胶回收后送上海生工生物工程有限公司测序。将测序结果在 GenBank数据库中进行比对,选择与测序结果同源性较高的序列,运用软件 Clustalx和 MEGA 6.0,采用最大似然法 (maximum likelihood)构建系统进化树,并上传基因序列。
1.6菌株胞外酶活性检测
测定与拮抗作用相关的4种胞外酶(蛋白酶、纤维素酶、几丁质酶和β-1,3-葡聚糖酶)的活性。分别在4种检测培养基平板上距中心等距离处均匀放置3个5 mm的滤纸片,每个滤纸片滴入2 μL新鲜的拮抗细菌菌液,每个处理重复3次。接菌后,28℃恒温培养48 h左右,检测相应的胞外酶活性[24]。观察酶解圈的有无和大小,并作进一步分析。
1.7拮抗细菌代谢产物对稻瘟病菌及其孢子的拮抗活性测定
1.7.1拮抗细菌代谢产物对稻瘟病菌菌丝生长的影响
参照1.3.2的方法,制取菌株WH1G代谢产物无菌滤液。将代谢产物无菌滤液分别按照1%、2%、5%、10%、20%的体积比与PDA培养基混合后制成平板,在混合平板中央放置5 mm新鲜的稻瘟病菌菌丝块,每处理重复3次,设NA培养基处理为空白对照,28℃培养5 d,用十字交叉法测量不同体积比平板上生长的稻瘟病菌菌落直径,计算菌丝生长抑制率,并在显微镜下观察不同处理的稻瘟病菌边缘菌丝的生长状态。
1.7.2拮抗细菌代谢产物对稻瘟病菌孢子萌发的影响
将新鲜的稻瘟病菌菌丝块在PDA平板上培养6 d后,接种到酵母淀粉斜面培养基上(水溶性淀粉10 g/L,酵母浸膏2 g/L,琼脂20 g/L),待菌丝长满后,加入1.5 mL灭菌水并轻轻地刮菌丝,后移取100 μL菌丝液到盛有燕麦片培养基(燕麦片50 g/L,蔗糖20 g/L,琼脂20 g/L,pH 6.0~6.5)平板上,涂布均匀后放置在28℃恒温培养箱中培养。待平板上菌丝长满后(约7 d),在无菌条件下刮除平板上菌丝,将平板置于室内培养架上24 h光照培养,室温25~28℃。等到充分产孢(约3~4 d)后,每皿用5 mL蒸馏水洗下孢子[25],然后用灭菌的擦镜纸过滤后制成孢子液。将孢子悬浮液分别于拮抗细菌代谢产物按照5%、10%、20%、50%的体积比混合,每个处理重复3次,设置无菌水与孢子悬浮液混合为对照,于28℃培养箱中培养24 h后镜检孢子萌发情况[26],统计各处理的孢子萌发率,计算孢子萌发抑制率(%)=(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100。
2 结果与分析
2.1拮抗细菌的筛选与抑菌谱测定
2.1.1拮抗细菌WH1G的筛选
从安徽省水稻根际土壤中分离到516株细菌菌株。采用室内平板对峙生长法,测定了上述细菌菌株对稻瘟病菌的拮抗作用。结果显示(图1~2),有3株生防细菌(WH5G、YS-1、WH1G)对稻瘟病菌具有明显的抑菌效果,其菌丝生长抑制率均在80%以上,其中,菌株WH1G(CGMCC No.10722)平板拮抗活性最强,对稻瘟病菌抑制效果最为明显,几乎完全抑制了稻瘟病菌的生长,WH1G菌液对稻瘟病菌菌丝的抑制率达到91.79%,其代谢产物无菌滤液对稻瘟病菌的抑制率可达80.46%,故选择此菌株用于进一步研究。
2.1.2拮抗细菌WH1G的抑菌谱测定
菌株WH1G对供试的其他常见的12种病原真菌(表1)、7种病原细菌(表2)的抑菌活性测定结果表明,WH1G的抑菌谱较广,对这19种供试主要作物病原菌均具有不同程度的抑菌效果。其中对西瓜蔓枯病菌的抑制率达90%以上;对油菜菌核病菌、枇杷灰斑病菌、梨轮纹病菌、石榴干腐病菌抑制率达到80%以上;对黄瓜枯萎病菌、水稻恶苗病菌抑制率达到70%以上。此外,对水稻细菌性条斑病菌、水稻白叶枯病菌、青枯雷尔氏菌等病原细菌均具有明显的抑制效果。
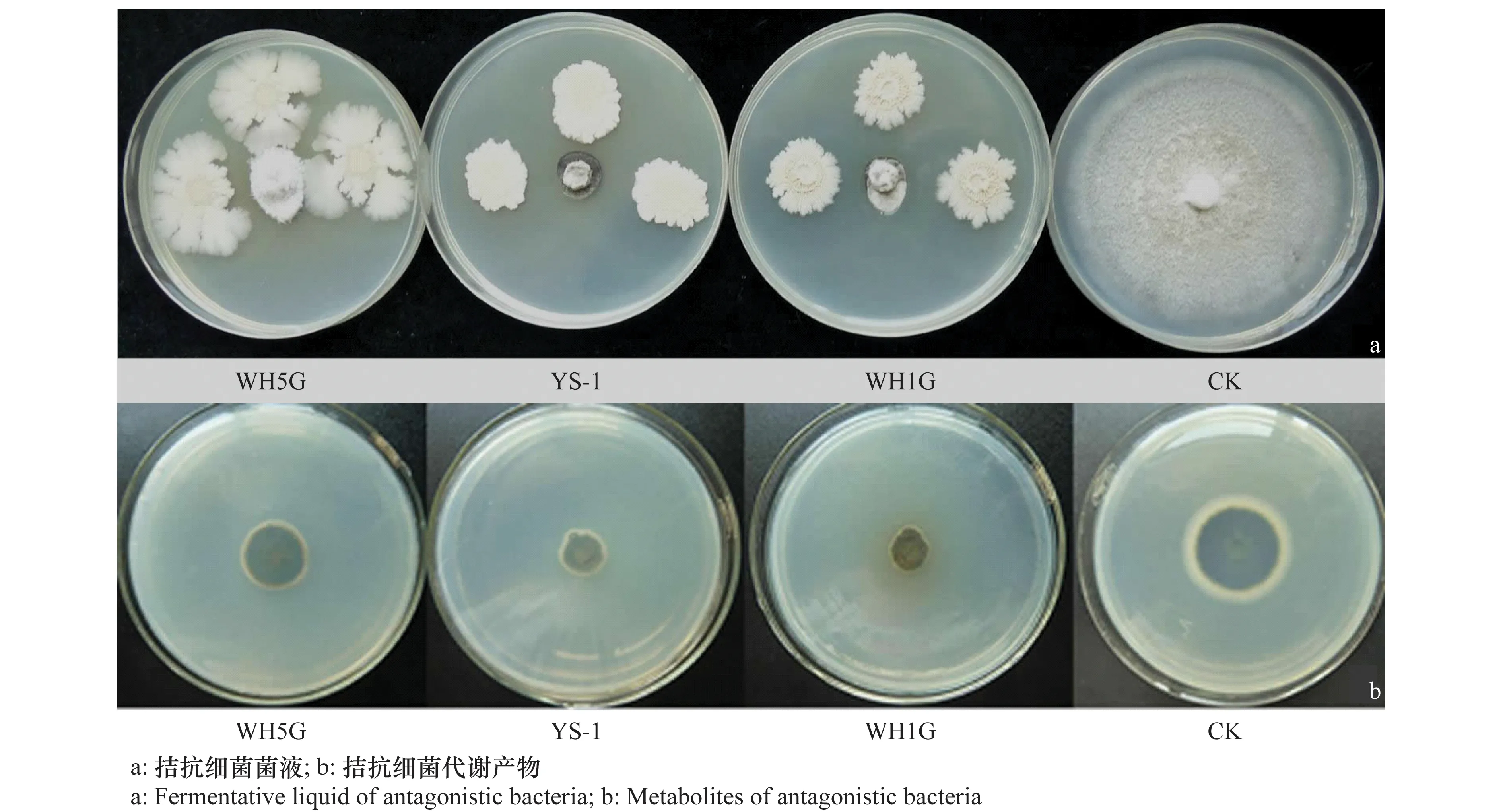
图1 3株拮抗细菌对稻瘟病菌的抑菌活性Fig.1 The antimicrobial activity of the three strains against Magnaporthe oryzae

图2 3株拮抗细菌对稻瘟病菌的抑制率Fig.2 Inhibition rates of the three strains against Magnaporthe oryzae
2.2拮抗细菌WH1G的鉴定
2.2.1培养性状的观察
WHIG在改良的NA固体培养基平板上培养,培养初期菌落乳白色,边缘整齐,圆形隆起,表面光滑湿润;培养后期菌落呈奶白色,边缘不整齐,不透明,表面干燥呈皱褶状突起。
2.2.2生理生化特征测定
参照芽胞杆菌鉴定表中规定的相关测定项目[21],对菌株WH1G进行了生理生化主要指标测定。由表3可以初步鉴定WH1G为解淀粉芽胞杆菌(B.amyloliquefaciens)或枯草芽胞杆菌(B.subtilis)。

表1 WH1G对12种植物病原真菌生长的抑菌效果
2.2.3WH1G菌株的分子鉴定
本研究以WH1G菌株的基因组DNA为模板,扩增gyrB基因片段,得到序列长度约为1 200 bp的序列(登录号为KP143083),与芽胞杆菌gyrB基因的理论值基本相符。将测序结果在NCBI中通过BLAST比对,运用MEGA 6.0软件,根据Kimura 2-parameter 模型,采用最大似然法 (maximum likelihood) 构建系统发育树(图3),系统发育树各分支的置信度(Bootstrap) 进行1 000 次的重复检验。结果显示,WH1G菌株与解淀粉芽胞杆菌(B.amyloliquefaciens)在同一分支上,因此,将WH1G鉴定为解淀粉芽胞杆菌(B.myloliquefaciens)[28]。

表2 WH1G对7种植物病原细菌生长的抑菌效果1)
1) 抑菌带宽指拮抗菌的菌落边缘到病原菌的距离。
Width of antibacterial belt indicates distance between antagonist colony and pathogen.
2.3WH1G菌株胞外酶活性检测
将细菌发酵液接种在4种胞外酶检测培养基上,2 d后进行活性检测,结果(图4)显示,拮抗菌WH1G可以分泌蛋白酶和纤维素酶,在这两种检测培养基中能够产生较大的酶解圈,其直径分别约为16 mm和14 mm,说明WH1G菌株产生的纤维素酶和蛋白酶活性较高。但是WH1G在几丁质酶和β-1,3-葡聚糖酶检测培养基上无透明圈产生,表明WH1G不产生几丁质酶和β-1,3-葡聚糖酶。

表3 拮抗菌WH1G的生理生化特征1)
1) +:阳性或能够利用;-:阴性或不能利用。
+:Positive or usable;-:Negative or unusable.

图3 基于gyrB基因序列BLAST结果构建的菌株WH1G的系统发育树Fig.3 Phylogenetic tree of WH1G and related strains based on gyrB gene sequences

图4 WH1G菌株胞外酶活性检测Fig.4 Detection of the extracellular enzyme activity of strain WH1G
2.4WH1G菌株代谢产物对稻瘟病菌菌丝生长及孢子萌发的影响
2.4.1代谢产物对稻瘟病菌及菌丝生长的影响
将拮抗菌代谢产物的无菌滤液按不同体积比加入PDA培养基,5 d后检测稻瘟病菌生长情况,结果表明,拮抗菌WH1G的代谢产物对稻瘟病菌的抑菌活性较高,并且随着代谢产物体积分数的不断增大,对稻瘟病菌的抑制率也相应地提高,当体积分数为20%时,可显著抑制稻瘟病菌菌丝生长,菌丝生长抑制率达88.44%(表4);镜检结果显示,与对照菌落相比,稻瘟病菌菌落边缘菌丝分支减少、萎缩,弯曲生长,菌丝细胞膨大、畸变,形成泡囊状结构(图5a~l)。

图5 不同体积分数的WH1G代谢产物对稻瘟病菌菌丝生长的抑制作用Fig.5 Inhibition of different concentrations of filtrates on pathogen growth

代谢产物体积/%Filtrateconcentration菌落平均直径/cmDiameterofthecolony抑制率/%Inhibitionrate0(CK)4.91±0.120dD13.29±0.0336.73cC23.18±0.0339.23cC51.79±0.0270.75bB101.13±0.0485.71aA201.01±0.0288.44aA
1) 同列数据后不同的小、大写字母分别表示在P<0.05和P<0.01水平差异显著。下同。
The different lowercase and capital letters in the same column indicate significant difference at 0.05 and 0.01 levels. The same below.
2.4.2代谢产物对稻瘟病菌孢子萌发的影响
将稻瘟病菌孢子悬浮液与不同体积比的拮抗菌WH1G代谢产物混合培养24 h后镜检(10×40),结果如表5所示,对照孢子萌发率达到90%,而随着代谢产物体积分数的增加,稻瘟病菌孢子萌发率逐渐降低,对孢子萌发的抑制率逐渐增大。当代谢产物体积分数为50%时,可显著抑制稻瘟病菌孢子萌发,对孢子萌发的抑制率达到80.38%。
3 结论与讨论
目前筛选和利用拮抗细菌防治稻瘟病的研究,国内外已有不少报道[5-10],但是利用解淀粉芽胞杆菌防治稻瘟病的研究,国内外未见有报道。本研究从安徽水稻根际土壤中分离筛选出1株对水稻稻瘟病菌具有显著抑菌活性的生防菌株WH1G,该菌株在离体条件下,几乎完全抑制了稻瘟病菌的生长,WH1G发酵液对稻瘟病菌的抑制率达到91.79%,其代谢产物无菌滤液对稻瘟病菌的抑制率可达80.46%。而目前国内外报道的拮抗细菌对稻瘟病菌的抑制率较低,最高为88.93%[5-7,10],与以上结果相比,菌株WH1G对稻瘟病菌的抑制作用较好,具有很大的开发和应用价值。
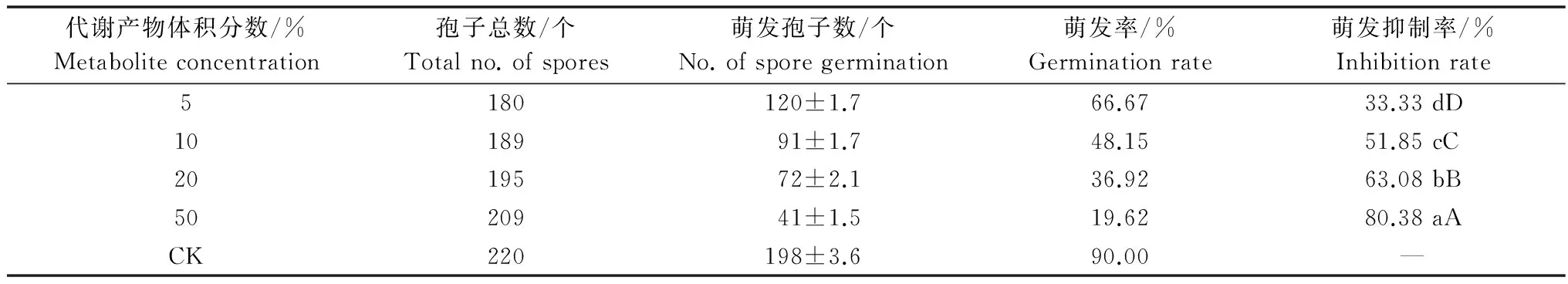
表5 WH1G代谢产物对稻瘟病菌孢子萌发率的影响
解淀粉芽胞杆菌和枯草芽胞杆菌表型相似,很难区分,仅从同源性上很难精确确定它的分类地位。目前已有多种基因如gyrA[27]、gyrB[28]、ropD基因[29]等用于枯草芽胞杆菌和解淀粉芽胞杆菌的分类研究,如Wang等[28]通过以gyrB序列为靶标,能从种水平上区分枯草芽胞杆菌及其近缘种。本文除了形态观察和生理生化方面的测试,在分子水平利用gyrB基因序列分析进行鉴定,结果表明WH1G为解淀粉芽胞杆菌,这为其他细菌的快速鉴定提供了一种方法。
拮抗细菌对病原真菌的作用方式主要是抑制病原真菌菌丝生长和孢子萌发[3,8],以及诱发病菌菌丝膨大,顶端畸形[30],这在本研究中已得到证实。本研究通过检测胞外酶活性,用代谢产物无菌滤液处理稻瘟病菌菌丝和孢子,对解淀粉芽胞杆菌WH1G的作用机理有了初步的认识。结果表明:菌株WH1G对病原真菌的抑菌机制与已有报道基本一致。因此我们推断解淀粉芽胞杆菌对植物病原菌的抑制作用不是通过产生几丁质酶溶解真菌细胞壁来实现的,而是主要依赖于其生长过程中产生的某种或多种代谢产物即抗菌物质,抑制病原真菌孢子萌发,降低孢子萌发率,使菌丝畸形、细胞膨大崩解、内含物外泄,从而达到抑制病原真菌的目的。但是解淀粉芽胞杆菌所产生的纤维素酶和蛋白酶是否对病原菌有抑制作用,以及在其中发挥了多大的作用,还需进一步研究。
通过平板拮抗试验发现,以稻瘟病菌为靶标筛选的解淀粉芽胞杆菌WH1G具有广谱的抑菌活性,不仅对常见的12种病原真菌有较好的抑制作用,对供试的7种病原细菌也有较好的抑制作用,特别是对水稻细菌性条斑病菌、水稻白叶枯病菌具有显著的抑菌活性。通过盆栽试验表明,该菌株发酵液不仅在离体条件下活性较高,在活体情况下也显示了较好的抑菌活性(数据未发表),是一株极具开发潜力的生防菌株。但要将该菌株用于农业生产上防治植物病害尤其是水稻稻瘟病的防治,还需进一步通过田间试验来证明。如果田间防治效果较好,那么对于其产生的抗菌活性物质有效成分的分离纯化、结构鉴定以及是否适合大面积的使用,都值得进一步的研究。
[1]温小红, 谢明杰, 姜健, 等. 水稻稻瘟病防治方法研究进展[J]. 中国农学通报, 2013, 29(3): 190-195.
[2]Li Y B, Wu C J, Jiang G H, et al. Dynamic analyses of rice blast resistance for the assessment of genetic and environmental effects [J]. Plant Breeding, 2007, 126(5): 541-547.
[3]刘任, 韩静君, 游春平, 等. 稻瘟病菌拮抗细菌bio-2的抑菌作用及其鉴定[J]. 植物保护学报, 2011, 38(1): 91-92.
[4]史学涛, 肖应辉, 刘杨, 等. 水稻第11染色体抗稻瘟病基因研究进展[J]. 中国农学通报, 2011, 27(12): 1-6.
[5]张芬, 刘邮洲, 于俊杰, 等. 水稻稻瘟病菌拮抗细菌的筛选与鉴定[J]. 江苏农业学报, 2011, 27(3): 505-509.
[6]刘诗胤, 姜华, 张震, 等. 稻瘟菌拮抗细菌的筛选与鉴定[J]. 浙江农业学报, 2012, 24(4): 609-614.
[7]温小红, 姜健, 杨宝灵, 等. 稻瘟病菌拮抗假交替单胞菌的分离与鉴定[J]. 江苏农业科学, 2012, 40(11): 122-124.
[8]周华强, 谭芙蓉, 周颖, 等. 多粘类芽孢杆菌极端嗜热多肽的纯化及性质研究[J]. 现代农药, 2007, 6(3): 40-43.
[9]Kuo T M, Kim H, Hou C T.Production of a novel compound, 7, 10, 12-trihydroxy8(E)-octadecenoic acid from ricinoleic acid byPseudomonasaeruginosaPR3 [J]. Current Microbiology, 2001, 43(3): 198-203.
[10]Tendulkar S R, Saikumari Y K, Patel V, et al. Isolation, purification and characterization of an antifungal molecule produced byBacilluslicheniformisBC98, and its effect on phytopathogenMagnaporthegrisea[J]. Journal of Applied Microbiology, 2007, 103(6): 2331-2339.
[11]陈成, 崔堂兵, 于平儒. 一株抗真菌的解淀粉芽孢杆菌的鉴定及其抗菌性研究[J].现代食品科技, 2011, 27(1): 36-39.
[12]朱晓飞, 张晓霞, 牛永春, 等. 一株抗水稻纹枯病菌的解淀粉芽胞杆菌分离与鉴定[J]. 微生物学报, 2011, 51(8): 1128-1133.
[13]张荣胜, 王晓宇, 罗楚平, 等. 解淀粉芽孢杆菌Lx-11产脂肽类物质鉴定及表面活性素对水稻细菌性条斑病的防治作用[J]. 中国农业科学, 2013, 46(10): 2014-2021.
[14]田洁萍, 王玉霞, 张淑梅. 解淀粉芽孢杆菌防治水稻恶苗病效果初报[J]. 黑龙江科学, 2010, 1(4): 10-11.
[15]Nagendran K, Karthikeyan G, Mohammed F P, et al. Exploiting endophytic bacteria for the management of sheath blight disease in rice [J]. Biological Agriculture and Horticulture, 2014, 30(1): 8-23.
[16]蒋淑贞, 钱国良, 刘轶儒, 等. 产酶溶杆菌OH11菌株胞外酶调控相关基因ctp的克隆及功能的初步分析[J]. 中国生物防治学报, 2011, 27(1): 68-75.
[17]朱慧, 王云霞, 胡白石, 等. 产酶溶杆菌OH11菌株α-水解蛋白酶基因的克隆与表达[J]. 中国生物防治学报, 2007, 23(4): 358-362.
[18]朱慧, 王云霞, 胡白石, 等. 产酶溶杆菌OH11菌株几丁质酶基因的克隆与表达[J]. 南京农业大学学报, 2008, 31(1): 47-50.
[19]张玉胜, 谭亚男. 油菜核盘菌拮抗菌的筛选及鉴定[J]. 生命科学仪器, 2009, 7(10): 27-28.
[20]魏彩燕, 毛雪琴, 柴荣耀, 等. 草莓炭疽病生防菌株MT-06的鉴定及生物学特性[J]. 菌物学报, 2010, 29(4): 481-487.
[21]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[22]Christensen J J, Andresen K, Justesen T, et al. Ribosomal DNA sequencing: experiences from use in the Danish National Reference Laboratory for identification of bacteria [J]. APMIS,2005, 113 (9): 621-628.
[23]Yamamoto S, Harayama S.PCR amplification and direct sequencing ofgyrBgenes with universal primers and their application to the detection and taxonomic analysis ofPseudomonasputidastrains [J]. Applied and Environmental Microbiology, 1995, 61(3): 1104-1109.
[24]孙建波, 王宇光, 赵平娟, 等. 香蕉枯萎病生防细菌的筛选、鉴定及其抑菌作用[J]. 中国生物防治, 2010, 26(3): 347-351.
[25]王宝华, 郑武, 鲁国东, 等. 稻瘟菌产孢培养基的筛选[J]. 福建农业科技, 2000(2): 1-2.
[26]Kleinkauf H, von DÖhren H.Nonribosomal biosynthesis of peptide antibiotics [J]. European Journal of Biochemistry, 1990, 192(1): 1-15.
[27]Chun J, Bae K S.Phylogenetic analysis ofBacillussubtilisand related taxa based on partialgyrAgene sequence [J]. Antonievan Leeuwenhoek, 2000, 78(2): 123-127.
[28]Wang Liting, Lee F L, Tai Chunju, et al. Comparison ofgyrBgene sequences, 16S RNA gene sequences and DNA-DNA hybridization in theBacillussubtilisgroup [J]. International Journal of Systematic and Evolutionary Microbiology,2007,57:1846-1850.
[29]Yamamoto S, Harayama S.Phylogenetic relationships ofPseudomonasputidastrains deduced from the nucleotide sequences ofgyrB,rpoDand 16S rRNA genes [J]. International Journal of Systematic Bacteriology, 1998, 48: 813-819.
[30]张艳群, 来航线, 韦小敏, 等. 两株生防芽孢细菌筛选、鉴定及拮抗研究[J]. 微生物学通报, 2014, 41(2): 281-289.
(责任编辑:田喆)
Screening, identification of the antagonistic bacterium WH1G againstMagnaportheoryzaeand analysis of its antagonistic activity to other plant pathogens
Gu Chunyan,Zhang Aifang,Yang Xue,Yan Dankan,Chen Yu,Wang Xuefeng
(Institute of Plant Protection and Agro-Products Safety, Anhui Academy of Agricultural Sciences, Hefei230031, China)
By plate confrontation culture, the antagonistic strain was screened from the rice rhizosphere soils in Anhui Province, which exhibited anti-fungal activity againstMagnaportheoryzaecausing rice blast. In order to explore the anti-fungal mechanism of the antagonistic strain toM.oryzaeand its taxonomic status, a series of physiological and biochemical experiments were conducted. The results showed that the strain WH1G could strikingly inhibit the growth ofM.oryzaewith an inhibition efficiency of 91.79%. Based on morphological observation, biochemical and physiological characteristics andgyrBgene sequence analysis, WH1G was identified asBacillusamyloliquefaciens. It could produce proteinase and cellulose, but no chitinase orβ-1,3-glucanase were detected. The metabolites of the antagonistic bacteria could lead to decreased spore germination ratio and abnormal hyphal growth ofM.oryzae, such as twist, short growth, less branches and swollen tip. Moreover, the strain could inhibit the growth of 20 common plant pathogenic fungi and bacteria, showing broad anti-microbial spectrum.
Magnaportheoryzae;Bacillusamyloliquefaciens;identification;anti-fungal activity
2015-06-29
2015-10-25
安徽省农业科学院院长青年创新基金项目(14B1149);安徽省农业科学院学科建设项目(14A1129)
E-mail:feng.ahas@tom.com
S 476
A
10.3969/j.issn.0529-1542.2016.04.007
