真菌Sr18代谢产物对根结线虫胁迫下黄瓜叶片保护酶的影响
2016-09-14王修清孟庆恒孙建华黄文坤彭德良
任 毅, 王修清, 孟庆恒, 孙建华, 冯 欣*, 黄文坤, 彭德良
(1. 天津市动植物抗性重点实验室,天津师范大学生命科学学院, 天津 300387;2. 中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
真菌Sr18代谢产物对根结线虫胁迫下黄瓜叶片保护酶的影响
任毅1,王修清1,孟庆恒1,孙建华1,冯欣1*,黄文坤2,彭德良2
(1. 天津市动植物抗性重点实验室,天津师范大学生命科学学院, 天津300387;2. 中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京100193)
为探究根结线虫胁迫下丝状真菌Sr18代谢产物对黄瓜的作用机理,采用温室盆栽及人工接种试验,研究了不同浓度的Sr18代谢产物对南方根结线虫胁迫下黄瓜叶片保护酶的影响。结果表明,线虫侵染黄瓜根部以后,黄瓜叶片SOD、POD和CAT活性减弱,PPO和PAL浓度降低。施加不同浓度的Sr18代谢产物,能够使线虫胁迫下的黄瓜叶片SOD、POD和CAT活性增强,使PPO和PAL的含量增加,说明Sr18代谢产物能够提高黄瓜的保护酶活性与含量,增强黄瓜对南方根结线虫的抗性。
Sr18丝状真菌;根结线虫;保护酶;抗性机理
根结线虫 (Meloidogynespp.,俗称root knot nematode,RKN) 能侵染2 000多种植物,是严重危害农作物生产的病原线虫之一,对蔬菜等农作物造成的危害尤为严重[1-2]。真菌的次生代谢产物属于第二代线虫生防因子,具有作用快、药效好、环境相容性高等优点[3]。丝状真菌SyncephalastrumracemosumSr18是从土壤中自主分离筛选的一株线虫生防菌[4],其代谢产物对松材线虫、大豆孢囊线虫和南方根结线虫都具有很强的杀线虫活性[5],并可显著降低线虫的虫口密度,减少线虫对植物的危害程度,还具有提高植物鲜重和果实产量的作用[6]。
前人研究结果显示,植物受逆境胁迫时,体内会积累O2·-、H2O2等活性氧(reactive oxygen species,ROS),能引发膜脂过氧化反应,进而改变植物细胞膜透性;攻击核酸和蛋白质,导致核酸结构受损,蛋白酶失活,植株受害[7-8];而植物体内会启动抗氧化酶系统来适应环境的变化[9],以抵御逆境造成的氧化胁迫[10],包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)、苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL)等。其中SOD酶活性的变化可以作为鉴定植物抗病性的生化标记[11]。此外,前人研究还发现,抗病品种黄瓜体内的POD、PAL活性显著高于感病品种[12],这一现象在孢囊线虫胁迫下的大豆中也同样得到证实[13]。尽管Sr18代谢产物对根结线虫有很好的防控效果[14-15],但是,在根结线虫胁迫条件下使用Sr18代谢产物后,植物的保护酶活性及防御相关机制还不清楚。由此,本试验以南方根结线虫胁迫条件下黄瓜植株作为研究对象,测定了不同浓度Sr18代谢产物处理后植株叶片的SOD、CAT、POD、PPO和PAL的变化情况,以探究在根结线虫胁迫条件下Sr18代谢产物对黄瓜植株的保护作用及提高植株抗性的机理。
1 材料与方法
1.1试验材料
供试黄瓜(CucumissativusL.)品种:‘津春4号’,天津黄瓜研究所生产。
供试线虫:南方根结线虫(Meloidogyneincognita),中国农业科学院植物保护研究所线虫实验室提供。
供试菌株Sr18为天津师范大学分离自土壤的一株线虫生防菌[4]。
1.2Sr18代谢产物的制备
将保藏的Sr18菌株接入PSM(potato-sucrose-malt extract)斜面培养基,放置在26℃恒温培养箱中静置培养活化。取活化后的Sr18菌株斜面,加入无菌水洗脱孢子,以6.985×108个孢子的接种量接入装有300 L液体的PSM培养基的500 L种子罐中,27℃通气搅拌培养24 h。再经过装有3 000 L液体发酵培养基的5 t通气搅拌型发酵罐发酵40 h,得到下罐液(菌体浓度5g/L)。将下罐液经过板框过滤以及真空浓缩,制得浓缩7倍的Sr18代谢产物,发酵过程在天津市新星兽药厂进行。将浓缩液用无菌水稀释7倍成原液(干物质浓度8 g/L),再依次用无菌水等比例稀释成2倍、4倍,即为所需的Sr18代谢产物部分。
1.3黄瓜植株的栽培
黄瓜种子于50℃温水中浸种15 min,水温降至25℃左右,继续浸泡6 h, 28℃催芽40 h,选取胚根一致的种子播种至穴盘中培养,条件为白天28℃、16 h,夜晚22℃、8 h。两周后,选取生长一致的黄瓜幼苗移栽至花盆。
1.4南方根结线虫孵化与收集
采用机械捣碎过筛法[16],略有改动。将发病重、根结多的根系,剪成1~2 cm,放入组织搅拌机中,加入适量2%的NaClO溶液捣碎成混合物。倒入组合筛上冲洗,组合筛自上而下依次为60目、230目、500目。直至泡沫和氯气味去除,喷淋后期使用无菌水,逆流将卵冲入烧杯中。用40%的蔗糖和虫卵液等体积离心,收集絮状虫卵。在25℃下,采用改进的贝尔曼漏斗法收集孵化的2龄幼虫。
1.5试验设计
将移栽后的黄瓜幼苗随机分为A、B两组。A组为不接种线虫组,B组为接种线虫组。黄瓜幼苗移栽24 h后,A、B两组均分别用Sr18代谢产物原液(Sr18)、原液的2倍稀释液(1/2Sr18)、原液的4倍稀释液(1/4 Sr18)3 mL喷洒处理土壤,以等体积清水做空白对照。随后,向B组每株黄瓜靠近根部的土壤接种1 mL南方根结线虫的2龄幼虫稀释液(1 000条/mL)。
1.6Sr18代谢产物对南方根结线虫的防治效果
定植60 d后,调查根结线虫对黄瓜的危害情况,计算不同浓度Sr18代谢产物处理后的根结指数与对根结线虫的防治效果[14]。
1.7不同处理下黄瓜植株酶活性和酶浓度测定
定植60 d后[17]测量黄瓜植株叶片的酶活性指标。准确称量黄瓜叶片组织,按重量(g)∶体积(mL)=1∶9的比例,量取 9倍体积的0.1 mol/L的磷酸缓冲液(pH=6.5);将植物叶片组织剪碎后放入匀浆器中,在冰浴上充分研磨,将研磨均匀的植物组织匀浆液倒入离心管,经离心后取得的上清液即为酶提取液,每个处理3个重复。SOD、CAT、POD的活性和PPO、PAL的浓度测定采用南京建成生物工程研究所生产的超氧化物歧化酶测定试剂盒(A001-3 WST-1法),过氧化氢酶测定试剂盒(A007-1可见光法),过氧化物酶测定试剂盒(A084-3),植物苯丙氨酸解氨酶酶联免疫检测试剂盒和植物多酚氧化酶酶联免疫检测试剂盒。
1.8数据统计分析方法
统计分析采用SPSS17.0软件,比较采用Duncan’ s 新复极差法(P<0.05)进行显著性检验,作图采用Origin Pro 8 软件。
2 结果与分析
2.1Sr18代谢产物对根结线虫的防治效果
在黄瓜接种线虫60 d后,挖取全部根系,调查根结线虫的危害情况。Sr18代谢产物原液及2种不同浓度的稀释液均可显著降低根结线虫的危害程度,其中Sr18代谢产物原液处理的黄瓜根结指数最低,防治效果最好(67.4%);其次是Sr18代谢产物2倍稀释液,防治效果达58.8%;Sr18代谢产物4倍稀释液的根结指数较高,但防治效果达50.8% (图1)。说明Sr18代谢产物稀释4倍后仍然可以有效地控制根结线虫的危害。

图1 不同浓度的Sr18代谢产物对南方根结线虫的防治效果Fig.1 Control effects of different dilutions of Sr18 metabolites on Meloidogyne incognita in cucumber
2.2Sr18代谢产物对黄瓜植株超氧化物歧化酶(SOD)活性的影响
Sr18代谢产物处理根结线虫胁迫下的黄瓜植株SOD酶活力的测定见图2。未接种线虫时,施加Sr18代谢产物后,SOD活性明显增加。施加原液的2倍稀释液时,SOD活力达到最大值。当线虫侵染黄瓜植株以后,SOD酶活力显著降低。线虫胁迫下,施加不同浓度的Sr18代谢产物,叶片SOD 活性均明显升高,且随着Sr18代谢产物浓度的增加SOD酶活力增加。SOD是植物体中清除自由基最重要的防御酶,是植物防御活性氧毒害的第一道防线,能有效清除线虫侵染植株体内产生的自由基[11]。说明Sr18代谢产物可以促使植物体内SOD酶活力上升,增强植株清除活性氧的能力。
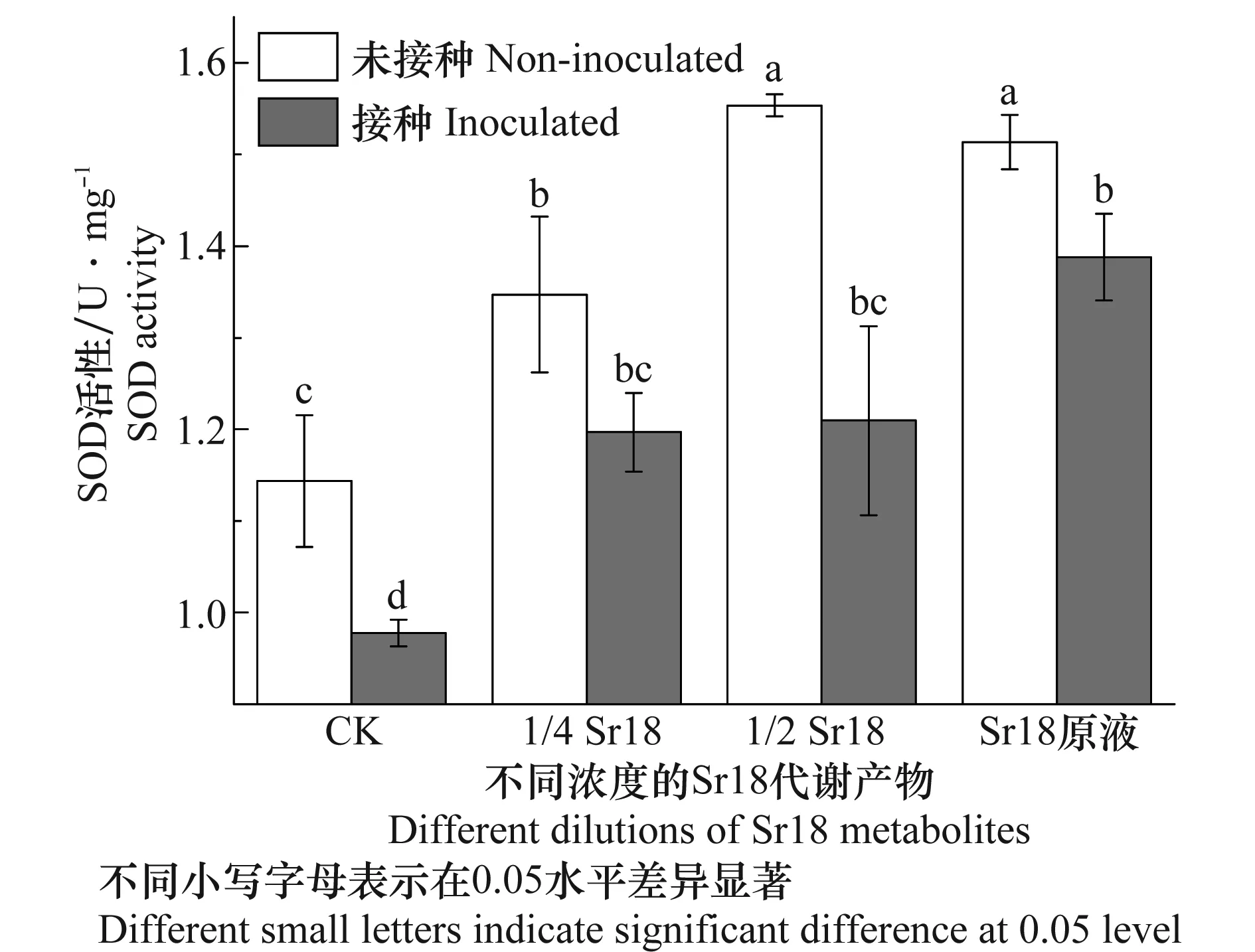
图2 不同浓度的Sr18代谢产物处理后南方根结线虫胁迫下黄瓜植株SOD酶活力的测定Fig.2 Tests on SOD activity in cucumber treated with different dilutions of Sr18 metabolites under Meloidogyne incognita stress
2.3Sr18代谢产物对黄瓜植株过氧化氢酶(CAT)活性的影响
Sr18代谢产物处理根结线虫胁迫下的黄瓜植株CAT酶活力的测定结果见图3。未接种线虫时,随着Sr18代谢产物浓度的增加CAT活性也增加,当施加原液时,植株体内的CAT活性比清水对照高21.6%。当接种线虫后,黄瓜植株体内的CAT活性明显减小。而施加Sr18代谢产物后,线虫侵染的黄瓜植株叶片CAT活性呈现上升的趋势,其中施加原液的CAT活性比清水对照增加了63%。CAT对植物防御活性氧毒害有重要的作用,能够及时清除线虫胁迫产生的过氧化氢等物质[18]。因此,Sr18代谢产物可以通过提高植株的CAT活性,减轻过氧化氢对植株的毒害。
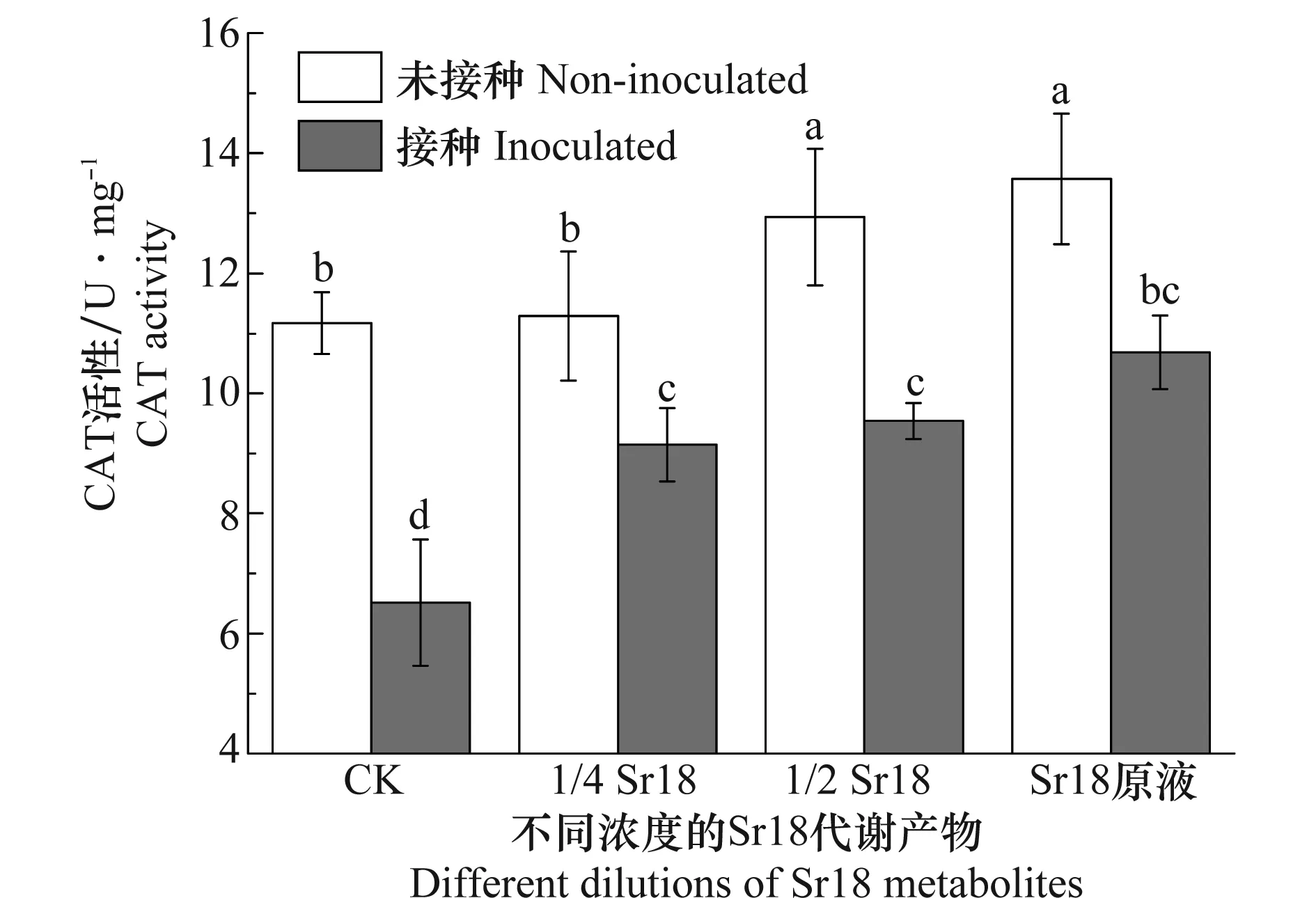
图3 不同浓度的Sr18代谢产物处理后南方根结线虫胁迫下黄瓜植株CAT酶活力的测定Fig.3 Tests on CAT activity in cucumber treated with different dilutions of Sr18 metabolites under Meloidogyne incognita stress
2.4Sr18代谢产物对黄瓜植株过氧化物酶(POD)活性影响
Sr18代谢产物处理根结线虫胁迫下的黄瓜植株POD活性测定见图4。未接种线虫时,施加2倍稀释液能显著提高植株的POD活性。施加原液时,植株体内的POD活性比清水对照高出50.6%。当受到线虫胁迫后,POD活性明显减小。而施加不同浓度的Sr18代谢产物,又能够显著提高黄瓜植株叶片内POD活性,且随施加浓度的增加呈现上升的趋势。因此,线虫的胁迫能使黄瓜植株叶片的POD酶活性降低,不同浓度的Sr18代谢产物却能有效增加植株叶片体内POD的活性。POD同SOD、CAT相似,是细胞内重要的活性氧清除剂[19],能够及时清除线虫侵染的植物体内的过氧化氢。除此之外,POD在植物细胞壁成熟过程的木质素合成中还有重要的作用[20]。

图4 不同浓度的Sr18代谢产物处理后南方根结线虫胁迫下黄瓜植株POD酶活力的测定Fig.4 Tests on POD activity in cucumber treated with different dilutions of Sr18 metabolites under Meloidogyne incognita stress
2.5Sr18代谢产物对黄瓜植株苯丙氨酸解氨酶(PAL)浓度的影响
Sr18代谢产物处理根结线虫胁迫下的黄瓜植株叶片PAL酶浓度的测定见图5。未接种线虫时,施加不同浓度的Sr18后,黄瓜叶片的PAL酶浓度明显升高。在4倍稀释液下为最大值,相比清水对照高86.8%。当黄瓜植株受到线虫胁迫后,PAL酶浓度测定值比清水对照下降了21.3%。而线虫胁迫下用不同浓度Sr18代谢产物处理,相比线虫对照PAL酶浓度明显升高,当用原液的4倍稀释液时,PAL酶浓度达到最高值。因此,线虫的胁迫能降低植株叶片PAL酶浓度,但施加不同浓度Sr18代谢产物能缓解线虫对植株的PAL的影响,提高叶片PAL浓度。PAL与细胞壁成熟过程的木质素合成相关[21],PAL的增加有利于促进木质素的合成,形成细胞屏障物质抵御线虫的侵害。
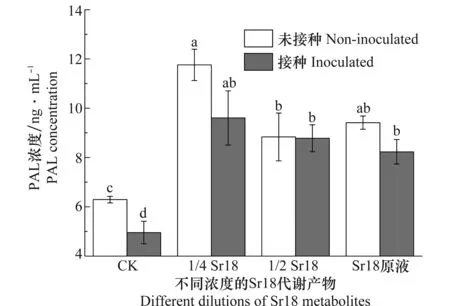
图5 不同浓度的Sr18代谢产物处理后南方根结线虫胁迫下黄瓜植株PAL酶浓度的测定Fig.5 Tests on PAL concentration in cucumber treated with different dilutions of Sr18 metabolites under Meloidogyne incognita stress
2.6Sr18代谢产物对黄瓜植株多酚氧化酶(PPO)浓度的影响
Sr18代谢产物处理根结线虫胁迫下的黄瓜植株叶片PPO的测定见图6。未接种线虫时,施加Sr18代谢产物,黄瓜叶片PPO酶浓度明显升高,且随着Sr18代谢产物浓度的增加,PPO浓度逐步增加。当用Sr18代谢产物处理后,黄瓜叶片PPO酶浓度测定值与清水对照相比增加了48.7%。当黄瓜植株受到线虫胁迫后,PPO酶浓度明显下降。而线虫胁迫条件下,用不同浓度Sr18代谢产物处理黄瓜植株,PPO酶浓度与线虫对照相比显著增加。因此,线虫的胁迫,使黄瓜植株体内的PPO酶浓度降低,而施加不同浓度的Sr18代谢产物,能有效提高植株叶片内PPO的浓度,PPO是酚类物质氧化的关键酶[22],能保护植物免受酚类物质的毒害,抑制线虫对植物的侵害作用。
3 讨论
植物遭受侵害时,病原体及其致病物不仅可导致植物组织和细胞的损伤,还可破坏或降低植物体内的一系列保护反应;而植物体内也通常会通过发生一系列生理生化反应来增加自身的抵御能力,其中诱导相关保护酶活性发挥了重要作用[10,23]。
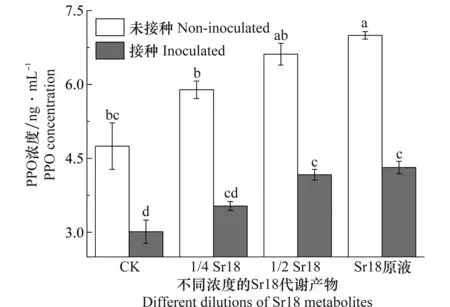
图6 不同浓度的Sr18代谢产物处理后黄瓜植株PPO酶浓度的测定Fig.6 Tests on PPO concentration in cucumber treated with different dilutions of Sr18 metabolites under Meloidogyne incognita stress
本试验结果表明:线虫侵染黄瓜植株以后,黄瓜叶片内的抗氧化酶SOD、POD和CAT活性减弱,而Sr18代谢产物能够使线虫胁迫下黄瓜叶片SOD、POD和CAT活性增强。PPO和PAL浓度的测定也证实了抗氧化酶测定的结果。许多研究表明,植物在逆境如病害条件下,活性氧代谢失衡,产生的过氧化物能破坏细胞膜结构,而通过提高黄瓜叶片中的SOD、POD和CAT活性,可降低活性氧对植物的伤害。因为SOD、POD以及CAT是细胞内重要的活性氧清除剂,能及时清除由于线虫侵染植物体产生的自由基,维持植物体内活性氧正常水平,从而达到保护植物的目的[11, 18-19]。PAL是植物木质素合成的关键酶,其浓度增加,能够促进植物合成木质素,加强植物细胞屏障物质合成,强化植物细胞壁,阻碍或者延迟线虫的入侵[21]。PPO是酚类物质氧化的关键酶,较高的浓度能保护植物免受酚类物质的毒害,抑制线虫对植物的侵害[22]。这一结果与他人对黄瓜抗性方面的研究结果具有一致性。邹芳斌等人的研究发现,黄瓜感染尖孢镰刀菌(Fusariumoxysporumf.sp.cucumerinumOwen)患枯萎病后,抗性品系的黄瓜叶片保护酶(SOD、POD、PPO、PAL)活性明显高于感病品系,这几种酶活性的提高与黄瓜抗性呈显著相关性[24];王安乐等人也发现黄瓜感染霜霉病菌[Pseudoperonosporacubensis(Berk.etCurt) Rostov]后,抗病材料的SOD、POD、PAL酶活性也明显高于感病材料[25];姜玉萍等人研究白粉虱(Trialeurodesvaporariorum)对黄瓜的影响时发现,白粉虱的胁迫能显著提高黄瓜叶片中抗氧化酶SOD、POD活性[26]。根结线虫是植物病原物之一,当黄瓜根结线虫侵染不同砧木后,黄瓜叶片内的SOD和CAT活性显著下降,但嫁接苗叶片的保护酶SOD和CAT活性降低的幅度显著小于自根苗[27]。此外,类似的结果在真菌代谢物和拮抗菌的研究中也有发现,如:香菇多糖浸种后,可以提高黄瓜植株体内POD、PPO和PAL活性[28];同样,在接种拮抗菌(DS-1、SG-126、Q-2)的患枯萎病的黄瓜叶片内也观察到保护酶(SOD、CAT、PPO和PAL)活性上升的现象[17]。
综上所述,Sr18代谢产物可以提高抗氧化酶SOD、POD和CAT的活性,提升保护酶PPO和PAL的含量以抵抗根结线虫对黄瓜植株的伤害,从而增强黄瓜植株对线虫的抗性,提高黄瓜的产量和品质。
[1]Jones J T, Haegeman A, Danchin E G J, et al. Top 10 plant-parasitic nematodes in molecular plant pathology [J]. Molecular Plant Pathology, 2013, 14(9): 946-961.
[2]Dubreuil G, Deleury E, Magliano M, et al. Peroxiredoxins from the plant parasitic root-knot nematode,Meloidogyneincognita, are requires for successful development within the host [J]. International Journal for Parasitology, 2011, 41: 385-396.
[3]张晓歌, 王海宽, 王建玲, 等. Sr18菌杀线代谢产物30 L罐发酵放大条件的优化[J]. 天津师范大学学报(自然科学版), 2008, 28(2): 1-4.
[4]孙建华. 土壤真菌培养物对松材线虫生长和繁殖抑制作用的研究[J]. 南开大学学报(自然科学版), 1997, 30(3): 82-87.
[5]李平, 田阳, 孙建华, 等. Sr18代谢产物的杀线虫谱研究[J]. 中国农学通报, 2012, 28(18): 238-245.
[6]Sun Jianhua, Wang Gaofeng, Wang Haikuan, et al. The efficacy of nematicidal strainSyncephalastrumracemosum[J]. Annals of Microbiology, 2008, 58(3): 369-373.
[7]王海波, 黄雪梅, 张昭其. 植物逆境胁迫中活性氧和钙信号的关系[J]. 北方园艺, 2010(22): 189-194.
[8]王娟, 李德全. 逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J]. 植物学通报, 2001, 18(4): 459-465.
[9]Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction [J]. Annual Review of Plant Biology, 2004, 55: 373-399.
[10]贺文婷, 彭德良. 植物对线虫胁迫的生理生化相应机制[J]. 植物保护, 2007, 33(2): 11-14.
[11]窦俊辉, 喻树迅, 范术丽, 等. SOD与植物胁迫抗性[J]. 分子植物育种, 2010, 8(2): 359-364.
[12]叶德友, 钱春桃, 王暄. 南方根结线虫侵染对黄瓜植株生长和抗氧化系统的影响[J]. 植物保护学报, 2012, 39(4): 321-326.
[13]李海燕, 段玉玺, 陈丽杰, 等. 大豆胞囊线虫3号生理小种胁迫下不同抗性大豆品种的生化响应[J]. 大豆科学, 2014, 33(5): 783-786.
[14]孙建华, 齐军山, 冯欣, 等. Sr18生物杀线虫制剂防治黄瓜根结线虫病研究[J]. 华北农学报, 2005, 20(4): 74-78.
[15]刘屾, 冯欣, 黄文坤, 等. Sr18生物杀线剂对蔬菜根结线虫的防治作用[M]∥中国线虫学研究(第五卷),北京:中国农业科学技术出版社,2014: 19-24.
[16]刘丽, 颜世翠, 姚良同, 等. 一种番茄根结线虫人工培养和保存的优化方法[J]. 山东农业科学, 2012, 44(11): 117-120.
[17]张璐, 杜秉海, 魏珉, 等. 黄瓜枯萎病拮抗菌的生防效果及其对植株生长代谢的影响[J].山东农业科学, 2007(4): 89-91.
[18]Sofo A, Scopa A, Nuzzaci M, et al. Ascorbate peroxidase and catalase activities and their genetic regulation in plants subjected to drought and salinity stresses [J]. International Journal of Molecular Sciences, 2015, 16(6): 13561-13578.
[19]Mandal S, Mallick N, Mitra A. Salicylic acid-induced resistance toFusariumoxysporumf.sp.lycopersici[J]. Plant Physiology and Biochemistry, 2009, 47: 642-649.
[20]刘小阳, 李玲, 高贵珍, 等. 光照对砀山酥梨果实发育过程中POD、PAL、PPO酶活性的影响研究[J]. 激光生物学报, 2008, 17(3): 295-298.
[21]Ritter H, Schulz G E. Structural basis for the entrance into the phenylpropanoid metabolism catalyzed by phenylalanine ammonia-lyase [J]. Plant Cell, 2004, 16: 3426-3436.
[22]Boeckx T, Winters A L, Webb K J, et al. Polyphenol oxidase in leaves: is there any significance to the chloroplastic localization?[J]. Journal of Experiment Botany, 2015, 66(12): 3571-3579.
[23]田世平, 产祝龙. 诱导抗性在果蔬采后病害防治中的研究与应用[J]. 植物病理学报, 2004, 34(5): 385-394.
[24]邹芳斌, 司龙亭, 李新, 等. 黄瓜枯萎病抗性与防御系统几种酶活性关系的研究[J]. 华北农学报, 2008, 23(3): 181-184.
[25]王安乐, 邓稳桥, 朱海泉, 等. 黄瓜感染霜霉病菌后关键酶活性的变化[J]. 长江蔬菜, 2008(7b): 52-54.
[26]姜玉萍, 丁小涛, 张兆辉, 等. 白粉虱侵害对黄瓜光合作用和抗氧化酶活性的影响[J]. 上海农业学报, 2015, 31(5): 87-91.
[27]张自坤, 刘士琦, 张强, 等. 根结线虫对不同砧木黄瓜嫁接苗生理生化指标的影响[J]. 山东农业科学, 2009(7): 82-86.
[28]李鹏鹏, 王杰, 乔康, 等. 香菇多糖浸种对黄瓜幼苗抗霜霉病及生理特性的影响[J]. 农药, 2014, 53(4): 287-289.
(责任编辑:田喆)
The effects of Syncephalastrum racemosum Sr18 metabolites on cucumber protective enzymes under root-knot nematode stress
Ren Yi1,Wang Xiuqing1,Meng Qingheng1,Sun Jianhua1,Feng Xin1,Huang Wenkun2,Peng Deliang2
(1. Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Sciences, Tianjin Normal University, Tianjin300387, China;2.State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing100193, China)
To understand the action mechanism ofSyncephalastrumracemosumSr18 metabolites to cucumber under the root-knot nematodeMeloidogyneincognitastress,the effects of Sr18 metabolites on five protective enzymes (SOD, POD, CAT, PAL, PPO) of cucumbers with/without seedling inoculation by nematodes were investigated in greenhouses. The results showed that higher levels of SOD, POD, CAT activities and PPO, PAL contents were observed in the plants pretreated with Sr18 and inoculated with nematodes than that in non-treated control, while lower activities of SOD, POD and CAT and lower contents of PPO and PAL in leaves of cucumber were observed in the plants inoculated with nematodes than that in non-inoculated control. Sr18 metabolites induced the upregulated activity of antioxidative enzymes in cucumber leaves and enhanced the resistance level of cucumber against the root-knot nematodeM.incognita.
Syncephalastrumracemosum;root-knot nematode;protective enzymes;defence mechanism
2016-01-29
2016-04-22
国家自然科学基金(31272019, 31272022);国家科技支撑计划(2012BAD19B06)
E-mail:fengxin216@163.com
Q819
A
10.3969/j.issn.0529-1542.2016.04.015
