高分辨磁共振成像在内囊纹状体梗死患者的诊断价值
2016-09-14高根善查云飞卢祖能
高根善 查云飞 卢祖能
高分辨磁共振成像在内囊纹状体梗死患者的诊断价值
高根善查云飞卢祖能
目的探讨高分辨磁共振成像(high resolution magnetic resonance imaging, HRMRI)对内囊纹状体梗死(striatocapsular infarction)的诊断价值。方法收集经磁共振证实的内囊纹状体梗死患者26例,分别行磁共振血管成像(magnetic resonance angiography, MRA)和HRMRI 检查,利用HRMRI分析动脉粥样硬化斑块在大脑中动脉(middle cerebral artery, MCA)的分布位置,比较MRA 与HRMRI 识别MCA狭窄能力的差异。结果MRA检查显示MCA狭窄者10例(38. 5%),HRMRI 显示MCA狭窄者20例(76.9%)(χ2=4.875,P=0.027)。HRMRI显示MCA狭窄的20例患者,其粥样硬化斑块位于血管管壁的下侧12例(60.0%)、腹侧6例(30.0%)、上侧2 例(10.0%)、背侧0例(χ2=7.600,P=0.022)。结论HRMRI在诊断MCA狭窄方面可信度较高;内囊纹状体梗死患者MCA粥样硬化斑块大多分布在穿支动脉开口对侧。
内囊纹状体梗死大脑中动脉磁共振血管成像高分辨磁共振成像
内囊纹状体梗死(striatocapsular infarction)是由于大脑中动脉(middle cerebral artery, MCA)动脉主干发出的分支豆纹动脉闭塞,导致内囊前肢、壳核和尾状核头上部梗死[1]。内囊纹状体梗死主要由MCA粥样硬化斑块引起穿支动脉狭窄或闭塞而导致相应部位发生梗死,亦可以由穿支动脉玻璃样变或纤维素样坏死等穿支动脉疾病所引起。传统的血管影像学检查手段如磁共振血管成像(magnetic resonance angiography, MRA)可用于诊断MCA主干的血管管腔狭窄或闭塞,但不能显示血管管壁的斑块,且检出血管狭窄的比例低。因此,对于MRA显示血管管腔未见狭窄或轻度狭窄的内囊纹状体梗死患者,临床医师并不能明确其发病机制。目前,高分辨磁共振成像( high-resolution magnetic resonance imaging, HRMRI)作为唯一可以实现活体内动脉管壁结构分析的无创技术,已被广泛用于诊断和评估颅内动脉粥样硬化斑块[2]。本研究采用HRMRI观察内囊纹状体梗死患者MCA狭窄情况,并观察动脉粥样硬化斑块在MCA的分布部位,以进一步明确内囊纹状体梗死患者可能的发病机制。
1 资料与方法
1.1入选排除标准
连续纳入2015 年5 月~2016 年1月入住武汉大学人民医院神经内科的急性缺血性脑卒中患者,符合中华医学会《中国急性缺血性脑卒中诊治指南》标准[3]。入选标准:①颅脑磁共振弥散加权像(diffusion weighted imaging, DWI)证实梗死部位在内囊前肢、壳核和尾状核头上部,梗死灶在头部轴位DWI 影像上≥3 个层面,梗死灶直径≥30mm[1],且为责任病灶;②所有患者均行心电图、超声心动图检查以排除心源性栓子来源可能,行TCD检查排除支配内囊纹状体梗死病灶区的主干动脉严重狭窄(>50%)或闭塞;③至少存在一项脑血管病高危因素如高血压病、糖尿病、高脂血症、高同型半胱氨酸血症和吸烟等;④所有患者均行MRA和HRMRI检查。
排除标准:①病灶同侧有颈动脉血管狭窄或闭塞;②具有非动脉粥样硬化性狭窄病因如烟雾病、颅内动脉夹层、肌纤维发育不良、颅内动脉炎等;③合并肺炎、严重肝肾功能疾病、风湿免疫性疾病、肿瘤放疗等;④影像学资料不完善;⑤非孤立性豆纹动脉供血区梗死,存在其他部位新发梗死灶。
所有患者均在检查之前签署知情同意书。该研究项目已通过武汉大学人民医院伦理委员会审查。
1.2方法
1.2.1相关指标收集详细记载患者的年龄、性别,高血压病、糖尿病、高脂血症、脑卒中等病史,对其危险因素分层。所有患者均行血、小便、大便常规、肝肾功能、血糖、低密度脂蛋白、电解质、同型半胱氨酸水平等常规检查,并完善抗核抗体全套、凝血谱、梅毒血清学试验、艾滋病抗体检测等实验室检查,以排除其他病因导致的脑梗死。
1.2.2影像学检查所有患者均在武汉大学人民医院完成相关检查,均行头颅CT 检查排除脑出血,然后行颅脑MRI 常规序列检查,成像序列包括T1加权成像(T1-weighted imaging, T1WI)、T2加权成像(T2-weighted imaging, T2WI)和DWI。在确定梗死部位后行颅内动脉斑块成像,主要由三维时间飞跃法磁共振血管成像(3D time-of-flight MR angiography, 3D TOF MRA)和HRMRI。使用3.0T磁共振仪(Discovery MR750 Plus, GE Healthcare, USA),使用8 通道头颅线圈,首先完成常规3D TOF MRA 检查,然后以3D TOF MRA 定位,结合MRA 重建图像和原始图像,做垂直于MCA长轴的高分辨T2WI 断面成像。参数:层厚2 mm,间距0 mm,加压脂技术,采集次数4,视野(field of view, FOV)130 mm,矩阵384 × 256,使用零充填(zero-fill interpolation, ZIP)512 技术,共扫描12层。FSE T2WI序列TR 3400 ms,TE 56 ms,成像时间2 min 37 s。所有图像传入ADW4.6工作站(GE Healthcare)分析。
1.2.3图像分析MRA图像参照文献标准评估MCA有无狭窄[4];HRMRI图像由两位经验丰富的医师在工作站上通过盲法共同评价,所有HRMRI评估均在T2WI断面图像上进行。纳入本研究图像标准:梗死灶、血管管腔和外壁同时清晰显示。评价项目包括管壁增厚情况,有无明确的斑块以及斑块位置。
1.2.4统计学处理
采用SPSS 20. 0统计软件。计数资料采用百分比表示,组间比较采用χ2检验。P<0. 05为差异具有统计学意义。
2 结 果
2.1临床相关指标
共纳入26例患者,其中男18例,女8 例,男女比例为2.25∶1,年龄41~75 岁,平均年龄(56.5 ±14.2)岁。既往有高血压病16例(61.5%),糖尿病10例(38.5%),高脂血症8例(30.8%),吸烟10例(38.5%)。合并两种及以上危险因素者12例(46.2%)。所有患者临床相关指标见表1。
2.2MCA狭窄评估及粥样硬化斑块分布
26 例患者中MRA检测到MCA狭窄10例(38. 5%),而HRMRI检测到MCA狭窄20例(76.9%)(χ2=4.875,P=0.027)。
MRA检测到MCA狭窄的10例患者中HRMRI均显示狭窄(图1~2);MRA未检测到MCA狭窄的16例患者中HRMRI显示狭窄者10例(图3)。
HRMRI显示MCA狭窄的20例内囊纹状体梗死患者,取垂直于MCA长轴的断面图像,确定MCA管腔最狭窄层面,在此层面进行斑块分布分析。将其MCA管腔均分为4个象限,对斑块在4个象限分布情况进行统计,其动脉粥样硬化斑块分布位于下侧12例(60.0%)、腹侧6例(30.0%)、上侧2 例(10.0%)、背侧0例(χ2=7.600,P=0.022)。斑块分布分别见于图1~3。

表1 26例内囊纹状体梗死患者临床相关指标
注:F=female,女性;M=male,男性;NIHSS=National Institutes of Health Stroke Scale为美国国立卫生研究院卒中量表
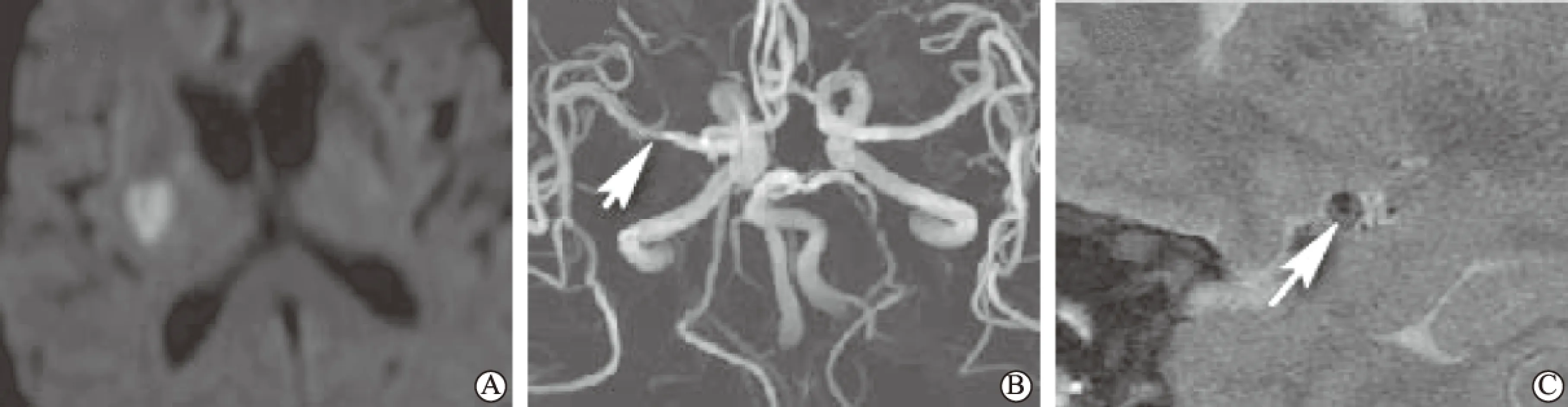
图1内囊纹状体梗死患者MRA 和HRMRI均显示MCA狭窄-管壁下侧斑块A为DWI显示右侧内囊纹状体高信号;B为MRA显示右侧MCA M1段轻度狭窄(短箭头所示);C为HRMRI也显示狭窄,并可见动脉粥样硬化斑块位于管壁下侧(长箭头所示)

图2内囊纹状体梗死患者MRA 和HRMRI均显示MCA狭窄-管壁腹侧斑块A为DWI显示右侧内囊纹状体高信号;B为MRA显示右侧MCA M1段轻度狭窄(短箭头所示);C为HRMRI也显示狭窄,并可见动脉粥样硬化斑块位于管壁腹侧(长箭头所示)

图3内囊纹状体梗死患者仅HRMRI显示MCA狭窄-管壁上侧斑块A为DWI显示左侧内囊纹状体高信号;B为MRA未显示左侧MCA狭窄;C为HRMRI显示MCA轻度狭窄,并可见动脉粥样硬化斑块位于管壁上侧(箭头所示)
3 讨 论
高山等[5]于2011年提出了中国缺血性脑卒中分型(Chinese ischemic stroke subclassification, CISS),对缺血性脑卒中的病因进行了细化,并进一步探讨颅、内外大动脉粥样硬化导致脑卒中的病理生理机制,包括载体动脉(斑块或血栓)阻塞穿支动脉、动脉到动脉栓塞、低灌注/栓子清除下降以及混合机制。其中在载体动脉斑块阻塞穿支动脉的发病机制方面HRMRI的应用为其提供了理论依据。因此,20年前由Caplan教授提出的穿支动脉粥样硬化性疾病(branch atheromatous disease, BAD)受到了更多关注。其中Lee等[6]认为内囊纹状体梗死可能是MCA局部形成的动脉粥样硬化斑块堵塞了多个垂直发出的豆纹动脉开口,梗死灶体积明显大于单一深穿支闭塞引起的腔隙性脑梗死。
内囊纹状体梗死在常规磁共振扫描图像上可以看到长T1长T2信号,DWI为高信号,ADC值减低,梗死病灶在头部轴位MRI 影像上≥3 个层面,梗死灶直径≥30 mm。其临床表现多样,包括经典腔隙综合征、早期神经功能恶化(early neurological deterioration, END)。目前,END诊断标准国内外亦无统一定论,主要依据早期症状、体征加重、美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale , NIHSS)评分增加来诊断[1]。BAD最主要的特点是急性期症状进行性加重,尤其以运动障碍为主[1]。Yamamoto等[7]研究95例豆纹动脉供血区BAD患者,其中运动进展者占40%,非BAD进展者占11.3%;后续有研究表明,与腔隙性脑梗死相比,BAD更容易导致END[8]。与以往的研究相比,本研究发现神经功能恶化者仅有5例,比例相对较低,推测可能原因为本中心常规采用他汀稳定斑块等脑卒中二级预防治疗,尤其是HRMRI提示易损斑块存在时采用了强化他汀治疗,故尚待大样本研究来证实。
内囊纹状体梗死与高血压导致的脂质透明变性不同,其发病基础为动脉粥样硬化,病理机制分为主干动脉斑块堵塞分支动脉入口、主干动脉斑块延伸至分支动脉起始部、分支动脉入口处斑块等三种[4]。早在1979年Fisher[9]对10例内囊梗死患者进行病理学研究时发现,部分患者为斑块阻塞豆纹动脉近端而导致内囊梗死。在分支动脉入口处出现狭窄或闭塞时,一旦主干动脉出现灌注量减少,将导致穿支动脉供血区缺血。Yamamoto等[10]对26例内囊纹状体梗死患者行CT灌注检查时发现,梗死区域脑血流量下降者约占一半,且发生END,表明低灌注可能是其主要发病机制。此外,微栓子脱落机制也逐渐被国内外学者所接受,是由于栓子进入穿支动脉而引起缺血性脑卒中[1]。还有研究表明,BAD出现神经功能恶化的机制可能为在低灌注基础上缺血半暗带转化为梗死灶,从而出现神经功能恶化[11];高血压病、糖尿病是BAD的危险因素,其中炎性因子是促进神经功能恶化的一个因素[2,10]。Klein认为斑块从穿支入口部位向穿支近端部位发展或斑块破裂,可造成分支阻塞而促使梗死灶扩大[2]。
本研究26 例内囊纹状体梗死患者中MRA显示MCA狭窄者10例,而HRMRI 显示MCA狭窄者20例。此外,HRMRI可清晰地显示MCA管壁结构,并且能够发现MRA不能明确的血管狭窄。有时MRA显示为轻度狭窄的血管,通过HRMRI检查能够清晰地显示管壁斑块,血管表现为重度狭窄。Tatsumi等[12]病理研究也证实MRA显示为正常的MCA已发生了中、重度动脉粥样硬化改变,由主干血管向穿支动脉延伸的结合部位的斑块造成起始部狭窄,导致内囊纹状体梗死。本研究通过HRMRI图像分析发现,MCA粥样硬化斑块以偏心型斑块为主,斑块最常见的部位为下侧,其次为腹侧,与以往研究不同。Xu等[13]采用HRMRI研究MCA斑块的分布,结果显示40.6%的斑块位于腹侧,23.7%位于上侧,21.7%位于下侧。 Zhu等[14]研究发现44例患者中10例(22.7%)患者斑块位于上侧,5例(11.4%)斑块位于背侧,13例(29.5%)斑块位于下侧,16例(36;.4%)斑块位于腹侧。解剖研究发现,大部分穿支起源于MCA的上侧及背侧[12]。本研究中神经功能恶化的5例患者血管壁均有斑块,推测可能是斑块累及邻近穿支,梗死面积增加而导致症状加重,其中3例患者无高血压病史,不排除低灌注机制参与脑卒中进展可能。
随着影像学技术的发展,HRMRI被越来越多的临床医师所认识,并将其应用于患者血管壁斑块检查。内囊纹状体梗死由穿支动脉起始处动脉粥样硬化引起,而穿支动脉本身发生玻璃样变性或纤维素样坏死时亦表现为小梗死,其临床表现难以区别,但临床预后较好,几乎不会导致死亡,尸检鲜见。但目前HRMRI仅能观察到载体动脉(MCA,基底动脉)的管壁情况,能够区分大动脉粥样硬化性疾病与穿支动脉疾病;尚不能观察穿支动脉近端的斑块以及无法辨别穿支动脉粥样硬化与动脉纤维玻璃变;不能明确发生在穿支动脉病变的两种机制(近端动脉粥样硬化与远端纤维玻璃样变)。
本研究存在一定局限性。首先,样本量较小,需要更多样本来证实试验结果,但该试验对临床却有较大帮助,对于颅内血管MRA 显示正常或可疑狭窄,斑块成像显示有明确的斑块存在,对诊断动脉粥样硬化有较为重要的参考价值;其次,缺乏病理标本验证与斑块的相关性;再者,其颅内动脉血管走形迂曲的解剖特性,使得断面成像不能完全垂直血管长轴,可能导致血管狭窄判断的准确率下降;最后,需要更进一步试验明确斑块存在位置与脑卒中发生和脑卒中亚型之间的关系以及对技术改进,应用增强技术对斑块稳定性进行研究,并明确和验证Kim等[15]研究提出斑块强化与脑卒中恶化相关,并需要随访来明确斑块存在位置与脑卒中再发和脑卒中恶化的相关性,给予针对性二级预防治疗。
HRMRI作为目前唯一可以实现活体颅内动脉管壁结构分析的无创技术,能够更加准确地识别MCA狭窄,并清楚显示MCA粥样硬化斑块的形态和分布,从而判断内囊纹状体梗死的病因和发病机制。针对脑卒中二级预防治疗,真正做到个性化,确定脑卒中亚型、风险分级,指导血管介入治疗和监测治疗效果。尽管存在上述诸多问题,HRMRI对于颅内动脉斑块成像具有较好的前景。
[1]Petrone L,Nannoni S,Del Bene A,et al. Branch atheromatous disease: a clinically meaningful,yet unproven concept[J].Cerebrovasc Dis,2016,41(1-2): 87-95.
[2]Klein IF,Lavall e PC,Mazighi M,et al. Basilar artery atherosclerotic plaques in paramedian and lacunar pontine infarctions: a high-resolution MRI study[J]. Stroke,2010,41(7): 1405-1409.
[3]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中华神经科杂志,2010,43(2): 146-152.
[4]Lee WJ, Choi HS, Jang J, et al. Non-stenotic intracranial arteries have atherosclerotic changes in acute ischemic stroke patients: a 3T MRI study[J].Neuroradiology,2015,57(10):1007-1013.
[5]Gao S, Wang YJ, Xu AD,et al. Chinese ischemic stroke subclassification[J].Front Neurol,2011,2: 6.
[6]Lee KB,Oh HG,Roh H,et al. Can we discriminate stroke mechanisms by analyzing the infarct patterns in the striatocapsular region[J]? Eur neurol,2008,60(2): 79-84.
[7]Yamamoto Y. Concept,pathophysiology and treatment for branch atheromatous disease[J].Rinsho Shinkeigaku,2014,54(4): 289-297.
[8]Jeong HG,Kim BJ,Yang MH,Neuroimaging markers for early neurologic deterioration in single small subcorticai infarction[J]. Stroke,2015,46(3): 687-691.
[9]Fisher CM. Capsular infarcts: the underlying vascular lesions [J]. Arch Neurol,1979,36(2): 65.
[10]Yamamoto Y,Ohara T,Hamanaka M,et al. Characteristics of intracranial branch atheromatous disease and its association with progressive motor deficits[J]. J Neurol Sci,2011,304: 78-82.
[11]Terborg C,Gora F,Weiller C,et al. Reduced vasomotor reactivity in cerebral microangiopathy: a study with near-infrared spectroscopy and transcranial Doppler sonography[J]. Stroke,2000,31(4): 924-929.
[12]Tatsumi S,Yamamoto T. An autopsied case of an apparent pontine branch atheromatous disease[J]. Eur Neurol,2010,63( 3): 184-185.
[13]Xu WH,Li ML,Gao S,et al. In vivo high-resolution MR imaging of symptomatic and asymptomatic middle cerebral artery atherosclerotic stenosis[J]. Atherosclerosis,2010,212( 2): 507-511.
[14]Zhu XJ,Du B,Lou X,et al. Morphologic characteristics of atherosclerotic middle cerebral arteries on 3T high-resolution MRI[J]. AJNR Am J Neuroradiol,2013,34(9): 1717-1722.
[15]Kim JM,Jung KH,Sohn CH,et al. Intracranial plaque enhancement from high resolution vessel wall magnetic resonance imaging predicts stroke recurrence[J].Int J Stroke,2016,11(2): 171-179.
(2016-00-00收稿 2016-00-00修回)
Diagnosis significance of high-resolution magnetic resonance imaging in patients with striatocapsular infarction
GaoGenshan,ZhaYunfei,LuZuneng.
DepartmentofNeurology,RenminHospitalofWuhanUniversity,Wuhan430060
ObjectiveTo investigate the diagnosis value of high-resolution magnetic resonance imaging (HRMRI) in striatocapsular infarction.MethodsTwenty-six patients with striatocapsular infarction conformed by MRI were recruited and underwent magnetic resonance angiography (MRA) and HRMRI respectively. The distributions of atherosclerotic plaque in the middle cerebral artery (MCA) were assessed by HRMRI, and differences of the ability to evaluate MCA stenosis between MRA and HRMRI were compared.ResultsMCA stenosis were detected in 20 patients by HRMRI (76.9%), compared with 10 patients by MRA imaging (38.5%), there were significant statistically differences (χ2=4.875,P=0.027) between them. In the 20 patients with MCA stenosis revealed by HRMRI, there were 12 patients (60.0%) whose plaques located at the vascular inferior wall, 6 patients at the ventral wall (30.0%) and 2 patients at the superior wall (10.0%) (χ2=7.600,P=0.022).ConclusionHRMRI is more accurate to detect MCA stenosis compared with MRA imaging. MCA plaques tend to locate opposite to the orifices of penetrating arterial branches in patients with striatocapsular infarction.
Striatocapsular infarctionMiddle cerebral arteryMagnetic resonance angiographyHigh-resolution magnetic resonance imaging
湖北省卫计委重点项目(WJ2015MA007);武汉市科技局2015年应用基础研究计划项目(2015060101010047)
430060武汉大学人民医院神经内科[高根善卢祖能(通信作者)],放射科(查云飞)
R
A
1007-0478(2016)04-0237-06
10.3969/j.issn.1007-0478.2016.04.005
