5-氨基酮戊酸光动力疗法对不同疾病来源的耐甲氧西林金黄色葡萄球菌的体外杀伤作用
2016-09-13赵可庆杨晨吴旸郭丽敏刘华勇吉建陈小英郑春泉
赵可庆,杨晨,吴旸,郭丽敏,刘华勇,吉建,陈小英,郑春泉
1. 复旦大学附属眼耳鼻喉科医院耳鼻咽喉科,上海市耳鼻咽喉科临床重点学科,上海 200031; 2. 上海交通大学医学院附属瑞金医院耳鼻咽喉科,上海 200025; 3. 复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032; 4. 复旦大学附属眼耳鼻喉科医院检验科,上海 200031; 5. 上海交通大学医学院附属瑞金医院皮肤科,上海 200025
·论著·
5-氨基酮戊酸光动力疗法对不同疾病来源的耐甲氧西林金黄色葡萄球菌的体外杀伤作用
赵可庆1,*,杨晨1,2,*,吴旸3,郭丽敏1,刘华勇3,吉建4,陈小英5,郑春泉1
1. 复旦大学附属眼耳鼻喉科医院耳鼻咽喉科,上海市耳鼻咽喉科临床重点学科,上海 200031; 2. 上海交通大学医学院附属瑞金医院耳鼻咽喉科,上海 200025; 3. 复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032; 4. 复旦大学附属眼耳鼻喉科医院检验科,上海 200031; 5. 上海交通大学医学院附属瑞金医院皮肤科,上海 200025
光动力疗法(photodynamic therapy,PDT)利用光敏剂与光源反应后产生的活性氧,破坏细菌组分,进而致细菌死亡。其多靶位杀伤特性在治疗耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)感染方面有应用前景,但相关研究尚处于起步阶段。本研究MRSA菌株取自烧伤、急性咽炎、鼻窦炎和肺炎4类临床常见MRSA感染性疾病患者,使用5-氨基酮戊酸(5-aminolevulinic acid,ALA)光敏剂、发光二极管光源,于体外检测ALA介导的PDT(ALA-PDT)对MRSA菌株的杀伤作用。结果显示,经5 mmol/L ALA孵育1 h后,给予360 J/cm2强光〔(633±10)nm〕照射1 h,ALA-PDT对MRSA菌株具有1.80 log10cfu的有效杀伤作用。结果提示,在相同实验条件和参数下,ALA-PDT对上述4种疾病来源的MRSA菌株体外杀伤作用无统计学差异。
光动力疗法;5-氨基酮戊酸;耐甲氧西林金黄色葡萄球菌
耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus, MRSA)是一类对β内酰胺类抗生素普遍耐药,具有较强毒性和较大危害性的金黄色葡萄球菌。自20世纪60年代在英国首次发现至今,MRSA感染几乎遍及全球。目前,临床上治疗MRSA感染主要用万古霉素、喹宁始霉素、利奈唑胺等药物,但这类药物的长期使用会促使新的耐药菌株出现[1-2],因此相关感染的临床治疗工作面临着巨大挑战,对新治疗手段的探索也成为亟待解决的问题[3]。
光动力疗法(photodynamic therapy,PDT)是一种使用特定波长的可见光照射经光敏剂预处理的靶细胞从而产生活性氧,破坏靶细胞结构组分,进而致其死亡的治疗手段[4]。由于活性氧分子的氧化性极高,这一特性使PDT在杀伤细菌时没有特定的靶目标[5],不易产生细菌耐药。PDT的这一作用机制从根本上克服了抗生素治疗感染性疾病的诸多缺陷,理论上使其成为传统抗生素治疗方法的一种有效补充,以及在抗生素治疗无效情况下的一种潜在替代性治疗手段。
目前,PDT对MRSA杀伤效果的研究尚处于起步阶段。本研究验证了5-氨基酮戊酸(5-aminolevulinic acid,ALA)介导的PDT(ALA-PDT)对烧伤、急性咽炎、鼻窦炎和肺炎4种疾病来源的MRSA具有普遍杀伤作用,各组之间杀伤效率无差异,于体外初步探讨了ALA-PDT用于治疗MRSA感染的可行性,以期为后续研究奠定基础。
1 材料与方法
1.1材料
本研究所用MRSA菌株取自南京医科大学第二附属医院及复旦大学附属眼耳鼻喉科医院患者。ALA购自上海复旦张江生物医药股份有限公司。光动力治疗仪〔发光二极管-IB(light emitting diode-IB,LED-IB)〕购自武汉亚格光电技术有限公司。各种培养基购自英国Oxoid公司,96孔细胞培养板购自美国Corning公司。
1.2方法
1.2.1细菌取材及耐药性监测所有细菌均于无菌环境中取材,立即送至检验科进行菌种鉴定及药敏测试,再将获得的菌株保存于含有35%丙三醇的胰蛋白胨大豆肉汤(tryptone soya broth, TSB)培养基中,-80 ℃保存。实验时,于室温下融化后划线种菌。
1.2.2细菌培养取-80 ℃保存的菌种,按分区划线法接种于胰蛋白胨大豆琼脂(tryptone soya agar,TSA)平板上,37 ℃静态培养24 h。挑取4区单菌落接种于5 mL新鲜TSB培养基中,37 ℃振荡培养12 h,按1∶200比例将菌液再次接种于5 mL新鲜TSB培养基中,37 ℃振荡培养12 h。将活化后的细菌悬液离心去上清液,收集底部细菌,加入无菌生理盐水,调整细菌密度至2.0×108cfu/mL左右备用。
1.2.3ALA溶液的配制在避光条件下用无菌生理盐水配制不同浓度的ALA溶液,经0.22 μm滤膜过滤除菌后4 ℃避光保存。
1.2.4PDT参数光输出波长:(633±10)nm;光输出功率密度:100 mW/cm2。60 min光照强度为360 J/cm2。
1.2.5PDT照射细菌于生物安全柜中,将菌液按100 μL/孔加入无菌96孔细胞培养板,每株细菌重复3孔。随后每孔中加入ALA溶液,使ALA浓度达到相应实验浓度,充分混匀,加盖后外包锡纸,37 ℃振荡孵育。取出96孔细胞培养板置于生物安全柜中,在上方约10 cm处安置光动力仪照射灯头,按360 J/cm2光照剂量予以红光照射,照射光斑覆盖整块96孔板。以上实验均在避光条件下完成。
1.2.6细菌存活实验将ALA-PDT处理后的菌液离心,去上清液后收集底部细菌,用200 μL无菌生理盐水重悬细菌。将样本倍比稀释后涂布于TSA平板,cfu计数,并将测得的cfu进行以10为底的对数转换(log10cfu),计算各组的均值和标准差。
1.3统计学分析
采用GraphPad Prism 5统计软件进行分析。log10cfu结果用mean±SD表示。两组间均值比较采用独立样本t检验,多组独立样本比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1单纯光敏剂或光照射影响细菌活性相关参数的优化
分别取烧伤患者皮肤分泌物、急性咽炎患者口咽部分泌物、鼻窦炎患者中鼻道分泌物及肺炎患者痰液,经药敏试验后共筛选26株MRSA,其中烧伤组6株、急性咽炎组7株、鼻窦炎组 7株、肺炎组6株(表1)。
表1临床MRSA菌株耐药情况
Tab.1Drug sensitivity testing of MRSA strains
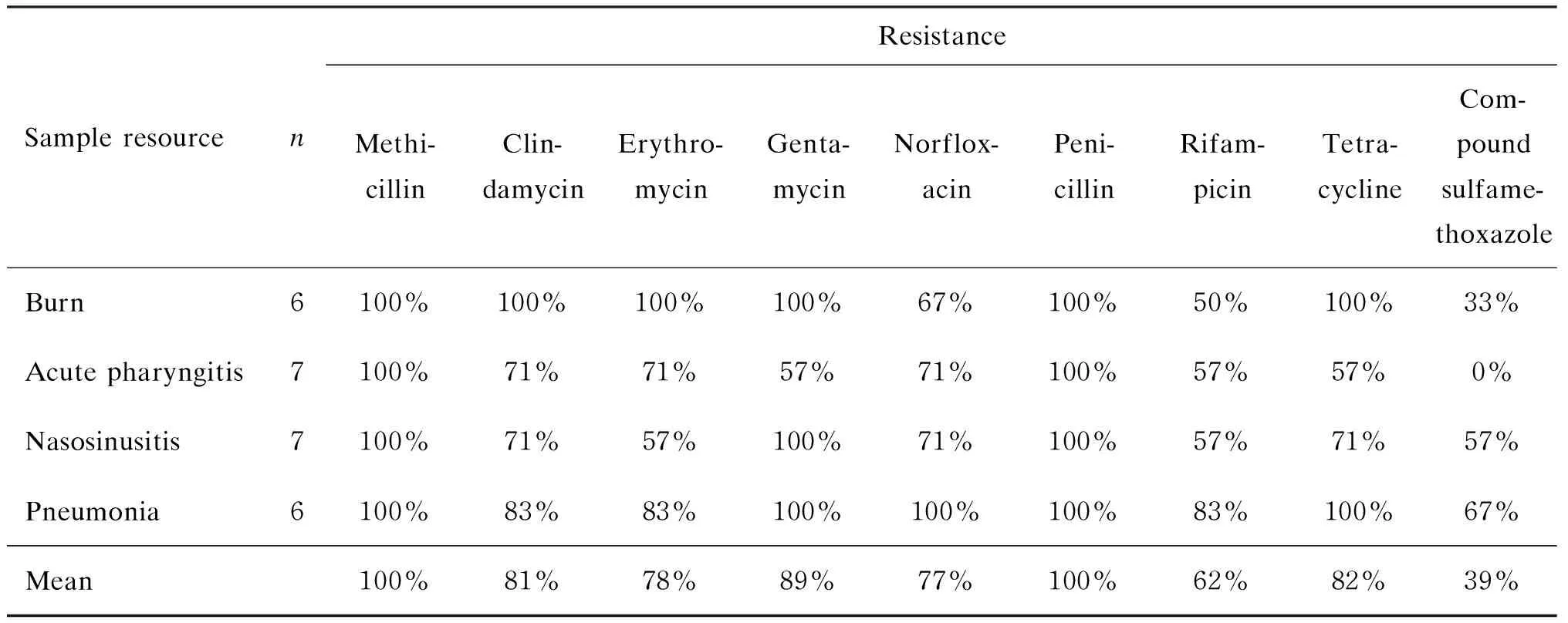
SampleresourcenResistanceMethi-cillinClin-damycinErythro-mycinGenta-mycinNorflox-acinPeni-cillinRifam-picinTetra-cyclineCom-poundsulfame-thoxazoleBurn6100%100%100%100%67%100%50%100%33%Acutepharyngitis7100%71%71%57%71%100%57%57%0%Nasosinusitis7100%71%57%100%71%100%57%71%57%Pneumonia6100%83%83%100%100%100%83%100%67%Mean100%81%78%89%77%100%62%82%39%
结合现有相关文献报道[6]设计参数优化实验。以MRSA USA300菌株为模式菌,使用不同浓度(0、1.25、2.5、5、10 mmol/L)的光敏剂对细菌进行不同时长(1或2 h)的孵育处理,并对孵育后的细菌进行cfu计数。结果显示,经1 h处理后,10 mmol/L ALA组的log10cfu值与对照组相比具有统计学差异(P<0.05);而2 h处理后,5 mmol/L ALA即可对细菌活性产生影响(P<0.05)(图1A)。
使用不同光照强度(0、60、120、240、360 J/cm2)对细菌进行照射,结果显示不同强度光照组细菌活性均无统计学差异(P>0.05)(图1B)。
在此基础上测定不同浓度ALA与不同强度光照组合对细菌的杀伤作用。结果显示,当ALA浓度为5 mmol/L、 光照强度为360 J/cm2时,细菌的
杀伤效果最明显(图2)。综合参考有效性和安全性后,设定5 mmol/L ALA孵育细菌1 h后,给予360 J/cm2强度光照作为PDT参数。
2.2PDT对临床MRSA菌株活性影响的检测
ALA-PDT对临床MRSA菌株具有杀伤作用(对照组log10cfu=8.28±0.05,n=26;实验组log10cfu=6.48±0.16,n=26;P<0.01)(图3A),其杀伤效率(log10cfu对照组- log10cfu实验组)分布于0.46~3.68(图3B)。 按不同疾病对杀伤效率进行分组统计,结果显示PDT对各组标本的杀伤效率分别为:烧伤组1.68±0.15(n=6)、急性咽炎组1.91±0.41(n=7)、鼻窦炎组1.86±0.32(n=7),肺炎组1.77±0.38(n=6),各组之间无显著性差异(P>0.05)(图4)。

A: The effect of ALA with a range of concentration on bacterial cfu. B: Bacterial cfu after exposure to different LED intensities.
图1单纯光敏剂或光照对细菌活性的影响
Fig.1The influence of ALA or LED alone on bacterial cfu

图2ALA-PDT对USA300模式菌株活性的影响
Fig.2The effect of ALA-PDT on USA300 with the combination of different ALA concentrations and LED densities

A: The viability of MRSA in ALA-PDT group and control group. B: The effect of ALA-PDT on each clinical MRSA strain from burn, acute pharyngitis, nasosinusitis and pneumonia.
图3ALA-PDT对临床MRSA菌株活性的影响
Fig.3The effects of ALA-PDT on different clinical MRSA strains
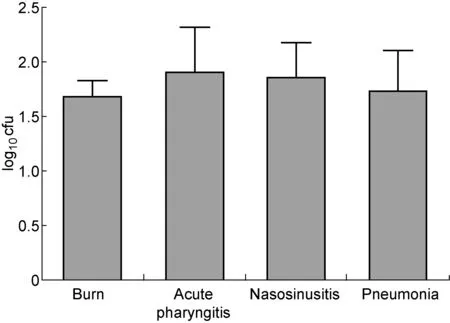
图4ALA-PDT对不同疾病来源MRSA菌株的杀伤效果
Fig.4The effects of ALA-PDT on different clinical MRSA strains
3 讨论
MRSA是医院内和社区感染[7]的重要致病菌之一,其毒性强、危害大,对一些免疫缺陷患者甚至是致命的。目前,抗生素仍是临床治疗MRSA感染的主要手段,但由于其杀伤细菌的靶位较为单一,长期使用会促使细菌产生耐药性。已有文献报道MRSA菌株对万古霉素耐药[8]。此外,MRSA常具有多重耐药性[9],致使相关感染的治疗过程复杂且效果受限,成为临床研究中亟待攻克的难题。PDT能利用光敏剂与光源反应后产生的活性氧,破坏核酸、蛋白质、膜脂质等细菌组分而致细菌死亡[10]。这一光敏作用所表现出的多靶位杀伤特性使MRSA不易对PDT产生耐药性,在相关感染的治疗中较抗生素更有优势,极具潜在的应用价值[11]。据此,本研究选取ALA作光敏剂、LED作光源,自烧伤、急性咽炎、鼻窦炎和肺炎4类临床常见MRSA感染性疾病患者收集MRSA菌株,在相同实验条件和参数下,证实ALA-PDT对上述4类疾病来源的MRSA菌株体外杀伤效果明显,且各组间杀伤效果无统计学差异。
目前,关于ALA-PDT在治疗MRSA感染及其相关领域的研究尚处于起步阶段。Grinholc曾报道,MRSA菌株与10 mmol/L ALA 孵育24 h,经(624±18)nm波长、50 J/cm2强度的光照射后,于体外能被有效杀伤(log10cfu下降1.6)[3]。但由于该结论仅基于对1株MRSA菌株的研究,数量过少,其结论的可靠性存疑。此外,在Grinholc实验中ALA孵育MRSA菌株的时间长达24 h,后续的光照射时间也有4 h 10 min。如此长的处理时间,从临床应用角度考虑,缺乏可行性。对比上述研究,同时参考Nitzan等的研究结果——金黄色葡萄球菌经0.38 mmol/L ALA孵育4 h,即可于细菌内产生大量光敏剂原卟啉Ⅸ (protoporphyrin Ⅸ,PpⅨ)[6],本研究从4种临床常见的MRSA感染性疾病患者中选取26株MRSA,经5 mmol/L ALA孵育1 h后,给予360 J/cm2强度LED光〔(633±10)nm〕照射1 h,结果显示在该参数条件下,ALA-PDT对MRSA菌株具有1.80 log10cfu的有效杀伤作用。据此,本研究样本种类具有临床代表性,且数量充足,选取的实验参数又考虑到了后续临床应用,为研究的深入开展奠定了良好基础。
在相同的实验条件和参数下,本研究对4种不同疾病来源的MRSA菌株进行分组,比较ALA-PDT体外杀伤作用,结果显示杀伤效率无差异。此类实验尚未见报道。该结果表明,MRSA菌株来源的不同不是决定ALA-PDT对MRSA菌株体外杀伤作用有效性的关键因素。由此推断,虽然MRSA感染导致的各类疾病有不同的临床特征,但ALA-PDT对其的杀伤作用极有可能是普遍存在的。
本研究选择ALA作为光敏剂是因为其只在细胞内转化为PpⅨ[12],而细菌比正常人体细胞的代谢速度快,所以ALA-PDT的光敏作用更集中表现在细菌而非周围组织细胞,这一特性使其较其他光敏剂介导的PDT在临床应用中有更高的安全性。目前已证实,ALA作为第2代卟啉类光敏剂,其本身不具备光敏活性,而是作为亚铁血红素代谢途径的第一级产物天然存在于细菌和真核细胞中并产生PpⅨ,当PpⅨ积累到一定浓度后,经585~635 nm波长光处理即可发生光敏效应而杀伤细菌[13]。本研究通过控制外源性ALA的加入量和孵育时间,以及LED功率和光照时间影响光敏作用的效果,在参考相关文献并综合考虑临床因素后,确定实验参数。结果证实,MRSA菌株在与5 mmol/L ALA孵育1 h,经(633±10)nm波长、360 J/cm2光照强度的LED光源照射1 h后,杀伤作用有效。
需特别指出的是,本研究中不同MRSA菌株对ALA-PDT杀伤作用的敏感性呈现出了菌株依赖性。经ALA-PDT处理后,MRSA菌株的log10cfu下降范围介于0.46~3.68,ALA-PDT对不同菌株的杀伤作用存在很大差异。类似现象在Grinholc等应用PPArg2作为光敏剂的研究中亦有报道[14]。目前研究认为,这一现象可能与细菌自身的药物泵系统、生物膜形成能力、细菌毒力等因素有关,但确切机制仍有待深入研究[15]。
目前,临床应用PDT治疗感染性疾病仅限于口腔科和皮肤科。影响PDT广泛应用的主要原因包括:①PDT产生光敏作用所需的照射光源穿透能力有限,故其适用范围被限制在体表或体腔感染性疾病,对深部感染的治疗存在照射和给药困难的问题[16]。②PDT对不同组织的作用安全性仍需大量实验验证。③对于鼻腔这种存在大量正常菌群的部位,PDT的应用有导致菌群失调的风险。随着PDT与纳米技术和分子靶向技术联合应用的不断开展[17],以及光敏剂和光源的不断优化,相信这些问题将得以逐步解决,PDT治疗感染性疾病的潜力不可限量。
Ojulong J, Mwambu TP, Joloba M, Bwanga F, Kaddu-Mulindwa DH. Relative prevalence of methicilline resistant Staphylococcus aureus and its susceptibility pattern in Mulago Hospital, Kampala, Uganda [J]. Tanzan J Health Res, 2009, 11(3): 149-153.
[2]Nada T, Ichiyama S, Osada Y, Ohta M, Shimokata K, Kato N, Nakashima N. Comparison of DNA fingerprinting by PFGE and PCR-RFLP of the coagulase gene to distinguish MRSA isolates [J]. J Hosp Infect, 1996, 32(4): 305-317.
[3]Grinholc M, Szramka B, Olender K, Graczyk A. Bactericidal effect of photodynamic therapy against methicillin-resistant Staphylococcus aureus strain with the use of various porphyrin photosensitizers [J]. Acta Biochim Pol, 2007, 54(3): 665-670.
[4]Rkein AM, Ozog DM. Photodanamic therapy [J]. Dermatol Clin, 2014, 32(3): 415-425.
[5]Noimark S, Dunnill CW, Wilson M, Parkin IP. The role of surfaces in catheter-associated infections [J]. Chem Soc Rev, 2009, 38(12): 3435-3448.
[6]Nitzan Y, Salmon-Divon M, Shporen E, Malik Z. ALA induced photodynamic effects on Gram positive and negative bacteria [J]. Photochem Photobiol Sci, 2004, 3(5): 430-435.
[7]Chen YJ, Liu KL, Chen CJ, Huang YC. Comparative molecular characteristics of community-associated and healthcare-associated methicillin-resistant Staphylococcus aureus isolates from adult patients in northern Taiwan [J]. Medicine (Baltimore), 2015, 94(49): e1961.
[8]Friães A, Resina C, Manuel V, Lito L, Ramirez M, Melo-Cristino J. Epidemiological survey of the first case of vancomycin-resistant Staphylococcus aureus infection in Europe [J]. Epidemiol Infect, 2015, 143(4): 745-748.
[9]Bhattacharya PK. Emergence of antibiotic-resistant bacterial strains, methicillin-resistant Staphylococcus aureus, extended spectrum beta lactamases, and multi-drug resistance is a problem similar to global warming [J]. Rev Soc Bras Med Trop, 2014, 47(6): 815-816.
[10]Vatansever F, de Melo WCMA, Avci P, Vecchio D, Sadasivam M, Gupta A, Chandran R, Karimi M, Parizotto NA, Yin R, Tegos GP, Hamblin MR. Antimicrobial strategies centered around reactive oxygen species—bactericidal antibiotics, photodynamic therapy and beyond [J]. FEMS Microbiol Rev, 2013, 37(6): 955-989.
[11]Wainwright M. ‘Safe’ photoantimicrobials for skin and soft-tissue infections [J]. Int J Antimicrob Agents, 2010, 36(1): 14-18.
[12]Kennedy JC, Pottier RH. Endogenous protoporphyrin IX, a clinically useful photosensitizer for photodynamic therapy [J]. J Photochem Photobiol B, 1992, 14(4): 275-292.
[13]Harris F, Pierpoint L. Photodynamic therapy based on 5-aminolevulinic acid and its use as an antimicrobial agent [J]. Med Res Rev, 2012, 32(6): 1292-1327.
[14]Grinholc M, Szramka B, Kurlenda J, Graczyk A, Bielawski KP. Bactericidal effect of photodynamic inactivation against methicillin-resistant and methicillin-susceptible Staphylococcus aureus is strain-dependent [J]. J Photochem Photobiol B, 2008, 90(1): 57-63.
[15]Vera DM, Haynes MH, Ball AR, Dai T, Astrakas C, Kelso MJ, Hamblin MR, Tegos GP. Strategies to potentiate antimicrobial photoinactivation by overcoming resistant phenotypes [J]. Photochem Photobiol, 2012, 88(3): 499-511.
[16]Marchal S, Dolivet G, Lassalle HP, Guillemin F, Bezdetnaya L. Targeted photodynamic therapy in head and neck squamous cell carcinoma: heading into the future [J]. Lasers Med Sci, 2015, 30(9): 2381-2387.
[17]Zhang Z, Wang S, Xu H, Wang B, Yao C. Role of 5-aminolevulinic acid-conjugated gold nanoparticles for photodynamic therapy of cancer [J/OL]. J Biomed Opt, 2015. http://biomedicaloptics.spiedigitallibrary.org/article.aspx?articleid=2300900.
Invitrostudy of antimicrobial effect of photodynamic therapy using 5-aminolevulinic acid-mediated photodynamic treatment against methicillin-resistantStaphylococcusaureusstrains from different infectious diseases
ZHAO Keqing1,*, YANG Chen1,2,*, WU Yang3, GUO Limin1, LIU Huayong3, JI Jian4, CHEN Xiaoying5, ZHENG Chunquan1
1. Department of Otolaryngology, Eye, Ear, Nose and Throat Hospital, Fudan University; Shanghai Key Clinical Disciplines of Otorhinolaryngology, Shanghai 200031, China; 2. Department of Otolaryngology, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China; 3. Department of Medical Microbiology and Parasitology, Key Laboratory of Medical Molecular Virology of Ministries of Education and Health, School of Basic Medical Sciences, Fudan University, Shanghai 200032, China; 4. Department of Clinical Laboratory, Eye, Ear, Nose and Throat Hospital, Fudan University, Shanghai 200031, China; 5. Department of Dermatology, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China
In photodynamic therapy (PDT), the reactive oxygen species generated by the activation of photosensitizers by light of an appropriate wavelength, are able to inactivate microbes by damaging various microbial components. Due to its multi-targeting antimicrobial capability, PDT has shown a potential as an effective alternative therapeutic option against methicillin-resistantStaphylococcusaureus(MRSA). In this study, MRSA strains isolated from burn, acute pharyngitis, nasosinusitis and pneumonia patients were subjected to a 5-aminolevulinic acid (ALA) mediated light emitting diode (LED) arrayinvitro. The results showed that a significant reduction (1.8 log10cfu) was achieved with an ALA treatment (1 h, 5 mmol/L) followed by 1 h of illumination [(633±10) nm wavelength light source, and a 360 J/cm2light dose]. MRSA strains collected from different tissues showed a similar sensitivity to the treatment.
Photodynamic therapy; 5-Aminolevulinic acid; Methicillin-resistantStaphylococcusaureus
国家自然科学基金(81300810),上海市青年医师培养资助计划(20141057)
郑春泉,赵可庆
Corresponding authors. ZHENG Chunquan, E-mail: 96zheng@sina.com; ZHAO Keqing, E-mail: rhinoresearch@163.com
2015-11-23)
*同为第一作者
