天麻素改善氯化钴诱导大鼠缺氧性脑神经元损伤的效果
2016-09-13鲍月宁曹传宇宁夏回族自治区固原市人民医院神经内科宁夏固原756000
鲍月宁 曹传宇宁夏回族自治区固原市人民医院神经内科,宁夏固原 756000
天麻素改善氯化钴诱导大鼠缺氧性脑神经元损伤的效果
鲍月宁曹传宇
宁夏回族自治区固原市人民医院神经内科,宁夏固原756000
目的 研究天麻素对氯化钴诱导大鼠缺氧性脑神经元损伤的修复作用,为缺血缺氧性脑损伤的临床治疗提供实验依据。方法 取SD大鼠大脑皮质神经细胞,原代培养7 d后按照培养皿编号,采用随机数字表法分为空白对照组、模型组、天麻素组及天麻素对照组,并实施相应处理。观察各组细胞形态学、神经元相对活力、乳酸脱氢酶(LDH)释放量、EphA4表达的差异。结果 空白对照组神经元细胞相对活力显著高于其他各组,模型组神经元细胞相对活力显著低于天麻素组、天麻素对照组,天麻素组神经元细胞相对活力显著低于天麻素对照组(P<0.01)。模型组神经元细胞LDH活性显著高于其他各组,天麻素组、天麻素对照组神经元细胞LDH活性显著高于空白对照组(P<0.01)。模型组神经元平均累积吸光度(IOD)值显著高于其他各组,空白对照组神经元平均IOD值显著低于其他各组(P<0.01)。结论 天麻素能够显著降低大鼠缺氧损伤神经元EphA4表达水平,抑制神经元细胞LDH活性,增强细胞相对活力,对大鼠皮质神经元损伤的保护具有积极作用,值得进一步研究。
天麻素;氯化钴;皮质神经元损伤;神经保护;缺血缺氧性脑损伤
[Abstract]Objective To study the repair effect of gastrodin on hypoxic brain neurons damage induced by cobalt chloride in rats,and provide an experimental reference for clinical treatment of ischemic and hypoxic brain damage. Methods Cerebral cortex nerve cells of SD rats were selected for study.The original generation after 7 d,they were numbered according to the culture dish.Primary cells were divided into blank control group,model group,gastrodin group and gastrodin control group by using random number table method,and corresponding treatment was implemented.Cell morphology,neurons relative vigor,lactate dehydrogenase(LDH)release quantity,EphA4 expression difference among four groups were observed.Results The relative activity of neurons in blank control group was significantly higher than that in other groups,the relative activity of neurons in model group was significantly lower than that in gastrodin group and gastrodin control group,the relative activity of neurons in gastrodin group was significantly lower than that in gastrodin control group(P<0.01).The neurons LDH activity of model group was significantly higher than that of other groups,the neurons LDH activity of gastrodin group and gastrodin control group were significantly higher than those of blank control group(P<0.01).The average neurons IOD of model group was higher than that of other groups,the average neurons IOD of blank control group was lower than that of other groups(P<0.01).Conclusion Gastrodin can reduce the expression level of EphA4 in the injured neuron,inhibit the activity of LDH in neuronal cells,and enhance the cell relative viability,has a positive effect on the protection of rat cortical neuronal injury,is worthy of further study.
[Key words]Gastrodin;Cobalt chloride;Cortical neuron injury;Nerve protection;Hypoxic ischemic brain damage
缺血缺氧性脑损伤的病理过程包括能量代谢障碍、细胞内钙超载、兴奋性氨基酸分泌过多及一氧化氮蓄积等,上述病理反应引发的级联细胞毒作用是诱发神经元损伤的主要原因[1]。目前已有大量西药相继应用于神经元损伤的预防及治疗,其临床效果得到了一定认可,但伴随而来的明显副作用大大限制了其应用前景[2]。天麻素的强效镇痛、镇静、心血管功能改善、抗炎及抗自由基作用已被广泛证实,研究表明,天麻素还具有增强血管顺应性作用,有望改善脏器缺血缺氧状态、发挥脑保护作用[3]。本研究就天麻素对神经元损伤的影响进行实验分析。
1 材料与方法
1.1实验材料
实验动物:出生24 h内健康新生SPF级SD大鼠,由郑州大学医学院动物实验中心提供,动物合格证号:120000KXWQR08001。
主要药品:天麻素(昆明制药集团药物研究所生产,100 g/瓶,批号:20130115,分析纯),纯度99.5%,分子量286.27,其化学结构式如图1所示。

图1 天麻素化学结构式
主要试剂:Neurobasal培养基(美国Gibco公司生产)、B27试剂(斯百汇生物科技有限公司,规格:10 mL)、胎牛血清(美国Gibco公司生产,规格:500 mL)、胰蛋白酶(苏州亚科科技股份有限公司,型号:9002-07-7)、多聚赖氨酸(上海宝曼生物科技公司,浓缩液,25 mg/瓶)、氯化钴(CoCl2,山东淄博润兴化工厂生产,分析纯)、3-(4,5-二甲基噻唑-2)-2、5-二苯基四氮唑溴盐(MTT)(美国 Sigma公司,分析纯)、乳酸脱氢酶(LDH)定量检测试剂盒(美国罗氏公司)、抗鼠人肝癌细胞系A4(EphA4)多克隆抗体(美国Santa Cruz公司)、CY3荧光试剂盒(武汉博士得生物制品公司),其他试剂均为进口分析纯。
1.2处理方法
1.2.1大鼠皮质神经元细胞原代培养使用75%乙醇消毒实验大鼠,在严格无菌条件下,行神经元细胞原代培养[4],持续7 d。
1.2.2细胞分组及处理将原代培养7 d后的细胞按照培养皿编号,使用随机数字表法分为空白对照组、模型组、天麻素组及天麻素对照组,以125 μmol/L CoCl2溶液处理模型组及天麻素组细胞4 h,然后以25 mg/L天麻素处理天麻素组、天麻素对照组细胞24 h[5]。
1.3观察指标
1.3.1神经元形态观察于倒置显微镜下,对各组细胞神经元形态变化进行拍照、观察,并比较。
1.3.2细胞相对活力检测采用MTT法,对各组细胞相对活力进行检测[6],使用全自动酶标仪,检测其570 nm波长处吸光度(OD)值。
1.3.3LDH活性检测LDH活性检测采用速率法[7],检测其440 nm波长处OD值。
1.3.4EphA4表达量检测采用细胞荧光化学法,对各组细胞EphA4表达量进行检测[8],红色荧光即为免疫阳性细胞。使用Image-Pro Plus 6.0软件,对各实验组的荧光图片单个细胞的累积吸光度(IOD)值和平均IOD值进行分析并比较。
1.4统计学方法
采用SPSS 18.0统计软件对数据进行分析和处理,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1神经元形态
倒置显微镜观察结果示,空白对照组神经元形态均匀一致,大小相仿,胞体饱满,呈光滑的椭圆形或锥形,神经元的突起广泛分枝,相互交叉,折光性强;模型组神经元形态发生明显改变,细胞折光性下降,胞体萎缩,出现颗粒,轴突变细变短,形状僵硬,分枝减少;天麻素组神经元形态较模型组有所改善,胞体萎缩减轻,轴突保留较多,但仍有少数细胞坏死;天麻素对照组形态较对照组稍差。见图2。

图2 各组神经元细胞倒置显微镜照片(200×)
2.2细胞相对活力
空白对照组神经元细胞相对活力显著高于其他各组,模型组神经元细胞相对活力显著低于天麻素组、天麻素对照组,天麻素组神经元细胞相对活力显著低于天麻素对照组,差异有高度统计学意义 (P<0.01)。见图3。

图3 各组神经元细胞相对活力比较
2.3LDH活性
模型组神经元细胞LDH活性显著高于其他各组,天麻素组、天麻素对照组神经元细胞LDH活性显著高于空白对照组,差异有高度统计学意义 (P<0.01)。见图4。

图4 各组神经元细胞LDH活性比较
2.4EphA4表达
荧光显微镜观察结果示,各组神经元胞体、突起均可见红色荧光显示,但各组荧光强度存在一定差异。模型组神经元平均IOD值显著高于其他各组,空白对照组神经元平均IOD值显著低于其他各组,差异有高度统计学意义(P<0.01)。见图5和图6。
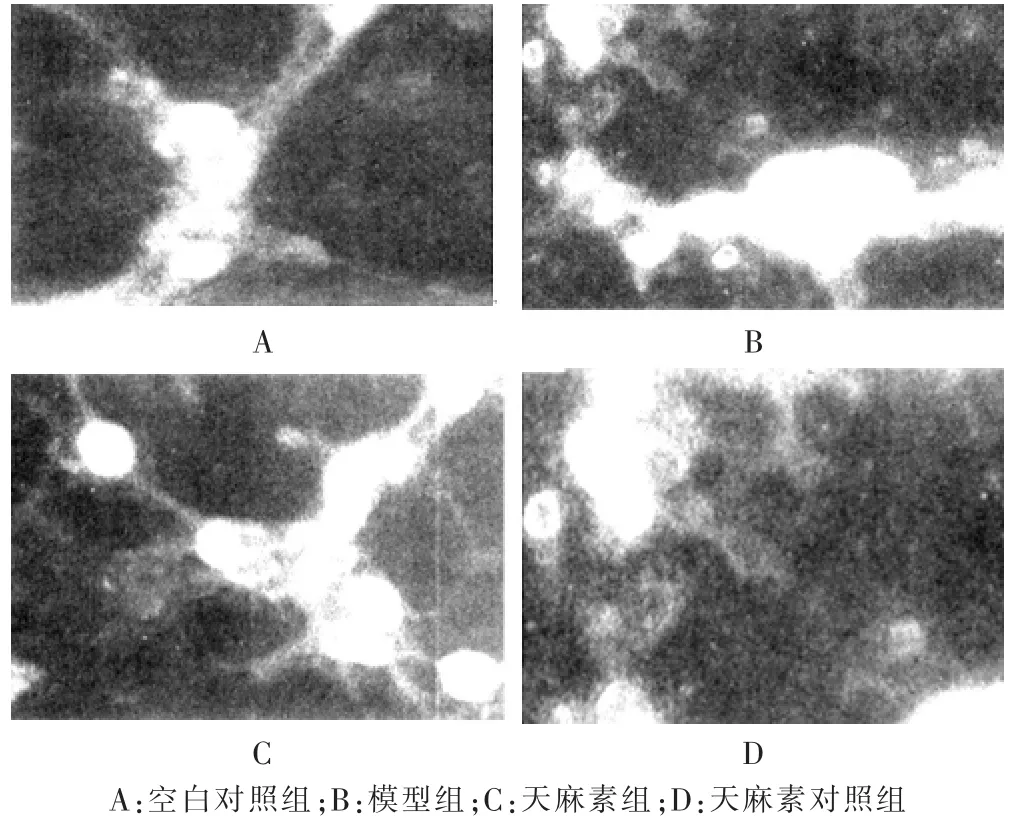
图5 各组神经元细胞EphA4表达的荧光染色图(CY荧光染色,100×)

图6 各组神经元细胞EphA4表达水平比较
3 讨论
缺血缺氧性脑病存活患者病残率高达75%,这与脑组织缺血缺氧引发的神经细胞死亡,继而导致的神经功能缺损具有密切关联[9-10]。因此,临床亟需一种能够有效保护神经元功能、避免神经元损伤的药物。
天麻素是我国传统中药材天麻中的主要有效成分,已有大量研究证实,天麻素具有恢复大脑皮质兴奋与抑制过程间平衡失调等作用[11]。研究表明,天麻素还可通过抑制兴奋性氨基酸诱导的细胞凋亡过程,在清除自由基、对抗自由基诱导的细胞损伤、神经保护等方面发挥积极效果[12]。本研究结果示,经CoCl2处理后,模型组、天麻素组神经元细胞均出现了不同程度的形态学变化,以胞体萎缩、细胞坏死为主,说明天麻素具有一定的神经保护作用。
在天麻素神经保护作用机制的研究中发现,模型组神经元细胞相对活力最低,但其LDH活性最高,说明模型组神经元细胞存在明显损伤,而天麻素在一定程度上使CoCl2诱导的化学性损伤得到抑制,考虑与天麻素在对抗兴奋毒性、双向调节一氧化氮和一氧化氮合酶、促进胶质细胞产生营养因子、稳定胞膜、抗细胞氧化等方面发挥的积极作用有关[13]。大量LDH的漏出表明,神经细胞膜完整性受损,且Cai等[14]研究证实,LDH活性与神经细胞损伤程度呈正比,故本研究结果示,天麻素处理后神经细胞LDH漏出量显著降低,提示天麻素对细胞膜完整性的维持亦具有一定作用。
此外,本研究发现,经CoCl2处理后,模型组细胞EphA4表达水平显著升高,而天麻素可使细胞EphA4表达水平得到明显控制,与何保丽等[15]研究结论一致。作为一种具有影响突触可塑性的基因,EphA4广泛分布于大脑各个区域,并集中于海马锥体细胞树突棘部位,研究表明,配体Ephrin-A3可激活EphA4,诱发下游信号转导级联瀑布,导致树突棘瓦解,使成熟大脑突出的重构能力得以保存[16-18],因此,EphA4在缺血缺氧损伤后神经元的损伤中扮演了重要角色。本研究天麻素组细胞EphA4表达得到有效抑制,说明经天麻素处理后,EphA4参与的CoCl2诱导神经元损伤过程得到了有效控制,细胞自我保护现象有所降低,神经元重构能力得以保存,从而有效延缓了神经元损伤过程[19-20]。
综上所述,天麻素能够有效抑制CoCl2诱导的大鼠皮质神经元损伤,其保护作用可能与EphA4表达抑制有关,为缺血缺氧性脑损伤的临床治疗开拓了新的研究方向,但其具体作用机制有待进一步深入观察。
[1]Song C,Fang S,Lv G,et al.Gastrodin promotes the secretion of brain-derived neurotrophic factor in the injured spinal cord[J].Neural Regen Res,2013,8(15):1383-1389.
[2]Zhang M,Liu Y,Yu H,et al.A potential method for recycling of gastrodin separated from urine[J].Asian J Chem,2013,25(8):4603.
[3]杨汀,樊光辉.天麻素治疗神经系统疾病机制研究进展[J].华南国防医学杂志,2013,27(2):131-132.
[4]Zhang F,Li A.Dual regulating effects of gastrodin on extracellular dopamine concentration in rats models of Tourette's syndrome[J].Int J Neurosci,2015,125(10):784-792.
[5]位凯,王飞,张瑾,等.天麻素预处理减轻大鼠心肌缺血再灌注损伤的可能机制[J].安徽医科大学学报,2014,49 (6):756-758.
[6]Sun G,Yuan Z,Zhang B,et al.Gastrodin blocks neural stem cell differentiation into glial cells mediated by kainic acid[J].Neural Regen Res,2012,7(12):891-895.
[7]陈伟康.天麻素注射液的药理作用与临床应用进展[J].海峡药学,2013,24(11):13-16.
[8]Wang X,Yan S,Wang A,et al.Gastrodin ameliorates memory deficits in 3,3′-iminodipropionitrile-induced rats:possible involvement of dopaminergic system[J].Neurochem Res,2014,39(8):1458-1466.
[9]Jiang G,Wu H,Hu Y,et al.Gastrodin inhibits glutamateinduced apoptosis of PC12 cells via inhibition of CaMKII/ ASK-1/p38 MAPK/p53 signaling cascade[J].Cell Mol Neurobiol,2014,34(4):591-602.
[10]梅梅,王显鹤,孙华威.白藜芦醇对缺氧缺血性脑损伤新生大鼠MMP-9及TIMP-1的影响[J].中国现代医生,2015,53(9):6-7,15.
[11]章正祥,曹克刚,王春丹,等.天麻素对多巴胺,硝酸甘油诱发的血管舒缩异常模型大鼠神经肽,一氧化氮系统的影响[J].中华中医药学刊,2013,31(7):1514-1517.
[12]Liu W,Su BL,Wang ZS,et al.Gastrodin improved baroreflex sensitivity and increased gamma-amino butyric acid content in brains without decreasing blood pressure in spontaneously hypertensive rats[J].CNS Neurosci Ther,2012,18(10):873-875.
[13]吴迪,陈冠婕,彭正午,等.天麻素对脑缺血再灌注模型小鼠大脑及纹状体髓鞘的保护作用[J].中华行为医学与脑科学杂志,2015,24(3):198-200.
[14]Cai Z,Lei X,Lin Z,et al.Preparation and evaluation of sustained-release solid dispersions co-loading gastrodin with borneol as an oral brain-targeting enhancer[J].Acta Pharm Sin B,2014,4(1):86-93.
[15]何保丽,角建林,李波,等.天麻素对老年痴呆树鼩海马BDNF表达的影响[J].昆明医科大学学报,2013,34(9):29-30.
[16]张晖芬,陈晓辉,霍艳双,等.RP-HPLC双波长切换法同时测定天舒胶囊中天麻素、阿魏酸和6,7-二羟基藁本内酯的含量[J].沈阳药科大学学报,2012,29(6):443-447.
[17]Li C,Chen X,Zhang N,et al.Gastrodin inhibits neuroinflammation in rotenone-induced Parkinson's disease model rats[J].Neural Regen Res,2012,7(5):325-331.
[18]何小波,王晓燕.天麻素联合多奈哌齐治疗血管性痴呆疗效分析[J].实用老年医学,2014,28(7):580-582.
[19]Zhao GW,Wang Y,Li YC,et al.The neuroprotective effect of modified“Shengyu”decoction is mediated through an anti-inflammatory mechanism in the rat after traumatic brain injury[J].J Ethnopharmacol,2014,151(1):694-703.
[20]Ding W,Yu P,Liu W,et al.Buyang Huanwu decoction increases the expression of glutamate transporter-1 and glutamate synthetase in association with PACAP-38 following focal ischemia[J].Biomed Rep,2015,3(5):651-656.
Improvement effect of gastrodin on hypoxic brain neurons damage induced by cobalt chloride in rats
BAO YueningCAO Chuanyu
Department of Neurology,People′s Hospital of Guyuan City,Ningxia Hui Autonomous Region,Guyuan756000,China
R332
A
1673-7210(2016)05(b)-0017-04
鲍月宁(1980.4-),女,汉族;研究方向:脑损伤相关疾病的临床诊治。
曹传宇(1970.2-),男,汉族,副主任医师;研究方向:脑损伤相关疾病的临床诊治。
2016-01-09本文编辑:李亚聪)
