小鼠气管平滑肌原代细胞的分离、培养与鉴定
2016-09-13叶致豪许文豪刘庆华沈金花彭勇波
叶致豪,许文豪,刘庆华,沈金花,彭勇波
(中南民族大学生命科学学院医学生物研究所,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074)
小鼠气管平滑肌原代细胞的分离、培养与鉴定
叶致豪,许文豪,刘庆华,沈金花,彭勇波*
(中南民族大学生命科学学院医学生物研究所,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
目的建立一种可靠的通过组织块贴壁法分离培养原代小鼠气管平滑肌细胞及免疫组化鉴定的方法。方法体视显微镜下立体分离小鼠气管平滑肌组织,组织块贴壁法培养原代细胞,对分离培养细胞通过免疫组化方法进行鉴定,并用MTT法对其增殖特性进行检测。结果从BALB/c雄性小鼠分离气管平滑肌组织,剪碎为1mm3,用含1%青-链霉素的PBS及培养液漂洗,使组织块贴于培养皿底,并加入5mL培养液,放入37℃、5%CO2的细胞培养箱培养,3~5d后有明显梭状细胞从组织块爬出,5~6d后,细胞可见明显“峰-谷”结构。经免疫荧光鉴定,在传代、纯化后,可得纯度为99%以上的气管平滑肌细胞。用MTT法测量其生长曲线。结论本方法操作简单、经济,获得的气管平滑肌细胞具有较好增殖能力,细胞数量和纯度能够满足后续细胞生物学实验研究的需要。
气管平滑肌细胞;原代培养;组织块贴壁法;免疫荧光;MTT法;小鼠
哮喘是一种常见的气道慢性炎症性疾病,目前我国有约2000万人罹患哮喘[1, 2]。近些年,由于雾霾等空气质量与环境污染程度的日益恶劣,呼吸系统疾病也逐渐成为了全世界范围影响人类健康最严重的慢性疾病之一,据世界卫生组织预测,到2025年,世界上将会有4亿人患上哮喘[3, 4]。
哮喘发病症状众多,早期表现为过敏性炎症[5],后期由于气管平滑肌增生[6, 7],阻塞气管,导致气道狭窄、气道高反应[5]及气道重塑[8, 9],患者出现胸闷、气喘等症状,严重时危及生命。因此,对哮喘的发病机理与治疗的研究是至关重要的。
在对哮喘发病机制的研究中,气管平滑肌是针对气道阻塞性症状的主要研究目标之一[10, 11],针对气管平滑肌细胞(airwaysmoothmusclecells,ASMCs)的形态学观察与细胞增殖速率的测量是在细胞生物学水平研究哮喘发病机制的常用手段。因此, 成功建立ASMCs的原代培养技术十分关键。原代细胞培养的方法通常有酶消化法[12, 13]与组织块贴壁法[14, 15],但对于不同特性的不同组织,两种方法并不是都适用。尤其是对于气管平滑肌细胞,尽管已有文献采用上述两种方法分离原代ASMCs的报道,但气管平滑肌组织量较少,使用酶消化法时酶解时间与酶浓度不好控制[16],组织贴壁法也存在原代细胞密度不均、细胞爬出慢等问题[17]。本研究针对现有气管平滑肌细胞原代分离培养中存在的问题,旨在建立一种简单经济的ASMCs原代培养与鉴定的方法,为获得足够数量、较高纯度的ASMCs用于后续哮喘发病机制的研究及治疗哮喘疾病的药物筛选奠定基础。
1 材料与方法
1.1材料
1.1.1实验动物
1.1.2试剂耗材
维纳斯镊子,维纳斯剪,超净工作台,二氧化碳恒温细胞培养箱,体视显微镜,恒温水浴锅,酶标仪,激光共聚焦显微镜(LSM-700)。0.25% 胰蛋白酶,75%乙醇,95%乙醇,酒精灯,圆形盖玻片,0.22μm滤膜,6cm培养皿,6孔板,96孔板,二甲基亚砜(DMSO)、牛血清白蛋白(BSA)、甘氨酸(glycine)。①培养液100mL: 78mLDMEM(high-glucose,Hyclone)、20mL胎牛血清(FBS,Hyclone)、1mL青-链霉素 (Hyclone)、1mL200mmol/LL-谷氨酰胺(L-Glu)。②一抗:Anti-α-smoothmuscleactin[EPR5368] (Abcam)。③二抗:GoatAnti-RabbitIgG,FITCConjugated(康为世纪)。④PBS:NaCl10g,KCl0.25g,Na2HPO4·12H2O3.62g,KH2PO40.25g,调pH=7.4。⑤MTT母液:5mg/mLMTT溶于PBS,调pH=7.4。⑥MTT工作液:MTT母液∶DMEM=1∶9。Propidiumiodide(PI,Biosharp).
1.2方法
1.2.1气管平滑肌的分离
用断颈法处死小鼠后,除口鼻部之外全身浸泡在75%乙醇中片刻,避免乙醇进入呼吸道而损伤气管平滑肌。将小鼠从乙醇中取出,用大头针固定在解剖板上,用75%乙醇浸泡过的手术器械从小鼠的胸腹部剪开皮肤至下颚,再从正中间剪开肋骨,暴露胸腔内部,除去心脏及其余组织,小心取出完整的气管与肺组织。把取出的组织放置在体视显微镜下,浸泡在含有1%青-链霉素的PBS中,用维纳斯剪与镊子精准地剪去食管及其余组织。从软骨环的一侧剖开气管,可见中部平行条纹的气管平滑肌组织,并将其分离出来。
1.2.2原代细胞培养
将分离出的气管平滑肌组织剪碎为1mm3的小块,放入内盛1% 青-链霉素的培养皿中,转入超净工作台中漂洗片刻;将组织块转至培养液中漂洗片刻,再放置在干燥的6cm培养皿。放入的组织块按合适的间隔密集地铺满皿底。随后将培养皿放入37℃的恒温培养箱中,倒置放置20~30min,组织块会因干涸而贴在皿底。从培养箱取出培养皿,加入5mL培养液,放入恒温培养箱继续培养,3~5d后即会有细胞爬出,之后每两天换1次培养液。
1.2.3细胞传代
“中国市场作为全球农业市场的核心之一,受到了西班牙海拉的高度关注,积极将优质产品和技术服务中国农业。”西班牙海拉公司出口部经理Antonio Arres表示,为满足中国市场的需求,西班牙海拉已提前做好了产能准备,今后将携手瑞丰生态,在技术、产品、品牌等多方面继续深度合作,将优质产品与种植理念与中国市场相融合。
组织块周围细胞生长至逐渐融合80% 左右时,即可传代。吸净培养皿中的培养液,加入5mLPBS,轻轻晃动培养皿,将PBS吸净。向培养皿中加入1mL0.25%胰蛋白酶,覆盖整个皿底,轻轻晃动,片刻后吸出大部分胰酶。将培养皿放入37℃培养箱中放置1~2min左右,取出培养皿,轻轻拍打,在显微镜下观察到绝大部分细胞浮起。用1mL的培养液收集细胞,均匀滴入两个含有4.5mL培养液的培养皿中,前后、左右轻晃分散细胞,显微镜观察到细胞均匀分散后,放入5%CO2、37℃培养箱中培养。
1.2.4细胞纯化
经原代培养所得的细胞中会含有少部分的气管上皮细胞及成纤维细胞,气管上皮细胞及成纤维细胞一般在半小时内就可以贴壁,而气管平滑肌细胞一般至少需1~4h贴壁[18]。利用气管平滑肌细胞与其他细胞贴壁时间不同的特性,就可以将培养皿中的气管平滑肌细胞进行纯化。利用上述细胞传代的方法,将一皿中融合率达80%左右的细胞经0.25%胰酶消化制备成细胞悬液,1∶1传入一新的培养皿;30~60min后,小心地吸出上层细胞悬液(此悬液即含有还未贴壁的气管平滑肌细胞),转入另一培养皿中。反复几次,即可得到较纯的气管平滑肌细胞。
1.2.5细胞免疫荧光
将一皿生长至80%左右的细胞经胰蛋白酶消化后用1mL培养液收集细胞。取经过乙醇消毒后的干净的圆形盖玻片,逐一放入六孔板中,每个盖玻片上滴1~2滴细胞悬液,随后小心地放入培养箱培养过夜,细胞将会贴附于盖玻片上。接下来,PBS洗2~3次,每次1min;4%多聚甲醛固定30min;PBS洗2~3次,每次1min;0.5%TritonX-100孵育20min;PBS洗2~3次,每次1min;50mmol/Lglycine孵育20min;PBS洗2~3次,每次1min;20g/LBSA封闭30min。转入湿盒中。一抗anti-α-smoothmuscleactin(1∶300)孵育1h;20g/LBSA洗3次,每次5min;二抗FITC(1∶50)孵育1h;20g/LBSA洗3次,每次5min;PI染料(50μg/mL)孵育30min;PBS洗3次,每次5min。在共聚焦显微镜下观察。
1.2.6细胞增殖
将细胞消化后所得的细胞悬液按照1×105个/mL的密度种入96孔板,每个孔内加入细胞悬液100μL,96孔板的最外圈全部加入100μL的PBS,防止蒸发。培养1d后,开始用于实验。将待测孔中的培养液全部吸出,加入MTT工作液100μL。37℃培养4h后,吸尽MTT工作液,加入150μLDMSO,放入37℃恒温的酶标仪中测量其在492nm的吸光度[19, 20]。每一天测量一列细胞的吸光度,连续测量。培养中的细胞也需要按时换液。
2 结果
2.1ASM原代细胞
建立原代培养的3~5d后,通过显微镜观察,可见组织块周围有少许细胞爬出,细胞呈梭形或多角梭形(图1A)。继续培养,组织块周围的细胞会生长至融合,呈现出原代气管平滑肌细胞典型的“峰-谷”样结构(图1B)。经传代、纯化后,可以得到比较纯的气管平滑肌细胞(图1C)。传代细胞与原代细胞的表观特性与生长特性基本相同。
2.2细胞免疫荧光
通过对平滑肌内特异性表达的α-smoothmuscleactin(α-SMA) 进行细胞免疫荧光实验,激光共聚焦显微镜下观察,细胞内绿色荧光所示与细胞纵轴方向平行的纤维即为α-SMA,红色荧光为PI染料显示出的细胞核(图2)。可见气管平滑肌细胞的纯度可达99% 以上。
2.3ASMCs增殖曲线
气管平滑肌在传代后生长速度逐渐加快,在3~4d到达对数生长期,生长最为迅速;5d之后到达生长的平台期,细胞间发生接触抑制,细胞生长逐渐停滞,并出现略微的细胞凋亡现象(图3)。
3 讨论
细胞原代分离培养技术主要包括组织块贴壁法和单酶(胰酶[21]或胶原酶[22])或酶联消化法[23],但消化法非常难以控制所运用酶的浓度、浓度比例及消化时间,很容易造成细胞消化过度而损伤细胞或并不能完全消化而使细胞分散[16],比较适合于大块的组织[22];其次,各种酶也都价格不菲。与此相对的是,组织块贴壁法[14, 15]能较好避免上述酶消化法的问题。本文采用的经改进后的组织块贴壁法十分方便、经济,细胞自由地从组织块游出也不会损伤细胞的活性;组织块爬出的速度也较快,适当的组织块间隔保证了细胞的数量与生长的状态;同时,经α-SMA免疫荧光鉴定,培养出的细胞纯度也较高,不需要多代传代培养纯化,且分离细胞可多次传代,表现出较好增殖特性。因此,针对气管平滑肌的原代细胞培养,组织块贴壁法是更为合适的一种方法。

注:A: 建立原代培养后3 d左右,气管平滑肌细胞从组织块爬出。B: 5~6 d后,组织块周围的细胞逐渐生长,部分融合,呈现出原代气管平滑肌细胞生长的典型“峰-谷”样结构。C: 经传代、纯化后的气管平滑肌细胞,细胞呈梭形或长梭形,部分为多角形,并含有一个或数个足突。图1 气管平滑肌原代细胞Note. A. Cells grew out from tissue pieces within 3 to 5 days. B. Cells cultured after 5 to 6 days, “hill-valley” structure can be observed. C. ASMCs after cell passage and purification are fusiform or long-fusiform, some of which have one or more projections.Fig.1 Primary ASMCs
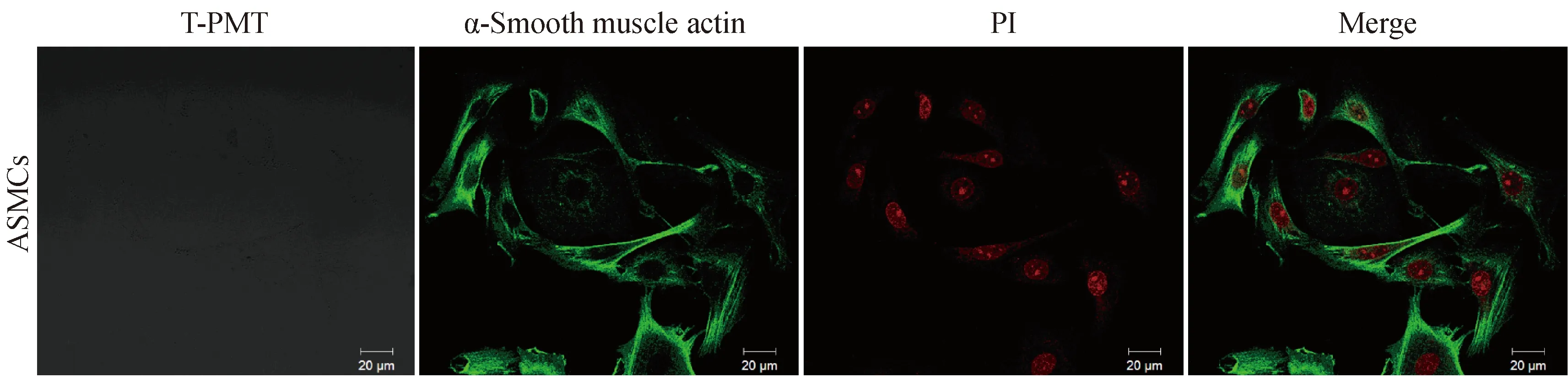
注:T-PMT:透射光;绿色荧光为α-SMA;红色荧光为细胞核。图2 气管平滑肌细胞的免疫荧光鉴定Note. T-PMT. Transmission light; Green fluorescence: α-SMA; Red fluorescence. Nucleus.Fig.2 Identification of ASMCs by immunofluorescence microscopy.

注:A: 接种细胞后的第1 ~7天,通过MTT法处理细胞后,利用酶标仪测量其在492 nm处的吸光度(A492, n=6, Mean±SEM)。B:通过MTT法所得吸光度,绘制气管平滑肌细胞的生长曲线。图3 气管平滑肌细胞生长曲线Note. A. Day 1 to 7 after cell seeding, measuring the absorbance of 492 nm after MTT treatment (A492, n=6, Mean±SEM). B. The growth curve of ASMCs was constructed with absorbance by MTT assay.Fig.3 The growth curve of the ASMCs.
在本实验中,我们主要通过做到以下几点提高气管平滑肌细胞分离培养的成功率。①选择年龄较小的小鼠(5~6周为宜)。因为年龄较小的小鼠还处于生长发育时期,细胞的生长还比较旺盛,原代气管平滑肌更易爬出。②解剖小鼠所用的实验器械都需经75%乙醇浸泡消毒,在超净工作台中使用的器械还需经酒精灯火焰灼烧,以防止原代培养细胞污染。③在解剖小鼠的过程中都必须尽量避免气管平滑肌组织的过度牵拉,以保证气管平滑肌组织的活性,提高细胞爬出率。④组织块转入干燥的培养皿的时候可将组织块稍稍沥干,这样组织块会更快地干涸,使组织块暴露在无培养液的环境下的时间尽可能的短。⑤组织块在培养皿中的排列间隔需要合适。组织块的排列不宜太密,细胞太密集会有接触抑制现象;也不宜太稀疏,细胞密度太低会导致细胞生长缓慢,甚至停滞。⑥在原代细胞培养的前3d都不需要换液,使培养皿在细胞培养箱中静置,以免影响细胞爬出。
总之,本文提供了一种经济又方便的以组织块贴壁法为基础的气管平滑肌原代细胞培养方法,能在短时间内获得数量较多且较纯的原代气管平滑肌细胞,可满足在细胞水平上针对气管平滑肌细胞相关实验的需要,为哮喘等与气管平滑肌相关呼吸道疾病的研究奠定了基础。
[1]姚秀娟, 李艳, 吕喆等. 不同剂量过敏原对滴鼻制备急性和亚急性小鼠哮喘模型的影响[J]. 中国医学装备, 2012, 9(3): 4-8.
[2]钟南山. 我国支气管哮喘防治研究重点及努力方向 [J]. 中华结核与呼吸杂志, 2005, 28(12): 809-811.
[3]MasoliM,FabianD,HoltS,etal.Theglobalburdenofasthma:executivesummaryoftheGINADisseminationCommitteereport[J].Allergy, 2004, 59(5): 469-478.
[4]AkinbamiLJ,MoormanJE,LiuX.Asthmaprevalence,healthcareuse,andmortality:UnitedStates, 2005-2009 [J].NatlHealthStatReport, 2011, (32): 1-14.
[5]MatusovskyOS,KachmarL,IjpmaG,etal.Peripheralairwaysmoothmusclebutnotthetrachealisishypercontractileinanequinemodelofasthma[J].AmJRespirCellMolBiol, 2016, 54(5): 718-27.
[6]PlantPJ,NorthML,WardA,etal.Hypertrophicairwaysmoothmusclemasscorrelateswithincreasedairwayresponsivenessinamurinemodelofasthma[J].AmJRespirCellMolBiol, 2012, 46(4): 532-540.
[7]ChenM.,LvZ,HuangL,etal.TriptolideinhibitsTGF-beta1-inducedcellproliferationinratairwaysmoothmusclecellsbysuppressingSmadsignaling[J].ExpCellRes, 2015, 331(2): 362-368.
[8]WestAR,SyyongHT,SiddiquiS,etal.Airwaycontractilityandremodeling:linkstoasthmasymptoms[J].PulmPharmacolTher, 2013, 26(1): 3-12.
[9]BerairR,SaundersR,BrightlingCE.Originsofincreasedairwaysmoothmusclemassinasthma[J].BMCMed, 2013, 11: 145.
[10]HershensonMB,BrownM,Camoretti-MercadoB,etal.Airwaysmoothmuscleinasthma[J].AnnuRevPathol, 2008, 3: 523-555.
[11]WrightDB,TrianT,SiddiquiS,etal.Phenotypemodulationofairwaysmoothmuscleinasthma[J].PulmPharmacolTher, 2013, 26(1): 42-49.
[12]AbeMK,ChaoTS,SolwayJ,etal.Hydrogenperoxidestimulatesmitogen-activatedproteinkinaseinbovinetrachealmyocytes:implicationsforhumanairwaydisease[J].AmJRespirCellMolBiol, 1994, 11(5): 577-585.
[13]蔺鹏翔, 张焕萍,张爱芝.TGF-β1对不同阶段哮喘模型大鼠气道平滑肌细胞增殖的作用[J]. 中国比较医学杂志, 2010, 20(7): 44-48.
[14]JohnsonPR.,BlackJL,CarlinS,etal.Theproductionofextracellularmatrixproteinsbyhumanpassivelysensitizedairwaysmooth-musclecellsinculture:theeffectofbeclomethasone[J].AmJRespirCritCareMed, 2000, 162(6): 2145-2151.
[15]PangL,KnoxAJ.PGE2releasebybradykinininhumanairwaysmoothmusclecells:involvementofcyclooxygenase-2induction[J].AmJPhysiol, 1997, 273(6Pt1):L1132-1140.
[16]刘志洋, 姚平,佟文革. 豚鼠支气管平滑肌细胞的分离 [J]. 第四军医大学吉林军医学院学报, 2001, 23(1): 26-27.
[17]吴海亚, 戴元荣,尹娟. 改良组织贴块法培养大鼠气道平滑肌细胞 [J]. 温州医学院学报, 2010, 40(6): 571-573.
[18]卓致远, 黄茂, 崔学范, 等. 组织贴块法培养小鼠气道平滑肌细胞 [J]. 中国组织化学与细胞化学杂志, 2007, 12(2): 247-250.
[19]马荣, 王意忠, 郭姗姗, 等.BN大鼠和豚鼠对卵清白蛋白致主动过敏反应的免疫学特性比较 [J]. 中国实验动物学报, 2012, 20(3): 7-12.
[20]徐元基, 周涛, 杜芝燕, 等. 采用活体成像技术监测肿瘤生长及转移模型的建立 [J]. 中国实验动物学报, 2008, 16(1): 19-22.
[21]徐妍, 张焕萍.TNF-α对哮喘模型大鼠气道平滑肌细胞增殖及ERK1/2活性的影响 [J]. 中国比较医学杂志, 2009, 19(7): 23-28.
[22]吴建芳. 小鼠血管平滑肌细胞原代培养方法的改良 [J]. 青海医学院学报, 2008, 29(1): 52-53.
[23]卢虹蓓, 张维溪, 李昌崇. 哮喘大鼠气道平滑肌细胞培养方法探讨 [J]. 温州医学院学报, 2009, 39(3): 264-266.
Isolation, culture and identification of primary airwaysmoothmusclecellsfrommice
YEZhi-hao,XUWen-hao,LIUQing-hua,SHENJin-hua,PENGYong-bo*
(HubeiProvincialKeyLaboratoryforProtectionandApplicationofSpecialPlantsinWulingAreaofChina,InstituteofMedicalBiology,SchoolofLifeScience,South-CentralUniversityforNationalities,Wuhan430074,China)
ObjectiveTodevelopareliablemethodfortheprimarycultureofairwaysmoothmusclecells(ASMCs)frommicebyadherenttissuecultureandtoidentifythembyimmunofluorescencemicroscopy.MethodsAirwaysmoothmuscle(ASM)tissuewasisolatedfromBALB/cmiceunderdissectingmicroscope,andcutinto1mm3pieces.ThesetissueblockswerewashedwithPBSwith1%penicillinandstreptomycin,andadheredon6cmculturedishwith5mLculturemedia.Thedisheswereincubatedat37℃inanincubatorwith5%CO2.TheobtainedprimaryASMCswereidentifiedbyimmunofluorescencemicroscopy,andthecellproliferationwasmeasuredbyMTTassay.ResultsWeobservedthatobviousfusiformcellsgrewoutfromtissueblockswithin3to5days.After5to6days, “hill-valley”structurewasobserved.Aftercellpassageandpurification,theimmunofluorescencemicroscopyshowedthatthepurityofisolatedASMCsreachedupto99%.ThegrowthcurveofASMCswasconstructedbyMTTassay.ConclusionsObtainedASMCsfromthissimpleandeconomicalmethodshowapreferableproliferationability,densityandpurity,andcansatisfytheneedforcellbiologyresearch.
Airwaysmoothmusclecells,SMCs;Primaryculture;Tissuesectionadherence;Immunofluorescence;MTTassay;Mice
PENGYong-bo.E-mail:pyb1980@mail.scuec.edu.cn
国家自然科学基金项目(30900816, 31371307);湖北省自然科学基金项目(2014CFC116)。
叶致豪(1991-),男,硕士研究生,研究方向:气管平滑肌细胞及哮喘相关功能基因分析。
彭勇波,研究方向:气管平滑肌细胞及哮喘相关功能基因分析。E-mail:pyb1980@mail.scuec.edu.cn
研究报告
Q95-33
A
1005-4847(2016)04-0364-05
10.3969/j.issn.1005-4847.2016.04.006
2016-01-25
