M4受体阻滞剂MT3抑制豚鼠形觉剥夺性近视的探讨
2016-09-13李涛周晓东李炳罗秀梅龚哲平
李涛,周晓东*,李炳,罗秀梅,龚哲平
(1.复旦大学附属金山医院,上海 201508;2.上海市蒙山中学,上海 201508)
M4受体阻滞剂MT3抑制豚鼠形觉剥夺性近视的探讨
李涛1,周晓东1*,李炳1,罗秀梅1,龚哲平2
(1.复旦大学附属金山医院,上海201508;2.上海市蒙山中学,上海201508)
目的探讨高度选择性M4受体阻滞剂MT3对豚鼠形觉剥夺性近视的抑制作用及其潜在作用机理。方法3周龄豚鼠随机分为三组:对照组、形觉剥夺组、形觉剥夺+MT3组。实验前后使用带状光检影测量屈光度,A超测量眼生物学参数,RT-PCR检测视网膜和脉络膜中TGF-β2的mRNA相对表达量。结果与对照组右眼相比,形觉剥夺+MT3组豚鼠右眼形成了(-1.44±0.50)D相对近视(右眼-左眼),玻璃体腔和眼轴长度分别延长(0.10±0.02)mm和(0.14±0.07)mm(P =0.001,P<0.001,P<0.001),但近视量、玻璃体腔和眼轴长度增加量均显著小于单纯形觉剥夺组(P<0.001,P<0.001,P<0.001)。单纯形觉剥夺可引起视网膜和脉络膜TGF-β2的mRNA相对表达量下调(P<0.001,P =0.014);而玻璃体腔注射MT3可导致形觉剥夺眼视网膜和脉络膜TGF-β2的mRNA相对表达量上调(P<0.001,P<0.001)。结论MT3能抑制豚鼠形觉剥夺性近视的形成,其可能通过上调视网膜和脉络膜中TGF-β2的mRNA水平而发挥作用。
M4受体阻滞剂;MT3;形觉剥夺性近视;TGF-β2;豚鼠
近视已成为世界上最常见的眼科疾病之一,目前已报道有多种药物可以抑制实验性近视的形成和发展。有研究表明,高度选择性M4受体阻滞剂MT3能有效抑制小鸡[1, 2]和树鼩[3]的形觉剥夺性近视。但其具体作用机制未见相关报道。TGF-β是一类多功能的细胞因子,生物学活性以TGF-β2为主,其在形觉剥夺性近视形成过程中发挥重要作用[4]。本研究通过建立豚鼠形觉剥夺性近视模型,探讨MT3对豚鼠形觉剥夺性近视的抑制作用,进而阐述TGF-β2在形觉剥夺性近视中的表达变化以及MT3的潜在作用机理。
1 材料和方法
1.1实验动物
普通级3周龄英国种短毛三色雄性豚鼠32只,购自上海市松江区松联动物养殖场【SCXK(沪)2012-0008】,体重为140~150g,按实验动物使用的3R原则给予人道主义关怀。在复旦大学附属金山医院动物房【SYXK(沪)2010-0098】中饲养4周,保持室温在20~26 ℃,湿度50%,采用日光灯照明,光照周期12h∶12h;自由摄食、进水。
1.2实验分组
24只豚鼠随机分为三组:①对照组:8只,双眼不进行任何干预,正常开放饲养4周;②形觉剥夺组:8只,右眼形觉剥夺4周,根据李涛等[5]的方法建立形觉剥夺性近视模型;③形觉剥夺+MT3组:8只,右眼形觉剥夺4周,同时每2d进行玻璃体腔注射1次MT3(0.1mg/瓶,日本PeptideInstitute公司)。玻璃体腔注射方法:使用25μL微量注射器于豚鼠右眼上方角膜缘后1mm处进针注入10μL(10μmol/L)MT3,注射药物剂量和浓度参照既往文献报道[1]。其余8只豚鼠在实验前处死,并取材和测量视网膜和脉络膜TGF-β2的mRNA水平。
1.3眼生物学参数测量
分别在实验前和实验干预4周后进行如下眼生物学参数测量:
1.3.1屈光度测量
右眼使用睫状肌麻痹剂复方托吡卡胺滴眼液(参天制药有限公司,中国),每5min滴1次,共4次,30min后进行带状光检影验光(YZ24型,中国苏州六六公司),由验光经验丰富的检查者检影(散光以半量计入球镜)。
1.3.2眼轴长度测量
应用SuperSW1000 眼科A超测量仪,A超频率为11MHz,测量前先行角膜表面麻醉,测量时探头对准角膜中心并垂直于角膜平面。A超测量眼轴、前房深度和晶体厚度,每次测量5 次取平均值,精确到0.01mm,眼轴平均值减去前房深度平均值和晶体厚度平均值得出玻璃体腔长度平均值。
1.4标本收集
分别于实验前(3周龄)和实验干预4周(7周龄)时,处死豚鼠,摘取右眼。在冰块上快速分离视网膜和脉络膜,随后保存于-80℃冰箱。
1.5RT-PCR
按照TRIzolRNA提取试剂盒(美国Invitrogen公司)说明书操作,提取视网膜和脉络膜组织总RNA,紫外分析测定所抽提RNA的浓度。根据Invitrogen公司的M-MLV操作说明书进行,均为RNase-free操作,合成cDNA。根据Genbank中的基因序列,以Primer5.0软件设计特异性引物,由上海生工生物工程技术服务有限公司合成。TGF-β2引物序列如下:Forwardprimer:5′-TACCGTTACTGTGGCTACTGG-3′;Reverseprimer:5′-TAATTTGGACAGGATCTGACCG-3′。PCR反应条件:预发性95℃,2min;之后每一步发性95℃,15s;退火延伸60℃,30s;共进行45个循环;每次在延伸阶段60℃读取吸光值。拷贝CT值,采用2-ΔΔCT法进行分析。以GAPDH为内参,引物序列如下:Forwardprimer:5′-AAAGGCATCTTGGGCTACACCG-3′;Reverseprimer:5′-ATGAGGTCCACCACCCTGTTG-3′。
1.6统计分析

2 结果
2.1眼生物学参数变化
24只豚鼠均呈远视状态,3组间豚鼠右眼和组内豚鼠双眼间屈光度、眼轴长度、前房深度、晶体厚度及玻璃体腔长度差异均无显著性(所有P>0.05)。经过4周实验干预后,3组间豚鼠双眼生物学参数见表1。与对照组右眼相比,形觉剥夺组右眼诱导出(-5.44±1.05)D相对近视(右眼-左眼),玻璃体腔和眼轴长度分别延长(0.45±0.02)mm和(0.38±0.04)mm(P<0.001,P<0.001,P<0.001);形觉剥夺+MT3组豚鼠右眼形成了(-1.44±0.50)D相对近视,玻璃体腔和眼轴长度分别延长(0.10±0.02)mm和(0.14±0.07)mm(P =0.001,P<0.001,P<0.001),但近视量、玻璃体腔和眼轴长度增加量显著小于单纯形觉剥夺组(P<0.001,P<0.001,P<0.001)。而4周实验干预后,3组间前房深度和晶体厚度差异无显著性(P =0.329,P =0.088)。
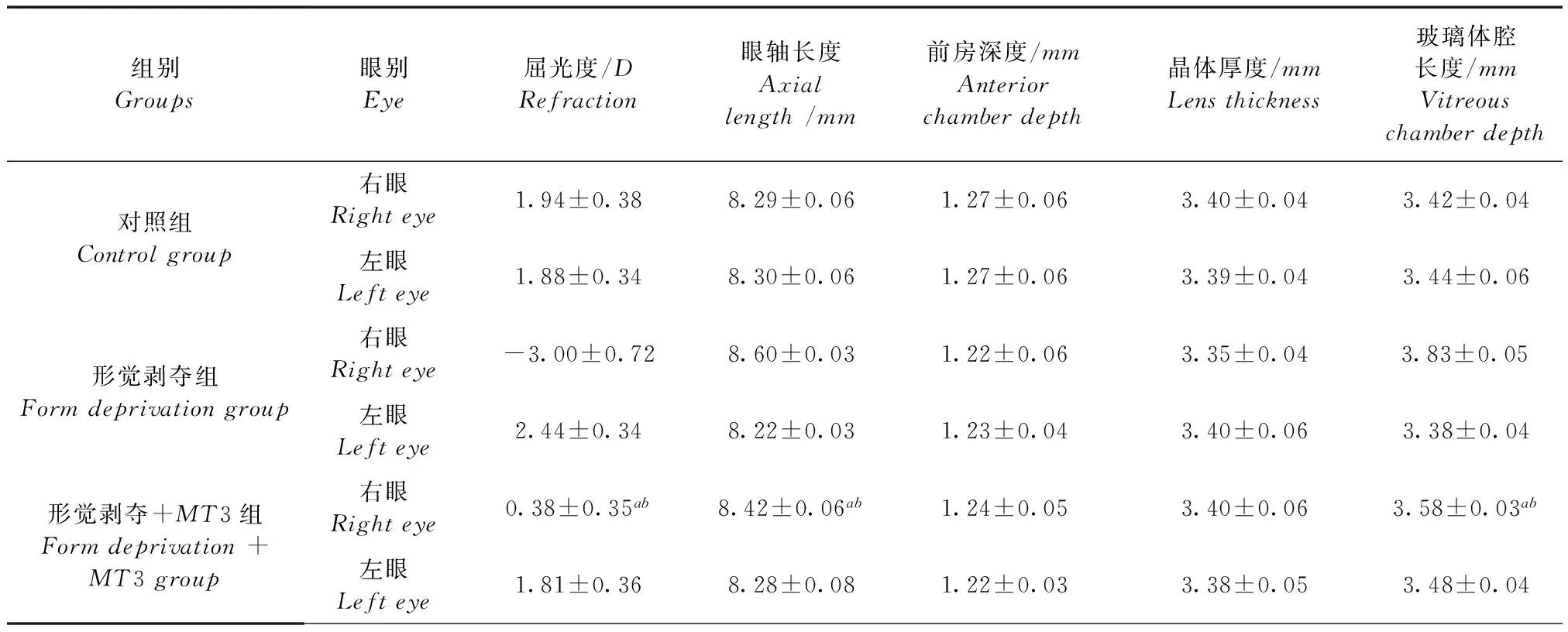
表1 4周实验结束后豚鼠右眼和左眼屈光度和眼生物学参数
注:aP<0.05,与对照组相比;bP<0.05,与形觉剥夺组相比。
Note.aP<0.05,comparedwiththecontrolgroup;bP<0.05,comparedwiththeformdeprivationgroup.
2.2TGF-β2mRNA相对表达量变化
为了解TGF-β2的mRNA水平变化规律,我们首先对3周龄豚鼠进行了视网膜和脉络膜TGF-β2的mRNA相对表达量检测。随着豚鼠成长,视网膜和脉络膜TGF-β2的mRNA相对表达量显著增加(见图1和2)。7周龄豚鼠视网膜和脉络膜TGF-β2的mRNA相对表达量显著高于3周龄豚鼠(P<0.001,P<0.001)。经过4周单纯形觉剥夺后,与对照组右眼相比,形觉剥夺组右眼视网膜和脉络膜TGF-β2的mRNA相对表达量下调(P<0.001,P =0.014);而玻璃体腔注射MT3可以引起形觉剥夺眼视网膜和脉络膜TGF-β2的mRNA相对表达量上调(P<0.001,P<0.001)(见图1、2)。
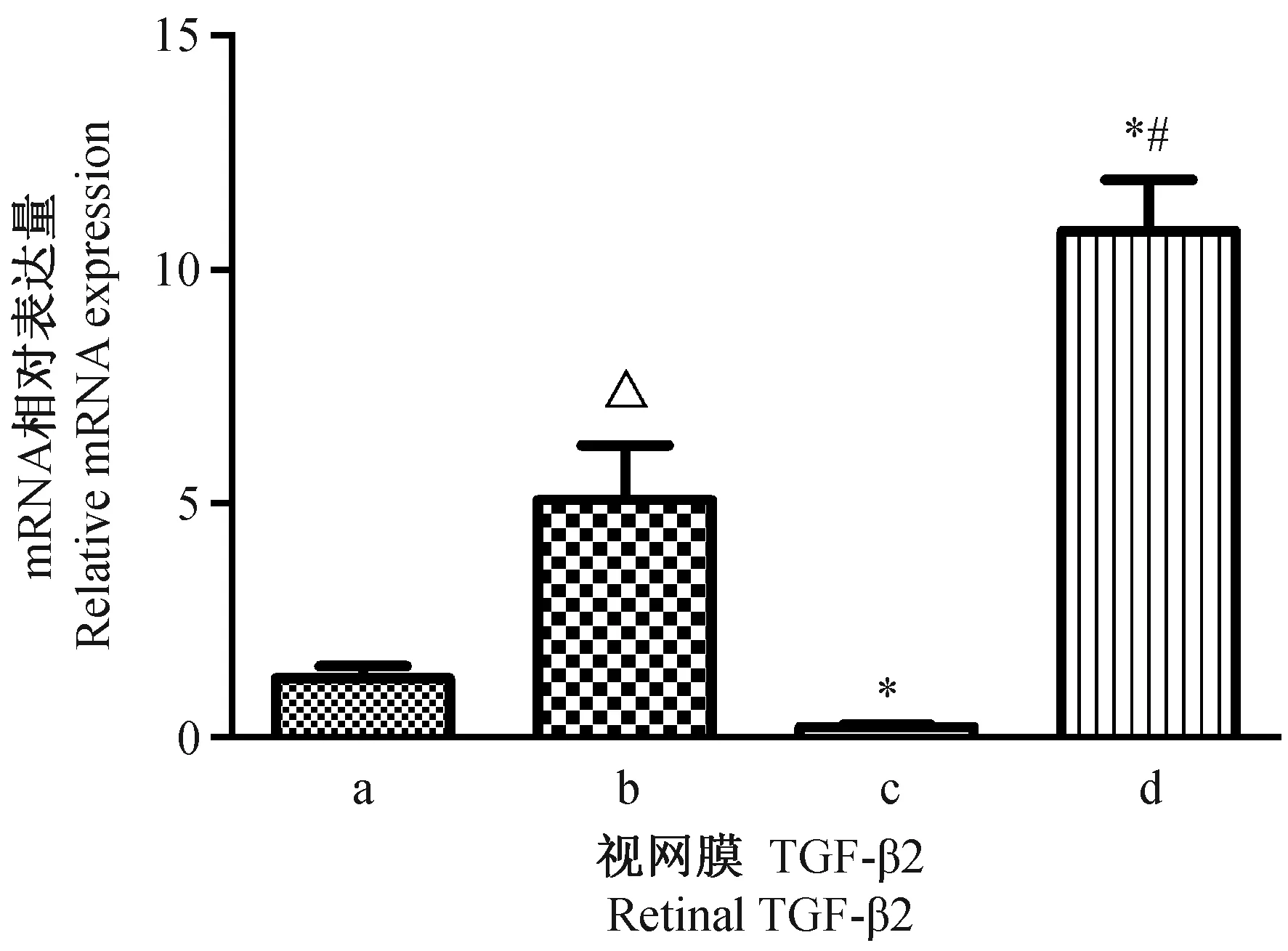
注:a,3周龄组;b,7周龄正常对照组;c,形觉剥夺组;d,形觉剥夺+MT3组。△:与3周龄组相比;*:与对照组相比;#:与形觉剥夺组相比。图1 各组间视网膜TGF-β2的mRNA相对表达量Note. A: 3-week group; b: 7-week control group; c: Form deprivation group; d: Form deprivation + MT3 group.△: Compared with the 3-week group; *: Compared with the control group; #: Compared with the form deprivation group.Fig.1 Relative mRNA expression of retinal TGF-β2 among different groups.
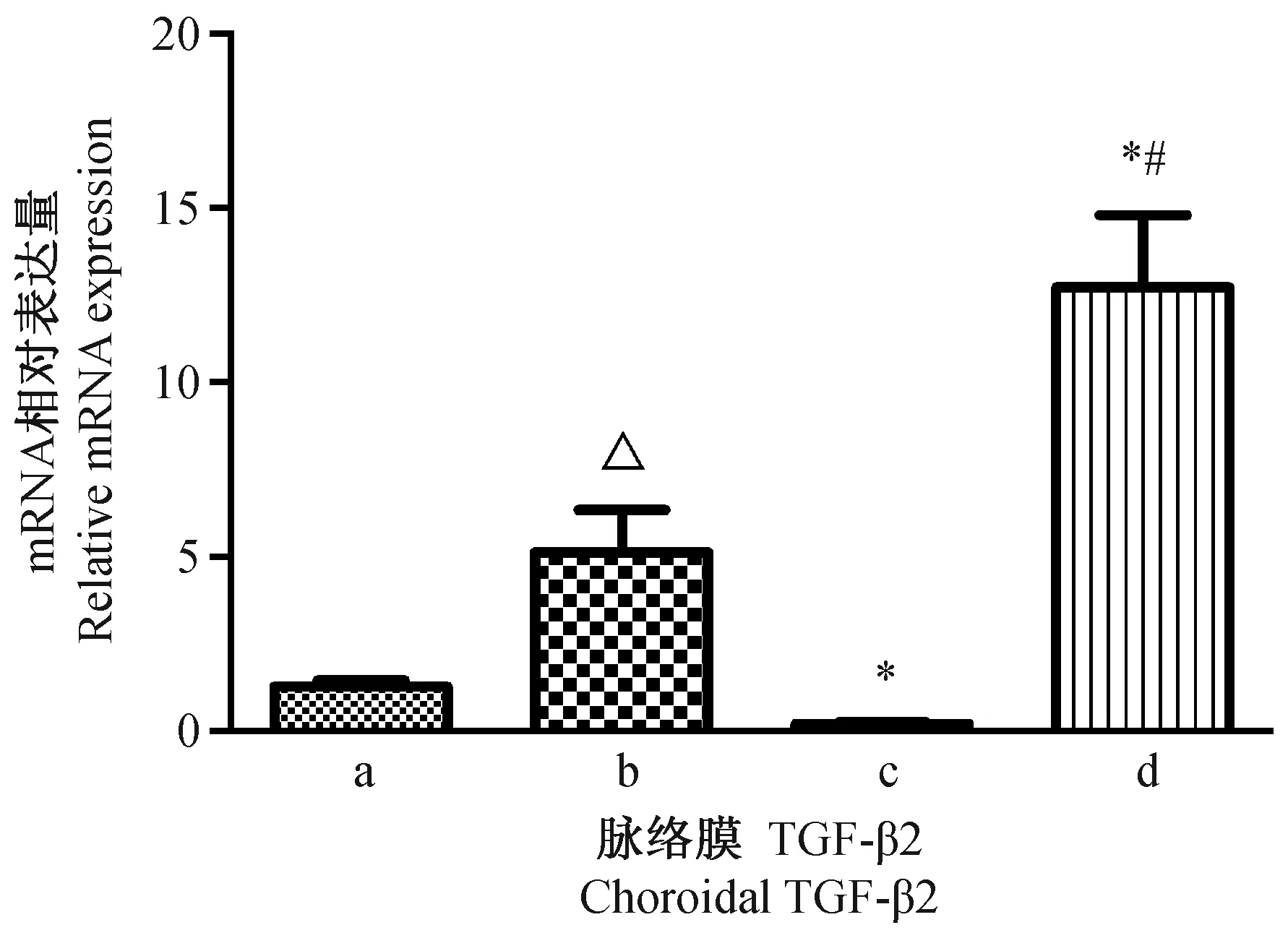
注:a,3周龄组;b,7周龄正常对照组;c,形觉剥夺组;d,形觉剥夺+MT3组。△:与3周龄组相比;*:与对照组相比;#:与形觉剥夺组相比。图2 各组间脉络膜TGF-β2的mRNA相对表达量Note. A: 3-week group; b: 7-week control group; c: Form deprivation group; d, Form deprivation + MT3 group. △: Compared with the 3-week group;*: Compared with the control group; #: Compared with the form deprivation group.Fig.2 Relative mRNA expression of choroidal TGF-β2 among the different groups.
3 讨论
本研究发现高度选择性M4受体阻滞剂MT3能显著抑制豚鼠形觉剥夺性近视,减少玻璃体腔和眼轴长度的延长量。在形觉剥夺联合玻璃体腔注射MT3组的豚鼠右眼中,与正常对照组和单纯形觉剥夺组右眼相比,其视网膜和脉络膜的TGF-β2mRNA相对表达量显著上调。
既往研究表明非选择性M受体阻滞剂阿托品[6]、消旋山莨菪碱[7]、环喷托酯[8]以及选择性M1/M4受体阻滞剂哌仑西平[9]等能够抑制形觉剥夺性近视,但这些药物会引起不同程度的瞳孔散大、调节麻痹等副作用。而MT3作为高度选择性M4受体阻滞剂,其对M4受体的亲和力是M1受体的102倍[10],能够使用最小剂量直接作用于目标受体,减少因结合其他亚型M受体(如M3等)而产生的副作用。McBrien等[1]报道MT3能有效抑制小鸡的形觉剥夺性近视以及预防近视伴随的脉络膜变薄。抑制作用最大的为玻璃体腔注射10μmol/L的MT3,随后是2.5μmol/L,抑制作用最小的则是250nmol/L。这说明玻璃体腔注射MT3的抑制效应具有剂量依赖性,玻璃体腔中MT3的注射浓度越大,对形觉剥夺性近视的抑制作用越强。Nickla等[2]发现MT3能抑制小鸡的形觉剥夺性近视,但对离焦性近视没有抑制作用。Arumugam等[3]证实了MT3对哺乳动物树鼠的形觉剥夺性近视也具有抑制作用。本研究根据McBrien等[1]的报道,对豚鼠采取玻璃体腔注射10μM的MT3,发现MT3能减少约74%的相对近视量。这说明MT3对豚鼠形觉剥夺性近视同样具有抑制作用。
但MT3对形觉剥夺性近视产生抑制效应的机制未见相关报道。既往研究表明TGF-β2作为多功能的细胞因子,在动物实验性近视形成中具有重要作用,但关于TGF-β2的表达变化规律仍有争议。Honda等[11]发现小鸡的近视眼中视网膜和脉络膜的TGF-β2的蛋白和mRNA水平是减少的。周凌霄等[12]发现豚鼠形觉剥夺性近视的视网膜TGF-β2表达下调。然而,Seko等[13]和Kusakari等[14]发现在小鸡的近视眼中,视网膜、脉络膜和巩膜中TGF-β2含量是增加的。在树鼠的近视模型中,视网膜中TGF-β2的蛋白和mRNA水平未发生显著变化[15],而巩膜中TGF-β2的mRNA表达是减少的[16]。
本研究发现3周龄的豚鼠视网膜和脉络膜中均存在TGF-β2表达,随着豚鼠的自然生长,其TGF-β2的mRNA相对表达量也随之增加。形觉剥夺可引起豚鼠视网膜和脉络膜TGF-β2的mRNA相对表达量下调,这与Honda等[11]和周凌霄等[12]的结果一致。TGF-β2能诱导纤溶酶原激活物抑制物(PAI-1)的产生,使得纤溶酶原激活物(PA)活性下降。PA不仅能够直接降解细胞外基质(ECM),还可激活其下游的基质金属蛋白酶(MMP),影响ECM降解。形觉剥夺时,TGF-β2活性下降,导致PAI-1的合成下降,PA活性增加, 引起MMP活性增加,从而发挥其蛋白水解酶功能使ECM过度降解,引起巩膜组织重塑[17]。而MT3则可导致豚鼠形觉剥夺眼视网膜和脉络膜TGF-β2的mRNA相对表达量上调,我们推测MT3可能通过上调形觉剥夺眼视网膜和脉络膜中TGF-β2,进而诱发一系列信号通路变化,减少巩膜组织重塑,维持巩膜生物力学性能,抑制形觉剥夺性近视的形成。此外,我们发现形觉剥夺联合玻璃体腔注射MT3组中,视网膜和脉络膜中TGF-β2的mRNA相对表达量均高于正常对照组,但仍形成了形觉剥夺性近视,说明在形觉剥夺性近视的形成过程中,TGF-β2可能并非唯一变化的细胞因子,还有其他信号通路参与近视的发生发展。
综上所述,高度选择性M4受体阻滞剂MT3能抑制豚鼠形觉剥夺性近视的形成,其可能通过上调视网膜和脉络膜中TGF-β2的mRNA水平而发挥作用。
[1]McBrienNA,ArumugamB,GentleA,etal.TheM4muscarinicantagonistMT-3inhibitsmyopiainchick:evidenceforsiteofaction[J].OphthalPhysiolOpt, 2011, 31(5): 529-539.
[2]NicklaDL,YusupovaY,TotonellyK.ThemuscarinicantagonistMT3distinguishesbetweenformdeprivation-andnegativelens-inducedmyopiainchicks[J].CurrEyeRes, 2015,40(9): 962-967.
[3]ArumugamB,McbrienNA.Muscarinicantagonistcontrolofmyopia:evidenceforM4andM1receptor-basedpathwaysintheinhibitionofexperimentally-inducedaxialmyopiainthetreeshrew[J].InvestOphthalmolVisSci, 2012, 53(9): 5827-5837.
[4]McBrienNA.Regulationofscleralmetabolisminmyopiaandtheroleoftransforminggrowthfactor-beta[J].ExpEyeRes, 2013, 114: 128-140.
[5]李涛, 周晓东, 崔心瀚, 等. 豚鼠眼形觉剥夺后恢复期的生物学参数变化规律探讨 [J]. 中国实验动物学报, 2012, 20(06): 51-56.
[6]DietherS,SchaeffelF,LambrouGN,etal.Effectsofintravitreallyandintraperitoneallyinjectedatropineontwotypesofexperimentalmyopiainchicken[J].ExpEyeRes, 2007, 84(2): 266-274.
[7]杨颖, 李涛, 陈志, 等. 球结膜下注射不同浓度消旋山莨菪碱液对雏鸡形觉剥夺近视眼轴的影响 [J]. 中国实验动物学报, 2011, 19(4): 297-300.
[8]LiT,ZhouXD,ChenZ,etal.Effectsofcyclopentolateonformdeprivationmyopiainguineapigs[J].OpenJOphthalmol, 2015, 5:10-18.
[9]CottriallCL,McbrienNA,AnniesR,etal.Preventionofform-deprivationmyopiawithpirenzepine:astudyofdrugdeliveryanddistribution[J].OphthalPhysiolOpt, 1999, 19(4): 327-335.
[10]LiangJS,Carsi-GabrenasJ,KrajewskiJL,etal.Anti-muscarinictoxinsfromDendroaspisangusticeps[J].Toxicon, 1996, 34(11-12): 1257-1267.
[11]HondaS,FujiiS,SekiyaY,etal.Retinalcontrolontheaxiallengthmediatedbytransforminggrowthfactor-betainchickeye[J].InvestOphthalmolVisSci, 1996, 37(12): 2519-2526.
[12]周凌霄, 王理论, 张林. 形觉剥夺性近视豚鼠视网膜形态学观察及TGF-β2表达 [J]. 国际眼科杂志, 2014, 14(11): 1950-1952.
[13]SekoY,ShimokawaH,TokoroT.ExpressionofbFGFandTGF-beta2inexperimentalmyopiainchicks[J].InvestOphthalmolVisSci, 1995, 36(6): 1183-1187.
[14]KusakariT,SatoT,TokoroT.Visualdeprivationstimulatestheexchangeofthefibrousscleraintothecartilaginoussclerainchicks[J].ExpEyeRes, 2001, 73(4): 533-546.
[15]JoblingAI,WanR,GentleA,etal.RetinalandchoroidalTGF-betainthetreeshrewmodelofmyopia:isoformexpression,activationandeffectsonfunction[J].ExpEyeRes, 2009, 88(3): 458-466.
[16]JoblingAI,NguyenM,GentleA,etal.Isoform-specificchangesinscleraltransforminggrowthfactor-betaexpressionandtheregulationofcollagensynthesisduringmyopiaprogression[J].JBiolChem, 2004, 279(18): 18121-18126.
[17]闫磐石, 张金嵩, 郭浩轶. 转化生长因子-β2在豚鼠形觉剥夺性近视中的表达 [J]. 眼科研究, 2007, 25(3): 168-170.
Preliminary study of the inhibitory effect of selective M4 muscarinicreceptorantagonistMT3onformdeprivationmyopiainguineapigs
LITao1,ZHOUXiao-dong1*,LIBing1,LUOXiu-mei1,GONGZhe-ping2
(1.JinshanHospitalofFudanUniversity; 2.ShanghaiCityMengshanMiddleSchool,Shanghai201508,China)
ObjectiveToevaluatetheinhibitoryeffectofhighlyselectiveM4receptorantagonistMT3ontheformdeprivationmyopiainguineapigsanditspotentialmechanism.MethodsThirty-twohealthymaleguineapigswererandomlydividedintothreegroups:controlgroup,formdeprivationgroup,andformdeprivation+MT3group, 8animalsineachgroup.Refractionwasmeasuredbyretinoscopyaftercycloplegiabeforeandaftertheexperiment.TheocularbiologicaldimensionsweremeasuredbyA-scanultrasound.RT-PCRwasusedtodetecttherelativeexpressionofTGF-β2mRNAintheretinaandchoroid.ResultsComparedwiththerighteyesofcontrolgroup,therighteyesofformdeprivation+MT3groupdevelopedrelativemyopiaof-1.44±0.50D(right-lefteye) (P =0.001).Thevitreouschamberdepthandaxiallengthoftherighteyesweresignificantlyprolongedby0.10±0.02mmand0.14±0.07mm(P<0.001, P<0.001),respectively,buttheincreasesofmyopiaandaxiallengthweresignificantlysmallerthanthatoftheformdeprivationgroup(P<0.001, P<0.001, P<0.001).Down-regulationofrelativemRNAexpressionofTGF-β2inretinaandchoroidwasfoundintheformdeprivationgroup(P<0.001, P =0.014)comparedwiththerighteyesofthecontrolgroup,whileup-regulationofrelativemRNAexpressionofTGF-β2inretinaandchoroidwasfoundintheformdeprivation+MT3group(P<0.001, P<0.001).ConclusionsMT3caninhibitthedevelopmentofformdeprivationmyopiainguineapigs,whichmayplayanimportantrolebytheregulationofTGF-β2mRNAlevelintheretinaandchoroid.
M4receptorantagonist;MT3;Formdeprivationmyopia;TGF-β2;Guneapigs
ZHOUXiao-dong.E-mail:xdzhou2005@163.com
上海市科委自然基金(13ZR1405800);上海市卫生局青年基金(2013-121)。
李涛(1983-),男,硕士,研究方向:眼视光学。Email:litao13013@sina.com
周晓东(1963-),男,主任医师,硕士生导师。Email:xdzhou2005@163.com
研究报告
Q95-33
A
1005-4847(2016)04-0403-05
10.3969/j.issn.1005-4847.2016.04.013
2015-12-09
