小鼠尾静脉注射与心肌注射腺病毒载体转染效率的比较
2016-09-13杨琳珊占贞贞杨珺琦范慧敏刘中民
杨琳珊,占贞贞,汪 波,杨珺琦,范慧敏,2,刘中民,2
(1.同济大学附属东方医院心力衰竭研究所,上海 200120;2.同济大学附属东方医院心胸外科,上海 200120)
小鼠尾静脉注射与心肌注射腺病毒载体转染效率的比较
杨琳珊1,占贞贞1,汪波1,杨珺琦1,范慧敏1,2,刘中民1,2
(1.同济大学附属东方医院心力衰竭研究所,上海200120;2.同济大学附属东方医院心胸外科,上海200120)
目的比较小鼠尾静脉注射或心肌注射腺病毒载体后心脏组织和肝脏组织中靶基因的转染效率。方法构建表达绿色荧光蛋白GFP的腺病毒载体(GFP-Ad)。C57BL/6小鼠20只随机分为尾静脉注射腺病毒载体组与心肌注射腺病毒载体组各10只,用实时定量PCR检测不同时间点小鼠心肌组织和肝脏组织中GFP的mRNA表达水平,并且通过荧光显微镜观察GFP荧光表达情况。结果心肌注射腺病毒载体组心脏组织中GFP的mRNA表达水平明显高于尾静脉注射腺病毒载体组,心肌注射腺病毒载体组心脏组织中荧光强度明显增强。同时,我们发现两组的肝脏组织中GFP 的mRNA表达水平和荧光强度均明显高于心脏组织中;且在尾静脉注射腺病毒载体组,肝脏组织中GFP的 mRNA表达水平和荧光强度在7 d达高峰,而心肌注射腺病毒载体组则在3 d达高峰。结论提高心脏组织中靶基因的转染效率宜采用心肌注射腺病毒载体的方法;对于肝脏组织转染效率,两种注射方法均可,鉴于尾静脉注射腺病毒载体的方法创伤小,宜采用。
心肌注射;尾静脉注射;腺病毒载体;转染效率
小鼠尾静脉注射是动物实验中药物干预的常用途径。但小鼠尾静脉较细,造成穿刺难度大,因此很大程度上制约了实验的成功与否,且其药效如何也有待论证。心肌注射是除尾静脉给药的另外一种方法,但由于其是一种有创的给药途径,因此其应用也受限制。现将这两种方法的心脏组织及肝脏组织中靶基因的转染效率作比较。
1 材料和方法
1.1实验动物
C57BL/6雄性小鼠20只,8 周龄,体重(24~26)g,购于上海斯莱克实验动物有限责任公司(生产许可证【SCXK(沪)2012-0002】),随机分为小鼠尾静脉注射组和心肌注射组各10只,饲养于同济大学实验动物中心屏障环境【SYXK(沪)2014-0026】。
1.2主要试剂和仪器
SYBR Green QPCR Mix(日本Toyobo公司);组织转染带绿色荧光的腺病毒载体由上海和元生物有限公司合成。0.1%戊巴比妥钠,倒置显微镜,小动物呼吸机,显微外科手术器械。
1.3方法
1.3.1小鼠尾静脉注射:将小鼠置于固定器内,露出尾巴,按陈育尧[1]的方法尾静脉注射GFP-Ad。一次注射量为0.05~0.1 mL/10 g 体重[2]。空白对照组注射同剂量PBS。
1.3.2小鼠心肌注射:0.1%戊巴比妥钠(0.1 mL/10 g)腹腔麻醉,小鼠肌肉松弛充分后气管插管,连接呼吸机。小鼠右侧卧位固定于手术台上,在距胸骨左缘0.3 cm 处沿4、5 肋间做横行切口进胸,暴露心脏,使用一次性胰岛素注射器于靠近心尖处直接心肌注射腺病毒液体,1只小鼠50 μL[4]。注射完毕后使用3-0 线逐层关闭胸腔。断开呼吸机,术后将小鼠放置于温毯上密切观察。空白对照组按同样操作注射同剂量PBS。
1.4检测组织中GFP的表达水平
两组小鼠于实验后第3、5、7天分别处死3对,分别取心脏组织和肝脏组织做冰冻切片和提取RNA做实时荧光定量QPCR。抽提组织RNA后,利用SYBR MicroRNA Assay Kit 中的探针进行实时荧光定量PCR,检测GFP表达水平。以U6 snRNA 为内参,反应体系为10 μL,2-ΔΔCt方法计算GFP的相对表达水平。定量反应条件为95 ℃10 min,扩增1 个循环, 95 ℃ 15 s,扩增40 个循环, 60 ℃ 1 min 扩增40 个循环,在每个循环的60 ℃时测定荧光。
1.5统计学方法

2 结果
2.1心脏组织和肝脏组织中GFP的表达水平比较
qPCR检测结果显示,心肌注射组的心脏组织中GFP的mRNA表达水平明显高于尾静脉注射组。两个实验组的肝脏组织中GFP的mRNA表达水平均明显高于心脏组织中,尾静脉注射组升高更为明显。GFP的mRNA表达水平尾静脉注射组在7 d左右达高峰,而心肌注射组则在3 d左右达高峰;同时QPCR 检测发现从小鼠尾静脉注射组取得的肝脏组织和心脏组织中的GFP的mRNA表达水平在3 d和5 d左右是下调于从心肌注射组中取得的肝脏组织,而在7 d左右结果却与之相反,这种变化在肝脏组织中更明显。见图1。
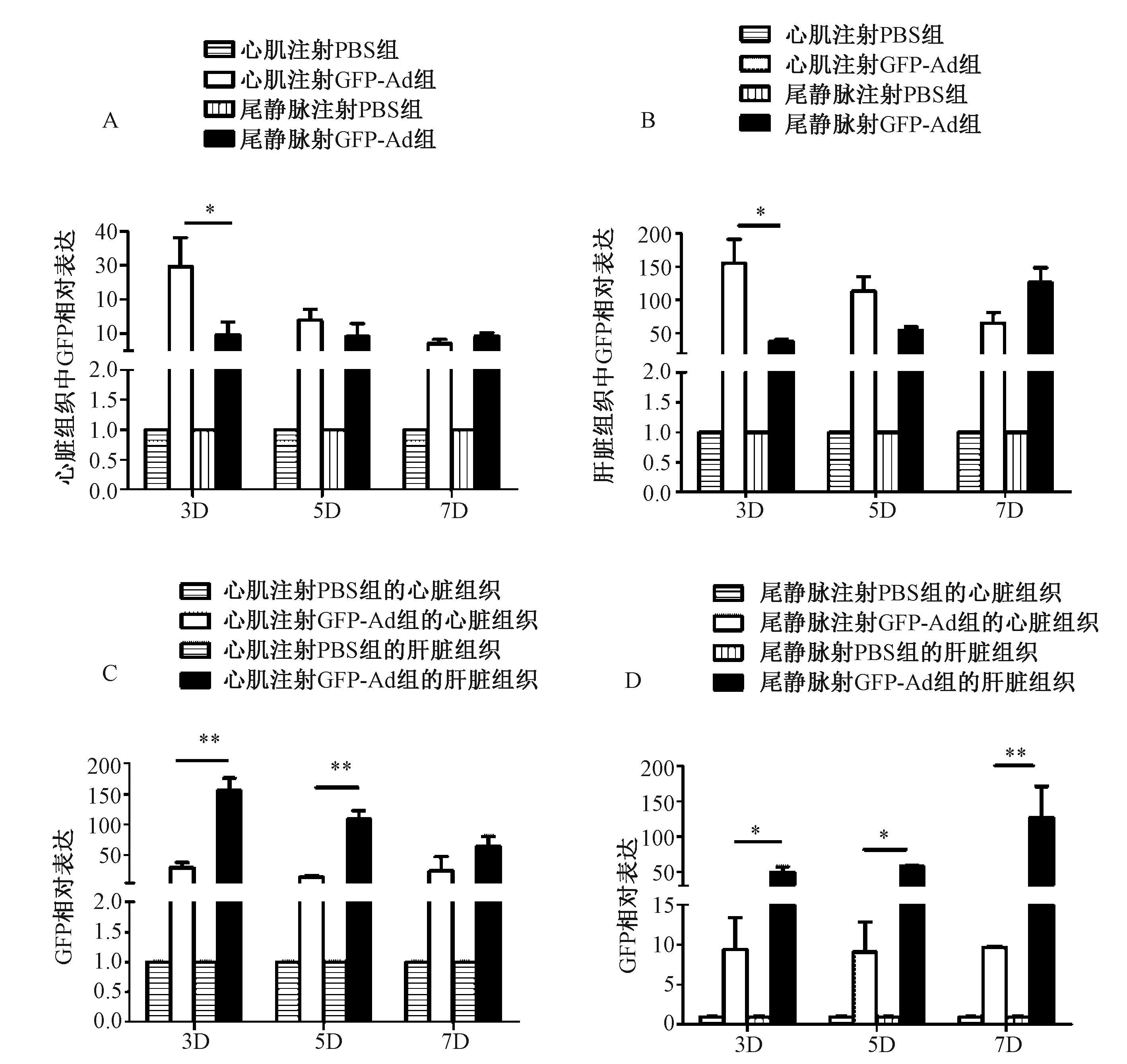
A:心肌注射腺病毒载体组与尾静脉注射腺病毒载体组,心脏组织中GFP的mRNA表达水平比较。B:心肌注射腺病毒载体组与尾静脉注射腺病毒载体组,肝脏组织中GFP的mRNA表达水平比较。C:心肌注射腺病毒载体组,心脏组织与肝脏组织中GFP的mRNA表达水平比较。D:尾静脉注射腺病毒载体组,心脏组织与肝脏组织中GFP的mRNA表达水平比较。*为P<0.05,**为P<0.01。图1 两实验组小鼠组织中GFP表达水平Note. A: Comparison of GFP mRNA expression levels in the mouse heart tissues of the intramyocardial injection and tail vein injection groups. B:Comparison of GFP mRNA expression levels in the mouse liver tissue of the intramyocardial injection and tail vein injection groups.C:Comparison of GFP mRNA expression levels in the mouse heart and liver tissues in the intramyocardial injection group. D. Comparison of GFP mRNA expression levels in the mouse heart and liver tissues in the tail vein injection group. *P<0.05,**P<0.01.Fig.1 GFP mRNA levels in mouse tissues of the two groups
2.2心脏组织和肝脏组织冰冻切片观察GFP荧光情况
结果发现,心脏组织中的GFP荧光强度心肌注射组明显强于尾静脉注射组。在尾静脉注射组,肝脏组织中GFP荧光明显强于心脏组织,且在7 d左右达高峰,而在心肌注射组,则心脏组织中GFP荧光强度明显高于肝脏组织,且在3 d左右达高峰。见图2。

A: 心肌注射腺病毒载体组与尾静脉注射腺病毒载体组的小鼠心脏组织中不同时间的GFP荧光强度比较。B:尾静脉注射腺病毒载体组,心脏组织与肝脏组织不同时间的GFP荧光强度比较。C:心肌注射腺病毒载体组,心脏组织与肝脏组织不同时间的GFP荧光强度比较。图2 两组小鼠组织中GFP荧光强度比较。(标尺=100 μm) Note. A: Comparison of fluorescence intensity of GFP in the mouse heart tissues at different time points of the intramyocardial and tail vein injection groups. B: Comparison of the fluorescence intensity of GFP in the mouse heart and liver tissues at different time points of the tail vein injection group. C: Comparison of the fluorescence intensity of GFP in the mouse heart and liver tissues at different time points of the intramyocardial injection group. Fig.2 GFP fluorescence expression in mouse tissues of the two groups(Bar=100 μm)
3 讨论
3.1小鼠尾静脉注射的几个问题探讨
3.1.1尾静脉扩张:应该保持实验室温度在26 ℃左右,尤其是冬季,适宜的室内温度对小鼠尾静脉有一定的扩张作用并且能够使血流通畅降低注射阻力。目前使用较多的是用酒精涂擦使尾静脉扩张,也有使用红外线灯加热小鼠尾部,另外有报道使用硝酸甘油扩张尾静脉从而降低穿剌难度,且其效果优于75%乙醇[5]。我们所使用的热水浸泡联合酒精涂擦法能使尾静脉扩张更充分,其效果优于单用热水浸泡法和单用酒精涂擦法。但是水浴的温度以50℃~60℃较为适宜,温度太低则尾静脉扩张效果不理想,若温度超过70 ℃则容易烫伤皮层,甚至在拉尾固定的过程中小鼠挣扎导致皮层脱落并出血,容易诱发感染。
3.1.2注射剂量:单次小鼠尾静脉注射剂量不宜超过400 μL每只,大剂量迅速推注容易造成小鼠循环超负荷导致猝死,特别是悬浮颗粒型液体更容易造成栓塞导致小鼠死亡,因此推注药物的过程应该缓慢并观察小鼠的反应。我们在实验过程中采用的注射剂量为200 μL每只,即约为全血体积的14%,小于100 μL注射剂量时在一次注射不成功时药物损失量的影响会比较大,因此200 μL是一个比较适宜的注射量。
3.2小鼠心肌注射的几个问题探讨
3.2.1小鼠模型的建立:成功的麻醉与气管插管是建立模型的前提,麻醉过量易导致小鼠死亡,故麻醉用量应谨慎, 药量宜少不宜多, 以使小鼠不能自主翻身为宜,本实验以0.1%戊巴比妥钠(0.1 mL/10 g)腹腔麻醉,效果良好。气管插管次数不宜太多,因插管次数太多易致喉水肿而窒息死亡,插管时用小镊子拉出鼠舌, 顺舌根插成功率较高, 插管后接呼吸机, 若小鼠胸廓起伏与呼吸机频率一致提示插管成功。
3.2.2心肌注射:成功开胸暴露心脏后,即于靠近心尖处直接心肌注射腺病毒液体,每只小鼠50 μL。注意排空注射器内空气,以免造成空气栓塞导致小鼠死亡。由于小鼠心肌比较薄,故注射液体时注射器针头不能刺入太深以防注入心腔。
3.3腺病毒转染效率的探讨
我们实验比较了心肌注射或尾静脉注射腺病毒载体后心脏组织和肝脏组织中靶基因的转染效率,结果发现心肌注射腺病毒载体方法心脏组织中靶基因的转染效率明显高于尾静脉注射方法,且两种方法注射腺病毒载体后肝脏组织中靶基因的转染效率均明显高于心脏组织中,尾静脉注射组升高更为明显,且在尾静脉注射腺病毒载体组,肝脏组织中靶基因的转染效率7 d达高峰,而心肌注射腺病毒载体组则在3 d达高峰。小鼠血液循环和人体血液循环是相似的,血液都是从左心室射入主动脉,沿动脉到全身各部包括肝脏的毛细血管,然后汇入小静脉,大静脉,最后经上下腔静脉回到右心房。其中,肝脏的血液循环十分丰富,肝脏对来自体内和体外的许多非营养物质如各种药物、毒物以及体内某些代谢产物,具有生物转化作用,通过新陈代谢将它们彻底分解或以原形排出体外。无论是心肌注射腺病毒载体还是尾静脉注射腺病毒载体方法,腺病毒载体相当于一种外来非营养物质,其首先进入肝脏进行生物转化,因此,两种方法注射腺病毒载体后肝脏组织中靶基因的转染效率均明显高于心脏组织中。腺病毒载体从尾静脉注入体内后,其首先经过静脉回流进入心脏,然后才经左心室射入主动脉,沿动脉到达肝脏组织中;而心肌注射腺病毒载体则直接从左心室射入主动脉,然后到达肝脏,因此两种方法注射腺病毒载体后,其在肝脏组织中的转染效率各显示不同的高峰,尾静脉注射腺病毒载体组肝脏组织中靶基因的转染效率7 d达高峰,而心肌注射腺病毒载体组则在3 d达高峰。肝脏还有药物首过效应,首过效应既某些药物经胃肠道等途径给药后,经门脉系统进入肝脏,在肝脏被代谢,而使进入血液循环的原形药量减少的现象,尾静脉注射腺病毒进入体内后首先经过肝脏的首过消除效应,到达心脏组织后病毒量减少,因此尾静脉注射腺病毒载体方法心脏组织中靶基因的转染效率明显低于心肌注射方法。具体机制还有待深入研究。
总之,小鼠尾静脉注射法是常用的药物干预途径,传统的方法是采用1 mL 注射器 (0.5 号针头)在回抽见血后予以注射,但是由于注射过程中小鼠挣扎尾部摆动易使针头移位,导致注射失败,且难以估算注射液有效入量,影响最终的实验结果。采用我们自制的这种方法进行尾静脉注射可以准确的估算注射液有效入量,但是由于其操作繁琐,耗时较久,且药物经过肝脏的首过消除到达心脏后其疗效有所下降,因此如果是研究肝脏方面的疾病,采用尾静脉注射效果优于心肌注射。采用心肌注射法,药物没有肝脏的首过消除效应,心脏组织中腺病毒转染效率明显增加,因此用于研究心脏方面疾病此法效果更好;且小鼠开胸可用于做心梗模型,利于后续方面的研究。
[1]陈育尧, 黄雪玲. 小鼠尾静脉注射法[J]. 毒理学杂志, 2008, 22(4):311-312.
[2]蔡陈之, 陈凯. 小鼠尾静脉注射的几点体会[J]. 科技向导, (2010),(6): 4.
[3]Oleg Tarnavski JRM., Schinke M, Nie Q, et al. Mouse cardiac surgery comprehensive techniques for the generation of human diseases and their application for genomic studies [J]. Physiol Genomics, 2004, 16(3): 349-60.
[4]Svensson EC, M., Marshall DJ, Woodard K, et al. Efficient and stable transduction of cardiomyocytes after intramyocardial injection or intracoronary perfusion with recombinant adeno-associated virus vectors [J]. Circulation, 1999, 99: 201-205.
[5]蒋兰兰, 冯俊涛, 罗百灵, 等. 硝酸甘油干预法对小鼠尾静脉穿刺效果的影响[J]. 中国医学工程, 2004, 12(4): 92-93.
Comparison of the efficiency of tail vein injection and intramyocardial injection of adenovirus vector in mice
YANG Lin-shan1, ZHAN Zhen-zhen1, WANG Bo1, YANG Jun-qi,1FAN Hui-min1,2, LIU Zhong-min1,2
(1. Institute of Heart Failure, East Hospital, Tongji University School of Medicine, Shanghai 200120, China;2.Cardio-Thoracic Surgery, East Hospital, Tongji University School of Medicine, Shanghai 200120)
ObjectiveTo investigate the efficiency of target gene transfection of the heart and liver after tail vein or intramyocardial injection of adenovirus vector (GFP-Ad). MethodsGFP-AD was constructed at first. A total of 20 male 8-week old C57BL/6 mice were randomly and equally divided into tail vein injection of GFP-AD group and intramyocardial injection of GFP-AD group. The mRNA levels of GFP in the heart and liver tissues were detected by Q-PCR at different time points. Fluorescence microscopy was performed to visualize the expression of GFP fluorescence. Results Compared with the tail vein injection group, the GFP mRNA level in mouse heart tissue was apparently higher in the intramyocardial injection group. In both groups, the GFP mRNA levels in liver tissue were significantly increased compared with that in the heart tissue. In the tail vein injection group, the GFP mRNA level in liver tissue reached a peak on day 7; but in the intramyocardial injection group, the mRNA level of GFP in liver tissue reached apeak on day 3. We also observed the same trend of GFP fluorescence expression in the tail vein injection group compared with that in the intramyocardial injection group.ConclusionsIntramyocardial injection of adenovirus vector is suitable to achieve a higher transfection efficiency in mouse heart tissue compared with the tail vein injection method. Although both injection methods are suitable for transfection of mouse liver, the tail vein injection method is preferential for it is simple and less invasive.
Intramyocardial injection; Tail vein injection; Adenovirus vector; Transfection efficiency,Mice.
国家自然科学基金面上项目(81370433,81373146,81571541);上海市“创新行动计划”基础研究领域项目(14JC1405200)。
杨琳珊,女,硕士在读,研究方向:心血管免疫;Email: yls2011114@163.com。
占贞贞,副教授、副研究员,Email: zhanzz@tongji.edu.cn;刘中民,教授、主任医师,Email: liu.zhongmin@tongji.edu.cn。
研究报告
R-33
A
1671-7856(2016) 08-0042-05
10.3969.j.issn.1671-7856.2016.08.006
2016-04-26
