急性肺损伤大鼠呼吸膜AQP1和AQP5的表达
2016-09-13乔国华
岳 胜,朱 平,岳 磊,乔国华
(郑州大学附属洛阳中心医院急诊科,河南 洛阳 471000)
急性肺损伤大鼠呼吸膜AQP1和AQP5的表达
岳胜,朱平,岳磊,乔国华
(郑州大学附属洛阳中心医院急诊科,河南 洛阳471000)
目的确定水通道蛋白AQP1及AQP5是否在大鼠肺泡毛细血管膜(呼吸膜)表达,进而研究急性肺损伤(ALI)大鼠AQP1和AQP5的表达调节及激素干预的作用。方法采用亲和的抗人AQP1和AQP5抗体,应用免疫组化及免疫电镜的方法研究AQP1及AQP5在呼吸膜的分布。选用肺泡内灌注脂多糖(LPS)制作大鼠ALI动物模型,研究ALI时呼吸膜AQP1及AQP5的变化。结果免疫染色显示AQP1主要表达于正常肺组织的微血管内皮,而AQP5主要表达于肺泡I型上皮细胞。免疫组化分析进一步表明LPS灌注后4h~48hAQP1及AQP5在呼吸膜的表达均下降;AQP1蛋白于LPS灌注后24h及激素干预后有部分恢复(P<0.05),而AQP5无这种恢复现象。结论 ALI时AQP1及AQP5在呼吸膜的表达减少,提示ALI时AQP1和AQP5的下降表达可能与其液体转运的异常有关。
水通道蛋白1,水通道蛋白5,急性肺损伤,激素
临床中,肺水肿的形成涉及肺间质和毛细血管的液体转运,近年来关于肺组织中液体转运的分子机制的研究显示,水通道蛋白(aquaporins,AQPs)是一组在哺乳动物体内表达的水选择通道的分子家族,它们可以增强浆膜面水通透力的功能,因而可以提供快速液体转运的通路[1,2]。在一些病理条件下,其可影响和破坏肺组织流体的运输,造成充血性心力衰竭、呼吸窘迫综合征、肺水肿损伤等。目前,涉及到水通道蛋白调节急性肺损伤(acute lung injury,ALI)的研究还很少。本研究探讨了水通道蛋白家族成员AQP1和AQP5在大鼠肺泡毛细血管膜的表达,并研究内毒素(LPS)诱导的急性肺损伤(ALI)大鼠模型中AQP1和AQP5的表达调节及激素干预的作用。
1 材料和方法
1.1动物
雄性SD大鼠共45只,均购自上海交通大学动物实验中心(SCXK(沪) 2013-0013),体质量(230±15)g,所有大鼠均在郑州大学附属洛阳中心医院动物实验室(SYXK (豫) 2011-0076)的清洁环境下饲养观察,普通饲料适应性喂养1周后使用。
1.2试剂和仪器
山羊抗人AQP1多克隆抗体,大鼠抗人AQP5单克隆抗体,小鼠抗人β-actin单克隆抗体购自美国Sigma公司,免疫组化S-P试剂盒,DAB显色试剂盒均购自北京中杉生物技术公司。RPMI Medium 1640培养基,Western-blot转印仪,蛋白电泳仪购自美国Bio-Rad公司。另备24孔板、OMEM培养液、DMSO、酶标仪、漩涡振荡器、移液枪等。
1.3急性肺损伤动物模型的制备
将SD大鼠随机分为3组,即NS组(对照组)(n=10),脂多糖(LPS)组(n=20)和激素组(n=15)。将3组大鼠均用七氟烷麻醉,暴露气管,将NS对照组(n=10)按0.5 mL/kg NS灌注大鼠气管,12 h后观察其生命体征和肺组织变化。将LPS (E. coli serotype 055: B5 LPS, Sigma, USA)按200 μg/kg溶于无菌NS,使用25号针头予大鼠0.5 mL/kg气管注射,观察气管注射LPS后4 h、12 h、24 h和48 h等不同阶段(n=5)的大鼠肺组织变化,激素组大鼠给予0.5 mL/kg LPS(200 μg/kg)气管内注射,并同时给予甲基强的松龙(30 mg/kg)尾静脉注射。观察注射后4 h、12 h、24 h等不同阶段(n=5)的大鼠肺组织变化。
1.4样本检测
将大鼠腹腔注射戊巴比妥钠(50 mg/kg),颈动脉插管监测血压。将大鼠放血处死,暴露肺组织和气管。采用2.5 mL的37℃无菌无热原的磷酸盐缓冲溶液(PBS)进行经右主气管进行灌洗肺组织,共计9次。丢弃第1次的灌洗液,将其他8个2.5 mL灌洗液馏分回收和汇总。使用标准法计算其总细胞数。
将细胞固定并行HE染色。将BAL在1 000 r/min离心10 min,并收集。BAL中的白蛋白浓缩5倍并用溴甲酚绿法测定。右下肺部分用4%多聚甲醛固定,石蜡包埋,每个肺切片常规用苏木精染色处理,光镜下观察。对大鼠左上肺行免疫组化研究,通过电子显微镜和免疫电子显微镜检查,左肺的其余部分进行称量,获得肺湿重,然后将其放置于60℃温箱内干燥脱水5 d。待其重量不再变化时称其干重。
1.5免疫组织化学和免疫电镜观察
AQP1和AQP5在肺组织中的表达:(1)免疫组化染色:按试剂盒说明书操作。抗AQPI抗体浓度1∶ 1000,抗AQP5抗体浓度1∶ 1000。图像分析测AQP1和AQP5阳性染色的平均吸光度(A)。(2)免疫电镜染色:扰AOP5抗体浓度1∶ 1000。(3)肺组织胞膜蛋白AOP1及AQP5分析:免疫印迹法一抗 (抗AQP1抗体1∶ 1000:抗AQP5抗体,1∶ 500),4℃过夜孵育,二抗(碱性磷酸酶标记,1∶ 2000)孵育后显色。阳性显色为棕黄色,经UVP扫描仪扫描成像,计算曲线下面积的A值。
1.6免疫组化染色结果判定
AQP1和AQP5在肺组织中的表达强度依阳性细胞数分为四级:(1)阴性(-):阳性细胞数<5%;(2)弱阳性(+):阳性细胞数5%~20%;(3)阳性(++):阳性细胞数20%~60%;(4)强阳性(+++):阳性细胞数>60%。
1.7Western-blot检测各组肺组织中 AQP1和AQP5蛋白含量
各组肺组织块称重,加入蛋白裂解液以及PMSF(50 μL PMSF + 3 mL 蛋白裂解液),用匀浆器研磨组织;4℃裂解30 min,置入4℃恒温离心机,以离心半径10 cm、12 000 r/min 离心15 min。收集上清液,BCA 试剂盒检测蛋白浓度。将样品蛋白8 μg在 5%~17%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转PVDF 膜,PBS 液加0.05% Tween-20 (PBS-T)洗涤,2% 脱脂奶粉室温封闭2 h;再用PBS-T洗膜,加AQP1和AQP5一抗,4℃孵育过夜,PBS-T 洗涤,二抗(羊抗兔/鼠 IgG)室温孵育 2 h,PBS-T 洗膜,用 ECL 方法在暗室显影,X线片曝光。采用Image Pro Plus 图像分析软件分析结果。
1.8统计学方法
应用SPSS 18.0软件:计数资料采用t检验,计量资料采用方差分析,P<0.05差异有统计学意义。

表1 LPS组各阶段BALF中PMN%和肺组织中AQP1和AQP5含量
注:*P<0.05, vs. NS 对照组;#P<0.05, vs. LPS 4 h~12 h 组.
Note:*P<0.05, vs. the NS control group;#P<0.05, vs. the LPS 4-12 h groups.
2 结果
2.1肺损伤的严重程度
3组中所有大鼠均存活。LPS组大鼠呼吸正常,和NS对照组大鼠的平均动脉压95±2.6 mmHg比较,LPS组大鼠的平均动脉压明显降低,4 h和12 h的平均动脉压分别为68±6.6 mmHg和71±6.8 mmHg,其差异具有统计学意义(P<0.05)。24 h和48 h大鼠的平均动脉压分别为83±10.4 mmHg和87±7.9 mmHg,虽有部分恢复,但和NS对照组大鼠相比,差异仍具有统计学意义(P<0.05)。
LPS灌注后,大鼠的肺湿干重比在显著增加4 h和12 h时显著增加,分别为6.73±0.68和6.50±0.59,和NS对照组大鼠(4.48±0.37)比较,差异具有统计学意义(P<0.05)。和NS对照组大鼠(4.48±0.37)比较,LPS组大鼠24 h和48 h时肺湿干重比的差异无统计学意义(P>0.05)。
2.2LPS组的组织学检查
组织学检查显示,LPS注入大鼠气管后,4 h和12 h后,大鼠肺间质水肿,肺组织明显中性粒细胞浸润。电镜显示大鼠肺组织Ⅰ型肺泡上皮肿胀,细胞膜突出像是肺泡腔空间的泡沫,同时,Ⅱ型细胞绒毛干枯脱落。在24 h和48 h后,在肺组织中检测到类似的组织学变化,在脂多糖灌注后,肺间质水肿缓解。电镜观察肺泡毛细管膜尚连续,但厚度不均匀。
2.3AQP1和AQP5在正常肺组织细胞中的分布
在NS对照组,免疫标记法显示AQP1主要分布在肺组织微血管的内皮细胞膜,以及少部分分布在肺上皮细胞膜(图1)。检测显示AQP5主要表达在I型肺泡膜上表达(图2),但不在II型肺泡上皮细胞、血管内皮细胞和间质细胞内分布。免疫电镜显示AQP1在微血管内皮细胞的顶端和基底膜上,而AQP5主要存在于I型肺泡上皮细胞的顶膜(图3)。
2.4不同组间AQP1和AQP5的表达
气管内灌注LPS 4 h~48 h后,免疫组化分析大鼠肺组织中AQP1和AQP5的表达。与NS对照组比较,LPS组AQP1和AQP5在细胞中表达的位置和特异性染色的细胞类型不变。但是,和NS对照组比较,LPS组各个阶段的AQP1表达均降低(图1和4)。与4 h~12 h阶段的LPS组大鼠相比,24 h~48 h后,LPS组大鼠的AQP1表达部分恢复(表1)。另一方面,LPS组大鼠肺组织AQP5表达4 h~48 h各个阶段均有所降低,24 h~48 h后也没有任何的恢复(图5)。
此外,结果显示,和LPS组相比,激素组大鼠在气管内灌注LPS联合甲基强的松龙的注射4 h~12 h后,大鼠肺组织微血管内皮细胞AQP1的表达增强,差异有统计学意义(P<0.05),但Ⅰ型肺泡细胞中AQP5的表达则不受甲基强的松龙的影响(表1)。此外,激素组大鼠在注射甲基强的松龙4 h~12 h后,BAL液中白蛋白浓度和PMN%显著下降,证明激素组肺泡毛细血管膜通透性部分恢复。

图1 NS组AQP1主要在肺组织微血管内皮细胞中表达(箭头示,SABC,×40)Fig.1 The expression of AQP1 in NS group was mainly expressed in microvascular endothelial cells in the lung tissue. Arrowhead indicates SABC.×40
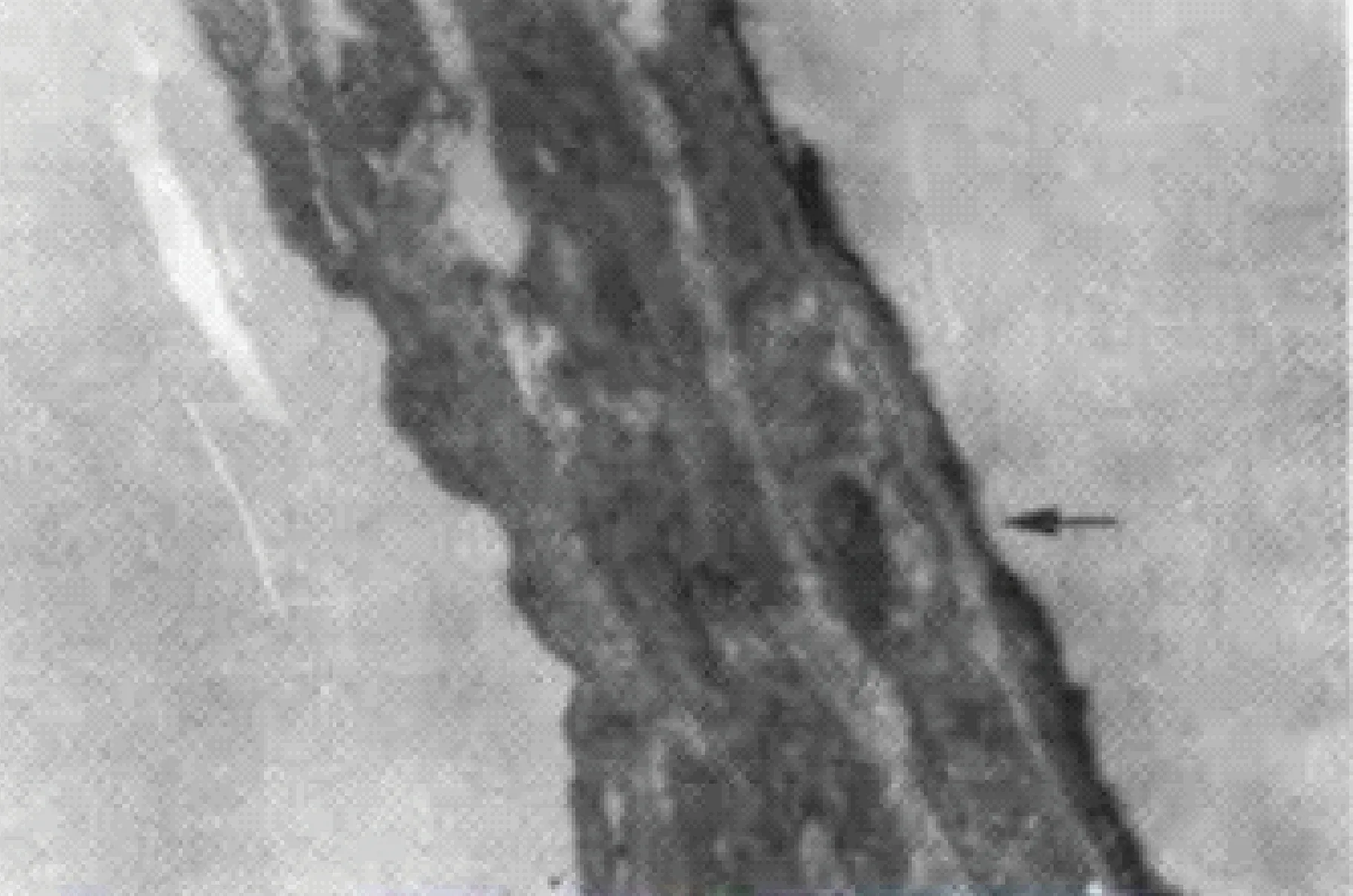
图3 免疫电镜显示,I型肺泡上皮细胞顶膜型中表达AQP5。(箭头示,SABC,标尺=20 μm)Fig.3 AQP5 is expressed in the apical membrane of type I alveolar epithelial cells, shown by immunoelectron microscopy. Arrowhead indicates SABC. Bar=20 μm

图5 免疫组化显示:气管内灌注LPS 12 h后,I型肺泡细胞AQP5表达降低。(箭头示,SABC,×40)Fig.5 Immunohistochemistry shows that the expression of AQP5 in type I alveolar cells is decreased at 12 h after LPS perfusion LPS. Arrowhead indicates SABC. ×40)
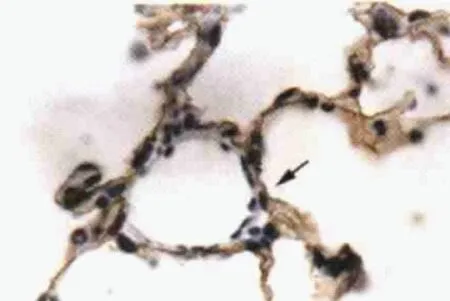
图2 免疫组织化学染色显示AQP5在Ⅰ型肺泡细胞内表达(箭头示SABC,×100)Fig.2 Immunohistochemical staining shows that AQP5 is expressed in type I alveolar cells. Arrowhead indicates SABC. ×100
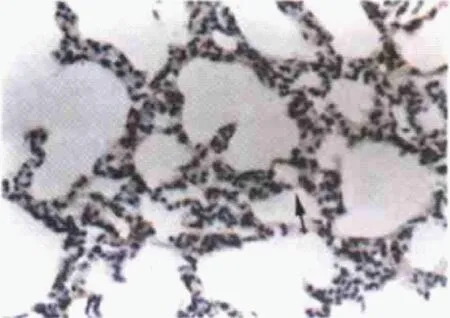
图4 免疫组织化学显示:气管内灌注LPS 4 h后,肺组织微血管内皮细胞的AQP1表达显著降低。(箭头示,SABC,×40)Fig.4 Immunohistochemistry shows that the expression of AQP1 in microvascular endothelial cells of lung tissue was significantly decreased at 4 hours after LPS perfusion. Arrowhead indicates SABC. ×40
2.5Western-blot 检测各组大鼠肺组织AQPl和AQP5蛋白表达
LPS组大鼠经LPS灌注后4 h,AQP1蛋白量减少至NS对照组的(45.2±4.4)%(P<0.05)。AQP5降至NS对照组的(68.6±8.9)%(P<0.05,n=5);24 h后AQPI蛋白量降至NS对照组的(63.4±5.9)%,AQP5降至NS对照组的(61.4±4.6)%,差异均具有统计学意义(P<0.05)。
3 讨论
水通道蛋白(aquaporins, AQPs)[3]是一种存在生物膜上的分子量为28000的具有通透水分功能的内在蛋白。水通道蛋白通过减小水越膜运动的阻力而使细胞间水分迁移的速率加快。水通道蛋白的嵌入使生物膜对水的通透能力大大提高,因此可以通过改变水孔蛋白的活性和调节水孔蛋白在膜上的丰度两种途径来调节膜对水的通透能力[4]。目前在人类细胞中已发现的AQP至少有12种, 均具有选择性的让水分子通过的特性。在动物中如肾脏、眼、脑中都存在AQP。而在肺组织中有6种AQP表达,其中AQPl主要分布在肺毛细血管内皮细胞,AQP5主要分布在肺泡I型细胞的顶膜面,这种分布表明AQPI、AQP5与肺水的形成和吸收过程密切相关[5]。
Towne等[6]采用免疫组织化学和免疫荧光染色法测银屑患者的皮肤组织中AQP5的表达,发现不同于正常表皮,AQP5在银屑病皮损和皮损周围的表皮中表达下降。使用Tewameter RTM210 和 CorneometerRCM 820 检测银屑病患者皮损及周围的结果显示:TEWL增加、水合作用下降。研究者们认为,AQP5的表达是引起银屑病患者皮损部位的干燥的一个关键因素。Nakakoshi M等[7]发现,皮肤鳞状细胞癌强表达AQP5蛋白,以及创伤愈合过程中AQP5对角质形成细胞起作用等现象,推进了深入研究AQP5参与了皮肤肿瘤的过程。研究发现,暴露于肿瘤诱导剂,AQP5基因敲除鼠未出现皮肤肿瘤,而野生型小鼠则出现多种肿瘤;皮肤乳头瘤状细胞强表达AQP5,并与增殖标记物K14共定位,这一点与皮肤鳞癌类似。在皮肤肿瘤的发生过程中,AQP5基因敲除小鼠对肿瘤诱导剂导致的皮肤肿瘤有明显的抵抗性[8]。
研究显示,AQP1主要表达于肺泡周围的毛细血管内皮细胞[9]。本实验结果显示,在NS对照组,免疫标记法显示AQP1主要分布在肺组织微血管的内皮细胞膜,以及少部分分布在肺上皮细胞膜。检测显示AQP5主要表达在I型肺泡膜上表达,但不在II型肺泡上皮细胞、血管内皮细胞和间质细胞内分布。免疫电镜显示AQP1在微血管内皮细胞的顶端和基底膜上,而AQP5主要存在于I型肺泡上皮细胞的顶膜。AQPI、AQP5在呼吸膜不同的表达位置,推测其可能具有不同的生理功能[10]。
在本研究中,组织学检查显示,LPS注入大鼠气管后,4 h和12 h后,大鼠肺间质水肿,肺组织明显中性粒细胞浸润。电镜显示大鼠肺组织I型肺泡上皮肿胀,细胞膜突出像是肺泡腔空间的泡沫,同时,II型细胞绒毛干枯脱落。在24 h和48 h后,在肺组织中检测到类似的组织学变化,在脂多糖灌注后,肺间质水肿缓解。电镜观察肺泡毛细管膜尚连续,但厚度不均匀。气管内灌注LPS 4 h~48 h后,免疫组化分析大鼠肺组织中AQP1和AQP5的表达。与NS对照组比较,LPS组AQP1和AQP5在细胞中表达的位置和特异性染色的细胞类型不变。但是,和NS对照组比较,LPS组各个阶段的AQP1表达均降低。与4 h~12 h阶段的LPS组大鼠相比,24 h~48 h后,LPS组大鼠的AQP1表达部分恢复。另一方面,LPS组大鼠肺组织AQP5表达4 h~48 h各个阶段均有所降低,24 h~48 h后也没有任何的恢复。
此外,结果显示,和LPS组相比,激素组大鼠在气管内灌注LPS联合甲基强的松龙的注射4 h~12 h后,大鼠肺组织微血管内皮细胞AQP1的表达增强,差异有统计学意义(P<0.05),但Ⅰ型肺泡细胞中AQP5的表达则不受甲基强的松龙的影响(表1)。此外,激素组大鼠在注射甲基强的松龙4 h~12 h后,BAL液中白蛋白浓度和PMN%显著下降,证明激素组肺泡毛细血管膜通透性部分恢复。
综上所述,AQP1和AQP5虽然均是AQP的家族成员,但两者在结构及功能上均有较明显的差异,根据本研究的结果,我们推测它们在完成液体转运的过程中可能通过不同的刺激方式发挥不同的作用。
[1]Arge P, Preston GM, Smith BL, et al. Aquaporin CHIP: the archetypal molecular water channel [J]. Am J Physiol,1993, 256: F463-F467.
[2]Borgnia M, Nielsen S, Engel A, et al. Cellular and molecular biology of the Aquaporin water channel. [J] Annu Rev Biochem,1999, 68: 425-458.
[3]杨国栋, 姚新民. 莨菪类药治疗急性肺损伤的探索和药理学基础 [J]. 中国急救医学, 2004, 4(4): 48-58.
[4]张惟才, 韩聪译. 蛋白质的SDS2聚丙烯酰胺凝胶电泳 [M]. 黄培堂,主译.分子克隆实验指南(第3版).北京:科学出版社, 2003:1713-1726.
[5]King LS, Nielsen S, Agre P. Aquaporins in complex tissues. I. Developmental patterns in respiratory and glandular tissues of rat [J]. Am J Physiol,1997, 273(5 pt1):C1541-C1548.
[6]Towne JE, Harrod KS, Krane CM, et al. Decreased expression of AQP 1 and AQP5 in mouse lung after acute viral infection [J]. Am J Respir Cell Mol Biol, 2000, 22: 34 -44.
[7]Ma T, Fukuda N, Song Y, et al. Role of AQP5 in lung fluid transport [J]. J Clin Invest 2000: 105:93-100.
[8]Rutschman DH, Olivera W, Sznajder JI. Active transport and passive liquid movement in isolated perfused rat lungs [J]. J Appl Physiol,1993, 75: 1574-1580.
[9]Bai C, Fukuda N, Song Y, et al. Lung fluid transport in aquaporin-1 and aquaporin-4 knockout mice [J]. J Clin Invest, 1999, 103: 555-561.
[10]Delclaux C, Rezaiguia RS, Delacourt C,etal. Alveolar neutrophils in endotoxin-induced and bacteria-induced acute lung injury in rats [J]. Am J Physiol,1997; 273: L104-L112.
Expression of AQP1 and AQP5 is decreased in the alveolar-capillary membrane in rats with acute lung injury
YUE Sheng, ZHU Ping, YUE Lei, QIAO Guo-hua
(Department of Emergency, Luoyang Central Hospital, the Affiliated Hospital of Zhengzhou University, Luoyang, Henan 471000, China)
ObjectiveTo determine if aquaporin1 (AQP1) and aquaporin5 (AQP5) are expressed in the alveolar-capillary membrane in rats, and to investigate the changes of AQP1 and AQP5 expression in the rat with acute lung injury. Methods The distribution of AQP1 and AQP5 in alveolar capillary membrane was investigated by immunohistochemistry and immunoelectron microscopy with affinity-purified antibodies to human AQP1 and AQP5. The possibility that alveolar capillary membrane AQP1 and AQP5 undergo altered regulation was studied by a rat model established using intra-tracheal instillation of lipopolysaccharide (LPS). ResultsImmunolabelling showed that AQP1 was stained primarily in the microvascular endothelium of normal lungs, while AQP5 was expressed in type I pneumocytes. Immunohistochemical analysis showed a significant decrease in the expression of AQP1 and AQP5 in injured lungs at 4-48 h after LPS instillation. AQP1 protein was resumed partly at 24 h after LPS instillation and steroid administration, whereas AQP5 was unchanged. ConclusionsThe decreased expressions of AQP1 and AQP5 in injured lungs suggest that both of them may play a role in abnormal fluid transportation.
Aquaporin 1, AQP1; Aquaporin 5, AQP5; Acute lung injury; Fluid transportation; Steroid; Rat
岳胜(1980-),男,主治医师,研究方向:内毒素诱导急性肺损伤大鼠呼吸膜AQP1及AQP5表达的实验研究。
研究报告
R-33
A
1671-7856(2016) 08-0070-05
10.3969.j.issn.1671-7856.2016.08.011
2016-05-30
