金属硫蛋白表达在C57BL/6J小鼠肝细胞癌发生中的变化及意义
2016-09-13程明亮
易 旭, 龙 黎, 程明亮
(1.贵阳中医学院第二附属医院中心实验室,贵州 贵阳 550002;2.贵州医科大学附属医院感染科,贵州 贵阳 550004)
金属硫蛋白表达在C57BL/6J小鼠肝细胞癌发生中的变化及意义
易旭1, 龙黎2, 程明亮2
(1.贵阳中医学院第二附属医院中心实验室,贵州 贵阳550002;2.贵州医科大学附属医院感染科,贵州 贵阳550004)
目的了解金属硫蛋白(MTs)基因表达水平在小鼠肝细胞癌(HCC)发生过程中的动态变化及其规律,探讨MTs在HCC发生中的重要意义。方法将125只5~8周龄雄性C57BL/6J小鼠随机分为正常对照组和HCC模型组。模型组小鼠于第1、2周分别腹腔注射一次二乙基亚硝胺(100 mg/kg,50 mg/kg),第3周起灌胃给予乙醇(53%,5 mL/kg,5 d/周),直至35周;正常组始终给予等量灭菌自来水灌胃。分别于实验1、3、9、13、24及35周末处死小鼠,收集肝组织样本并计算肝脏指数。采用组织病理学HE、Masson及网状纤维染色检测肝组织损伤及HCC发生情况,采用酶联免疫吸附法检测肝组织匀浆丙二醛( MDA)的活性;采用实时荧光定量PCR分析MTs转录水平。结果模型组小鼠可见进行性的肝脏病变,35周末时,肝脏质地显著变硬,表面可见大小不等结节形成,约50%小鼠可见肝细胞异常核分裂像和异常的肝板结构等HCC发生病理改变,具有显著增加的肝脏指数;不同时段均表现出增加的MDA活性;实验13周前各时段具有显著增加的MTs mRNA水平,24周后可见III级纤维化形成,且MTs mRNA水平显著下降,甚至低于正常水平。结论小鼠肝组织MTs mRNA水平从损伤初期的显著增加直至显著纤维化后的低表达变化,表明MTs表达下调与HCC发生有关。
肝细胞癌;金属硫蛋白;基因表达;小鼠
金属硫蛋白(metallothioneins, MTs)是一小分子量、富含半胱氨酸的重金属结合蛋白,其抗氧化能力在动脉粥样硬化、心肌保护、脑缺血再灌注损伤及肝毒性等多种生理及病理过程中具有重要意义[1-3]。研究认为,MTs在包括上皮及叶间来源的多种肿瘤中呈现上调表达,且与肿瘤的侵袭能力及较差的预后密切相关,但在胃肠道肿瘤和肝细胞癌(HCC)中的研究数据却得出相反的结论,即具有下调的,甚至低于正常水平的MTs水平[4-6]。由于大量研究表明了氧化应激和HCC恶性转化的相关性[7],因此,为了进一步明确肝脏MTs这一重要抗氧化剂的表达水平与HCC发生的关系,本文参考文献[8],以遗传毒物二乙基亚硝胺为引发剂,乙醇为促进剂制备C57BL/6J雄性小鼠HCC发生模型,在不同处理时段动态检测肝组织MTs基因表达水平,探讨其变化规律,以期为HCC的防治提供有意义的实验室依据。现报告如下:
1 材料和方法
1.1实验动物
选择SPF级雄性C57BL/6J小鼠125只,5~8周,体重(21±2)g,由北京华阜康生物科技股份有限公司提供(动物质量许可证号:SCXK (京)2009-0004)。饲养于贵州医科大学实验动物中心带有IVC系统的饲养房内,使用许可证号为SYXK(黔)2012-0001,SPF级小鼠用饲料喂养,自由饮用灭菌自来水,恒温(20~23)℃。
1.2试剂
二乙基亚硝胺(diethylnitrosamine,美国Sigma, N0756);无水乙醇(20110714,国药集团化学试剂有限公司,分析纯AR);丙二醛ELISA试剂盒(JK10167,美国BD);离心柱型总RNA提取试剂盒(L1126,北京天根);离心柱型RNA纯化试剂盒(K0011,北京天根);逆转录试剂盒(00135397,美国Thermo Scientific);2× SYBR Green Mix (1210,美国Biomiga);β-actin、MT-1及MT-2引物由上海基康生物技术有限公司合成;
1.3实验动物分组及处理
健康雄性C57BL/6J小鼠125只,适应性喂养7 d后,将小鼠随机分成正常对照组(60只)和模型组(65只)。模型组小鼠于实验第1、2周分别腹腔注射一次二乙基亚硝胺(100 mg/kg,50 mg/kg),第3周起灌胃给予乙醇(53%,5 mL/kg,5 d/周),直至35周。正常对照组小鼠始终灌胃给予灭菌自来水。
1.4检测指标和检测方法
1.4.1标本采集与组织病理学检测:小鼠经戊巴比妥钠麻醉后,分别于实验1、3、9、13、24及35周末观察、收集肝组织样本并计算肝脏指数(肝脏指数=肝脏湿重/体重 × 100%);病理学检测用肝组织置于4%中性甲醛内固定24~48 h后,常规石蜡包埋,制成4 μm切片,行HE、Masson及网状纤维染色,镜下观察肝组织病理学变化(HCC发生组织学判断以国际癌症研究机构出版的啮齿类动物肿瘤标准进行[9],由贵州医科大学病理学教研室协助完成)。1.4.2肝组织匀浆丙二醛的含量(nmol/mg)测定:分别制备各阶段两组小鼠肝组织混合样本0.5~0.8 g,置于预冷的1 mL生理盐水中,玻璃匀浆器手工匀浆,4 000 r/min,离心10~15 min,取上清液,稀释100倍后参考试剂盒说明书以双抗体夹心法检测匀浆中丙二醛的活性。
1.4.3肝组织MT-1、MT-2基因mRNA水平:提取、纯化各时段小鼠肝组织总RNA,运用变性琼脂糖凝胶电泳和紫外吸收测定法对RNA质量进行检测;以1 μg总RNA于10 μL逆转录体系中进行逆转录;cDNA产物4倍稀释后进行实时荧光定量PCR检测,设置实时定量PCR程序:50℃ 2 min(1个循环),95℃ 10 min(1个循环),95℃ 15 s,60℃ 1 min(40个循环)。目的基因Ct值经同一样本的内参基因校正后计算各组间每个基因的ΔΔCt,通过2-ΔΔCt计算组间对应基因的表达差异。β-actin、MT-1及MT-2基因引物序列如下:MT-1 F5′-AATGTGCCCAGGGCTGTGT-3′,R5′- GCTGGGTT GGTCCGATACTATT-3′;MT-2 F5′-TGTGCCTCC GATGGATCCT-3′,R5′-GCAGCCCTGGGAGCACTT-3′;β-actin F 5′-GGCCAACCGTGAAAAGATGA-3′,R5′- CAGCCTGGATGGCTACGTACA-3′。
1.5统计学方法
2 结果
2.1小鼠肝脏解剖与镜下病理学观察
35周后,正常组小鼠无肉眼可见的病理改变。模型组小鼠肝脏外观呈黄褐色,肿胀、质地变硬且表面形成大小不等结节(最大直径可达到0.5~1.0 cm)(图1)。运用H&E、Masson和网状纤维染色镜检发现,实验1周后,肝细胞明显水肿,3周后可见较多点灶状坏死,炎性细胞浸润(图2 A,B);9周后可见肝细胞气球样变、脂肪变性,部分肝组织可见轻度(I级)的纤维化形成(图2 C);13周后可见明显的碎片状坏死,II级纤维化形成(图2 D);24周时见显著的桥接坏死、亚大块坏死与密集的非典型增生,III级纤维化形成(图2 E);35周末可见异常核分裂像、异常的肝板结构(肝板数量增加≥3层)等肝细胞癌病理改变,伴有大量炎性细胞浸润、纤维间隔及假小叶形成(图2 F)。
2.2肝脏指数及肝组织匀浆MDA水平
处理35周后,与正常组比较,模型组小鼠肝脏显示显著增加的肝脏指数(P<0.01);在观察的6个时段,模型组均呈现比正常组显著增加的肝组织MDA水平(P<0.01)(表1)。
注:与正常组比较,aP<0.01。
Note.aP<0.01, compared with the control group.
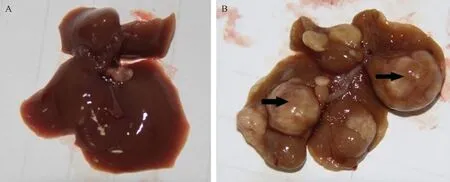
注:A:正常组;B:模型组图1 35周末正常组与模型组小鼠肝脏大体观(箭头示肿瘤结节)Note. A: Control group; B: Model groupFig.1 Representative images of the mouse livers at 35-week (arrows indicate the tumor nodules)

注:A、B、C、D、E、F、分别为处理1、3、9、13、24及35周末时肝组织镜下观(箭头示肝组织病理改变)。图2 不同时段小鼠肝组织H&E、Masson及网状纤维染色镜下观(标尺=100 μm/50 μm)Note. A-F: Light microscopy of mice liver at 1 ,3, 9, 13, 24 and 35 weeks, respectively (arrows indicate the pathological changes of liver).Fig.2 Pathological changes of the liver in mice. H&E, Masson and reticular fiber staining. (Bar=100 μm/50 μm)
2.3肝组织MT-1、MT-2 mRNA水平
正常组小鼠在不同时段间具有相似的肝组织MT-1或MT-2 mRNA表达水平;实验1、3、9及13周末,模型组小鼠均显示比正常组显著增加的MT-1 mRNA表达水平(P<0.01),且随病程进展逐渐降低;实验24及35周末,模型组小鼠肝组织MT-1的mRNA水平均显著低于正常组小鼠(P<0.01);MT-2 mRNA表达水平于实验13周末时与正常组相似,24周后也显著低于正常组小鼠(表2)。
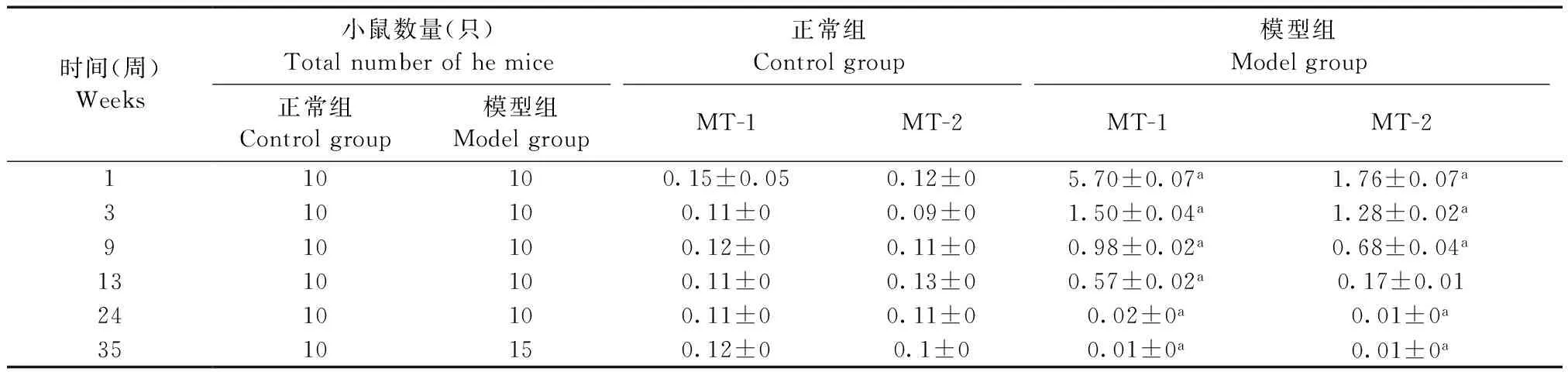
表2 不同时段小鼠肝组织MT-1、MT-2 mRNA表达水平分析
注:与正常组比较,aP<0.01
Note.aP<0.01, compared with the control group.
3 讨论
肝细胞癌(HCC)是世界范围内第5位最常见和第3位引起癌症相关死亡的恶性肿瘤,治疗选择非常局限[10]。许多研究证实了人类多种肿瘤中同时具有增加的MTs表达,如乳腺癌、肾癌、肺癌、鼻咽癌、卵巢癌、前列腺癌、唾液腺癌、睾丸癌和膀胱癌等[6],但也发现MTs的表达并不常见于所有人类肿瘤,如HCC[3,4]。运用DEN诱导的C57BL/6J小鼠HCC模型,Jharna D等[5]发现MT的表达在HCC组织中显著减少甚至缺乏,一致地,运用HCC临床样本,发现癌组织中MT表达亦显著低于相应的邻近正常肝组织。Park Y等[11]也发现,MT-1、MT-2人HCC癌组织细胞核和细胞质MT-1、MT-2表达的丢失比邻近癌旁组织显著,多元变量分析揭示MT-1、MT-2表达的减弱是无复发生存和总生存率的独立预后不良因素。研究表明[12],MTs敲除鼠(MTKO鼠)显示了更高的超氧化物阴离子水平,MTs的缺失通过活化NF-κB靶基因促进DEN诱导的肝癌形成。上述研究结果均提示MTs下调可能与肝癌的发生密切相关,因此,有必要了解HCC发生过程中MTs表达水平的变化,进一步证实其与HCC发生的相关性。基于上述研究设想,本文通过制备HCC发生动态小鼠动物模型,了解了不同时段肝组织MTs基因的转录水平。
基于酒精相关性肝癌形成的机制及HCC化学诱导模型制备的原理,本文参考文献方法[8],采用化学诱导二步法制备小鼠HCC发生模型,以遗传毒物二乙基亚硝胺(DEN)为引发剂,乙醇为促进剂。该诱导方法的优势在于对肝脏的损伤-纤维化-恶性转变周期同人类HCC的发生高度相似[13]。研究表明,HCC的发生除与诱导剂及浓度有关外,还与性别、年龄和鼠种类有关[5]。Brandon-Warner等研究了乙醇对HCC发生的影响,发现慢性乙醇喂养能协同DEN明显增加雄性小鼠肿瘤的发生[14]。基于上述研究背景,本文选择雄性C57BL/6J小鼠作为实验用动物。结果发现,乙醇 + DEN处理35周,显著诱导了小鼠肉眼可见的肝脏病变及镜下进行性的肝脏损伤、癌前病变甚至典型的HCC发生等病理改变;同时,通过对不同时段肝组织脂质过氧化物的检测也揭示了模型组小鼠始终增加的肝脏丙二醛含量。
基于氧化应激在DEN及酒精相关性肝细胞癌形成中的重要作用,以及过多自由基形成和MTs缺失或减弱促进肝癌形成的理论基础[7,15,16],从抗氧化应激角度探讨MTs水平动态变化与HCC发生的相关性具有重要的毒理学与临床意义。在哺乳动物中,MTs包括4种亚型(MT1-MT4),其中MT-1和MT-2几乎存在于所有类型软组织,能够被多种刺激,包括金属离子、细胞因子、生长因子和氧化应激等活化,呈数倍增加,从而保护细胞抗细胞毒性、辐射和DNA损伤[17,18]。Klaassen等[19]认为,肝脏MTs的诱导是一影响对肝脏毒性结果发生发展的重要适应性机制。运用MTs过表达的转染鼠或MTs裸鼠的研究也强有力地显示了不同氧化应激条件下MTs的抗氧化损伤保护,如阿霉素心脏毒性、缺血-再灌注、糖尿病和酒精消费等[1]。本文对不同时段小鼠肝组织MT-1、MT-2基因转录水平的分析发现,在诱导早期,即出现肝细胞坏死、急性炎症病理表现时,小鼠产生非常显著的MTs转录水平,尤其MT-1。随着诱导的进行,肝脏出现中重度纤维化,此时肝组织MTs表达水平亦显著下降,甚至低于正常水平。结果显示小鼠肝组织MTs基因表达水平呈现一定的变化与规律性,总的趋势表现为与肝脏损伤程度呈负相关,即从损伤初期的显著增加直至纤维化形成后的低表达。表明随着肝脏损伤因素的持续,肝组织应激性增加MTs转录的能力逐渐减弱甚至丧失,从而失去了其对肝脏损伤的保护。因此,本文结果进一步提示MTs在不同病理时段的表达差异性表明了其在肝细胞恶性转化中的潜在作用。由于大量的研究认为增加抗氧化剂的运用可降低癌症的发生率[20],故设想若早期刺激肝组织中MTs合成或外源补充MTs也许是阻止HCC发生发展的一个重要策略。综合目前国内外的研究,尚未有关不同病因所致HCC过程中MT表达情况的报道,因此,本文也是首先初步探讨了MT表达动态变化与酒精相关性肝癌发生的相关性,对于其他病因所致的HCC,尤其是乙型肝炎病毒/丙型肝炎病毒相关性HCC,其发生过程中MT表达的变化将是我们下一步努力探讨的方向。
[1]Ruttkay-Nedecky B, Nejdl L, Gumulec J, et al. The role of metallothionein in oxidative stress [J]. Int J Mol Sci, 2013, 14(3): 6044-6066.
[2]朱中生, 王海燕, 王登峰, 等. 金属硫蛋白对ApoE基因缺陷小鼠血脂、动脉粥样硬化及主动脉SR-AⅠ表达的影响[J]. 山东医药, 2013, 53(14): 30-33.
[3]郭家彬, 冯敏, 张丽,等. 金属硫蛋白在缺血性脑损伤过程中的调控作用 [J].中国药理学与毒理学杂志, 2014, 28(6): 898-903.
[4]Cherian MG, Jayasurya A, Bay BH. Metallothioneins in human tumors and potential roles in carcinogenesis [J]. Mutat Res, 2003, 533(1-2): 201-209.
[5]Datta J, Majumder S, Kutay H, et al. Metallothionein expression is suppressed in primary human hepatocellular carcinoma and is mediated through inactivation of CCAAT/enhancer binding protein alpha by phosphatidylinositol 3-kinase signaling cascade [J]. Cancer Res, 2007, 67(6): 2736-2746.
[6]鹿晓麟, 娄长杰, 张艳桥. 金属硫蛋白在癌症中的研究进展 [J]. 中国肿瘤, 2014, 23(3): 218-223.
[7]Valko M, Rhodes CJ, Moncol J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer [J]. Chem Biol Interact, 2006, 160(1): 1-40.
[8]Heindryckx F, Colle I, Van Vlierberghe H. Experimental mouse models for hepatocellular carcinoma research [J]. Int J Exp Pathol, 2009, 90(4): 367-86.
[9]Mohr U. International Classification of Rodent Tumors Part I — The Rat. 10. Digestive System [M]. In: Mohr U, (ed). IRAC Scientific Publications No. 122. International Agency for Research on Cancer, WHO; Lyon. 1997.
[10]Kew MC. Hepatocellular carcinoma in developing countries: Prevention, diagnosis and treatment [J]. World J Hepatol, 2012, 4(3): 99-104.
[11]Park Y, Yu E. Expression of metallothionein-1 and metallothionein-2 as a prognostic marker in hepatocellular carcinoma [J]. J Gastroenterol Hepatol, 2013, 28(9): 1565- 1572.
[12]Chaabane W, User SD, El-Gazzah M, et al. Autophagy, apoptosis, mitoptosis and necrosis: Interdependence between those pathways and effects on cancer [J]. Arch Immunol Ther Exp, 2013, 61(1): 43-58.
[13]赵彤, 李柏. 二乙基亚硝胺在小鼠诱发性肝癌模型中的应用 [J]. 中国比较医学杂志, 2016, 26(1): 76-80.
[14]Brandon-Warner E, Walling TL, Schrum LW, et al. Chronic ethanol feeding accelerates hepatocellular carcinoma progression in a sex-dependent manner in a mouse model of hepatocarcinogenesis [J]. Alcohol Clin Exp Res, 2012, 36(4): 641-653.
[15]Qi Y, Chen X, Chan CY, et al. Two-dimensional differential gel electrophoresis/analysis of diethylnitrosamine induced rat hepatocellular carcinoma [J]. Int J Cancer, 2008, 122(12): 2682-2688.
[16]Majumder S, Roy S, Kaffenberger T, et al. Loss of metallothionein predisposes mice to diethylnitrosamine-induced hepatocarcinogenesis by activating NF-KB target genes [J]. Cancer Res, 2010, 70(24): 10265-10276.
[17]肖定福, 张彬, 李忠义, 等. 不同应激因子对小鼠肝脏金属硫蛋白诱导合成的影响[J]. 中国实验动物学报, 2009, 17(2): 90-96.
[18]Thirumoorthy N, Manisenthil Kumar KT, Shyam Sundar A, et al. Metallothionein: An overview [J]. World J Gastroenterol, 2007, 13(7): 993-996.
[19]Klaassen CD, Liu J. Induction of metallothionein as an adaptive mechanism affecting the magnitude and progression of toxicological injury [J]. Environ Health Perspect, 1998, 106(1): 297-300.
[20]Seifried HE, McDonald SS, Anderson DE, et al. The antioxidant conundrum in cancer [J]. Cancer Res, 2003, 63(15): 4295-4298.
Changes and significance of metallothionein expression during hepatocarcinogenesis in C57BL/6J mice
YI Xu1, LONG Li2, CHENG Ming-liang2
(1.Central Laboratory, Second Hospital Affiliated to Guiyang College of Traditional Chinese Medicine, Guiyang 550002, China;2. Department of Infectious Diseases, Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China)
ObjectiveTo investigate the dynamic changes of metallothionein(MTs)gene expression and explore the important significance of MTs during hepatocarcinogenesis. Methods One hundred and twenty-five SPF 5-8-week old male C57BL/6J mice were randomly divided into control group and model group. Diethylnitrosamine (DEN) was given to the mice at a dose of 100 mg/kg, ip, and 50 mg/kg, ip, in the first and next week, respectively. The mice were given ethanol (53%, 5 mL/kg/day, 5 days/week) from the third week of experiment till 35 weeks. At 1, 3, 9, 13, 24 and 35 weeks of the experiment, liver samples were taken for histopathological examination of liver damages and incidence of HCC. The liver index and malondialdehyde (MDA) of liver homogenate were determined. All liver tissue samples were examined by histopathology using hematoxylin and eosin (HE), Masson and reticular fiber staining. Real-time RT-PCR was used to analyze the mRNA expression level of liver metallothionein-1/2 (MT-1/2) in different periods. ResultsProgressive liver damages in model group mice were identified in different periods. Hepatocytes abnormal tission and abnormal liver plate structure, architecture often characteristic of HCC could be seen in approximately 50% of mice at 35 weeks. In addition to these, a higher liver index also were seen at 35 weeks. Increased MDA levels in the mouse liver tissues were observed in each stage. Real-time RT-PCR analysis showed that significantly increased transcription of MT-1 and MT-2 at 1, 3 and 9 weeks, then gradually declined and even below the normal level. ConclusionsMTs gene expression levels in mouse liver tissues are changed from significantly increased in the early stage of injury to decreased expression combined with distinct fibrosis. Our findings further demonstrate that the down-regulation of MTs level is closely correlated with hepatocarcinogenesis.
Hepatocellular carcinoma; Carcinogenesis; Metallothionein; Gene expression; Mice
国家重点基础研究发展计划(973计划前期专项)(2011CB512114)。
易旭(1976-),女,研究方向:肝病的基础研究。 E-mail: yixu2013@yeah.net。
程明亮(1956-),男,研究方向:肝病的防治基础与临床研究,E-mail: mlcheng@yeah.net。
研究报告
R-33
A
1671-7856(2016) 08-0053-06
10.3969.j.issn.1671-7856.2016.08.008
2016-03-28
