巴贝西虫感染黑线仓鼠生物学特性的变化
2016-09-13王昱佳郑珺文王冬平李桂军范君文时彦胜张小飞白杰英
叶 莉,马 帅,王昱佳,3,郑珺文,3,王冬平,李桂军,范君文,时彦胜,张小飞,白杰英
(1.军事医学科学院实验动物中心,北京 100071;2.北京农业质量标准与检测技术研究中心,北京 100097;3.首都师范大学生物系,北京 100048;4.北京市兽药监察所,北京 102600)
巴贝西虫感染黑线仓鼠生物学特性的变化
叶莉1,马帅2,王昱佳1,3,郑珺文1,3,王冬平1,李桂军1,范君文1,时彦胜1,张小飞4,白杰英1
(1.军事医学科学院实验动物中心,北京100071;2.北京农业质量标准与检测技术研究中心,北京100097;3.首都师范大学生物系,北京100048;4.北京市兽药监察所,北京102600)
目的建立巴贝西虫感染的黑线仓鼠模型,明确感染后黑线仓鼠生物学特性的变化规律,为巴贝西虫病的检测与防治提供基础数据资料。方法腹腔注射含巴贝西虫的血液感染黑线仓鼠,感染的第0、2、4、6、8、10、12、14、16、23、30、37天每次取5只动物采集抗凝血和全血,制备血涂片,通过吉姆萨染色检测虫体繁殖情况;分离血液总DNA,用REAL-TIME PCR检测巴贝西虫的在宿主体内的繁殖规律;用全自动生理生化检测仪测定血液生理生化指标;处死动物后分别采集心、肝、脾、肺、肾等器官,称重测定脏器系数;用ELISA法检测感染动物血清中IL-2浓度。结果感染后第4天黑线仓鼠体内的巴贝西虫数量最多,之后整体呈下降趋势,在第12天有一个短暂升高。感染动物的脏器系数变化最大的属于肝脏和脾脏,心、肺和肾脏系数在整个感染期内稍有波,均在正常值范围内。感染动物的血细胞均有波动,在第10、23天两次达峰值,其中白细胞变化最为剧烈;检测到变化的血液生化指标在第12天达峰值。感染动物血清中的IL-2在第10天达峰值,之后连续下降。结论感染巴贝西虫的黑线仓鼠具有典型的蜱传寄生虫病特点,病原侵入一周内达繁殖顶峰,且病原可在宿主体内长期潜伏。宿主免疫响应在第2周达到峰值,与免疫相关的脏器及血细胞有明显的应激反应。据此,可有针对性的开展巴贝西虫病的诊断与防治。
巴贝西虫;黑线仓鼠;脏器系数;细胞因子
近年来,随着SARS、禽流感、MERS及ZIKA等各种新发或再发的人兽共患感染性疾病不断危害公众健康,对于病原微生物的研究再次成为科学研究热点,这其中也包括对于巴贝西虫等原虫类寄生虫的研究。巴贝西虫是一类寄生于宿主红细胞内的原虫,一般经蜱虫叮咬传播,属于蜱传寄生虫[1]。巴贝西虫病具有典型的寄生虫病症状,常见虫种包括双芽巴贝西虫(B.bigemina)、牛巴贝西虫(B.bovis)、马巴贝西虫(B.equi)、鼠巴贝西虫(B.microti)和犬巴贝西虫(B.canis)等[2,3],该类寄生虫可引起马、牛、羊、猪和犬等多种动物的巴贝西虫病。个别虫种可引起人的感染,人感染巴贝西虫后的症状主要表现为发热、寒战、溶血性贫血、头痛、咽痛、肌肉痛、关节痛和脾肿大等。免疫力低下的人和动物更易感染巴贝西虫,而且会表现出较严重的症状, 且长时间不能自愈,甚至危及生命[4]。
巴贝西虫感染动物模型的创制已有相关报道,卢艳等(2012年)建立了田鼠巴贝西虫感染的小鼠模型,比较和分析了感染田鼠巴贝西虫的雌性BALB/c小鼠、免疫抑制BALB/c小鼠、雄性SCID小鼠和NOD-SCID小鼠的感染率和虫体分布等数据[5]。但用免疫抑制或者缺陷动物作为模型,对于病原与机体相互作用的研究有诸多不足,因此,筛选正常动物创制寄生虫感染模型是一件非常重要的工作。本研究拟以黑线仓鼠为目标动物开展巴贝西虫感染研究。作者单位具有自主培育的黑线仓鼠及其白化突变系,课题组前期对黑线仓鼠的生理生化指示及其特性进行了详细的比较分析[6];开展旋毛虫感染黑线仓鼠的实验研究,确定黑线仓鼠是良好的寄生虫感染模型,在动物模型的制备和免疫响应方面都优于同类动物[7]。本研究拟建立巴贝西虫感染的黑线仓鼠模型,重点分析黑线仓鼠感染巴贝西虫后生物学特性的变化,免疫应答启动的过程及反应程度,从而深入了解巴贝西虫感染后宿主免疫应答响应机制。
1 材料和方法
1.1实验动物
清洁级黑线仓鼠200只,5周龄,雌雄各半,由军事医学科学院实验动物中心提供[SCXK-(军)2012-0004], 动物饲养与实验在军事医学科学院实验动物中心动物实验室完成[SYXK-(军)2012-0021]。实验过程中对动物的处置符合科技部颁布的《关于善待实验动物的指导性意见》要求,按3R原则给予人道关怀。
1.2仪器和材料
IL-2 ELISA kit(上海西唐); SYBR Premix Ex TaqTM II(Qiagen);DNA marker(康为世纪);血液DNA提取试剂盒(天根生物);血液生理生化与血细胞检测试剂(Backman)。一次性注射器、离心管、枪头、摄子、手术钳等耗材均从军事医学科学院科技部条件处器材供应站领取。仪器主要有二氧化碳培养箱(Healforce)、显微镜(Nikon)、酶标仪(Rayto)、微量核酸蛋白测定仪(ND2000)、电子天秤(Sartorius)和real-time PCR 扩增仪( Bio-Rad)、全自动血液生理生化分析仪(Backman)。巴贝西虫获赠于军事医学院微生物流行病研究所刘玮研究员,虫体保存在经血液感染的SCID鼠中,每两周经皮下注射感染血液传代1次。
1.3实验方法
1.3.1巴贝西虫感染黑线仓鼠:检测感染巴贝西虫的SCID种鼠,其红细胞巴贝西虫感染率大于50%时(约65%),用乙醚麻醉后立刻打开胸腔,用1mL注射器直接抽取心脏血,注入含乙二胺四乙酸钠(EDTA-Na)的离心管中。按1:1 比例与0.9%生理盐水混合后,立刻腹腔注射黑线仓鼠,每只动物注射200 μL抗凝血/生理盐水混合物。动物接种当天记为第0 天(第0天),接种次日开始观察记为第1 天(D1),依次记为D2、D3、D4、D5……。
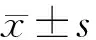

表1 荧光定量PCR反应体系
1.3.3感染动物脏器系数的计算:处死动物后,采取其心、肝、脾、肺、肾等相应脏器,用0.1% PBS缓冲液冲洗掉血渍,在吸水纸上轻轻吸干残余水渍,放到电子天秤上称量。脏器系数=脏器重量/动物体重。
1.3.4血液生理生化值的测定:取全血约0.2 mL,室温1 500 r/min离心10 min,取上清液即血清,用于测定血液生理生化值;另取全血0.2 mL用全自动血细胞分析仪测定实验动物的血细胞的变化,对照参数为地鼠专用数据。
1.3.5细胞因子变化分析:将抗小鼠IL-2单抗包被于酶标板上,标准品和样品中的IL-2与单抗相结合,加入生物素化的抗小鼠IL-2,形成免疫复合连接在板上,辣根过氧化物酶标记的Streptavidin与生物素相结合,加入底物工作液后显蓝色,最后加终止液,测定450 nm A值,绘制标准曲线计算标本中IL-2的浓度。
2 结果分析
2.1巴贝西虫感染情况检测
2.1.1镜检:感染第2天起,用显微镜观察到血涂片上细胞中的巴贝西虫(图1),虫体呈半月形或者弯钩形,个别呈梨形环。
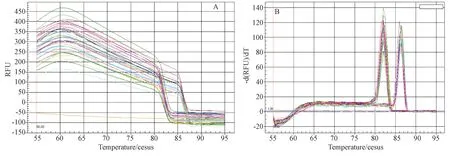
2.1.2Real-time PCR检测:提取的DNA用ND2000微量核酸蛋白测定仪测定A260/A280值,各组样品A260/A280的值在1.8~2.0之间,纯度较好。巴贝西虫与β-actin的扩增曲线均较为平滑,没有出现非正常的数值偏移,二者融解曲线分别82℃和86℃时有单一峰出现,判断为目的峰(图2)。通过公式计算可以看出,巴贝西虫在感染后的第2天即可达到较高感染率,在第4天达到整个感染期的峰值(图3)。在感染的前两周内都保持较高的感染率,自第3周开始急剧下降。
A:样品D2-D37的扩增曲线。B:样品D2-D37的融解曲线图2 巴贝西虫与β-actin的real-time PCR扩增与融解曲线A:Amplification of the sample D2-D37. B:Dissociation curves of the sample D2-D37.Fig.2 Amplification and dissociation curves of Babesis and β-actin in real-time PCR
感染率=巴贝西虫CT平均值/β-actin CT平均值。图3 感染期间巴贝西虫感染率的变化趁势 (real-time PCR 结果)The infection rate=average CT values of Babesia/average CT values of β-actin.Fig.3 Tendency of the changes of infection rate of Babesia detected by real-time PCR
2.2黑线仓鼠脏器系数的变化
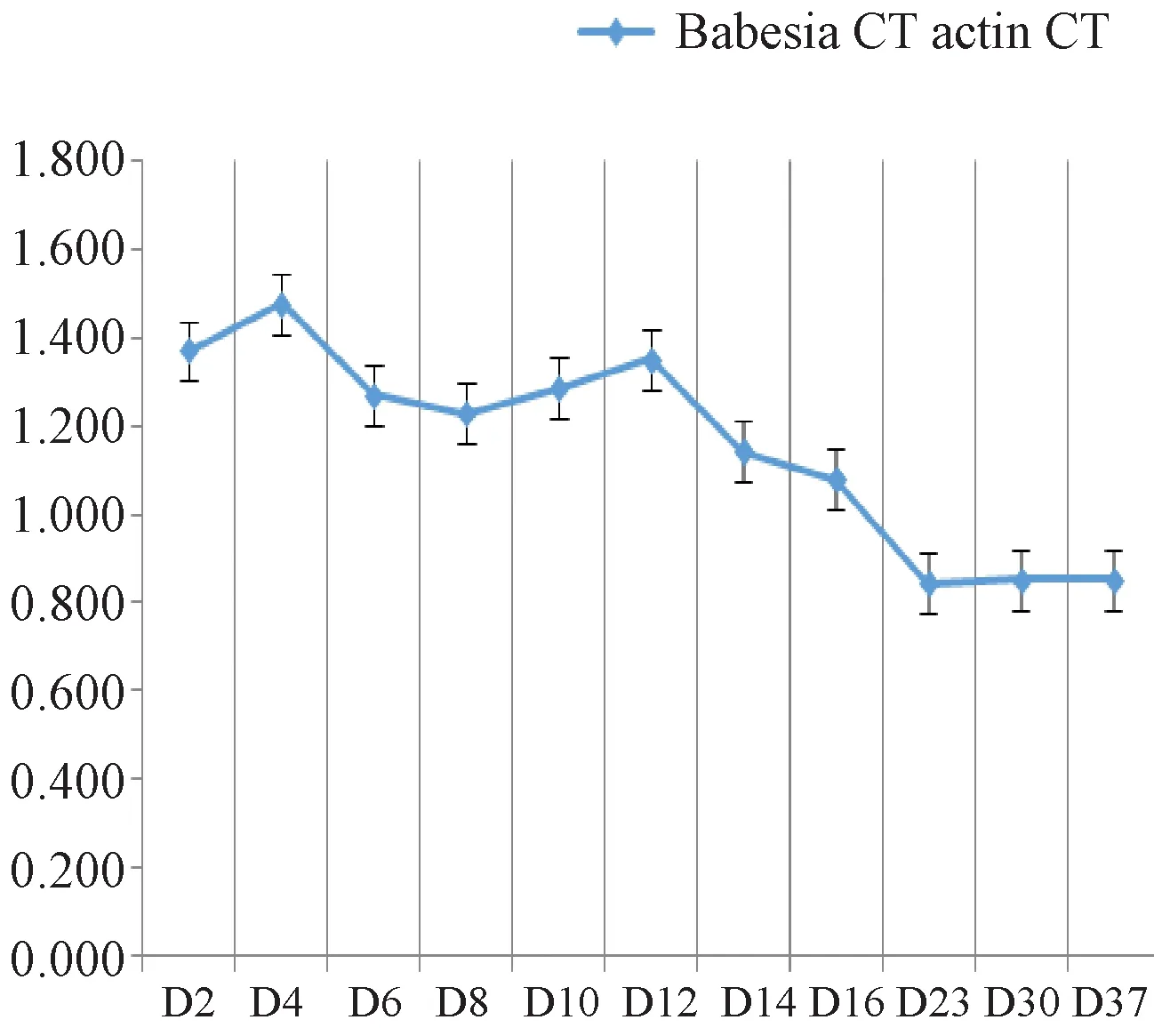
黑线仓鼠受巴贝西虫感染后,其心、肝、脾、肺、肾等脏器系数均有不同程度的变化。但是变化最为明显的是肝脏和脾脏。肝脏在感染的前3周有3次波动,每周都有1个峰值,自第三周后便开始持续下降(图4A)。而脾脏系数在第1周相对稳定,在D4天稍有升高,从第2周开始(第10天)至第3周(第16天)有两次峰值,且一次比一次变化大,在第3周的第16天达高大值,之后便持续下降(图4B)。
2.3黑线仓鼠血液生理生化值的变化
2.3.1血液生化指标的变化:对血液中的总蛋白、碱性磷酸酶、胆固醇、尿酸、血糖、淀粉酶、谷草转氨酶和甘油三酯等生化指标进行了测定。其中,总蛋白、碱性磷酸酶和胆固醇没有明显变化,而后面五个生化指标都呈现了相同的变化趋势。淀粉酶在第前两周分别有两次升高,在第3周(第12天)达峰值(图5);谷草转氨酶在感染后的第2天即迅速升高,但随即下降,在感染后的第3周(第12天)达峰值(图5);甘油三酯、血糖和尿酸在感染后无明显变化,直到第3周(第12天)升高至最大值,之后回复到原来状态(图5)。从图5可以看出,所有呈现变化的血液生化指标均在感染后的第三周(第12天)上升至最大值,之后回复原状。
2.3.2血液生理指标的变化:全自动生理生化测定仪共检测了22项生理指标,其中有明显变化的共有6个,包括白细胞、红细胞、淋巴细胞、嗜酸性粒细胞、血红蛋白和中性粒细胞。统计分析发现,白细胞与红细胞的变化趋势相同,感染后每周的细胞计数都有波动,第2周(第10天)达到峰值(图6);而淋巴细胞、嗜酸性粒细胞、血红蛋白和中性粒细胞则有多次波动,在第2周(第8天)达峰值(图6)。
2.4感染动物细胞因子的变化
巴贝西虫感染黑线仓鼠血清IL-2含量的变化如图7所示。感染后第2天IL-2便升高,之后持续升高,第2周(第10天)达峰值,自第3周后便恢复到正常状态。
A:心、肝、脾、肺和肾脏系数变化趋势;B:肾脏系数变化趋势。图4 巴贝西虫感染黑线仓鼠脏器系数变化图A: Tendency of the changes of heart, liver, spleen, lung and kidney coefficients. B: Tendency of the changes of kidney coefficient.Fig.4 Changes of organ coefficients in the Chinese hamster infected wih Babesia
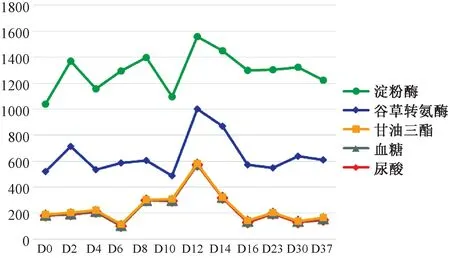
图5 巴贝西虫感染黑线仓鼠生化指标变化趋势图Fig.5 Tendency of the changes of biochemical components in the Chinese hamster infected with Babesia

图6 巴贝西虫感染黑线仓鼠生理指标变化趋势图Fig.6 Tendency of the changes of physiological indexes in the Chinese hamster infected with Babesia
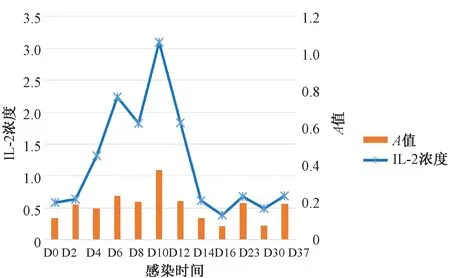
图7 巴贝西虫感染黑线仓鼠血清中IL-2浓度的变化Fig.7 Changes of the serum concentration of IL-2 in the Chinese hamster infected with Babesia
3 讨论
巴贝西虫是一类微小的寄生虫,直径约1~5 μm,主要侵袭宿主的红细胞[8]。已知此类寄生虫在生命周期中有两个宿主:蜱和各种脊椎动物。其中蜱是其终身宿主,而其它脊椎动物,包括人,是其中间宿主。巴贝西虫病虽然没有像禽流感、SARS、MERS等病毒病那样暴发成灾,但近年来在世界各地均有报道,亚洲的中国[9]/日本[10]、南美的巴西[11]/乌干达[12]、欧洲的法国[13]/挪威[14]等均有相关报道,且有人畜致死病例。
巴贝西虫感染动物后,在24 h内可完成侵入,而进入宿主的红细胞[8]。在实验室条件下,巴贝西虫可在4℃存活21 d[15]。而当巴贝西虫感染黑线仓鼠后,24h完全侵入黑线仓鼠红细胞,第2天开始不断增殖,在第4天便可达到峰值(图3),之后持续下降,仅在第2周末(第12天)又出现一次增殖高峰(图3)。实验第37天,仍可通过real-time PCR检测到巴贝西虫。根据文献报道,巴贝西虫感染后的第1至4周表现出临床症状[4],而且其感染可持续9周甚至6个月之久[16]。因此,可确定巴贝西虫感染后会在动物体内长期存在,在没有药物作用的情况下,在感染的前两周会有两次增殖,之后在受试动物自身免疫系统的抵制下达到一个动态平衡。伴随着巴贝西虫的增殖,受感染黑线仓鼠的防御响应机制启动,其脏器系数发生一定的变化。脏器变化最为明显的是肝脏和脾脏,肝脏系数在感染后的3周内分别有3次升高(图4A),而脾脏系数在感染的第2和第3周分别有两次达峰值(图4B)。肝脏和脾脏是两个重要的免疫抑制细胞分泌器官,因此,在病原微生物入侵后,受影响最大的当属肝和脾。与其它的感染性病原微生物相似,巴贝西虫会使受感染动物产生与疟疾相似的症状,同时伴随着肝肿大和脾肿大等症状[1,4]。
血常规和血液的生理生化检查主要包括血细胞和血小板计数、血红蛋白含量测定、血液中的离子及各种酶的测定等,可为疾病的诊断、疗效的观察及预后的判断提供重要参考[17]。巴贝西虫感染后,黑线仓鼠血液的生化指标发生明显变化,其中淀粉酶、谷草转氨酶、甘油三酯、血糖和尿酸均在第2周(第12天)达到峰值(图5)。而血细胞的变化趋势为每周有一次峰值(图6),其中典型的当属白细胞,黑线仓鼠感染巴贝西虫后第2天,白细胞数迅速增加,第2周(第10天)达峰值,而第3周(第23天)则再次达峰值(图6)。巴贝西虫是血液寄生虫,动物感染后血细胞和血液生化值受影响最大,其参数都不同程度的波动[18]。而其中,白细胞因含诸多免疫抵制因子而发生最为显著的变化,以抵制病原微生物的侵染和攻击。
IL-2大部分是由血液白细胞产生的,可提高机体对病毒、细菌、真菌、原虫等感染的免疫应答,是一种免疫增强剂,具有抗病毒、抗肿瘤和提高机体免疫功能等作用[19]。巴贝西虫感染黑线仓鼠后,随着血细胞的变化,血清中的IL-2也发生了明显的变化,IL-2的变化直接反映了宿主的免疫响应。从感染第2天起,IL-2持续增加,在第2周(第10天)达峰值(图7),这一变化趋势与白细胞相似,反映出在没有药物作用的情况下,黑线仓鼠机体对病原体的抵制和适应有一个过程,在这一过程中,存在着宿主免疫系统与病原相互制衡,从而达到动态平衡的战斗。
了解巴贝西虫侵入宿主的时间点,分析其在宿主体内的增殖特性,可以深入分析病原与宿主相互作用,对于寄生虫病的诊断与治疗也有重要的参考意义。另外,黑线仓鼠对于寄生虫感染具有均一、稳定的应激反应状态,在旋毛虫、巴贝西虫、利什曼原虫等感染中均可获得较好的数据[7,20]。因此,黑线仓鼠可以作为寄生虫感染研究良好的候选模型动物。
[1]Hunfeld KP, Hildebrandt A, Gray JS. Babesiosis: recent insights into an ancient disease[J]. Int J Parasitol, 2008, 38(11): 1219-1237.
[2]Kjemtrup AM, Conrad PA. Human babesiosis: an emerging tick-born disease [J]. Int J Parasitol, 2000, 30(12-13): 1323-1337.
[3]Irwin PJ. Canine babesiosis: from molecular taxonomy to control [J]. Parasit Vectors, 2009, 2(Suppl 1): S4.
[4]Vannier E, Krause PJ. Human babesiosis[J]. N Engl J Med, 2012, 366(25): 2397-2407.
[5]卢艳,蔡玉春,陈韶红,等。田鼠巴贝虫实验动物模型的建立[J]. 中国寄生虫学与寄生虫病杂志,2012,30(6): 423-427.
[6]赵爽, 王冬平, 刘晓, 等. 黑线仓鼠及其白化突变系血液生理生化值的测定与分析 [J]. 中国比较医学杂志, 2011, 21(7): 17-21.
[7]张小飞, 刘冉, 崔晓霞, 等. 旋毛虫感染黑线仓鼠及其白化突变系后细胞因子变化比较分析[J]. 中国比较医学杂志, 2014, 24(8): 11-15.

[9]Wang HX, Huang F.BabesiaInfection in the Southwest of China, a case report [J], Jundishapur J Microbiol, 2014, 7(11): e13504. DOI: 10.5812/jjm.13504
[10]Iguchi A, Soma T, Suzuki H, et al. The epidemiological survey for atovaquone resistant related gene ofBabesiagibsoniin Japan [J]. J Veter Med Sci, 2015, published in advance. DOI: 10.1292/jvms.15-0480
[11]Moraes PHG, Rufino CP, Baraúna ARF, et al. Molecular characterization ofBabesiavogeliin dogs from Belém, northern Brazil [J], Genet Mol Res, 2015, 14 (4): 16364-16371.
[12]Proboste T, Kalema-Zikusoka G, Altet L, et al. Infection and exposure to vector-borne pathogens in rural dogs and their ticks, Uganda [J]. Parasites & Vectors, 2015, 8: 306.
[13]Magalie RM, Claire VM, Jeanne C, et al. Update on epidemiology of canine babesiosis in Southern France[J]. BMC Vet Res, 2015, 11: 223.
[14]Mørch K, Holmaas G, Frolander PS, et al. Severe humanBabesiadivergent infection in Norway[J]. Int J Infect Dis, 2015, 33: e37-e38.
[15]Eberhard ML, Walker EM, Steurer FJ. Survival and infectivity ofBabesiain blood maintained at 25℃and 2-4℃[J]. J Parasitol, 1995, 81: 790-792.
[16]Herwaldt BL, Linden JV, Bosserman E, et al. Transfusion-associated babesiosis in the United States: a description of cases[J]. Ann Intern Med, 2011, 155: 509-519.
[17]张华, 侯绍华. 血常规检查在猫犬疾病诊断中的应用[J].中国动物检疫, 2009, 26(3): 55-56.
[18]Mylonakis E. When to suspect and how to monitor babesiosis[J]. Am Fam Physician, 2001, 63(10): 1969-1974.
[19]金伯泉, 熊思东. 医学免疫学 (第5版) [M]. 北京. 人民卫生出版社, 2008: 61-62.
[20]遇秀玲,郑振峰.白化黑线仓鼠解剖学与组织学特性的比较研究[J]. 中国实验动物学杂志, 1991, 1( 3,4): 191-193.
Biological characteristics of Chinese hamster infected with Babesia
YE Li1, MA Shuai2, WANG Yi-jia1,3, ZHENG Jun-wen1,3, WANG Dong-ping1,LI Gui-jun1, FAN Jun-wen1, SHI Yan-sheng1, ZHANG Xiao-fei4, BAI Jie-ying1
(1.Laboratory Animal Center, Academy of Military Medical Sciences, Beijing 100071, China;2. Beijing Research Center for Agricultural Standards and Testing, Beijing 100097; 3. Capital Normal University,Beijing 100048; 4. Beijing Institute of Veterinary Drug Control, Beijing 102600)
ObjectiveTo establish a Chinese hamster model ofbabesiainfection, to find the changing pattern of organs and biochemical parameters in Chinese hamster infected withBabesia, and to promote the detection and treatment of babesiosis.Methods Healthy 5-week old Chinese hamsters were infected by intraperitoneal injection of blood containingBabesia. Blood samples were collected at 0, 2, 4, 6, 8, 10, 12, 14, 16, 23, 30, and 37 days after infection from 5 hamsters at each time point. Blood smears were prepared to detect the parasites using Giemsa staining. ELISA assay was employed to test the IL-2 concentration. The blood biochemical indexes were detected using an automatic biochemical analyzer. DNA was extracted from the whole blood and REAL-TIME RCR was performed to determine the reproduction ofBabesia. Aftert the animals were sacrificed, the heart, lung, spleen, liver, and kidney were taken to analyze the changes of organ coefficients. ResultsThe highest level ofBabesiain the hamsters occurred on day 4 after theBabesiainjection, and then showing a decreasing tendency. However, there was a transient increase on the 12thday after infection. The liver and spleen displayed most extensive response to the infection showing hepatomegaly and splenomegaly, but the variation of heart and kidneys coefficients was within the norm. There were prominent changes of blood cells, especially leucocytes, with two peaks at day 10 and 23 after theBabesiainfection. The peak changes of blood biochemical indexes occurred at day 12 after infection. The concentration of serum IL-2 reached a peak on the 10th day after infection. ConclusionsThe Chinese hamsters display typical characteristics of tick-borne diseases such as hepatomegaly and splenomegaly. The immunological system is activated along with the infection and reaches a highest stage in the second week. Afterwards theBabesiacan live in the hamster body for a long period of time. The results of this study provide useful information supporting further studies on the detection, treatment and prevention ofBabesiosis.
Babesia; Babesiosis; Chinese hamster; Organ coefficients; Blood biochemistry; Il-2
国家自然科学基金面上项目(31272385); “十二五”重大专项(2011ZXJ09201-031);北京市自然科学基金面上项目(5152023);病原微生物生物安全国家重点实验室开放课题(SKLPBS1435);军事医学科学院创新基金(2012CXJJ022);后勤“十二五”面上项目(CWS11J092)。
叶(1988-),女,研究实习员,研究方向:人兽共患疾病模型,E-mail:18066045532@163.com; 马帅(1990-),女,助理研究员, E-mail: mashuai19890926@126.com。叶莉和马帅为本文共同第一作者。
张小飞(1978-),女,副研究员,研究方向:兽药安全与检测, E-mail: wangyizxf@163.com;白杰英(1977-),男,,副研究员,硕士生导师,研究方向:人兽共患感染性疾病致病机理, E-mail:baijieying@126.com。
研究报告
R-33
A
1671-7856(2016) 08-0036-06
10.3969.j.issn.1671-7856.2016.08.005
2016-04-08
