奥沙利铂联合希罗达一线化学治疗K-ras突变型结直肠癌的疗效分析
2016-09-13李大鹏李仕武
李大鹏 李仕武
奥沙利铂联合希罗达一线化学治疗K-ras突变型结直肠癌的疗效分析
李大鹏 李仕武
目的 评价奥沙利铂联合希罗达(LOHP方案)与伊立替康联合5-氟尿嘧啶(CPT-11方案)一线化学治疗K-ras 突变型晚期结直肠癌患者的疗效和安全性。方法 收集2012年1月至2015年1月被确诊为K-ras突变型晚期结直肠癌并采用奥沙利铂联合希罗达进行治疗的30例患者作为观察组;选择同期采用伊立替康联合5-氟尿嘧啶进行治疗的30例K-ras突变型晚期结直肠癌患者作为对照组。比较两种治疗方案的有效率、疾病控制率、无进展生存时间和安全性。结果 (1)近期疗效:两组间完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)、疾病控制率(DCR)差异无统计学意义(P>0.05);观察组的有效率(ORR)为36.7%,高于对照组的13.3%,且差异有统计学意义(P=0.04)。(2)远期疗效:观察组中位无进展生存期PFS为9.3个月(95%CI:6.5~12.0个月),对照组无进展生存期(PFS)为7.0个月(95%CI:5.3~9.8个月),组间差异无统计学意义(Log-rank=1.89,P=0.17)。(3)不良反应:LOHP方案组主要的不良反应为恶心、呕吐(53.3%),血小板减少(33.3%)和白细胞下降(20.0%);CPT-11方案组的主要不良反应为恶心、呕吐(43.3%),血小板减少(40.3%)和白细胞下降(30.0%)。组间不良反应发生率比较差异均无统计学意义(P>0.05)。结论 奥沙利铂联合希罗达用于治疗K-ras突变型晚期结直肠癌的近期疗效优于伊立替康联合5-氟尿嘧啶,而远期疗效和安全性相当,可以作为一线化学治疗的方案。
奥沙利铂 伊立替康 K-ras突变型 结直肠癌 疗效 安全性
结直肠癌是仅次于肺癌和肝癌位居第3位最常见的恶性肿瘤,在我国结直肠癌的发病率有逐渐增高的趋势[1]。晚期结直肠癌一线化疗药物主要为氟尿嘧啶(5-Fu)、伊立替康、 奥沙利铂、希罗达等[2]。本研究通过收集近年来本院使用奥沙利铂联合希罗达(LOHP方案)或伊立替康联合5-氟尿嘧啶(CPT-11方案)药物一线治疗晚期结直肠癌的临床资料,并对两种化疗方案的近期疗效、远期效应和不良反应进行比较,为晚期K-ras基因突变型的结直肠癌患者提供更好的一线治疗方案。
1 临床资料
1.1 一般资料 回顾性收集2012年1月至2015年1月经病理确诊为K-ras突变型晚期结直肠癌并采用奥沙利铂联合希罗达(卡培他滨)进行治疗的30例患者作为LOHP方案组;选择同期采用伊立替康联合5-氟尿嘧啶进行治疗的30例K-ras突变型晚期结直肠癌患者作为CPT-11方案组。60例符合研究标准的观察对象中男39例,女21例;年龄42~71岁,平均年龄(54.03±8.48)岁。原发灶部位:结肠35例,直肠25例。分化程度:低分化17例、中分化29例、高分化14例。病理类型:腺癌38例、黏液腺癌4例、腺癌合并黏液癌18例。既往手术史:39例。纳入标准[3]:(1)经病理证实为K-ras 基因为突变型结直肠癌。(2)美国东部肿瘤协作组评分≤2分,且有≥1处可测量病灶,预计生存期≥3个月。(3)接受奥沙利铂联合希罗达或伊立替康联合5-氟尿嘧啶为主的一线化疗。(4)有影像学病灶评价结果。排除标准:(1)合并有其他肿瘤治疗方案。(2)合并肠梗阻或有严重心肺疾病史。
1.2 治疗方案 (1)LOHP方案组:第 1天给予奥沙利铂(130mg/m2)静脉滴注90min,第1~14天给予希罗达(1000 mg/m2)口服,2次/d,21d为1个周期。(2)CPT-11方案组:第 1天伊立替康(180mg/m2)静脉推注90min联合5-氟尿嘧啶(400mg/m2)静脉推注,5 -氟尿嘧啶(2400mg/m2)持续静脉滴注44 h,14 d为1个疗程。
1.3 疗效与不良反应评估指标 疗效评价按照WHO制定的实体肿瘤化疗疗效评价标准进行[4]。(1)近期疗效:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD);有效率(ORR)=CR+PR和疾病控制率(DCR)=CR+PR+SD。(2)远期疗效:采用疾病无进展生存期(PFS)进行评价,是指患者从接受治疗方案起至影像学复查至首次出现疾病进展或因疾病进展导致死亡为止的时间跨度。(3)不良反应:按照美国国家癌症研究所常见毒性反应标准(NCI-CTC)3.0版标准[6]进行评价,评价指标主要包括:脱发、神经毒性、手足综合征、腹泻和白细胞下降等。
1.4 统计学方法 采用SPSS 19.0统计软件。计量资料以(±s)表示,组间比较采用t检验;计数资料以%表示,组间比较采用χ2检验;PFS采用Kaplan-Meier法绘制生存曲线,组间差异采用Log-rank对数秩检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 两组结直肠癌患者一般情况比较 两组患者在年龄、男女比例、原发灶部位、分化程度、病理类型和是否有既往手术史的分布差异无统计学意义(P>0.05),具有可比性 。见表1。
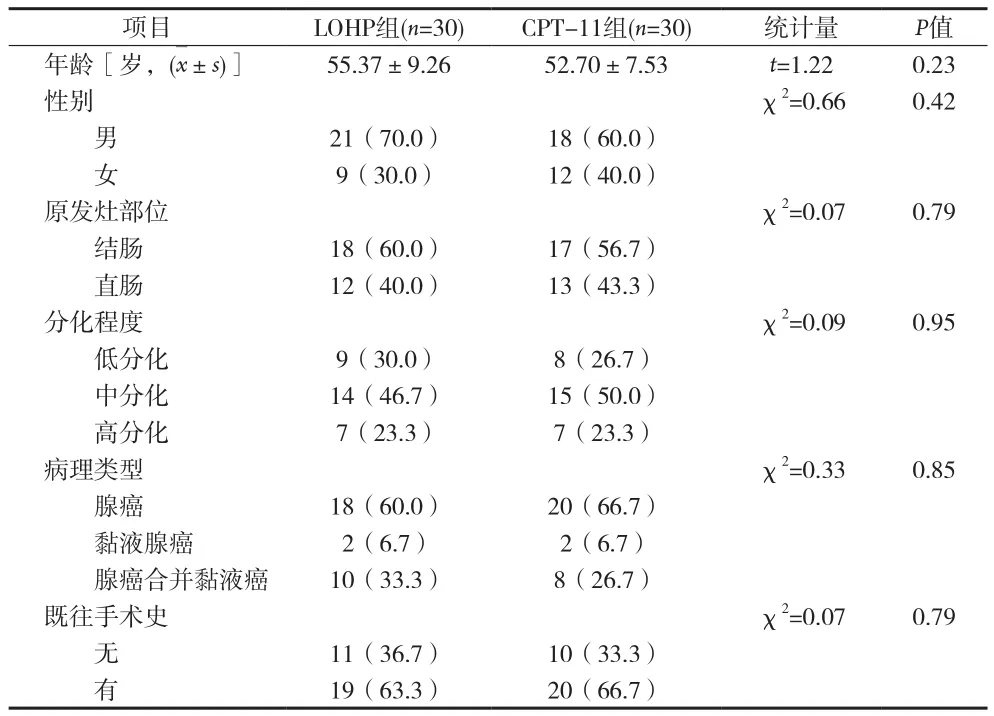
表1 两组结直肠癌患者一般情况比较[n(%)]
2.2 两组结直肠癌患者近期疗效比较 两组间CR、PR、SD、PD和DCR差异无统计学意义(P>0.05),而LOHP组的ORR为36.7%,高于CPT-11组的13.3%,且差异有统计学意义(χ2=4.36,P=0.04)。见表2.
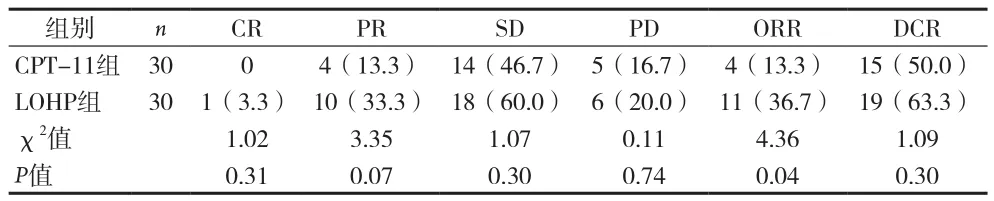
表2 两组结直肠癌患者近期疗效比较[n(%)]
2.3 远期疗效 奥沙利铂联合希罗达治疗组的中位PFS为9.3个月,95%CI为(6.5,12.0);而伊立替康联合5-氟尿嘧啶治疗组的中位PFS为7.0个月,95%CI为(5.3,9.8)。奥沙利铂联合希罗达治疗组与而伊立替康联合5-氟尿嘧啶治疗组中位PFS间的比较差异无统计学意义(Log-rank=1.89,P=0.17)。生存曲线见图1。
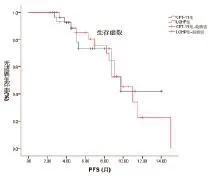
图1 组间PFS曲线
2.4 不良反应 LOHP组主要的不良反应为恶心、呕吐(53.3%),血小板减少(33.3%)和白细胞下降(20.0%);CPT-11组的主要不良反应为恶心、呕吐(43.3%),血小板减少(40.3%)和白细胞下降(30.0%)。两组间不良反应发生率比较差异均无统计学意义(P>0.05)。见表3。
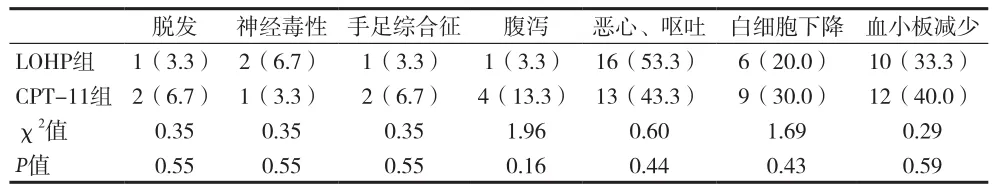
表3 两组结直肠癌患者不良反应的比较[n(%)]
3 讨论
近年来我国结直肠癌的发病率不断上升,国外结直肠癌的发病率占恶性肿瘤第2~3位,在我国位居恶性肿瘤第3位,严重危害人群健康[5]。目前研究表明K-ras基因突变在结直肠癌中发挥重要的作用,在亚洲结直肠癌患者中K-ras基因的突变率约为35%~40%[6],存在K-ras 基因突变的结直肠癌患者其预后常较差[7]。K-ras基因能编码具有鸟苷三磷酸(GTP)酶活性的小G蛋白,该蛋白能将胞外信号通过一系列信号通路转导到细胞内,从而参与细胞的增殖、分化及凋亡。当 K-Ras 的基因发生突变时,其编码的蛋白结构发生改变,从而导致GTP酶活性降低,导致下游信号的过度激活,进而促进细胞恶性转化,最终发生癌变。
结直肠癌早期主要采取手术治疗,然而晚期发生转移的结直肠癌患者则主要采取化疗。5-FU、奥沙利铂、卡培他滨、伊立替康、希罗达等以及靶向药物是治疗晚期结直肠癌的主要用药[8,9],其中奥沙利铂联合卡培他滨是目前治疗晚期结直肠癌的代表性化疗方案。K-ras基因分为野生型和突变型,目前大量研究显示EGFR抑制剂(如西妥昔单抗或帕尼单抗)能特异性地抑制野生型K-ras基因的结直肠癌细胞的生长[7,10],然而K-ras突变型的患者不能从中获益[11]。但针对K-ras 基因突变型结直肠癌采用何种可以获得更好疗效的化疗方案,目前仍未达成共识。因此分析比较K-ras 基因突变型晚期结直肠癌患者一线化疗方案的疗效,对于晚期结直肠癌整体治疗效果的提高具有重要的意义。
本研究结果显示奥沙利铂联合希罗达方案组与伊立替康联合5-氟尿嘧啶方案组比较,在近期疗效方面奥沙利铂组的DCR为63.3%,伊立替康组DCR 为50.0%,两组间DCR比较差异无统计学意义(χ2 =1.09,P=0.30);此外两组间的CR、PR、SD和PD差异无统计学意义(P>0.05);然而奥沙利铂组的ORR 为36.7%,高于伊立替康组的13.3%(P<0.05)。在远期疗效方面,奥沙利铂组中位PFS为9.3月(95%CI:6.5~12.0),伊立替康组中位PFS为7.0月(95%CI:5.3~9.8);两组间中位PFS比较差异无统计学意义(P>0.05)。王丽等[7]通过分析74例K-ras突变型晚期结直肠癌患者采用奥沙利铂或伊立替康联合氟尿嘧啶类药物进行一线化疗的疗效和安全性,其结果显示奥沙利铂组和伊立替康组的ORR分别为20.0%和12.5%,DCR分别为80.0%和83.3%,中位PFS分别为8.0个月和和6.7个月两组间ORR、DCR和中位PFS差异均无统计学意义;该结果与本研究结果相似。
两组结直肠癌患者主要的不良反应为恶心、呕吐,血小板减少和白细胞下降;而手足综合征、神经毒性和脱发不良反应相对较低,且未发生与治疗相关的死亡病例。总之,奥沙利铂组和伊立替康组组间不良反应发生率比较差异均无统计学意义(P>0.05)。
综上所述,奥沙利铂联合希罗达治疗组治疗有效率优于伊立替康联合5-氟尿嘧啶治疗组,但两组间的远期疗效和不良反应方面并无明显差异。因此,对于K-ras基因突变型晚期结直肠癌患者,推荐使用奥沙利铂联合氟尿嘧啶作为一线化疗方案。然而本研究存在样本量较少和观察期短等缺点,本研究所得结论仍需进一步研究验证以及更多、更深入的研究。
1 Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010.CA: a cancer journal for clinicians,2010,60(5):277~300.
2 李娟,张婷婷,王以尚,等.西妥昔单抗联合化疗-线治疗k-ras野生型晚期结直肠癌疗效观察.解放军医学院学报,2015,36(6):590~594.
3 夏学明,闫晓杰,房慧,等.奥沙利铂或伊立替康联合氟尿嘧啶类药物一线治疗k-ras突变型晚期结直肠癌的疗效分析.华西医学,2015,30(7):127 0~1273.
4 Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors.European organization for research and treatment of cancer,national cancer institute of the united states,national cancer institute of canada. Journal of the National Cancer Institute,2000,92(3):205~216.
5 Conroy T,Hebbar M,Benn ouna J,et al.Quality-of-life findings from a randomised phase-iii study of xelox vs folfox-6 in metastatic colorectal cancer.British journal of cancer,2010,102(1):59~67.
6 Benvenuti S,Sartore-Bianchi A,Di Nicolantonio F,et al.Oncogenic activation of the ras/raf signaling pathway impairs the response of metastatic colorectal cancers to anti-epidermal growth factor receptor antibody therapies.Cancer research,2007,67(6):2643~2648.
7 王丽,余英豪.结直肠癌k-ras基因检测及其靶向治疗的研究现状.世界华人消化杂志,2011,19(1):62~67.
8 Cassidy J.Xeloda in colorectal cancer.International journal of clinical practice,2001,55(5):326~328.
9 Cersosim o RJ. Management of advanced colorectal cancer,part 2.American journal of health-system pharmacy: AJHP : offi cial journal of the American Society of Health-System Pharmacists,2013, 70(6): 491~506.
10 Karapetis CS,Khambata-Ford S,Jonker DJ,et al.K-ras mutations and benefit from cetuximab in advanced colorectal cancer.The New England journal of medicine,2008,359(17):1757~1765.
11 庄荣源,刘天舒,周宇红,等.西妥昔单抗联合化疗治疗转移性结直肠癌疗效与k-ras状态的关系.中国癌症杂志,2009,19(12):943~946.
Objective To compare the efficacy and safty of Oxaliplatin combined with Xeloda among patients with K-ras mutant colorectal cancer. Methods From October 2010 to October 2014,30 cases of patients diagnosed as K-ras mutant colorectal cancer and treated with Oxaliplatin combined with Xeloda were selected as oberservation group;another 30 cases of patients diagnosed as K-ras mutant colorectal cancer but treated with Irinotecan combined with 5-fluorouracil at the corresponding period were selected as control group. The overall response rate(ORR),disease control rate(DCR),progress free survival(PFS)and side effect were collecet and compared between groups. Results (1)The difference of CR,PR,SD,PD and DCR between groups are insignificant(P>0.05). The ORR is 36.7% in observation group,which is significantly higher than 13.3% in control group(P=0.04).(2)The median PFS are 9.3 month(95%CI:6.5~12.0 month)and 7.0 month(95%CI:5.3~9.8 month)in observation group and control group respectively,while there is no significance between groups(Log-rank test=1.89,P=0.17).(3)The main side effects are nausea and vomiting(53.3%),thrombocytopenia(33.3%)and leukocyte decrease(33.3%)among LOHP group,but nausea and vomiting (43.3%),thrombocytopenia(40.3%)and leukocyte decrease(30.0%)among CPT-11 group. Insignificant difference between goups are detected (P>0.05). Conclusion The overall effect rate of Oxaliplatin combined with Xeloda is better than Irinotecan combined with 5-fluorouracil among patients with K-ras mutant colorectal cancer,while the median PFS and side effect are the same.
Oxaliplatin Irinotecan K-ras mutant Colorectal cancer Bowel preparation Efficacy analysis Safty analysis
河北省秦皇岛市科技计划项目(201502A217)
066000 河北省秦皇岛市第四医院
