L氨基酸氧化酶的诱导表达及生物催化合成5氨基戊酸的研究
2016-09-12马金莲应晗笑曹伟佳陈可泉
马金莲,应晗笑,王 璟,曹伟佳,吴 昊,陈可泉
(南京工业大学生物与制药工程学院,江苏南京 211816)

马金莲,应晗笑,王璟,曹伟佳,吴昊,陈可泉*
(南京工业大学生物与制药工程学院,江苏南京 211816)
L-氨基酸氧化酶可以催化L-氨基酸生成酮酸等化学品,具有重要的应用前景。本研究成功将来源于红球菌(Rhodococcus opacus)的氨基酸氧化酶在大肠杆菌中表达,并首次用于生物催化合成5-氨基戊酸。结果表明:L-氨基酸氧化酶诱导表达最适温度为25℃,最适诱导剂浓度0.5 mmol/L,最适诱导时间为7 h,诱导时最佳细胞量为0.246 g/L。催化合成5-氨基戊酸时,最适底物L-赖氨酸(Lys)浓度17 mmol/L,最适pH为7.0,最适温度为37℃,最适时间为24 h,最适补加0.5% H2O2,添加酶与黄素腺嘌呤二核苷酸(FAD)的最适摩尔比为1∶1,最终5-氨基戊酸产量达到16.71 mmol/L。本研究成功的实现了单酶(LAAO)合成5-氨基戊酸,为简便生物合成5-氨基戊酸奠定基础。
L-氨基酸氧化酶,诱导表达,酶催化,5-氨基戊酸
L-氨基酸氧化酶(L-amino acid oxidase,LAAO,EC 1.4.3.2)在自然界中分布较广,它们可以催化氨基酸生成对应的酮酸、氨和双氧水[1]。LAAO主要从蛇毒中分离[2],但由于蛇毒源酶的获取困难,表达不易,极大限制了其在酶催化合成中的应用。最近越来越多的非蛇毒源LAAO被发现和报道,主要集中在真菌、细菌、海藻等微生物中[3]。虽然有多种的LAAO的编码序列已发表[3-4],但由于需要翻译后酶的修饰[2,5],迄今只有少量LAAO异源表达系统被报道[6-7]。来源于R.opacus的LAAO由于具有广泛的底物特异性与较高的底物亲和力,使得R.opacus在异源表达LAAO的基因筛选中受到广泛关注[8]。
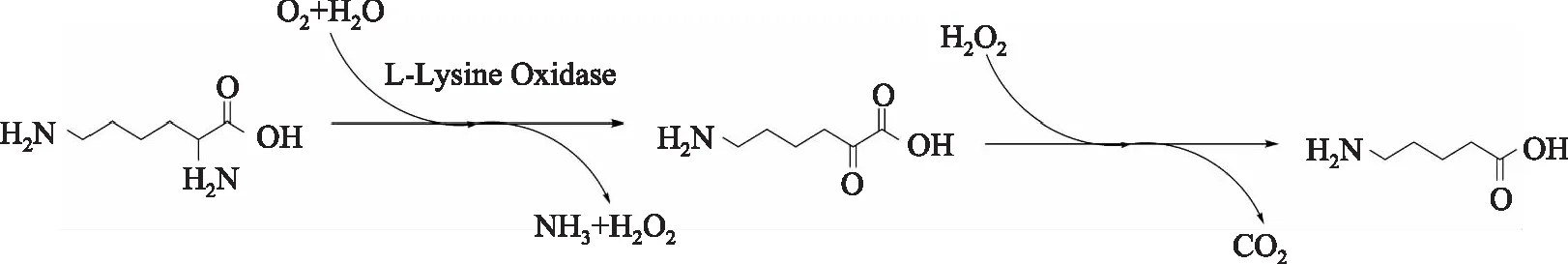
图1 5-氨基戊酸机理图Fig.1 5-aminovaleric acid mechanism map
近年来,研究发现LAAO可有效催化生成5-氨基戊酸,进一步使其成为研究热点[9]。如图1所示,LAAO在以Lys为底物作用下生成α-酮酸、氨和双氧水[1]。α-酮酸在双氧水作用下生成5-氨基戊酸[10]。目前工业上制备5-氨基戊酸主要使用化学法。一般采用戊内酰胺或戊内酰胺聚合物(尼龙6的熔块、废丝、废弃织物、渔网等)水解后精制而得[11]。这些方法与酶法相比反应条件苛刻,能耗大,设备腐蚀大,效率低,分离复杂[12]。因此开发条件温和,转化高效5-氨基戊酸生物合成路线具有重要的现实意义。本研究采用大肠杆菌工程菌MZ505异源表达LAAO,进行酶法合成5-氨基戊酸的研究。为5-氨基戊酸衍生物的研究奠定了基础。
1 材料与方法
1.1材料与仪器
1.1.1菌株本实验使用菌株为大肠杆菌MZ505,现保藏于中国典型培养物保藏中心(保藏号:CCTCC M2015042)。LAAO基因片段交由Genscript(金斯瑞)构建完成。以R.opacus基因组DNA为模板,以EcoR I和Hind III为酶切位点,以P1(CCGGAATT CATGGCATTCACACGTAGAT)、P2(CCCAAGCTTTCA GGCTTCCTGGGC)为引物连接到载体pET-28a中,随后将pET-28a(+)转化进BL21(DE3),构建得到大肠杆菌MZ505。
1.1.2LB培养基蛋白胨10 g/L,酵母粉5 g/L,氯化钠5 g/L,固体培养基另加25 g/L琼脂粉,使用前121℃,15 min高压蒸汽灭菌。
1.1.3实验仪器精密pH计PHS-3C上海雷磁仪器厂;紫外可见分光光度计752S上海棱光技术有限公司;生物净化工作台SW-CJ-1FD苏州净化设备有限公司;电子天平BS124SSartourius公司;高压蒸汽锅HVE-85HIRAYAMA公司;离心机LD10北京医用离心机厂;台式恒温振荡器THZ-D太仓市强乐实验设备厂;超低温冰箱MDF-382E(H)三洋电机株式会社。
1.2实验方法
1.2.1种子培养在50 mL的摇管中接种10 μL含有pET-28a重组质粒的E.coli BL21(DE3)工程菌株于5 mL的LB液体培养基中,加入10 μL的25 g/L卡那霉素(Kana)抗生素。放入37℃摇床中,200 r/min过夜培养。
1.2.2发酵培养在500 mL的摇瓶中接种1 mL上述种子液于100 mL的LB液体培养基中,加入200 μL的25 g/L Kana抗生素培养,当细胞量达到0.246 g/L时加入0.5 mol/L异丙基-β-D-硫代半乳糖苷(IPTG),使其终浓度达到0.5 mmol/L于25℃诱导7 h。
1.2.3LAAO粗酶液的制备将诱导后的发酵液在4℃条件下,8500 r/min离心3 min收集菌体,使用菌体两倍体积pH7.0的50 mmol/L磷酸盐缓冲液(PBS)重悬清洗两次,最后将菌体重悬于1/10体积的50 mmol/L pH7.0的PBS缓冲液超声破碎,超声破碎功率150 W、时间15 min、时间间隔(工作时间∶间歇时间)3∶5(s/s),超声完毕后的浑浊液 12000 r/min离心20 min,收集上清,获取LAAO粗酶液。
1.2.4蛋白浓度测定方法考马斯亮蓝法:向试管中加入LAAO粗酶液1 mL及Bradford 4 mL,混匀并室温静置3 min,紫外分光光度计测定其吸光值。
1.2.5蛋白表达的测定方法SDS-PAGE电泳[13],配制12.5%分离胶和3.9%浓缩胶,取10 μL酶液与等体积的样品缓冲液混匀 99℃加热10 min,4℃冷却后上样;跑胶完成后染色20 min后脱色。
1.2.6酶活的测定方法采用1 mmol/L 4-氨基安替比林(AAP)、60 mmol/L苯酚(PA)和7000 U/L辣根过氧化物酶(HRP)的体系测定[14]。分别向具塞试管中依次加入1 mL。Lys溶液100 μL,LAAO粗酶液50 μL,混匀,在37℃下加热20 min后,煮沸5 min终止反应,在508 nm波长下测定吸光度值。单位酶活(unit)定义为37℃下每分钟产生1 μmol/L H2O2所需的酶量。
1.2.7诱导表达通过SDS-PAGE发现会生成大量的包涵体,所以对诱导条件进行了优化。LAAO和Lys作用会生成H2O2。H2O2的量可以直观的反映出酶活的大小,所以测定H2O2的量确定最优的表达条件。
1.2.7.1诱导温度的优化初始发酵温度37℃,细胞量生长到0.492 g/L时加入0.5 mol/L IPTG,使其终浓度达到0.75 mmol/L分别于20、25、28、30、37℃诱导5 h。
1.2.7.2诱导时间的优化初始发酵温度37℃,细胞量生长到0.492 g/L时加入0.5 mol/L IPTG,使其终浓度分别达到0.75 mmol/L在25℃分别诱导1、3、5、7、9 h。
1.2.7.3诱导细胞量的优化初始发酵温度37℃,细胞量分别生长到0.041、0.123、0.246、0.492、0.656 g/L时加入0.5 mol/L IPTG,使其终浓度分别达到0.75 mmol/L在25℃诱导7 h。
1.2.7.4诱导剂剂量的优化初始发酵温度37℃,细胞量生长到0.246 g/L时加入0.5 mol/L IPTG,使其终浓度分别达到0.1、0.25、0.5、0.75、1.0 mmol/L在25℃诱导7 h。
1.2.8利用LAAO催化合成5-氨基戊酸各反应条件的优化
1.2.8.1利用LAAO催化合成5-氨基戊酸底物浓度的优化底物浓度分别为10、17、34、51、68 mmol/L与0.8 g/L LAAO粗酶液pH6.5 37℃条件下反应24 h。
1.2.8.2利用LAAO催化合成5-氨基戊酸pH的优化底物浓度为17 mmol/L与0.8 g/L LAAO粗酶液pH分别为5.5、6.5、7.0、7.5、8.0,37℃条件下反应24 h。
1.2.8.3利用LAAO催化合成5-氨基戊酸温度的优化底物浓度为17 mmol/L与0.8 g/L LAAO粗酶液pH7.0分别为20、25、30、37、40℃条件下反应24 h。
1.2.8.4利用LAAO催化合成5-氨基戊酸时间的优化底物浓度为17 mmol/L与0.8 g/L LAAO粗酶液pH7.0、37℃条件下分别反应3、6、10、16、24、28 h。
1.2.8.5利用LAAO催化合成5-氨基戊酸H2O2的优化底物浓度为17 mmol/L与0.8 g/L LAAO粗酶液中分别添加0.1%、0.3%、0.5%、0.7%、1%的H2O2,pH7.0、37℃条件下反应24 h。
1.2.8.6利用LAAO催化合成5-氨基戊酸FAD的优化底物浓度为17 mmol/L与0.8 g/L LAAO粗酶液和FAD pH7.0、37℃条件下反应24 h,酶与FAD的比例分别为1∶1、2∶1、3∶1、4∶1、5∶1。
1.2.95-氨基戊酸和L-赖氨酸测定方法高效液相色谱法(安捷伦1290 Infinity系统)色谱柱为C18分析柱(5 μm,250 mm×4.6 mm,Netherlands),流动相A为0.1 mol/L的乙酸钠溶液(pH通过冰醋酸调节到6.5)∶乙腈=93∶7(V/V);流动相B为乙腈∶水=80∶20(V/V),流速 1 mL/min,进样体积10 μL,柱温40℃,利用紫外检测器检测,波长为254 nm。具体方法如表1。
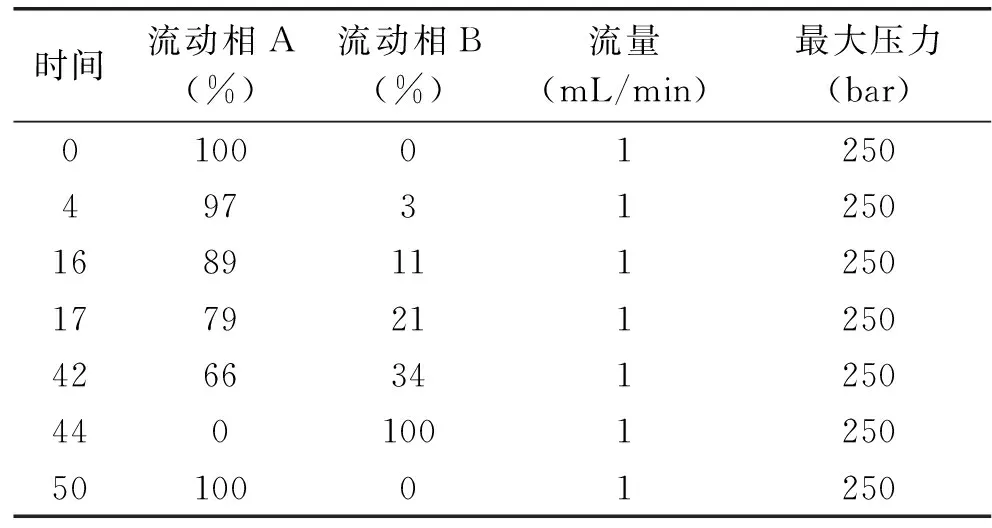
表1 高效液相色谱检测条件
1.3数据统计分析
实验数据均平行三次,计算平均数和标准方差,作图统一采用Origin8.0。
2 结果与讨论
2.1重组菌大肠杆菌工程菌MZ505的构建及表达
依据R.opacus LAAO氨基酸序列,经过密码子优化后设计出适合在大肠杆菌表达的DNA序列[15],并交由南京金斯瑞公司合成。合成的LAAO基因通过EcoR I/Hind III位点克隆至质粒pET-28a(+),得到重组质粒pET-28a-LAAO,并转化至BL21(DE3)中获得重组菌株MZ505。菌株在37℃条件下诱导(IPTG终浓度1 mmol/L)培养,L-氨基酸氧化酶的表达情况如图2所示,在57.6 ku大小处为LAAO SDS-PAGE条带,但是形成了大量的包涵体。

图2 L-氨基酸氧化酶的SDS-PAGE结果Fig.2 SDS-PAGE of the LAAO from Rhodococcus opacus注:M是蛋白质分子量标准,1,未加诱导剂诱导(37℃)上清;2,未加诱导剂诱导(37℃)沉淀;3,加诱导剂诱导(37℃)上清;4,加诱导剂诱导(37℃)沉淀,箭头所指示的条带是LAAO位置。
2.2重组L-氨基酸氧化酶的诱导表达条件优化
2.2.1诱导温度对菌体产L-氨基酸氧化酶的影响为了研究诱导温度对菌体产LAAO的影响,结果如图3所示,随着温度的增加,25℃酶活最高。温度较低时,外源基因的表达量不足,而温度过高则容易使表达的L-氨基酸氧化酶不能及时转运至细胞外,在胞内形成无活性的包涵体,所以达不到最高的分泌表达量[16]。因此,25℃是诱导LAAO表达的最佳温度,H2O2产量达0.353 mmol/L。

图3 温度对L-氨基酸氧化酶诱导表达的影响Fig.3 Effects of different induction temperatures on LAAO activity
2.2.2诱导时间对菌体产L-氨基酸氧化酶的影响为了研究诱导时间对菌体产LAAO的影响,结果如图4所示,加入诱导剂之后开始计时,随着诱导时间增加,诱导7 h酶活达到最高值。可能是因为诱导时间过长时LAAO的过量表达,超过了细菌的正常代谢水平且菌体分泌表达已稳定,菌体产酶诱导作用没有明显变化,因而后期菌体合成LAAO的能力又表现出下降趋势。诱导时间过短时,菌体分泌表达过低,菌体产酶诱导作用太小而不利于菌体的诱导表达[17-18]。因此,7 h是诱导LAAO表达的最佳时间,H2O2产量达0.744 mmol/L。
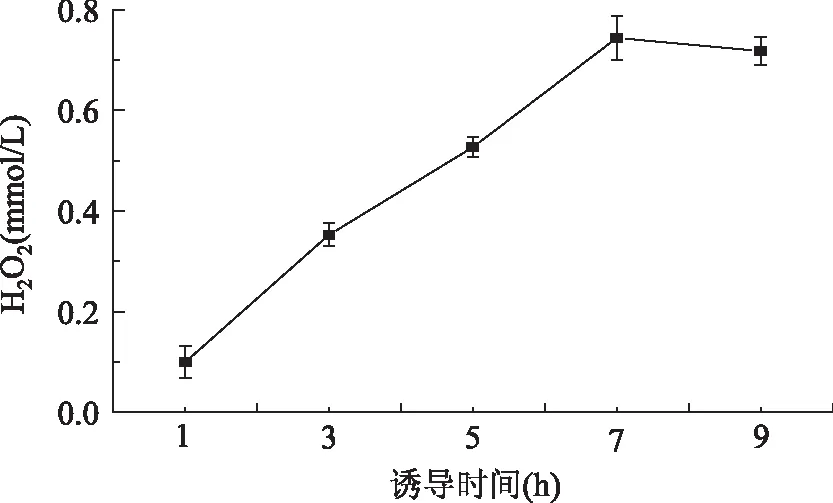
图4 诱导时间的诱导表达Fig.4 Effects of different induction time on LAAO activity
2.2.3诱导时不同细胞量对菌体产L-氨基酸氧化酶的影响为了研究诱导时不同细胞量对菌体产LAAO的影响,结果如图5可见,随着细胞量值的增加,在0.246 g/L时加入IPTG,诱导L-氨基酸氧化酶的酶活达到最大值,可能由于最佳诱导时期在重组菌生长到平稳期,此时的细胞数量增速稳定,细胞各种机能健全,分泌系统也已完善,因而利于L-氨基酸氧化酶的分泌表达。在菌体浓度较低时诱导L-氨基酸氧化酶,菌体生长还处于初期,表达效果差,酶活偏低,在菌体浓度高时诱导L-氨基酸氧化酶表达,菌体内各种酶系已趋于成熟,蛋白酶等的切割能力增强,或由于菌体的代谢产物抑制目的蛋白的表达而导致了酶活的下降[17-18]。因此,细胞量值达到0.246 g/L是诱导LAAO表达的最佳细胞量,H2O2产量达 0.798 mmol/L。
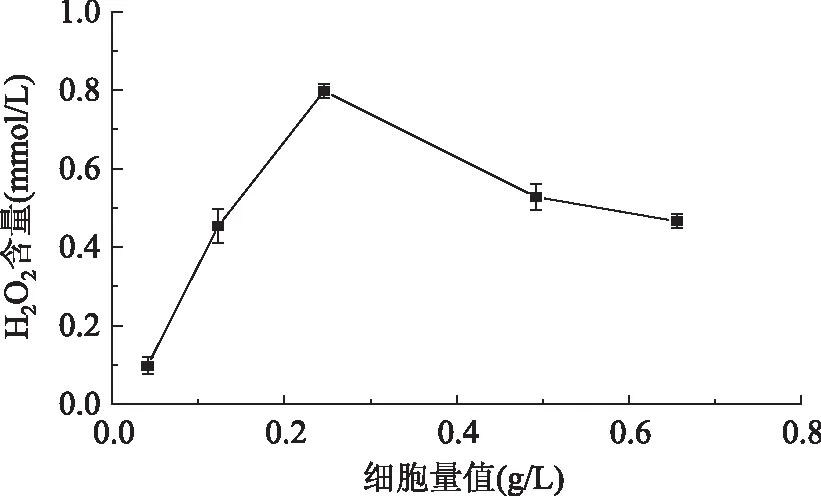
图5 细胞量的诱导表达结果Fig.5 Effects of different cell masses on LAAO activity
2.2.4诱导剂IPTG浓度对菌体产L-氨基酸氧化酶的影响为了研究诱导剂浓度对菌体产LAAO的影响,结果如图6所示,随着IPTG浓度的增大,在0.5 mmol/L时酶活达到最大值。当IPTG浓度高于0.5 mmol/L时,酶活迅速降低。这可能是因为由于随着诱导剂浓度的增加,L-氨基酸氧化酶的表达量也相应增加,而大肠杆菌的分泌能力是有限的,当L-氨基酸氧化酶的表达量低于细胞的分泌力时,酶活持续增加。L-氨基酸氧化酶的表达量高于细胞的分泌力时,会形成大量的包涵体,使得单位蛋白浓度的酶活降低[17]。因此,0.5 mmol/L是诱导LAAO表达的最佳IPTG浓度,H2O2产量达1.167 mmol/L。

图6 IPTG浓度的诱导表达结果Fig.6 Effects of different IPTG concentrations on LAAO activity
2.2.5单因素最优条件诱导时对菌体产L-氨基酸氧化酶的影响为了研究单因素最优条件诱导时对菌体产LAAO的影响,当菌液的细胞量值为0.246 g/L,加入0.5 mol/L IPTG,其终浓度为0.5 mmol/L,25℃诱导7 h发酵结束,收集菌液。得到的粗酶液检测酶活,H2O2产量达1.178 mmol/L。
2.3L-氨基酸氧化酶催化合成5-氨基戊酸
2.3.1合成5-氨基戊酸反应中底物浓度的优化据报道,很多酶都会对底物有抑制性作用[19]。为了研究底物对LAAO催化生物合成5-氨基戊酸存在一定的影响,用50 mmol/L pH7.0的PBS将LAAO粗酶液蛋白浓度稀释为0.8 g/L,LAAO与10~68 mmol/L底物浓度反应24 h,检测产物的生成量和底物的消耗量。结果如图7所示,底物浓度低于17 mmol/L时,酶促反应随着底物的增加而增加;底物浓度高于17 mmol/L时,酶促反应开始随着底物的增加而下降。可能由于底物浓度增加到一定程度时,底物会对LAAO产生抑制作用。则说明LAAO催化合成5-氨基戊酸最适底物摩尔浓度为17 mmol/L,5-氨基戊酸产量达5.145 mmol/L。
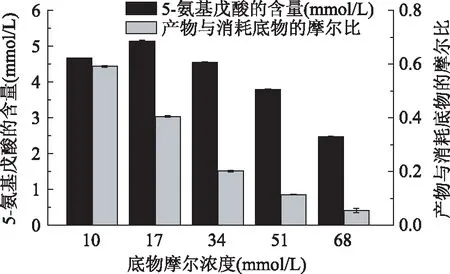
图7 底物摩尔浓度对合成5-氨基戊酸的影响Fig.7 Effects of substrate concentration on the synthesis of 5-aminovaleric acid
2.3.2合成5-氨基戊酸反应中pH的优化很多酶会随着环境的变化而变化,尤其pH的影响[20]。为了研究pH对LAAO催化生物合成5-氨基戊酸存在一定的影响,用50 mmol/L pH7.0的PBS将LAAO酶液蛋白浓度稀释为0.8 g/L,在pH5.5~8.0环境中与17 mmol/L的底物Lys在37℃下反应24 h,检测其产物的生成量和底物的消耗量。结果如图8所示,随着pH的升高,在pH7.0时达到最大值。则LAAO催化合成5-氨基戊酸最适pH为7.0,5-氨基戊酸产量达7.359 mmol/L。
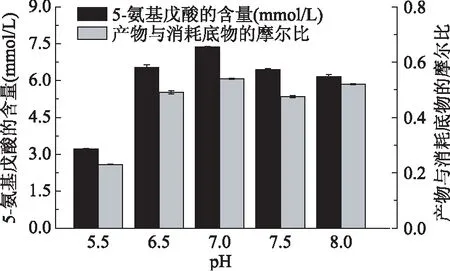
图8 pH对合成5-氨基戊酸的影响Fig.8 Effects of pH on the synthesis of 5-aminovaleric acid
2.3.3合成5-氨基戊酸反应中温度的优化酶是蛋白质,可随温度的变化而变化[20]。为了研究温度对LAAO催化生物合成5-氨基戊酸存在一定的影响,用50 mmol/L pH7.0的PBS将LAAO酶液蛋白浓度稀释为0.8 g/L,分别在20~40℃反应24 h,检测其产物的生成量和底物的消耗量。结果如图9所示,随着温度升高,37℃时达到最大值。由于LAAO随温度升高,酶变性而减少有活性酶的数量从而降低催化效果。则LAAO催化合成5-氨基戊酸最适温度为37℃,5-氨基戊酸产量达7.709 mmol/L。
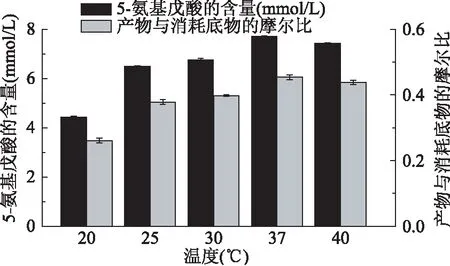
图9 温度对合成5-氨基戊酸的影响Fig.9 Effects of temperature on the synthesis of 5-aminovaleric acid
2.3.4合成5-氨基戊酸反应中时间的优化反应时间的长短也会对很多酶有一定的影响。为了研究时间对LAAO催化生物合成5-氨基戊酸存在潜在的影响,用50 mmol/L pH7.0的PBS将LAAO酶液蛋白浓度稀释为0.8 g/L,分别在37℃反应3~28 h,检测其产物的生成量和底物的消耗量。结果如图10所示,随着时间的延长,24 h时反应趋于完全。则LAAO催化合成5-氨基戊酸最适时间为24 h,5-氨基戊酸产量达6.239 mmol/L。
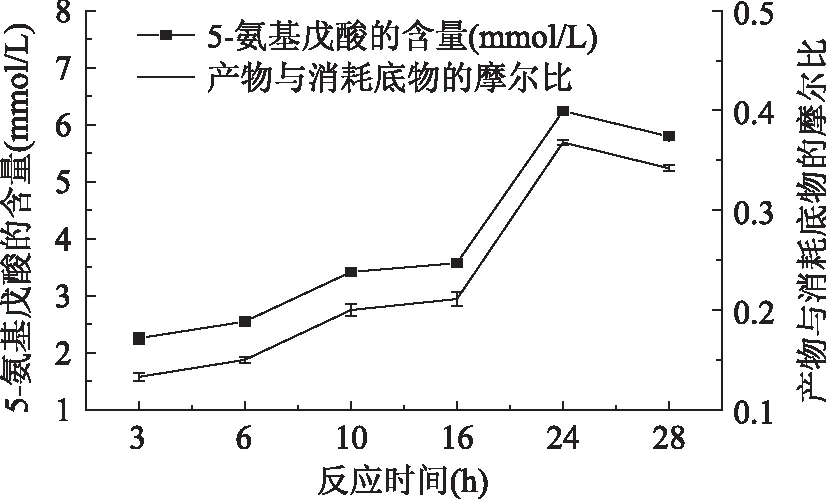
图10 时间对合成5-氨基戊酸的影响Fig.10 Effects of time on the synthesis of 5-aminovaleric acid
2.3.5合成5-氨基戊酸反应中添加H2O2量的优化L-氨基酸氧化酶生物合成5-氨基戊酸反应中会产生一定量的H2O2,为了研究反应中补加一定量的H2O2对LAAO催化合成5-氨基戊酸产生的影响,用50 mmol/L pH7.0的PBS将LAAO粗酶液蛋白浓度稀释为0.8 g/L,分别加入0.1%~1%的H2O2反应24 h,检测其产物的生成量和底物的消耗量。结果如图11所示,随着H2O2的补加,对酶促反应有一定的促进作用,过量时会对反应有一定的抑制作用。则最适补加0.5% H2O2,5-氨基戊酸产量达8.752 mmol/L,比未添加提高了近70%。
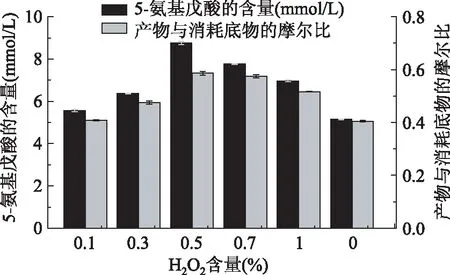
图11 H2O2对合成5-氨基戊酸的影响Fig.11 Effects of H2O2 on the synthesis of 5-aminovaleric acid
2.3.6合成5-氨基戊酸反应中添加辅酶的优化酶催化中,辅酶FMN或FAD对电子传递起到非常重要的作用,为了研究添加一定量的FAD对LAAO生物催化合成5-氨基戊酸产生一定的影响。分别添加适当0.8 g/L LAAO与FAD摩尔比在1∶1~5∶1的体系中反应24 h,检测其产物和底物Lys的消耗量。结果如图12所示,补加一定量的FAD对反应均有促进作用,可能由于LAAO其辅酶是FMN或FAD,使LAAO更好的作用于底物。重组LAAO与FAD摩尔比在1∶1时效果最好,5-氨基戊酸产量达7.034 mmol/L,比未添加提高了近36.7%。
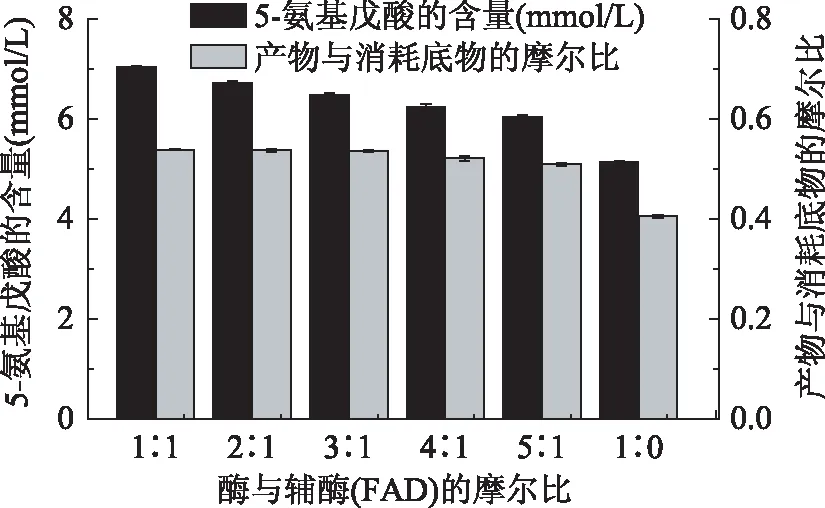
图12 FAD对合成5-氨基戊酸的影响Fig.12 Effects of FAD on the synthesis of 5-aminovaleric acid
2.3.7合成5-氨基戊酸反应通过对LAAO生物合成5-氨基戊酸反应进行了单因素优化后,将各单因素的最优条件综合验证催化效果。在以17 mmol/L底物浓度,添加0.5%的H2O2,酶与FAD的比为1∶1,pH7.0,温度37℃条件下反应24 h,检测其产物和底物Lys的消耗量。结果表2所示,经过单因素优化后,5-氨基戊酸的产率达到16.71 mmol/L,相比对照提高了约2.25倍。

表2 优化对照表
3 结论
本实验从诱导条件方面对其进行单因素优化,通过摇瓶实验优化单因素所得最佳产L-氨基酸氧化酶诱导条件为当菌液的细胞量值为0.246 g/L,加入IPTG,其终浓度为0.5 mmol/L,25℃诱导7 h,L-氨基酸氧化酶的酶活为1.178 mmol/L,并将其应用于5-氨基戊酸的生产合成中。通过利用LAAO生物催化合成5-氨基戊酸的研究实验,比较不同条件对5-氨基戊酸产量和赖氨酸的消耗量的研究,结果表明,最适底物浓度为17 mmol/L,最适pH7.0,最适温度为37℃,最适反应时间为24 h,添加H2O2最适为0.5%,酶与FAD最适的摩尔比为1∶1,产量能达到最大。经过单因素优化后,5-氨基戊酸的产率达到16.71 mmol/L,相比对照提高了约2.25倍。
[1]Kusakabe H,Kodama K,Kuninaka A,et al.L-lysine alphaoxidase from alphaoxidase from trichoderma-viride-purification and enzymological properties[J].The Journal of Biological Chemistry,1980,255:976-981.
[2]Torii S,Naito M,Tsuruo T,et al.A novel apoptosisinducing factor with L-amino acidoxidase activity purified from Western diamondback rattlesnake venom[J].The Journal of Biological Chemistry,1997,272:9539-9542.
[3]Niedermann D M,Lerch K.Molecular cloning of the L-amino acid oxidase gene from Neurospora crassa[J].The Journal of Biological Chemistry,1990,265:17246-17251.
[4]Raibekas A A,Massey V.Primary structure of the snake venom L-amino acid oxidase shows high homology with the mouse B cell interleukin 4-induced protein[J].Biological Chemistry,1998,248:476-478.
[5]Ahn M.Y,Lee B M,Kim Y S.Characterization and cytotoxicity of L-amino acid oxidase from the venom of king cobra(Ophiophagus hannah)[J].The Journal of Biological Chemistry,1997,29:911-919.
[6]余志良,周宁,乔华,等.L-氨基酸氧化酶的研究进展[J].中国生物工程杂志,2012,32(3):132-133.
Zhiliang Yu,Ning Zhou,Hua Qiao,et al.A review of researches on the mechanism of L-amino acid oxidase[J].China Biotechnology,2012,32(3):132-133.
[7]Sun Y,Nonobe E,Kobayashi Y,et al.Characterization and expression of L-amino acid oxidase of mouse milk[J].The Journal of Biological Chemistry,2002,20:19080-19086.
[8]Geueke B,Hummel W.A new bacterial L-amino acid oxidase with a broad substrate specificity:purification and characterization[J].Enzyme and Microbial Technology,2002,31:77-87.
[9]Shervani R K,Hemmatian Z,Hatefi-Mehrjardi A,et al.Immobilization of L-lysine alpha-oxidase on goldmercaptopropionic acid selfassembled monolayer:Preparation and electrochemical characterization[J].Bioelectrochemistry,2009,75:124-129.
[10]Aliaksei V P,Carmen G B,Elinor L S,et al.An efficient enzymatic synthesis of 5-aminovaleric acid[J].Journal of Molecular Catalysis,2010,65:58-62.
[11]Si J P,Eun Y K.Metabolic engineering of Escherichia coli for the production of 5-amino valerate and glutamates C5 platform chemicals[J].Metabolic Engineering,2013,16:42-47.
[12]Kusakabe H,Kodama K,Kuninaka A,et al.A new antitumor enzyme,L-lysine alpha-oxidase from Trichoderma viride,Purification and enzymological properties[J].The Journal of Biological Chemistry,1980,255:976-981.
[13]郭尧君.蛋白质电泳实验技术[M].第二版.北京:科学出版社,2005.100-107.
[14]Kimiyasu I,Asami S.Purification and characterization of an L-amino acid oxidase from Pseudomonas[J].journal of bioscience and bioengineering,2012,doi:10.1016.
[15]Grote A,Hiller K,Scheer M,et al.a novel tool to adapt codon usage of a target gene to its potential expression host[J].Nucleic Acids Research,2005,33:526-531.
[16]肖洁,郭刚,邹全明.提高大肠杆菌分泌表达重组蛋白的研究进展[J].微生物学杂志,2007,27(3):77-73.
[17]李海军,王林刚,王治泽,等.枯草杆菌脂肪酶基因在大肠杆菌中的诱导分泌表达[J].生物技术通报,2010,3:93-94.
[18]邓姗姗,李江华,王瑾,等.圆弧青霉BD26碱性脂肪酶基因的克隆及其在大肠杆菌中的表达[J].食品与发酵工业,2008,34(2):45-42.
[19]Costilow R N,Laycock L.Purification of a protein that converts ornithine to proline and definition of the optimal assay conditions[J].The Journal of Biological Chemistry,1971,246:6655-6660.
[20]汪春蕾.具细菌漆酶活性的芽孢外壁蛋白CotA基因克隆及异源表达研究[D].哈尔滨:东北林业大学,2010,6:99-100.
Studies on the induction expression of L-amino acid oxidase and its biocatalytic application on the 5-aminovaleric acid
MA Jin-lian,YING Han-xiao,WANG Jing,CAO Wei-jia,WU Hao,CHEN Ke-quan*
(Nanjing Tech University,Biotechnology and Pharmaceutical Engineering,Nanjing 211816,China)
L-amino acid oxidase,which catalyze the biosynthesis of keto acid and other chemicals from L-amino acid,is applied in many fields of industry.The LAAO from Rhodococcus opacus was cloned and heterologous expressed in Escherichia coli,followed the investigation of induced conditions and biosynthesis of 5-aminovaleric acid.The results showed that the optimum induction temperature of L-amino acid oxidase was 25℃,The optimal concentration of inducing agent,induction time,the cell mass were 0.5 mmol/L,7 h,0.246 g/L,respectively.Meanwhile,biocatalytic conditions were optimized to improve the production of 5-aminovaleric acid.The optimal substrate molar concentration of biosynthesis of 5-aminovaleric acid was 17 mmol/L,furthermore,the optimal pH,temperature,time,supplemented with H2O2,addition of the enzyme and FAD molar ratio were 7.0,37℃,24 h,0.5%,1∶1,respectively.As a result,a 5-aminovaleric acid concentration of 16.71 mmol/L was achieved.This study successfully realized the single enzyme(LAAO)synthesis of 5-aminovaleric acid,to lay the foundation for the simple biosynthesis of 5-aminovaleric acid.
L-amino acid oxidase;inducible expression;enzymatic;5-aminovaleric acid
2015-08-04
马金莲(1990-),女,在读硕士研究生,研究方向:酶催化,E-mail:302832765@qq.com。
陈可泉(1982-),男,博士,副教授,研究方向:生物催化工程,E-mail:kqchen@njtech.edu.cn。
江苏省产学研联合创新资金(BY2014005);863计划“2014AA021703”;国家自然科学基金(31440024)。
TS201.3
A
1002-0306(2016)07-0153-06
10.13386/j.issn1002-0306.2016.07.022
