磷酸盐精确控制策略提升大肠杆菌生长和产物合成效率
2016-09-12田康明路福平王正祥
田康明,尔 昊,路福平,王正祥
(天津科技大学生物工程学院工业微生物重点实验室,天津 300457)
磷酸盐精确控制策略提升大肠杆菌生长和产物合成效率
田康明,尔昊,路福平*,王正祥
(天津科技大学生物工程学院工业微生物重点实验室,天津 300457)
磷酸盐是微生物生长代谢关键物质之一,研究发酵进程中的磷酸盐变化与变化规律及其与特定目标产物合成效率间相互关系,有助于提升微生物的生长和产物合成效率,建立新的发酵控制模式。本文以工业上重要的大肠杆菌为研究对象,研究了发酵过程中磷酸盐含量变化规律,解析了大肠杆菌生长和产酶过程与磷酸盐消耗间的关系,并通过调控磷酸盐浓度提高产酶水平。通过摇瓶发酵实验,确定了大肠杆菌的磷酸盐耐受上限为磷酸氢二铵 24.0 g/L、磷酸二氢钾81.0 g/L,磷酸氢二铵和磷酸二氢钾最适初始含量分别为1.0 g/L、10.12 g/L,补加方式为:发酵培养基中补加总量的一半,剩余部分发酵4 h后补加。在此基础上,大肠杆菌细胞密度和赖氨酸脱羧酶的比酶活分别提高了58.42%和14.09%。研究结果证实通过动态监控并精确控制发酵过程中磷酸盐的存在量可以有效的提升大肠杆菌的生长代谢和产物合成效率。
大肠杆菌,磷酸盐,发酵,控制策略
磷是微生物代谢所需的主要元素之一,尤其对于微生物生长繁殖具有重要作用[1]。无机磷可借助微生物分解有机物时所产生的有机酸和CO2转化成可溶性磷酸盐,被微生物吸收,成为有机磷[2]。有机磷在有氧条件下可以被微生物分解,从而形成磷酸盐[3-4]。磷还是磷壁酸、高能磷酸化合物的重要组成部分[5-8],革兰氏阳性细菌细胞壁含有大量磷壁酸,ATP作为高能磷酸化合物的典型代表[9-11],实质是传递能量,使热力学上不利的反应能顺利进行[12-13]。磷在微生物生长代谢的EMP途径[14]和HMP途径[15]中发挥重要作用。可见,微生物生长过程中磷酸盐的变化情况是监控细胞代谢过程的重要指标。
长期以来,发酵过程控制参数局限于培养温度、pH、溶氧水平、底物浓度等。对于磷代谢在发酵控制方面的价值,虽已有较多研究,但控制策略停留在发酵培养基组成阶段。如:谢涛[16]研究了磷酸盐限量对胞内磷积累的影响。随着酵母在富磷培养基、低磷培养基培养时,胞内磷积累也随之变化。这只是说明限制培养基中的磷浓度是发酵过程中的必要条件。同样,钟国华[17]、吴学超[18]、王普[19]在优化微生物发酵过程的研究中,也只是简单从宏观上优化了磷酸盐的添加量,而非精确监控磷酸盐的变化过程来实现研究目的。
本研究通过对发酵过程中磷酸盐含量的定量检测,系统研究大肠杆菌细胞生长和产酶过程中磷酸盐的变化及其规律,并通过合理调整磷酸盐的添加方式提升大肠杆菌的生长效率和产酶水平,揭示了磷酸盐控制在发酵过程优化与控制中的巨大潜在应用价值。
1 材料与方法
1.1材料与仪器
1.1.1菌种大肠杆菌(Escherichiacoli)42-0#,保藏于天津科技大学生物工程学院酶与应用微生物研究室。该菌种为本研究室前期构建,具有合成赖氨酸脱羧酶的能力,是工业上用于高效转化赖氨酸为戊二胺的重组菌。
1.1.2试剂氨苄青霉素,MES和磷酸吡哆醛购自Sigma公司;茚三酮上海生工生物工程有限公司;L-赖氨酸,β-巯基乙醇和SDSSolarbio公司;过硫酸铵Invitrogen公司;其他试剂均为分析纯化学试剂。
1.1.3仪器3-18k冷冻离心机Sigma公司;DYY-III-6B电泳仪北京市六一仪器厂;PBl502-S电子天平梅特勒-托利多仪器(上海)公司;AB204-S分析天平梅特勒-托利多仪器(上海)公司;EHWY-2102恒温摇床上海智诚有限公司;HS-1300-V型超净工作台苏州安泰空气技术有限公司;SX500全自动高压灭菌锅日本TOMY公司;JY92-ⅡDN超声波细胞粉碎机宁波新艺超声设备有限公司。
1.1.4培养基平板培养基(g/L):蛋白胨10,酵母粉5,氯化钠10,琼脂20,pH7.0。氨苄青霉素50 μg/mL。
种子培养基(g/L):蛋白胨10,酵母粉5,氯化钠10,pH7.0。
原始发酵培养基(g/L):磷酸氢二铵2,磷酸二氢钾6.75,柠檬酸0.85,硫酸铵3,50%甘油20 mL,140 g/L硫酸镁母液5 mL,微量元素1 mL,pH7.0。
优化发酵培养基(g/L):磷酸氢二铵1,磷酸二氢钾10.12,柠檬酸0.85,硫酸铵3,50%甘油20 mL,140 g/L硫酸镁母液5 mL,微量元素1 mL,pH7.0。
微量元素(g/L):FeSO4·7H2O 50,无水CaCl27.56,ZnSO4·7H2O 11.0,MnSO4·4H2O 1.96,CuSO4·5H2O 5.0,(NH4)6Mo7O24·4H2O 0.5,Na2B4O7·10H2O 0.1。
1.2实验方法
1.2.1大肠杆菌的磷酸盐耐受上限实验在250 mL三角瓶(50 mL装液量)中考察大肠杆菌的磷酸盐耐受上限。在原始培养基的基础上,磷酸氢二铵和磷酸二氢钾的添加浓度分别为2,6.75、3,10.12、4,13.50、5,16.88、16,54.00、18,60.75、20,67.8、22,74.25、24,81.00 g/L,其余物质种类和含量不变,调节发酵培养基pH至7.0。发酵24 h后大肠杆菌细胞密度低于正常值的25%,这时的磷酸盐浓度为大肠杆菌的磷酸盐耐受上限[21]。
1.2.2大肠杆菌细胞生长及发酵过程中磷酸盐消耗分析采用单因素实验,分别考察磷酸氢二铵和磷酸二氢钾的初始含量对大肠杆菌细胞生长的影响。磷酸氢二铵初始含量分别选取0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00 g/L,磷酸氢二铵初始含量分别选取1.69、3.38、6.75、10.12、13.50 g/L,其余物质种类和含量不变,调节发酵培养基pH至7.0。并分析其发酵过程中磷酸盐的消耗情况。
1.2.3分批补加磷酸盐对大肠杆菌细胞生长的影响采用单因素实验,分别考察补加时间和补加量对大肠杆菌细胞生长的影响。补加时间分别选取发酵后2、4、6、8 h;得到最佳补加时间后,补加方式分别选取发酵初始只添加优化发酵培养基中磷酸盐总量的1/2、1/3、1/4,发酵到一定时间后补加余下部分的磷酸盐,并分析其发酵过程中磷酸盐的消耗情况。
1.2.4磷酸盐对大肠杆菌产酶的影响分别以原始发酵培养基和优化发酵培养基在三角瓶中进行发酵实验,诱导产酶后,测其蛋白含量、赖氨酸脱羧酶酶活力以及SDS-PAGE的变化情况。
大肠杆菌发酵液的预处理:取50 mL发酵液于离心管中,6000 r/min离心8 min;弃去上清,加入10 mL ddH2O,漩涡震荡混匀,补加ddH2O至30 mL,6000 r/min离心8 min;弃去上清,加入10 mL PBS,漩涡震荡混匀,补加PBS至30 mL,6000 r/min离心8 min;重复1次;加入10 mL PBS重悬菌体,超声破碎。(超声破碎条件:超声3 s,间隙2 s,温度25 ℃,破碎时间30 min,功率40%)。
1.2.5磷酸盐含量的测定采用磷酸盐快速检测试剂盒,来自江苏锐阳生物科技有限公司。

表1 赖氨酸脱羧酶酶活反应体系
1.2.6赖氨酸脱羧酶酶活的测定标准曲线的绘制:将1 g/L的L-赖氨酸标准品稀释成100、200、300、400、500 mg/L,分别取1 mL加入到15 mL具塞刻度试管中,另取一支试管加1 mL水做空白对照;每支试管加入1 mL茚三酮溶液,混匀,加上塞子;沸水浴10 min后放入凉水中冷却;每支试管加8 mL水补齐10 mL体系;紫外475 nm下检测吸光度。
赖氨酸脱羧酶酶活测定:测定赖氨酸脱羧酶酶活反应体系如表1所示;样品离心后稀释适当倍数,取1 mL加入到15 mL具塞刻度试管中,另取一支试管加1 mL水做空白对照;每支试管加入1 mL茚三酮溶液,混匀,加上塞子;沸水浴10 min后放入凉水中冷却;每支试管加8 mL水补齐10 mL体系;紫外475 nm下检测吸光度。
赖氨酸脱羧酶酶活的定义:37 ℃,pH6.5,反应15 min,每消耗100 mg/mL赖氨酸定义为1个酶活单位。
赖氨酸脱羧酶比酶活的定义:细胞破碎液中1 mg蛋白所对应的赖氨酸脱羧酶酶活定义为1个比酶活单位。
1.2.7蛋白浓度的测定按照文献介绍的方法进行[20]。以牛血清白蛋白(V部分)为标准参照。
1.2.8细胞密度的测定取适量发酵液经过适当稀释,使测定的吸光度值在0.1~0.8范围内,再使用紫外分光光度计,于波长600 nm处测定吸光度,所测得结果即为大肠杆菌的细胞密度。
1.3数据统计分析
利用OriginPro 8.0进行数据统计分析。
2 结果
2.1大肠杆菌培养中磷酸盐添加极限
了解大肠杆菌对磷酸盐添加极限的要求,对后续研究磷酸盐的若干作用以及新工艺路线的形成至关重要,结果如图1所示。发酵24 h后大肠杆菌发酵液吸光度A600的正常值为1.383±0.068,而当磷酸氢二铵添加量达到24.00 g/L和磷酸氢二钾的添加量达到81.00 g/L时,发酵24 h发酵液吸光度A600为0.321±0.015低于正常值的25%,此即为大肠杆菌细胞对磷酸盐的耐受上限。

图1 随着磷酸氢二铵和磷酸氢二钾含量的增加对大肠杆菌生长情况的影响Fig.1 Effects of the increasing concentrations of diammonium hydrogen phosphate and potassium hydrogen phosphate on the growth of Escherichia coliW1:(NH4)2HPO4 2 g/L,KH2PO4 6.75 g/L;W2:(NH4)2HPO4 3 g/L,KH2PO4 10.12 g/L;W3:(NH4)2HPO4 4 g/L,KH2PO4 13.50 g/L;W4:(NH4)2HPO4 5 g/L,KH2PO416.88 g/L;W5:(NH4)2HPO4 16 g/L,KH2PO4 54.00 g/L;W6:(NH4)2HPO4 18 g/L,KH2PO4 60.75 g/L;W7:(NH4)2HPO4 20 g/L,KH2PO4 67.8 g/L;W8:(NH4)2HPO4 22 g/L,KH2PO4 74.25 g/L;W9:(NH4)2HPO4 24 g/L,KH2PO4 8100 g/L。
2.2大肠杆菌细胞生长及发酵过程磷酸盐的消耗特征
培养基磷酸氢二铵、基磷酸二氢钾的初始含量对大肠杆菌细胞生长的影响分别如图2、3所示。随着初始磷酸氢二铵含量的增加,大肠杆菌细胞密度呈现先上升然后下降接着上升再下降的趋势。当初始磷酸氢二铵含量为1.00 g/L时,最有利于菌体生长,此时大肠杆菌发酵液吸光度A600为1.143±0.011。随着初始磷酸二氢钾含量的增加,大肠杆菌细胞密度呈现先上升再降低的趋势。当初始磷酸二氢钾含量为10.12 g/L时,最有利于菌体生长,此时大肠杆菌发酵液吸光度A600为1.450±0.002。其发酵过程中磷酸盐消耗情况分别如表2、3所示。当初始磷酸氢二铵含量为1.00 g/L时,大肠杆菌单位时间单位体积菌体平均生长速率为(1.893±0.115)×10-3h-1·mL-1,单位时间单位体积磷酸盐平均消耗速率为7.387±0.241 mg·h-1·mL-1,单位细胞磷酸盐比消耗率为8.080±0.053 10-2·g-1细胞。当初始磷酸二氢钾含量为10.12 g/L时,大肠杆菌单位时间单位体积菌体平均生长速率为(2.507±0.134)×10-3h-1·mL-1,单位时间单位体积磷酸盐平均消耗速率为12.990±0.138 mg·h-1·mL-1,单位细胞磷酸盐比消耗率为11.340±0.162 10-2·g-1细胞。

表2 磷酸氢二铵的初始含量对大肠杆菌发酵过程中磷酸盐消耗情况的影响

图2 磷酸氢二铵的初始含量对大肠杆菌细胞生长情况的影响Fig.2 Effects of initial contents of diammonium hydrogen phosphate on the growth of Escherichia coli cells
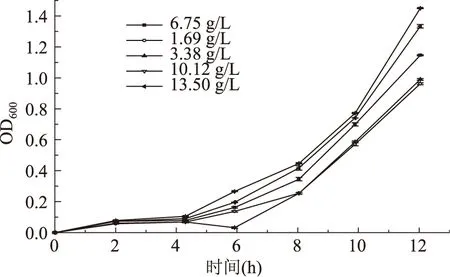
图3 磷酸二氢钾的初始含量对大肠杆菌细胞生长情况的影响Fig.3 Effects of the initial contents of monopotassium phosphate on the growth of E. coli cells
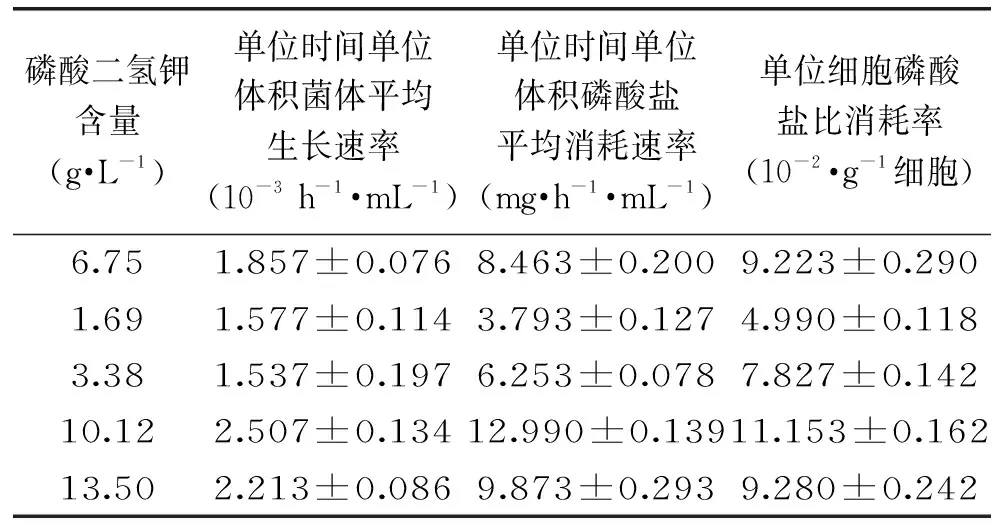
磷酸二氢钾含量(g·L-1)单位时间单位体积菌体平均生长速率(10-3h-1·mL-1)单位时间单位体积磷酸盐平均消耗速率(mg·h-1·mL-1)单位细胞磷酸盐比消耗率(10-2·g-1细胞)6.751.857±0.0768.463±0.2009.223±0.2901.691.577±0.1143.793±0.1274.990±0.1183.381.537±0.1976.253±0.0787.827±0.14210.122.507±0.13412.990±0.13911.153±0.16213.502.213±0.0869.873±0.2939.280±0.242
2.3分批补加磷酸盐对大肠杆菌细胞生长及发酵过程中磷酸盐消耗的影响
磷酸氢二铵和磷酸二氢钾的补加时间和补加比例对大肠杆菌细胞生长的影响分别如图4、5所示。随着补加磷酸氢二铵和磷酸二氢钾时间的推迟,大肠杆菌细胞密度与不补加磷酸盐时相比呈现先上升再降低的趋势。在发酵4 h后补加磷酸氢二铵和磷酸二氢钾最有利于菌体生长,发酵12 h后大肠杆菌发酵液吸光度A600为2.203±0.016。随着发酵4 h后补加磷酸氢二铵和磷酸二氢钾含量的增加,大肠杆菌细胞密度呈现下降的趋势。发酵初始只添加优化发酵培养基中磷酸氢二铵和磷酸二氢钾含量的1/2,发酵4 h后补加剩余的1/2磷酸氢二铵和磷酸二氢钾最有利于菌体生长,发酵12 h后大肠杆菌发酵液吸光度A600为2.191±0.008。2、4、6、8 h发酵过程中磷酸盐消耗情况如图5所示。其大肠杆菌发酵过程中磷酸盐消耗率分别为57.20%、46.62%、50.06%、38.19%。发酵4 h后补加1/2、2/3、3/4发酵过程中磷酸盐消耗情况如图7所示。其大肠杆菌发酵过程中磷酸盐消耗率分别为57.10%、21.43%、43.20%。

图4 不同时间补加磷酸氢二铵和磷酸二氢钾的大肠杆菌细胞生长情况对比Fig.4 Comparisons of the growth of E. coli cells after the addition of diammonium hydrogen hosphate and potassium dihydrogen phosphate at different times

图5 发酵2、4、6、8 h后补加磷酸盐大肠杆菌发酵过程中磷酸盐消耗情况对比Fig.5 Comparisons of phosphate consumption during the fermentation process of E. coli with the addition of phosphate after 2,4,6 and 8 h

图6 磷酸氢二铵和磷酸二氢钾的不同补加比例对大肠杆菌细胞生长情况的影响Fig.6 Effects of the ratios of diammonium hydrogen phosphate to potassium dihydrogen phosphate on the growth of E. coli cells

图7 发酵4 h后补加1/2、2/3、3/4磷酸盐的发酵过程中磷酸盐消耗情况对比Fig.7 Comparisons of phosphate consumption during the fermentation process with the addition of 1/2,2/3,3/4 phosphate after 4 h
本研究选择磷酸氢二铵和磷酸二氢钾两种磷酸盐进行研究:首先,磷酸氢二铵具有含氮磷两种营养成分的特点,在微生物培养基中为菌体提供磷酸根的同时也提供了一定量的氮源;其次,考虑到每摩尔磷磷酸氢二铵和酸二氢钾均可提供等摩尔的磷酸根离子;最后,这两种磷酸盐是微生物培养基中常用的两种无机盐添加物。
2.4磷酸盐对大肠杆菌产酶水平的影响
原始发酵培养基和优化发酵培养基的培养条件下,诱导产酶后,其赖氨酸脱羧酶的酶活力对比结果如图8所示。原始发酵培养基的培养条件下,赖氨酸脱羧酶的比酶活为78.75 U/mg,优化发酵培养基的培养条件下,赖氨酸脱羧酶的比酶活为89.85 U/mg,增长了14.09%。SDS-PAGE的结果如图9所示。从该图可以看出,在优化发酵培养基的培养条件下,蛋白的表达量均有了显著提高。

图8 原始发酵培养基和优化发酵培养基诱导产酶后赖氨酸脱羧酶的比酶活对比Fig.8 Comparisons of the specific enzyme activities of lysine decarboxylase in the original and optimized fermentation media after induction
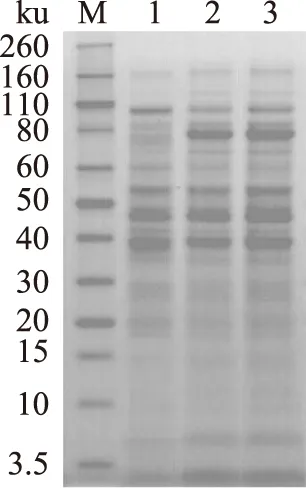
图9 原始发酵培养基和优化发酵培养基诱导产酶后SDS-PAGE对比Fig.9 SDS-PAGE analysis of the proteins in the originaland optimized fermentation media after induction M:protein marker;1:空白对照;2:原始发酵培养基;3:优化发酵培养基。
优化培养基中的磷酸盐含量后,使微生物的生长代谢速率加快,进而有利于产物的形成[22]。王建玲等[23]通过响应面的方法,虽然对磷酸盐的含量进行了优化,使赖氨酸脱羧酶的酶活得到了提高。但只是从宏观角度进行的研究,而本实验对微生物发酵过程中的磷酸盐含量进行了精确控制,连续监控微生物生长过程中磷酸盐的消耗情况,并找到微生物发酵过程中磷酸盐最适的补加时间和补加量。
3 结论
本实验通过对发酵过程中磷酸盐含量变化的检测,实现大肠杆菌工程菌株的高密度培养,进而提高赖氨酸脱羧酶酶活和产酶量。对摇瓶发酵工艺进行优化:大肠杆菌的磷酸盐耐受上限为磷酸氢二铵24.0 g/L、磷酸二氢钾81.0 g/L。当磷酸氢二铵的初始含量为1.0 g/L,磷酸二氢钾的初始含量为10.12 g/L,磷酸盐采取补加的方式对大肠杆菌进行发酵培养时,可以实现大肠杆菌的高密度培养。通过发酵过程中磷酸盐含量的精确控制,使大肠杆菌工程菌株的发酵液吸光度A600增长了58.42%,在此基础上,赖氨酸脱羧酶酶活增加了91.20%。基于以上研究结果,可进一步通过监控发酵生产过程中磷酸盐含量变化趋势,优化工业发酵过程,并进行更大规模发酵生产,提高产物合成水平,为工业化生产奠定基础。
[1]Anandan P,Parthipan G,Ravi G,et al. Growth and characterization of potassium halides mixed l-arginine phosphate monohydrate semi organic nonlinear optical single crystals[J]. Optik-International Journal for Light and Electron Optics,2014,125(1):8-10.
[2]Wetzel R G,Tuchman N C. Effects of atmospheric CO2enrichment and sunlight on degradation of plant particulate and dissolved organic matter and microbial utilization[J]. Archiv Fur Hydrobiologie,2005,volume 162(3):287-308(22).
[3]何燧源,金云云,何方. 环境化学(第三版)[M].上海:华东理工大学出版社,2000,96-106.
[4]喻林主编. 水质监测分析方法标准实务手册[M]. 北京:中国环境科学出版社,2002:332.
[5]Forster B M,Marquis H. Protein transport across the cell wall of monoderm Gram-positive bacteria[J]. Mol Microbiol,2012,84(3):405-413.
[6]Marcus I M,Bolster C H,Cook K L,et al. Impact of growth conditions on transport behavior of E. coli[J]. J Environ Monitor,2012,3(3):984-991.
[7]Formstone A,Carballido-López R,Noirot P,et al. Localization and interactions of teichoic acid synthetic enzymes in Bacillus subtilis[J]. J Bacteriol,2007,190(5):1812-1821.
[8]Potekhina N V,Shashkov A S,Streshinskaya G M,et al. Teichoic acids of three type strains of the Bacillus subtilis group,Bacillus mojavensis VKM B-2650,Bacillus amyloliquefaciens subsp. amyloliquefaciens VKM B-2582,and Bacillus sonorensis VKM B-2652[J]. Microbiology,2013,82(5):579-585.
[9]Desvaux M,Dumas E,Chafsey I,et al. Protein cell surface display in Gram-positive bacteria:from single protein to macromolecular protein structure[J]. FEMS Microbiol Lett,2006,256(1):1-15.
[10]Nath S. Beyond the Chemiosmotic Theory:analysis of key fundamental aspects of energy coupling in oxidative phosphorylation in the light of a torsional mechanism of energy transduction and ATP synthesis—invited review part 2[J]. Journal of Bioenergetics & Biomembranes,2010,volume 42(4):301-309.
[11]Ahmad Z,Senior A E. Identification of phosphate binding residues of Escherichia coli ATP synthase[J]. J Biloenerg Biomembr,2005,37(6):437-440.
[12]王镜岩,朱胜庚,徐长法. 生物化学(第三版)上册[M]. 北京:高等教育出版社,2002,51-55.
[13]王镜岩,朱胜庚,徐长法. 生物化学(第三版)下册[M]. 北京:高等教育出版社,2002,34-42.
[14]Lai S,Zhang Y,Liu S,et al. Metabolic engineering and flux analysis of Corynebacterium glutamicum for L-serine production[J]. Sci China Life Sci,2012,55(4):283-290.
[15]Phang J M,Donald S P,Pandhare J,et al. The metabolism of proline,a stress substrate,modulates carcinogenic pathways[J]. Amino Acids,2008,35(4):681-690.
[16]谢涛,方慧英,诸葛斌,等. 限磷对产甘油假丝酵母甘油合成与胞内磷积累的影响[J]. 微生物学通报,2009,32(9):1289-1293.
[17]钟国华,何玥,罗建军,等. 高效氯氰菊酯降解菌株HG-P-01的培养基筛选及优化[J]. 微生物学通报,2009,36(5):672-677.
[18]吴学超,曹新江,冀志霞,等. 聚γ-谷氨酸高产菌的选育与培养基优化[J]. 微生物学通报,2008,35(10):1527-1531.
[19]王普,孙立明,何军邀. 响应面法优化热带假丝酵母104菌株产羰基还原酶发酵培养基[J]. 生物工程学报,2009,25(6):863-868.
[20]Vieira E G,Henriques S B. Comparison of the Lowry and Coomassie Blue methods for the determination of protein concentration[J]. Brazilian Journal of Medical & Biological Research,1992,25(6):583-591.
[21]Restaino O F,Cimini D,Rosa M D,et al. High cell density cultivation of Escherichia coli K4 in a microfiltration bioreactor:a step towards improvement of chondroitin precursor production[J].Microbial Cell Factories,2011,10:10(4):363-368.
[22]Pijuan M,Casas C,Baeza J A. Polyhydroxyalkanoate synthesis using different carbon sources by two enhanced biological phosphorus removal microbial communities[J]. Process Biochemistry,2009,44(1):97-105.
[23]王建玲,张建昌,朱婧,等. 响应面法优化赖氨酸脱羧酶产酶培养基[J]. 生物技术,2009,19(4):46-49.
Precise control strategy of phosphate to enhance the cell growth and the efficiency of product synthesis inEscherichiacoli
TIAN Kang-ming,ER Hao,LU Fu-ping*,WANG Zheng-xiang
(College of Biotechnology,Tianjin University of science and technology,Key Laboratory of Industrial Microbiology,Tianjin 300457,China)
Phosphate is one of the key materials for microbial growth and product synthesis. Thus,systematic studies of the changes of phosphate,its change rule and the corresponding relationships between the change rule and the synthetic efficiency of target products help to improve the growth of microorganisms and the efficiency of product synthesis. This will also establish a novel control mode of fermentation processes. In this paper,industrially importantEscherichiacoliwas used as a research object to investigate the change rule of phosphate in the fermentation process as well as analyze the corresponding relationships between the growth ofEscherichiacoli,enzyme production and phosphate consumption. Subsequently,the production level of lysine decarboxylase was increased by controlling the concentrations of phosphate. Through shake flask fermentation,the highest concentrations of diammonium hydrogen phosphate and potassium dihydrogen phosphate thatEscherichiacolicells could tolerate were determined to be 24.00 g/L and 81.00 g/L,respectively. The optimum initial contents of diammonium hydrogen phosphate and potassium dihydrogen phosphate were 1.00 g/L and 10.12 g/L,respectively. Besides,only 1/2 of the total amounts of diammonium hydrogen phosphate and potassium dihydrogen phosphate was added at the beginning,while the remaining 1/2 was complemented after 4 hours of fermentation. After cultivated under the optimized conditions,the cell density of recombinantEscherichiacoliand the specific activity of lysine decarboxylase were increased by 58.42% and 14.09%,respectively. According to the result,the cell growth and products synthesis of E. coli can be improved by dynamic determination and precise control of the phosphate concentration during the fermentation process.
Escherichiacoli;phosphate;fermentation;control strategy
2015-04-27
田康明(1985-),男,博士,助理研究员,研究方向:工业微生物育种,E-mail:kangmingtian@tust.edu.cn。
路福平(1967-),男,博士,教授,研究方向:酶工程,E-mail:lfp@tust.edu.cn。
国家自然科学基金(21446010)。
TS
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
