淫羊藿药渣中多糖的提取及其体外抗氧化活性评价
2016-09-12袁璟亚丁春邦张中华
付 亮,袁璟亚,丁春邦,张中华
(1.达州市农业科学研究所,四川达州 635000;2.四川农业大学生命科学学院,四川雅安 625014)
淫羊藿药渣中多糖的提取及其体外抗氧化活性评价
付 亮1,袁璟亚1,丁春邦2,*,张中华1
(1.达州市农业科学研究所,四川达州 635000;2.四川农业大学生命科学学院,四川雅安 625014)

淫羊藿,药渣,多糖,提取,抗氧化活性
淫羊藿又名仙灵脾,是小檗科(Berberidacea)淫羊藿属(Epimedium)多年生草本植物,为我国传统补益中药,具有坚筋骨、益精气、补腰膝、强心力等作用[1]。近年来关于淫羊藿的药理研究表明,淫羊藿对心脑血管系统、免疫系统、生殖系统、骨髓系统等有一定的保健作用[2],具有改善心血管系统功能、调节雄性发育、调节免疫、抑制肿瘤、抗骨质疏松、抗氧化等生理活性[3-5]。
目前,对淫羊藿属植物的研究大多集中于药理药效,而对提取工艺的研究相对较少;此外,长期以来人们更注重对淫羊藿最主要有效成分总黄酮的提取研究而忽略了其另一主要有效成分多糖,提取完黄酮的淫羊藿药渣往往直接丢弃,很大程度上造成了淫羊藿资源的浪费。近年来,由于生物化学和分子生物学等学科的飞速发展,人们对多糖及其复合物的活性作用有了越来越深入的认识,使得多糖的研究已成为目前生命科学中最活跃的研究领域之一[6],淫羊藿多糖作为一种安全有效的多糖,也受到了越来越多的重视。药理学研究显示,淫羊藿多糖具有抗病毒、抗肿瘤、抗氧化、调节免疫、延缓衰老等多种活性[7-9],在许多药理指标上,效果优于或作用特点不同于淫羊藿总黄酮[10],有着不容忽视的地位,在癌症、心脑血管疾病等重大疾病的防治方面具有广阔的开发前景。
程浩然[11-12]等研究发现淫羊藿原药中提取的多糖和从药渣中提取的多糖都具有一定的体外抗氧化活性,但二者差异如何,未见深入报道。本研究从提完淫羊藿总黄酮的药渣中提取多糖,考察其得率和体外抗氧化活性,并与直接从原药材中提取多糖的方法相比较,不仅可以初步评价该工艺及所提多糖的质量,也可以初步比较其他各种提取方法及其所提多糖的抗氧化活性;从淫羊藿药渣中提取多糖并考察其体外抗氧化活性,不仅可以实现废物利用,提高淫羊藿药材的综合利用率,为淫羊藿多糖的大规模工业化生产提供理论依据,同时对于新型植物药、化妆品和食品配料或添加剂的研究与开发,特别是淫羊藿资源的合理利用和保护以及能源的节约也具有重要意义。
1 材料与方法
1.1材料与仪器
粗毛淫羊藿2012年9月采集于四川雅安上里的,由四川农业大学生命科学与理学院丁春邦教授鉴定。
石油醚(沸点60~90 ℃)、乙醇、氯仿、正丁醇、抗坏血酸、FeSO4、邻二氮菲均分析纯,成都科龙化工试剂有限公司;H2O2四川西陇化工有限公司;2,2-二苯基-1-苦味基肼(DPPH)、氯化硝基四氮唑蓝(NBT)、还原型辅酶Ⅰ(NADH)、吩嗪硫酸甲酯(PMS)、纤维素酶(≥400u/mg,Biochemika)Sigma公司;磷酸缓冲液(PBS)国药集团化学试剂有限公司;MD44透析袋截留分子量8000-14000,北京Solarbio科技有限公司。
UV-3200PC扫描型紫外/可见分光光度计上海美谱达仪器有限公司;BT-124S电子天平Sartorius公司;DHG-9240A电热恒温鼓风干燥箱上海一恒科技有限公司;FW80中草药粉碎机和DZ-2BC真空干燥箱天津泰斯特仪器有限公司;HPD-25无油真空泵及循环水式真空泵天津津腾实验设备有限公司;RB-52AA真空旋转蒸发仪上海亚荣生化有限公司;RM-220实验室超纯水机四川沃特尔科技发展有限公司;KQ-300GDV恒温数控超声波清洗器昆山舒美超声仪器有限公司;ML-2080MG微波炉海尔集团;HW·SY11-K电热恒温水浴锅北京市长风仪器仪表有限公司;H-1650离心沉淀机长沙湘仪离心机仪器有限公司。
1.2方法
1.2.1淫羊藿多糖的提取及纯化
1.2.1.1材料预处理将淫羊藿地上部分洗净,鼓风干燥箱内50 ℃烘干,中药粉碎机粉碎,过60目筛,经石油醚索氏提取至无色后烘干混匀,超声波提取法提取总黄酮[13],药渣烘干粉碎备用。
1.2.1.2淫羊藿药渣中多糖的提取称取经预处理过的材料100 g,置3000 mL具塞锥形瓶中,按料液比1∶10(g/mL)加入水,在90 ℃提取温度下提取2次,每次30 min[13]。
1.2.1.3其他方法提取淫羊藿多糖分别称取8份50 g经过预处理的材料至1000~3000 mL不等的具塞锥形瓶中,每种方法处理2份后合并。采取以下4种方法提取:水煮法[14],超声波提取法[15],酶提取法[16],微波提取法[17]。
1.2.1.4淫羊藿多糖的纯化[18]提取液分别合并,旋转蒸发仪浓缩至50 mL,完全转移至1000 mL容量瓶,加入纯乙醇,酒度计测定使醇含量达90%,搅匀,放置12 h后过滤得沉淀;将沉淀完全溶于200 mL蒸馏水中,搅匀放置4 h,过滤后滤液再次浓缩至50 mL,重复一次醇沉过程,过滤得沉淀,即为淫羊藿粗多糖;将粗多糖分别溶于100 mL蒸馏水中,Sevage法(氯仿∶正丁醇=4∶1,V/V)除尽蛋白质,水层逆向流水透析24 h,后浸入蒸馏水中透析36 h,透析袋内液体浓缩至30 mL,完全转移至50 mL烧杯中,冷冻干燥,分别得浅棕色淫羊藿多糖粉末并称重。
1.2.2淫羊藿多糖体外抗氧化活性的测定
1.2.2.1淫羊藿多糖对DPPH·清除能力的测定参照Yokozawa和Larrauri等[19-20]的方法进行适当修改。以抗坏血酸为对照,将五种方法所提多糖和抗坏血酸用水溶解,均制成一系列不同浓度(0.04~0.7 mg/mL)的样品溶液。每种样品溶液各取2 mL与2 mL 2×10-4mol/L DPPH-乙醇溶液混合,静置30 min,在517 nm处测定各吸光度。DPPH·清除能力通过以下公式计算:
DPPH自由基清除活性(%)=1-[(Asample-Ablank)/ADPPH]×100
式中,Asample为样品与DPPH反应(2 mL样品+2 mL DPPH)后的吸光度,Ablank为样品空白(2 mL样品+2 mL无水乙醇)的吸光度,ADPPH为未加样品的DPPH(2 mL DPPH+2 mL无水乙醇)的吸光度。抗坏血酸对DPPH·清除活性的测定中抗坏血酸溶液在操作上等同于上述样品组。
超氧阴离子自由基基清除活性(%)=1-[(Asample-Ablank)/Acontrol]×100
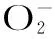
1.2.2.3淫羊藿多糖对·OH清除能力的测定,参考文献[23]以抗坏血酸为对照,将五种方法所提多糖和抗坏血酸用水溶解,制成一系列不同浓度(0.2~1.4 mg/mL)的样品溶液。样品溶液反应体系总体积为6 mL,包括1 mL 7.5×10-4mol/L邻二氮菲-乙醇溶液、2 mL PBS缓冲液(pH7.4)、1 mL 7.5×10-4mol/L FeSO4溶液、1 mL样品和1 mL 0.01% H2O2;空白溶液中,使用1 mL水取代样品,对照组中,2 mL H2O取代样品和H2O2。样品组、空白组和对照组均在37 ℃下恒温60 min,在536 nm下测定吸光度,分别表示为Asample、Ablank和Acontrol。·OH清除能力由以下公式计算:

1.2.3从淫羊藿药渣中提取多糖工艺的评价各种提取方法均可得到一定得率的多糖,这些多糖可以配制成使自由基清除率达50%的溶液总体积,本研究命名为自由基清除总效力,自由基清除总效力通过以下公式计算:
A=Y/C
式中,A为自由基清除总效力(mL/mg),Y为该方法所提多糖的得率(%),C为该方法所提多糖清除此自由基的IC50(mg/mL)。
2 结果与分析
2.1不同方法提取多糖的得率

表1 文献记载及本实验不同
水煮提取法、超声波提取法、酶提取法、微波提取法用原药材提取多糖和从淫羊藿药渣中提取多糖的得率如表1所示,分别为1.94%、5.98%、7.20%、3.45%和3.68%,相比文献记载有差异,但因文献记载中所用实验材料种类、多糖精制提纯方法均不同,所以不宜比较各方法优劣。本实验统一材料和精制提纯方法进行实验重现,相比直接用原材料提取,药渣本应因损失部分多糖而得率偏低,但本实验3.68%的多糖得率并非最低,这一方面可能是因为前人的方法应用在粗毛淫羊藿这种材料上并未发挥最大提取效率,另一方面是因为本工艺在前一步提取总黄酮时采用超声波提取法,其空化作用使材料细胞壁破碎,加大了后续多糖提取的效率,而多糖本身虽然也有损失,但该损失与空化作用相比显得不明显;而相比提取效率更高的超声法和酶法,这种损失就比较明显,分别损失了38.46%和48.88%。虽然理论上可以在总黄酮的精制过程中回收部分多糖,但如此会大大增加工艺的复杂性和成本;因本工艺的多糖提取原料为药渣,之前已经过超声提取法提取过总黄酮,已经过空化作用破壁,有利于多糖在水中的溶出,故之后多糖提取没有必要再采取高耗能的方法,只需操作简单且能耗低的水煮法即可,故从淫羊藿药渣中水煮提取多糖的工艺虽有多糖损失,但所得多糖的价值本身足以弥补这种损失。
2.2淫羊藿多糖的抗氧化活性
2.2.1淫羊藿多糖对DPPH·清除作用由图1可以看出,在低浓度范围内,多糖对DPPH·的清除率与质量浓度呈现较好的量效关系,但随着多糖浓度的增加,清除率趋于平缓,最后稳定;多糖浓度大于0.6 mg/mL后,超声波提取法、酶提取法、微波提取法、水煮法用原药材提取所得多糖和从淫羊藿药渣中提取所得多糖的清除率分别为89.41%、88.88%、87.29%、85.41%、和82.96%,虽然药渣所提多糖略低但差距都不明显;但就清除率达到50%时的多糖浓度而言,超声波提取法、酶提取法、微波提取法、水煮法用原药材提取所得多糖和从淫羊藿药渣中提取所得多糖的IC50分别为0.161、0.153、0.097、0.093和0.262 mg/mL,可知抗氧化活性强弱有所差别,大小分别为水煮所提多糖>微波所提多糖>酶法所提多糖>超声所提多糖>药渣所提多糖,其中水煮所提多糖和微波所提多糖差距仅为0.004 mg/mL,酶法所提多糖和超声所提多糖差距也只有0.008 mg/mL,初步推测水煮法所提多糖和微波法所提多糖的DPPH·清除能力相似,酶法所提多糖和超声法所提多糖的也相似,但这2组之间存在差距;至于药渣所提多糖,其清除率则明显偏低,需要适当增加浓度才能达到相应的清除率,这或许是因为与原材料相比,药渣已经损失了部分具有较强DPPH·清除能力的多糖种类而造成的。总地来说,药渣所提多糖仍然表现出了较强的DPPH·清除活性。
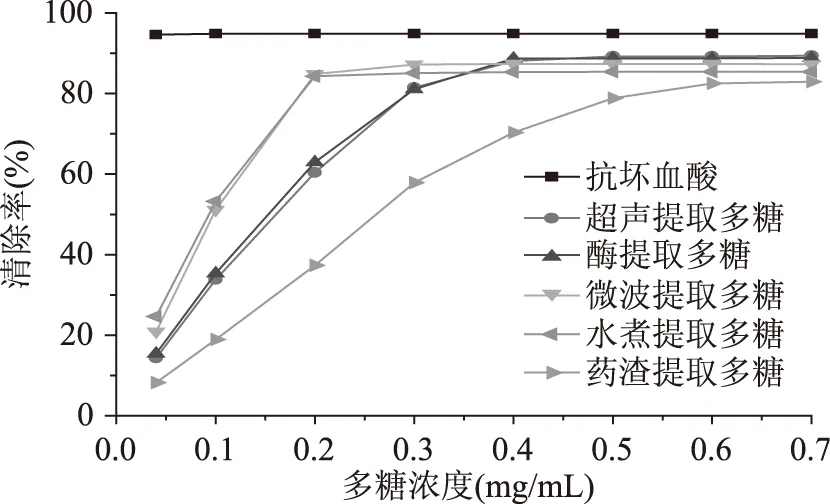
图1 不同方法所提多糖对DPPH·的清除作用Fig.1 Scavenging effects of polysaccharides from different extraction methods on DPPH·

图2 不同方法所提多糖对·的清除作用Fig.2 Scavenging effects of polysaccharides from different extraction methods on ·
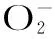
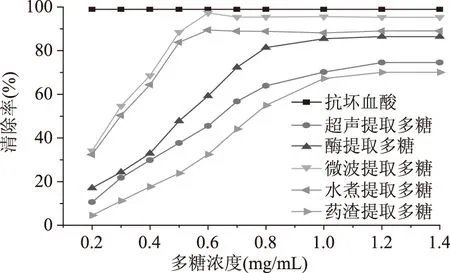
图3 不同方法所提多糖对·OH的清除作用Fig.3 Scavenging effects of polysaccharides from different extraction methods on·OH
2.3从淫羊藿药渣中提取多糖工艺的评价
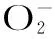
3 讨论
在多糖的精制过程中,本研究同时采用单因素实验考察了醇沉时乙醇体积分数、醇沉次数对多糖得率的影响,结果最佳工艺为使用纯乙醇令其体积分数达到90%,醇沉2次。

淫羊藿多糖虽经纯化,却不排除存在其他蛋白质等杂质对实验结果的影响,但因所有操作都统一有序,故这种影响也是相同的,实验结果仍然较为可靠,今后有必要对多糖进行进一步精制纯化。
在考察淫羊藿多糖对3种自由基的清除活性时,为了在图中有限范围内更多显示多糖对自由基的清除趋势,突出各提取方法所提多糖的差别,本实验对抗坏血酸的浓度选择偏大,造成抗坏血酸的清除率曲线规律不明显,也表明淫羊藿多糖对这3种自由基的清除活性与抗坏血酸相比有所差距,但对其他多种自由基的清除活性有待于进一步研究;此外,本实验所得多糖的自由基清除率曲线虽规律明显,但IC50准确性有待于进一步提高,所得多糖之间的自由基清除率大小顺序有待于进一步检验,今后的研究中有必要增加多糖溶液密度梯度,运用统计学方法处理数据,根据“浓度-清除率”对应关系精确拟合曲线方程,重新科学准确地比较各方法所提多糖的自由基清除活性。
如实验结果所示,如果分别从得率和3种自由基的清除活性去评价淫羊藿药渣中提取多糖的工艺,往往得出不同甚至相反的结论,为了使结论科学准确,需要将2者有机结合,为此,本研究拟定了自由基清除总效力这样一个概念,对该工艺做到了合理科学地评价。
4 结论
从提完总黄酮的淫羊藿药渣中提取多糖的工艺操作简单,不需要复杂的专业设备且能耗低,与直接用原材料提取相比,所提多糖损失较少;虽然部分清除自由基的能力有所下降,但体外抗氧化活性仍然较强,具有较高的医疗和保健价值,所以从得率和体外抗氧化活性来看,该工艺具有较高的可行性,较大限度地提高了淫羊藿的综合利用率,为淫羊藿药渣的合理开发利用和工业化生产提供了参考,但要真正科学全面的评价该工艺,需要精制提纯和药理药效等方面的进一步深入研究。
[1]李时珍. 本草纲目[M]. 北京:人民卫生出版社,1982:750.
[2]Wu H,Lien E J,Lien L L. Chemical and pharmacological investigations of Epimedium species:a survey[J]. Prog Drug Res,2003,60:1-57.
[3]Meng F H,Li Y B,Xiong Z L,et al. Osteoblastic proliferative activity of Epimedium brevicornum Maxim[J]. Phytomedicine,2005,12,189-193.
[4]Chen K K,Chiu J H. Effect of Epimedium brevicornum Maxim extract on elicitation of penile erection in the rat[J]. Urology,2006,67,631-635.
[5]Pan Y,Kong L,Li Y,et al. Icariin from Epimedium brevicornum attenuates chronic mild stress-induced behavioral and neuroendocrinological alterations in male Wistar rats[J]. Pharmacol Biochem Behav,2007,87,130-140.
[6]罗祖友,吴季勤,吴谋成. 植物多糖的抗氧化与抗病毒活性[J]. 湖北民族学院学报(自然科学版),2007,25(1):77-81.
[7]Lu Y,Wang D,Hu Y,et al. Sulfated modification of epimedium polysaccharide and effects of the modifiers on cellular infectivity of IBDV[J]. Carbohydr Polym,2008,71,180-186.
[8]Kong X,Hu Y,Rui R,et al. Effects of Chinese herbal medicinal ingredients on peripheral lymphoctye proliferation and serum antibody titer after vaccination in chicken[J]. Int Immunopharmacol,2004,4:975-982.
[9]Wang D,Li X,Xu L,et al. Immunologic synergism with IL-2 and effects of cCHMIs on mRNA expression of IL-2 and IFN-γin chicken peripheral T lymphocyte[J]. Vaccine,2006,24:7109-7114.
[10]郭宝林,罗崇念,肖培根. 淫羊藿多糖研究进展[J]. 中国中药杂志,1998,23(7):436-437.
[11]Cheng H R,Feng S L,Jia X J,et al. Structural characterization and antioxidant activities of polysaccharides extracted from Epimedium acuminatum[J]. Carbohydrate Polymers,2013,92:63-68.
[12]程浩然,付亮,冯士令,等. 淫羊藿药渣多糖体外抗氧化活性研究[J]. 食品工业科技,2014,35(2):143-145,153.
[13]付亮,袁璟亚,周永红,等. 正交实验优化淫羊藿总黄酮和多糖的分步提取工艺优化[J]. 食品科学,2012,33(24):56-60.
[14]郑晓翠,苏瑛,唐咏,等. 淫羊藿多糖的提取及其蛋白的脱除[J]. 华西药学杂志,2009,24(2):155-157.
[15]姜虹,李新龙,李海平,等. 响应面法优化淫羊藿多糖超声提取工艺的研究[J].长春师范学院学报(自然科学版),2013,32(1):59-64.
[16]苏瑛,郑晓翠,唐咏,等.淫羊藿多糖的酶法提取及其抗氧化作用的研究[J]. 食品科技(提取物与应用),2009,34(4):200-203.
[17]苏瑛,刘鹏举,李丽梅,等. 微波辅助提取淫羊藿多糖工艺条件及抑菌效果的研究[J]. 食品科技(提取物与应用),2011,36(11):158-161,165.
[18]陈鸿英,朱永智,吴乃居,等. 朝鲜淫羊藿多糖的含量测定[J]. 中草药,2003,34(9):810-811.
[19]Yokozawa T,Dong E,Natagawa,et al.Invitroandinvivostudies on the radical scavenging activity of tea[J]. J Agric Food Chem,1998,46(6):2143-2150.
[20]Larrauri J A,Sanchez-Moreno C,Saura-Calixto F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. J Agric Food Chem,1998,46(7):2694-2697.
[21]Yen G C,Chen H Y. Antioxidant activity of various tea extracts in relation to their antimutagenicity[J]. J Agric Food Chem,1995,43:27-32.
[22]Chen H Y,Yen G C. Antioxidant activity and free radical scavenging capacity of extracts from guava(Psidium guajava L.)leaves[J]. Food Chemistry,2007,101:686-694.
[23]Jin M,Cai Y X,Li JR,et al. 1,10-Phenanthroline-Fe2+oxidative assay hydroxyl radical produced by H2O2/Fe2+[J]. Prog Biochem Biophys,1996,23(3):553-555.
Polysaccharides Extraction from Residue ofEpimediumand Its Antioxidant Activity Evaluation
FU Liang1,YUAN Jing-ya1,DING Chun-bang2,*,ZHANG Zhong-hua1
(1.Dazhou Institute of Agricultural sciences,Dazhou,635000,China;2.College of Life Sciences,Sichuan Agricultural University,Ya’an 625014,China)

Epimedium;residue;polysaccharides;extraction;antioxidant activity
2014-12-24
付亮(1984-),男,硕士,主要从事药用植物资源研究工作,E-mail:fuliangrain@126.com。
张中华(1972-),男,本科,研究员,主要从事作物育种与栽培工作,E-mail:zzhdxh@163.com。
四川省科技厅应用基础项目(2008JY0094-2)。
TS
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
