瓜尔胶和黄原胶对方解石浮选的抑制行为差异及机理
2016-09-12高志勇宋韶博孙伟胡岳华钟宏
高志勇,宋韶博,孙伟,胡岳华,钟宏
(1. 中南大学 化学化工学院,湖南 长沙,410083;2. 中南大学 资源加工与生物工程学院,湖南 长沙,410083)
瓜尔胶和黄原胶对方解石浮选的抑制行为差异及机理
高志勇1,2,宋韶博2,孙伟2,胡岳华2,钟宏1
(1. 中南大学 化学化工学院,湖南 长沙,410083;2. 中南大学 资源加工与生物工程学院,湖南 长沙,410083)
采用浮选试验、吸附量测试、zeta电位测试、红外光谱测试等方法研究瓜尔胶(非离子型)和黄原胶(阴离子型)2种天然胶对方解石的浮选抑制行为及机理。研究结果表明:当pH为8.8,油酸钠浓度为0.3 mmol/L时,用量为50 mg/L的黄原胶,可显著降低捕收剂油酸钠在方解石表面的吸附量,降低方解石的浮选回收率,而瓜尔胶要达到相同的抑制效果,用量需超过100 mg/L。上述抑制行为差异主要是由于2种天然胶在方解石表面的吸附方式和强度不同造成的。瓜尔胶通过氢键作用在方解石表面吸附,而黄原胶的主要作用方式为化学键合和氢键作用。关键词:方解石;浮选;瓜尔胶;黄原胶;抑制;油酸钠
浮选领域,淀粉、丹宁和糊精等多糖有机大分子常作为方解石等矿物的抑制剂[1]。这些大分子抑制剂的共同特点是:相对分子质量较大(104~106),分子中含有大量的水化极性基团(—OH,C=O和—COOH)。天然胶也属于多糖类,且来源广泛、无毒、水溶性好,近年来也被用来作浮选大分子抑制剂。MHLANGA等[2]研究发现,瓜尔胶作抑制剂可实现黄铜矿/滑石/斜长石间的浮选分离,抑制能力由大到小顺序为:黄铜矿、滑石、斜长石。FENG等[3]研究发现:与CMC相比,瓜尔胶对滑石的抑制能力更强。NANTHAKUMAR等[4]采用浮选法处理高铁磷灰石,发现瓜尔胶对铁矿物的抑制能力比玉米淀粉更强,选择性更好。RIBEIRO等[5]采用浮选法回收磷酸盐矿物,发现樟如树胶对方解石的抑制能力比淀粉更强。O’OCONNOR等[6]报道:抑制剂瓜尔胶(Acrol LG-21)更容易在方解石表面吸附,捕收剂油酸更容易在磷灰石表面吸附,瓜尔胶+油酸药剂组合可实现磷灰石/方解石的浮选分离。RATH等[7-8]研究发现:在碱性溶液条件下,瓜尔胶主要通过氢键与黑云母和石英表面发生物理作用,而在酸性条件下,可能存在化学作用。可见,天然胶中非离子型的瓜尔胶对方解石具有较好的选择性抑制能力,但是关于瓜尔胶与方解石的作用机理及离子型天然胶抑制方解石的研究鲜有报道。本文作者选取2种代表性天然胶,即瓜尔胶(非离子)和黄原胶(阴离子)作为高分子抑制剂,通过浮选试验研究其对方解石浮选的抑制行为差异,并借助吸附量测试、zeta电位测试及红外光谱测试分析这2种天然胶与方解石的作用机理。
1 试验
1.1 矿样与试剂
方解石纯矿物取自长沙矿石粉厂,经破碎、细磨、筛分得粒度小于74 μm的矿样以备浮选试验和吸附量测试用。进一步细磨得粒度小于2 μm的样品,以备zeta电位测试和红外光谱测试用。方解石粉末样的纯度为98.85%,比表面积为2.6 m2/g。
pH调整剂为一定浓度的HCl和NaOH溶液。所有试验用水皆采用去离子水,电阻率大于18 MΩ·cm。所有试验都在常温下(约20 ℃)进行。瓜尔胶,分析纯,相对分子质量在 2×105~1×106之间,购自上海市达瑞精细化学品有限公司。黄原胶,分析纯,相对分子质量在 2×106~2×107之间,购自天津市光复精细化工研究所。油酸钠,分析纯,购自天津市大茂化学试剂厂。
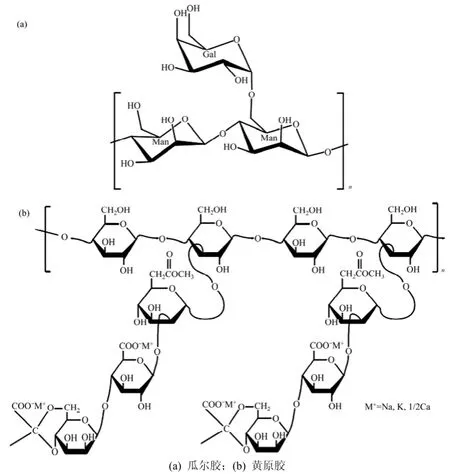
图1 瓜尔胶和黄原胶的分子结构单元Fig.1 Structural units of guar and xanthan gums
瓜尔胶和黄原胶的分子结构单元,如图1所示。由图1(a)可知:瓜尔胶分子结构单元中氧有3种形式:糖环上的醚基氧、联结2个环的醚基氧及与碳原子相连的羟基氧。由图1(b)可知:黄原胶分子中氧原子有多种形式:羧基上的2种氧、糖环内的醚基氧、联结2个环的醚基氧及与环上碳原子相联的羟基氧。
1.2 试验方法
单矿物浮选试验在挂槽式XFG浮选机上进行,主轴转速为1 800 r/min。称取2 g矿样,加入40 mL的浮选槽中,再添加35 mL左右的去离子水,将浮选槽固定在浮选机上。搅拌1 min,加入pH调整剂,搅拌调浆3 min,然后加入一定浓度的抑制剂,搅拌3 min,接着加入一定浓度的捕收剂,搅拌3 min,然后浮选4 min。最后将泡沫产品和槽内产品真空过滤并低温烘干,计算矿物的回收率。
吸附量测试采用 TU-1810型紫外可见分光光度计。波谱分析得油酸的最大吸附波长为232.6 nm。配制不同浓度的油酸钠标准溶液,用去离子水做参比,在波长为232.6 nm处测定标准溶液的吸光度,绘制吸光度与质量浓度的关系曲线,如图2所示。取2 g矿样,加入40 mL锥形瓶中,添加去离子水,根据单矿物浮选试验流程加药、调浆。将锥形瓶放入振荡机中振荡30 min,然后用离心沉降机固液分离10 min,吸取上层清液分析。最后利用油酸钠吸光度与质量浓度标准曲线计算出油酸钠的残余浓度。由下式计算矿物对油酸钠的吸附量。

式中:Γ为药剂的吸附量(mg/g); ρ0为药剂溶液的初始质量浓度(mg/L);ρ为药剂在上清液的质量浓度(mg/L);V为药剂溶液的体积(mL);m为矿物的质量(g)。
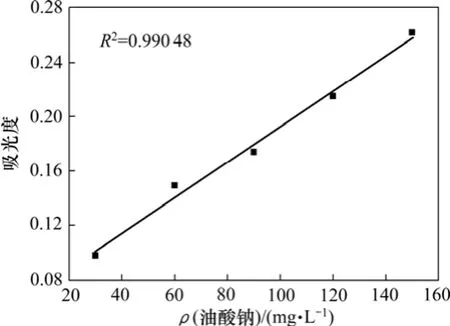
图2 油酸钠吸光度与质量浓度的关系Fig.2 Relationship between absorbency and oleate mass concentration
动电位的测量采用DELSA-440SX型zeta电位分析仪。取20 mg粉末样加入到50 mL的烧杯中,加入去离子水配成质量分数为0.04%的矿浆,调节矿浆pH。根据单矿物浮选试验流程,加入一定浓度的浮选药剂,将烧杯放在磁力搅拌器上搅拌6 min,静置5 min,用注射器抽取上清液,注入电极中,进行电位测定。
红外光谱测量采用Nicolet FTIR-740型光谱仪。取1 g矿样和适量去离子水放于烧杯中,超声波分散1 min,转入50 mL烧杯中并补水到40 mL。调节pH,按照浮选试验流程加入适量浮选药剂,搅拌30 min,静置20 min。吸出上清液,用相同pH的去离子水冲洗3次,固液分离后,在40 ℃下真空干燥,然后进行测定。
2 结果与讨论
2.1 浮选试验结果
所有浮选试验和吸附量测试中,捕收剂油酸钠用量设定为 0.3 mmol/L。瓜尔胶和黄原胶用量均为 25 mg/L时,考察了矿浆pH对方解石浮选回收率的影响,结果如图3所示。由图3可知:没有天然胶作用时,随着矿浆pH增大,方解石的回收率逐渐升高,且保持在80%以上。而黄原胶和瓜尔胶与方解石的预先作用,使得油酸钠捕收方解石的能力下降,特别在中性和弱碱性条件下(6.8<pH<8.8),2种天然胶对方解石的抑制能力最强,且黄原胶的抑制能力大于瓜尔胶的抑制能力。当pH>10时,2种天然胶对方解石的抑制作用较弱,方解石回收率在80%以上。因此,后续浮选试验和吸附量试验设定矿浆pH为8.8。

图3 天然胶作用下矿浆pH对方解石浮选回收率的影响Fig.3 Effect of pH on recovery of calcite minerals in the presence of natural gums
当油酸钠浓度为0.3 mmol/L、矿浆pH为8.8时,考察天然胶用量对方解石浮选行为的影响,试验结果如图4所示。由图4可知:随着天然胶用量的增加,方解石浮选回收率逐渐降低;随瓜尔胶用量的增加,方解石回收率下降较慢,当其用量为50 mg/L时,方解石回收率仍大于80%,用量继续增加到100 mg/L,方解石回收率在 50%~60%之间;而黄原胶用量为50 mg/L时,方解石回收率迅速下降为50%,用量继续增加,方解石回收率在40%左右。在同等的用量下,黄原胶比瓜尔胶对方解石浮选的抑制能力强。

图4 天然胶用量对方解石浮选回收率的影响Fig.4 Effect of mass concentration of natural gums on recovery of calcite
2.2 吸附量测试结果
考察瓜尔胶和黄原胶预先作用,对油酸钠在方解石表面吸附量的影响,结果如图5所示。由图5可知:在没有天然胶预先作用时,油酸钠在方解石表面的吸附量为3.25 μmol/g;随着瓜尔胶用量增加,油酸钠在方解石表面的吸附量变化不大,当其质量浓度超过80 mg/L时,油酸钠在方解石表面的吸附量开始大幅降低,在用量达100 mg/L时,吸附量降为2.00 μmol/g;而随着黄原胶用量的增加,油酸钠在方解石表面的吸附量迅速降低,用量为50 mg/L时,油酸钠的吸附量下降为2.00 μmol/g,继续增大用量,油酸的吸附量下降趋势放缓。表明,要对方解石浮选起到相同的抑制效果,黄原胶的用量比瓜尔胶用量小很多。图5所示的油酸钠在方解石表面的吸附量曲线,与图4所示的方解石浮选回收率曲线变化趋势一致。
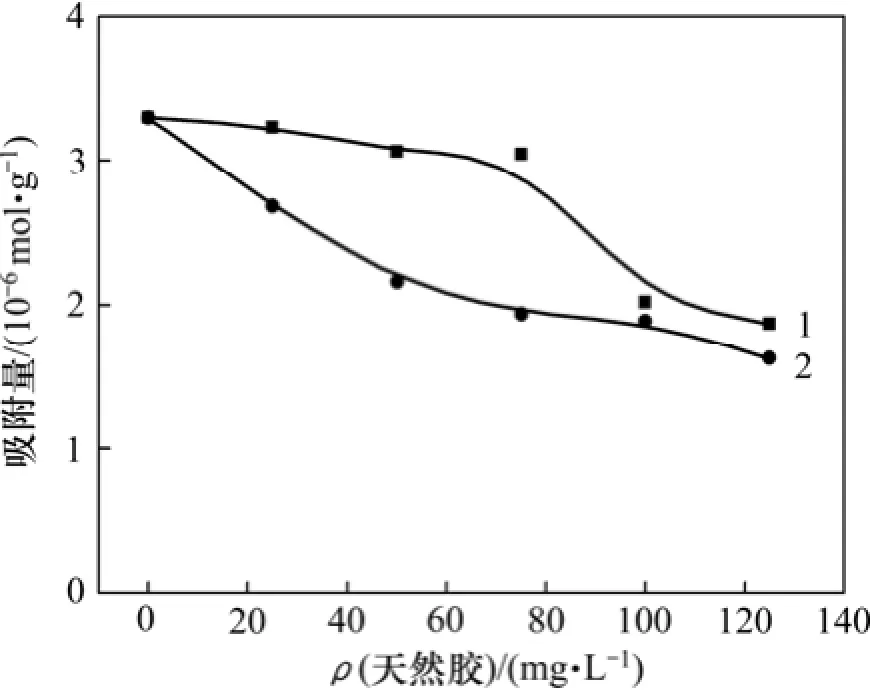
图5 天然胶用量对油酸钠在方解石表面吸附的影响Fig.5 Effect of mass concentration of natural gum on oleate adsorption onto calcite
2.3 动电位测量结果
选择天然胶质量浓度为25 mg/L,考察不同pH条件下瓜尔胶和黄原胶对方解石表面zeta电位的影响,结果如图6所示。由图6可知:在去离子水体系中,方解石表面等电点(IEP)为pH 9.6,在文献报道的数值范围内[9-12]。与瓜尔胶作用之后,方解石表面zeta电位的变化不明显。这主要是由于瓜尔胶属于非离子捕收剂,吸附在方解石表面并不能显著改变方解石的表面电性。而与黄原胶作用之后,方解石表面zeta电位发生负移。在pH=8.8附近,负移达30 mV。主要原因在于,在弱碱性矿浆条件下,黄原胶主要是以阴离子形式存在,利于其在表面荷正电的方解石表面发生吸附,使方解石表面电位由正变负。

图6 不同天然胶作用下方解石表面zeta电位与pH的关系Fig.6 Relationship between zeta potential of calcite and pH in different natural gums
2.4 红外光谱分析结果
浮选试验、吸附量测试和zeta电位测试表明:瓜尔胶和黄原胶对方解石的浮选抑制行为及2种天然胶在方解石表面的吸附行为存在差异。本研究借助红外光谱测试探讨瓜尔胶和黄原胶与方解石的作用机理。
结合图1所示的天然胶分子结构单元,分析瓜尔胶和黄原胶的红外光谱,结果如图7所示。由图7可知:瓜尔胶在3 416 cm-1处宽而强的峰为O—H振动峰,源于瓜尔胶分子链内或分子链间及瓜尔胶与缔合水之间形成的氢键[13];2 926 cm-1处的峰为—CH2—中C—H的伸缩振动峰[14];1 645 cm-1处的峰为缔合水分子的伸缩振动峰[13];1 420 cm-1处的峰对应较弱的—CH2的弯曲振动峰[15];1 153 cm-1处的峰为环上C—OH的吸收峰[13],1 028 cm-1处的峰为较强的醚基C—O—C中C—O的伸缩振动峰[16]。黄原胶1 735 cm-1处的峰为羧酸基团中C=O的伸缩振动峰;1 063 cm-1处的峰对应—CH2OH[13],其他振动峰的出现位置与瓜尔胶分子类似。图7表明:2种天然胶结构的显著差别在于,黄原胶结构中存在羧酸基团—COO-和羟基—OH这2种活性基团,而瓜尔胶分子中活性基团只有羟基—OH。

图7 瓜尔胶和黄原胶的红外光谱Fig.7 IR spectra of xanthan and guar gums
图8所示为方解石与瓜尔胶和黄原胶作用前后的红外光谱。方解石本体的红外吸收光谱有3处显著的吸收峰,1 467 cm-1宽而大的吸附峰为C—O的不对称伸缩振动吸收峰,是方解石的特征吸收峰;877 cm-1和720 cm-1处的峰分别为CO32-的面外和面内弯曲振动吸收峰。
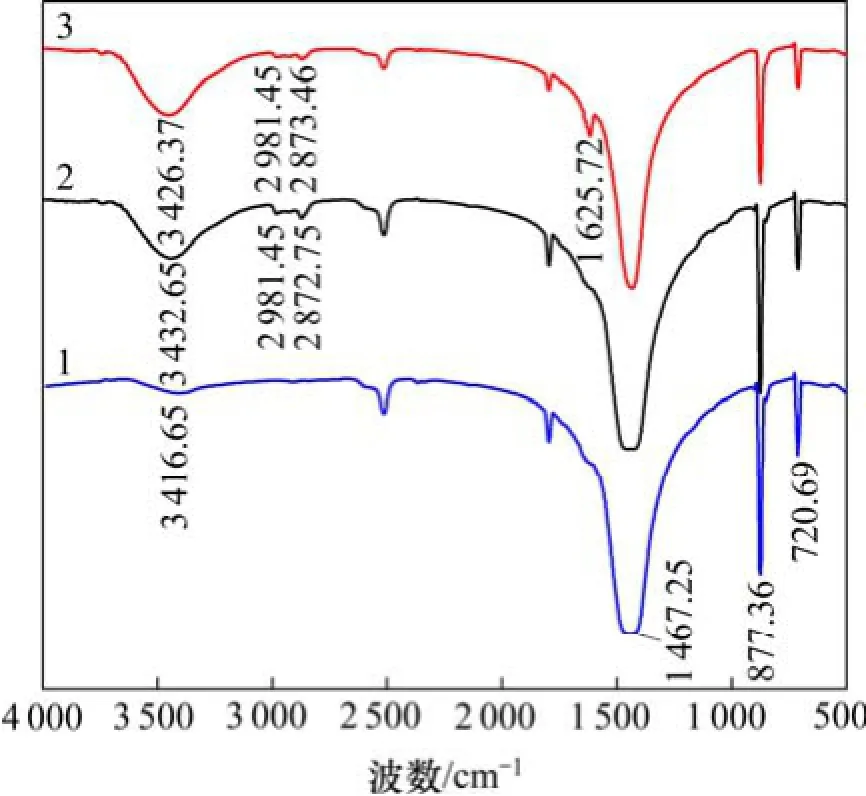
图8 方解石与天然胶作用前后的红外光谱Fig.8 IR spectra of calcite untreated and treated by gum
与瓜尔胶作用之后,方解石2 981 cm-1和2 872 cm-1处出现了2个新峰,是瓜尔胶分子中—CH2—的C—H的振动吸收峰分裂形成,表明瓜尔胶在方解石表面发生了吸附。方解石 3 432 cm-1处的峰为氢键O—H振动峰,比瓜尔胶分子和方解石本体相同位置的吸收峰更宽更强,表明瓜尔胶与方解石表面存在更多的氢键作用。据文献[7]报道,瓜尔胶只能通过活性官能团羟基—OH与硅酸盐矿物黑云母表面的O原子形成氢键而发生吸附。因此,推测瓜尔胶主要通过羟基与方解石表面的O原子形成氢键而在方解石表面发生吸附。
与黄原胶作用之后,方解石3 442,2 981和2 873 cm-1位置出现了3个新的吸收峰,与瓜尔胶作用后方解石吸收峰的位置相似,说明黄原胶与方解石之间存在氢键作用。区别在于,在1 625 cm-1处出现新的吸收峰,这是由于黄原胶中羧酸基团的羰基C=O吸收峰受氢键的影响向低波段发生位移所致。LIU等[17]报道:多糖中的羧酸基团容易和矿物表面的阳离子质点发生化学键合,产生化学吸附。据此推测,黄原胶可通过羧酸基团与矿物表面的 Ca质点发生化学键合。因此,黄原胶与方解石表面的作用方式既存在氢键,又存在化学作用。
综合以上试验结果,与瓜尔胶相比,在弱碱性(pH=8.8)矿浆中,黄原胶阴离子易通过化学键合和氢键在荷正电的方解石表面吸附,有效减少捕收剂油酸在方解石表面的吸附量,降低方解石的可浮性。
3 结论
1) 瓜尔胶(非离子型)和黄原胶(阴离子型)2种天然胶均能在方解石表面吸附,但作用方式和强度存在差异。瓜尔胶的主要作用方式为氢键,对方解石的表面电位影响不大,而黄原胶与方解石的主要作用方式为化学吸附和氢键,使方解石的表面电位显著负移。
2) 当pH为8.8,油酸钠浓度为0.3 mmol/L时,黄原胶在50 mg/L的低用量下,能显著减少捕收剂油酸钠在方解石表面的吸附量,降低方解石的可浮性,对方解石体现出较强的浮选抑制效果,而瓜尔胶要达到相同的抑制效果,其用量需超过100 mg/L。因此,相比瓜尔胶,黄原胶对方解石体现出更强的浮选抑制效果。
[1] GUIMARAES R C, ARAUJO A C D, PERES A. Reagents in igneous phosphate ores flotation[J]. Minerals Engineering, 2005,18(2): 199-204.
[2] MHLANGA S S, O’CONNOR C T, MCFADZEAN B. A study of the relative adsorption of guar onto pure minerals[J]. Minerals Engineering, 2012, 36/37/38: 172-178.
[3] FENG D, ALDRICH C. Effect of Ultrasonication on the Flotation of Talc[J]. Industrial & Engineering Chemistry Research, 2004, 43(15): 4422-4427.
[4] NANTHAKUMAR B, GRIMM D, PAWLIK M. Anionic flotation of high-iron phosphate ores-Control of process water chemistry and depression of iron minerals by starch and guar gum[J]. International Journal of Mineral Processing, 2009,92(1/2): 49-57.
[5] RIBEIRO R C C, CORREIA J C G, MONTE M B M, et al. Cashew gum: a new depressor for limestone in the phosphate minerals flotation[J]. Minerals Engineering, 2003, 16(9):873-875.
[6] O’CONNOR C T, DUNNE R C, MARTALAS A. The adsorption of oleate and the guar-based gum, acrol LG-21, onto apatite and calcite[J]. Colloids and Surfaces, 1987, 27(4):357-365.
[7] RATH R K, SUBRAMANIAN S. Studies on adsorption of guar gum onto biotite mica[J]. Minerals Engineering, 1997, 10(12):1405-1420.
[8] RATH R K, SUBRAMANIAN S, LASKOWSKI J S. Adsorption of dextrin and guar gum onto talc: a comparative study[J]. Langmuir, 1997, 13(23): 6260-6266.
[9] DARBHA G K, SCHA FER T, HEBERLING F, et al. Retention of latex colloids on calcite as a function of surface roughness and topography[J]. Langmuir, 2010, 26(7): 4743-4752.
[10] GOMARI K A R, HAMOUDA A A, DENOYEL R. Influence of sulfate ions on the interaction between fatty acids and calcite surface[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 287(1/2/3): 29-35.
[11] HU Yuehua, XU Zhenghe. Interactions of amphoteric amino phosphoric acids with calcium-containing minerals and selective flotation[J]. International Journal of Mineral Processing, 2003,72(1/2/3/4): 87-94.
[12] HICYILMAZ C, OZBAYOGLU G. The effects of amine and electrolytes on the zeta-potential of scheelite from Uludag,Turkey[J]. Minerals Engineering, 1992, 5(8): 945-951.
[13] MUDGIL D, BARAK S, KHATKAR B S. X-ray diffraction, IR spectroscopy and thermal characterization of partially hydrolyzed guar gum[J]. International Journal of Biological Macromolecules, 2012, 50(4): 1035-1039.
[14] KAČURÁKOVÁ M, BELTON P S, WILSON R H, et al. Hydration properties of xylan-type structures: an FTIR study of xylooligosaccharides[J]. Journal of the Science of Food and Agriculture, 1998, 77(1): 38-44.
[15] KAČURÁKOVÁ M, EBRINGEROVA A, HIRSCH J, et al. Infrared study of arabinoxylans[J]. Journal of the Science of Food and Agriculture, 1994, 66(3): 423-427.
[16] PARVATHY K S, SUSHEELAMMA N S, THARANATHAN R N, et al. A simple non-aqueous method for carboxymethylation of galactomannans[J]. Carbohydrate Polymers, 2005, 62(2): 137-141.
[17] LIU Qi, ZHANG Yahui, LASKOWSKI J S. The adsorption of polysaccharides onto mineral surfaces: an acid/base interaction[J]. International Journal of Mineral Processing, 2000,60(3/4): 229-245.
(编辑 杨幼平)
Depressant behavior and mechanism of guar and xanthan gums on calcite flotation
GAO Zhiyong1,2, SONG Shaobo2, SUN Wei2, HU Yuehua2, ZHONG Hong1
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;2. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China)
The depressant behavior and mechanism of guar and xanthan gums on calcite flotation were investigated through flotation experiment, adsorption study, zeta potential measurement and infrared spectroscopy measurement. The results show that when pH is 8.8 and oleate concentration is 0.3 mmol/L, xanthan gum with a dosage of 50 mg/L can markedly reduce the adsorption capacity of sodium oleate on calcite surfaces, and hence decrease the calcite recovery,while a higher dosage of 100 mg/L for guar gum should be added in order to achieve the similar depressant effect. The guar gum is adsorbed on calcite surface through hydrogen bonding, while xanthan interacts with calcite through chemisorption and hydrogen bonding.
calcite; flotation; guar gum; xanthan gum; depressant; sodium oleate
TD952
A
1672-7207(2016)05-1459-06
10.11817/j.issn.1672-7207.2016.05.001
2015-05-12;
2015-07-05
国家自然科学基金资助项目(51404300);中国博士后科学基金资助项目(2015M570689);湖南省自然科学基金资助项目(2015JJ3141) (Project(51404300) supported by the National Natural Science Foundation of China; Project(2015M570689) supported by China Postdoctoral Science Foundation; Project(2015JJ3141) supported by Hunan Provincial Natural Science Foundation of China)
孙伟,博士,教授,从事矿物浮选研究;E-mail: sunmenghu@126.com
