右美托咪定在主动脉夹层术前低氧血症未行机械通气患者中的应用
2016-09-11沈菲苏晞刘成伟张治平吴明祥
沈菲 苏晞 刘成伟 张治平 吴明祥
临床研究
右美托咪定在主动脉夹层术前低氧血症未行机械通气患者中的应用
沈菲 苏晞 刘成伟 张治平 吴明祥
目的 观察右美托咪定在主动脉夹层术前低氧血症患者中应用的临床效果。方法 我院2012年1月至2013年7月入院诊断急性主动脉夹层(AAD)243例,其中Standford A型104例、Standford B型139例。按是否使用右美托咪定分为右美托咪定组和对照组,观察其临床情况,统计CRP、细胞因子、血沉、白细胞总数及中性粒细胞分类、BNP等炎性因子,需机械通气辅助的例数,住院时间,以及是否出现二氧化碳潴留情况。结果 243例AAD患者中发生低氧血症145例,按是否使用右美托咪定分为两组,右美托咪定组68例,对照组77例。右美托咪定组患者使用右美托咪定后各项炎性指标(IL-6,IL-8,TNF-α等)较前均有所下降,与对照组比较差异有统计学意义(P<0.05),并缩短了住院时间[Standford A型(17.0±13.8)d比(19.9±16.2)d,P<0.05;Standford B型(15.0±9.8)d比(18.6±11.2)d,P<0.05],不引起明显二氧化碳潴留(t=0.454,P>0.05),改善了患者入住监护室后的治疗依从性,做到“清醒镇静”。结论 使用右美托咪定可改善主动脉夹层尚未手术治疗患者因低氧血症引起的烦躁、胸部不适甚至谵妄症状,降低炎性反应,减少需机械通气的例数,缩短住院时间,且无明显呼吸抑制,不加重低氧血症,无明显临床并发症。
夹层,主动脉; 低氧血症; 右美托咪定; 炎性反应
急性主动脉夹层(AAD)是死亡率最高的心血管急症之一[1-4]。因夹层动脉瘤压迫气道或因夹层后炎性反应并出现胸腔积液、肺淤血甚至急性呼吸窘迫综合征(ARDS),影响患者呼吸功能[5],故主动脉夹层合并低氧血症在临床发生率很高。同时入住CCU的AAD患者常因无法见到家人、重症监护室环境、目睹周围急性抢救事件,感焦虑、烦躁,如同时合并低氧血症使脑供氧不足,更加重了焦虑、烦躁。烦躁和焦虑有可能导致患者夹层破裂引起不良后果,故在住院诊治过程中,镇静、催眠治疗至关重要[5,6]。右美托咪定(Dexmedetomidine)是一种高选择性α2受体激动剂,具有镇静、镇痛、催眠、抗焦虑、抑制交感神经活性等特点,临床常用于重症监护室患者的镇静、催眠治疗。我院2012年1月至2013年7月共入院诊断ADD患者243例,出现低氧血症145例,Standford A型89例,Standford B型66例。按是否使用右美托咪定将其分为两组,观察右美托咪定在主动脉夹层术前低氧血症患者中应用的临床效果,现将结果报道如下。
1 资料与方法
1.1 一般资料 入选我院2012年1月至2013年7月入院诊断的ADD患者243例,出现低氧血症145例。排除标准:已机械通气辅助、低血压及心室率缓慢、原有严重肺部疾病史、原有二氧化碳储留的患者。
1.2 方法
1.2.1 观察指标 低氧血症患者共145例,统计其一般基线资料,包括年龄、性别、体重指数,是否合并高血压、糖尿病及有吸烟史等;并统计出现低氧血症时的相关检验指标,包括C反应蛋白(CRP)、细胞因子、血脂、血沉、白细胞总数及中性粒细胞分类、脑钠肽(BNP)、PaO2/FiO2、二氧化碳分压等,使用右美托咪定72 h后复查上述指标。统计低氧血症后需机械通气辅助的例数、住院时间及院内死亡率。
1.2.2 诊断标准及相关定义 低氧血症以PaO2/ FiO2≤300 mm Hg(1 mm Hg=0.133 kPa)为标准,ALI及ARDS以1994年欧美联席会议提出的ALI诊断为标准。全身炎性反应综合征定义为任何致病因素作用于机体引起的全身炎症反应,且患者有2项以上的下述临床表现:①体温>38℃或<36℃;②心率>90次/min;③呼吸频率>20次/min或Pa-CO2<32 mm Hg;④外周血白细胞计数>12×109/L或<4×109/L或未成熟细胞>10%[5]。
1.2.3 检验方法 细胞因子采用双抗体夹心ELISA酶联法测定,包括白介素-6(IL-6)、白介素-8(IL-8)、肿瘤坏死因子α(TNF-α);超敏C反应蛋白(hs-CRP)采用乳胶增强比浊法;BNP采用常规化学发光法。其余生化指标采用MODULAR-DP全自动生化仪检测。
1.2.4 诊治情况 入院后给予心电、血压、血氧饱和度监测,常规控制血压在120/70 mm Hg左右,心率在70次/min左右,给予一般镇静治疗以降低全身氧耗,给予双通道吸氧等增加氧供,低氧血症患者予以无创呼吸机辅助呼吸。145例患者中67例行主动脉腔内隔绝术,42例行外科手术治疗,其余药物治疗。
右美托咪定使用情况:使用恒瑞医药公司生产的盐酸右美托咪定,平均剂量为0.5μg·kg-1·h-1(范围0.1~0.7),静脉泵入,用药时间(46.0±11.7)h。
1.3 统计学方法 采用SPSS 13.0软件包进行统计学处理。计量资料用±s表示,各组间比较采用两独立样本t检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 入院诊断ADD的患者243例,其中Standford A型94例、Standford B型149例,出现低氧血症共145例,发生率为59.67%,其中男性111例、女性34例;Standford A型89例,Standford B型66例。145例患者中合并胸腔积液127例(87.59%)、肺淤血87例(60.00%)、肺部感染61例(42.07%),符合全身炎症反应综合征诊断的59例(40.69%)、符合ARDS诊断37例(25.52%)。低氧血症发生时间为起病后(4.2±3.4)d,3~5 d为高发期。右美托咪定组与对照组患者在年龄、性别、体重指数、高血压病史、糖尿病病史、吸烟史、白蛋白水平、用药情况、是否存在胸腔积液、PaO2/FiO2方面比较未见统计学差异(P>0.05)。见表1。右美托咪定组和对照组hs-CRP、IL-6、IL-8、TNF-α、血沉、白细胞总数及中性粒细胞分类、BNP比较未见统计学差异(P>0.05)。见表2。
2.2 用药后各项指标比较 用药72 h后,右美托咪定组患者的hs-CRP、IL-6、IL-8、TNF-α、BNP低于对照组,差异有统计学意义(P<0.05)。血沉、白细胞总数及中性粒细胞分类,右美托咪定组与对照组相比未见统计学差异(P>0.05)。二氧化碳分压两组无差异,未出现明显二氧化碳储留。使用右美托咪定后因血压低于90/60 mm Hg停药2例;因低氧血症严重需机械通气辅助的8例,右美托咪定组2例、对照组6例,二者相比差异有统计学意义(P<0.05)。见表3。
2.3 预后比较 术后脱呼吸机时间相比,外科手术后右美托咪定组为(15.0±8.7)h,对照组为(18.6± 7.6)h,对照组较右美托咪定组延迟,二者相比差异有统计学意义(P<0.05);主动脉腔内隔绝术后右美托咪定组为(9.0±8.5)h,对照组为(11.6±8.6)h,对照组较右美托咪定组延迟,二者相比差异有统计学意义(P<0.05)。住院时间相比:Standford A型行外科手术治疗的患者住院时间,右美托咪定组为(17.0±13.8)d,对照组为(19.9±16.2)d,二者相比差异有统计学意义(P<0.05);Standford B型行主动脉腔内隔绝术的患者住院时间,右美托咪定组为(15.0±9.8)d,对照组为(18.6±11.2)d,二者相比差异有统计学意义(P<0.05),即右美托咪定组外科手术和主动脉腔隔绝术术后的住院时间均短于对照组。院内死亡率的比较,右美托米啶组2例,对照组3例。
表1 两组患者临床特点比较(±s)
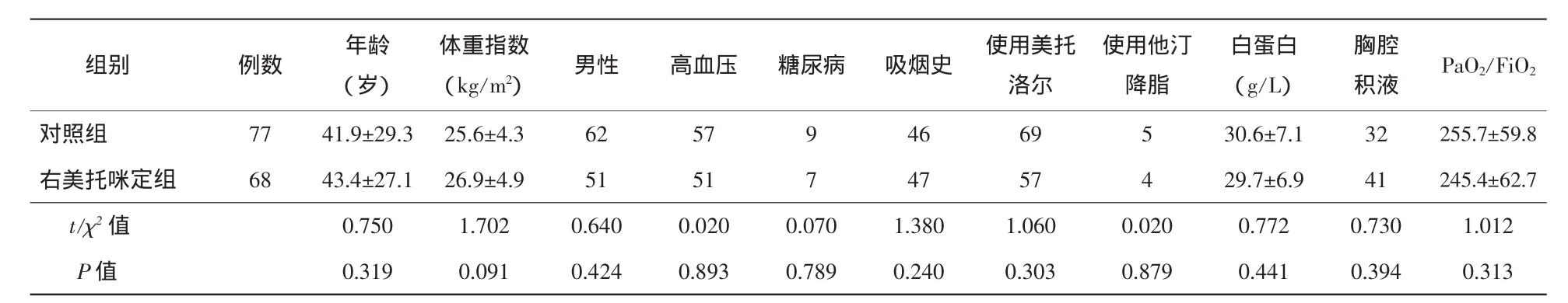
表1 两组患者临床特点比较(±s)
注:PaO2/FiO2:氧合指数
组别 例数 年龄(岁) (kg/m2) 男性 高血压 糖尿病 吸烟史 使用美托洛尔体重指数使用他汀降脂白蛋白(g/L)胸腔积液PaO2/FiO2对照组 77 41.9±29.3 25.6±4.3 62 57 9 46 69 5 30.6±7.1 32 255.7±59.8右美托咪定组 68 43.4±27.1 26.9±4.9 51 51 7 47 57 4 29.7±6.9 41 245.4±62.7 t/χ2值 0.750 1.702 0.640 0.020 0.070 1.380 1.060 0.020 0.772 0.730 1.012 P值 0.319 0.091 0.424 0.893 0.789 0.240 0.303 0.879 0.441 0.394 0.313
表2 两组患者用药前检验指标比较(±s)
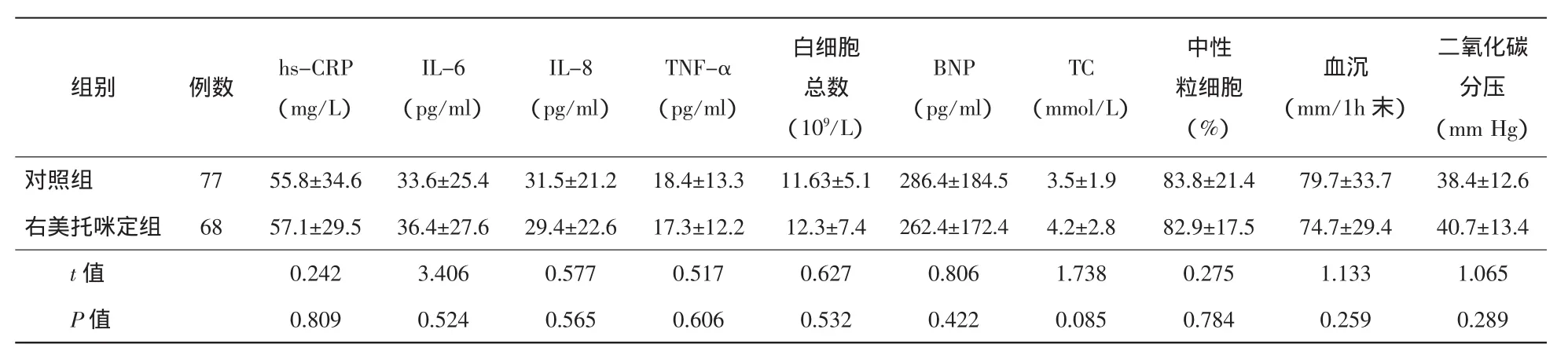
表2 两组患者用药前检验指标比较(±s)
注:hs-CRP:超敏C反应蛋白;IL-6:白介素6;,IL-8:白介素8;TNF-α:肿瘤坏死因子α;,BNP:B型钠尿肽;TC:总胆固醇。
二氧化碳分压(mm Hg)对照组 77 55.8±34.6 33.6±25.4 31.5±21.2 18.4±13.3 11.63±5.1 286.4±184.5 3.5±1.9 83.8±21.4 79.7±33.7 38.4±12.6右美托咪定组 68 57.1±29.5 36.4±27.6 29.4±22.6 17.3±12.2 12.3±7.4 262.4±172.4 4.2±2.8 82.9±17.5 74.7±29.4 40.7±13.4 t值 0.242 3.406 0.577 0.517 0.627 0.806 1.738 0.275 1.133 1.065 P值 0.809 0.524 0.565 0.606 0.532 0.422 0.085 0.784 0.259 0.289组别 例数 hs-CRP(mg/L)IL-6(pg/ml)IL-8(pg/ml)TNF-α(pg/ml)白细胞总数(109/L)BNP(pg/ml)TC(mmol/L)中性粒细胞(%)血沉(mm/1h末)
表3 两组患者用药后检验指标比较(±s)
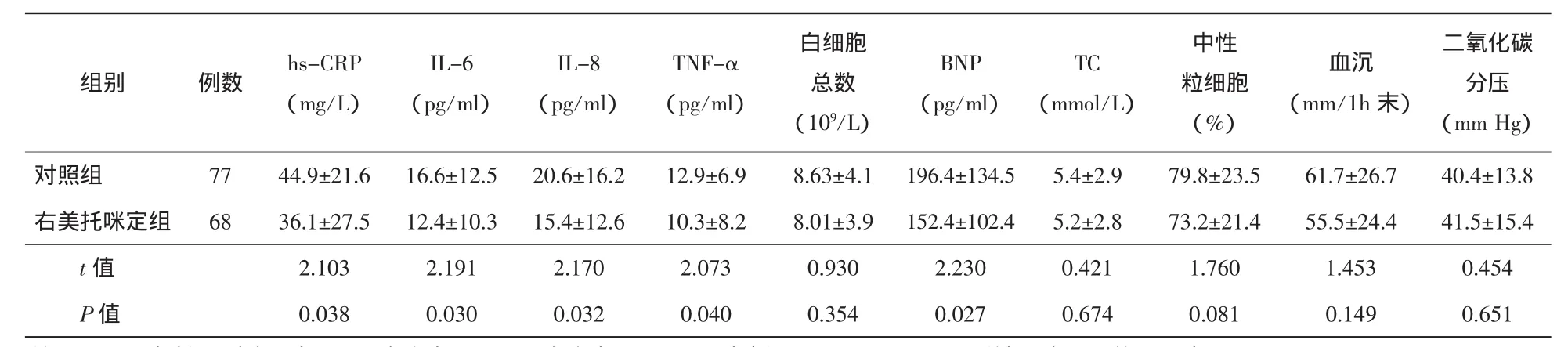
表3 两组患者用药后检验指标比较(±s)
注:hs-CRP:超敏C反应蛋白;IL-6:白介素6;,IL-8:白介素8;TNF-α:肿瘤坏死因子α;,BNP:B型钠尿肽;TC:总胆固醇。
二氧化碳分压(mm Hg)对照组 77 44.9±21.6 16.6±12.5 20.6±16.2 12.9±6.9 8.63±4.1 196.4±134.5 5.4±2.9 79.8±23.5 61.7±26.7 40.4±13.8右美托咪定组 68 36.1±27.5 12.4±10.3 15.4±12.6 10.3±8.2 8.01±3.9 152.4±102.4 5.2±2.8 73.2±21.4 55.5±24.4 41.5±15.4 t值 2.103 2.191 2.170 2.073 0.930 2.230 0.421 1.760 1.453 0.454 P值 0.038 0.030 0.032 0.040 0.354 0.027 0.674 0.081 0.149 0.651组别 例数 hs-CRP(mg/L)IL-6(pg/ml)IL-8(pg/ml)TNF-α(pg/ml)白细胞总数(109/L)BNP(pg/ml)TC(mmol/L)中性粒细胞(%)血沉(mm/1h末)
3 讨论
急性主动脉夹层合并低氧血症在临床上时有发生。本次入选患者的发生率为59.67%。患者入住CCU后常感焦虑、烦躁,尤其是合并低氧血症的患者因可能合并脑供氧不足,故焦虑、烦躁症状尤为明显。焦虑和烦躁可能引起患者夹层进展、破裂等不良后果,故在住院诊治过程中,镇静、催眠治疗尤为重要[6]。在临床镇静治疗时有多种镇静药物选择,但有时小剂量无法达到镇静效果,加大剂量又可能出现呼吸或循环抑制。特别是已经存在低氧血症的主动脉夹层患者,镇静治疗过程中需严密注意呼吸功能,避免出现呼吸抑制加重病情。本次观察使用右美托咪定组患者二氧化碳分压水平与对照组比较未见统计学差异,未引起明显的二氧化碳潴留及呼吸抑制,可以比较安全地使用于未行机械通气的低氧血症患者。
右美托咪定(dexmedetomidine)是一种高选择性α2受体激动剂,具有镇静、镇痛、催眠、抗焦虑、抑制交感神经活性等特点,且无呼吸抑制的副作用,故临床上适用于未行机械通气患者的镇静、催眠治疗[7]。同时研究发现,右美托咪定还具有心脏、肾脏和脑的保护作用[8-10]。
本次观察发现,右美托咪定组患者的hs-CRP、IL-6、IL-8、TNF-α、BNP低于对照组,两者相比差异有统计学意义(P<0.05)。主动脉夹层发生后会出现全身急性炎性反应,急性炎性反应的患者血浆中TNF-α、IL-6和IL-8水平持续升高,并且与器官损伤严重程度存在明显相关性。IL-6在损伤中早期表达增高,可以通过促炎症反应激活多种组织因子,增加一氧化氮(NO)、氧自由基的表达。诱发和放大炎症反应[11]。目前很多研究发现,右美托咪定(5μg·kg-1·h-1)对多种原因引起的急性肺损伤都能够明显地降低TNF-α、IL-1B和IL-6等炎症因子的表达,并推断右美托咪定抗炎作用及对创伤肺的保护作用与激活α2受体有关,认为α2受体激动剂抗炎作用可能与巨噬细胞、单核细胞调节炎症因子的产生有关[10,11]。同时右美托咪定能够显著降低支气管肺泡灌洗液中PMN浓度,降低肺组织中性粒细胞渗出,也能够降低损伤肺的通透性,降低肺湿/干质量比,减轻肺水肿[12,13],有利于改善低氧血症症状和预后。本次观察亦发现,右美托咪定组术后的机械通气时间及住院时间均短于对照组。
综上所述,右美托咪定能有效改善患者因低氧血症引起的紧张、烦躁、焦虑症状,不导致明显二氧化碳储留,减少需机械辅助例数,持续静脉泵注可有效降低血清IL-6和IL-8等炎症因子的产生和释放,降低肺泡中中性粒细胞浸润和减轻肺水肿,对炎性反应引起的肺损伤导致低氧血症能够起到一定的保护作用[11,14]。使用右美托咪定对改善主动脉夹层合并低氧血症患者住院期间的依从性、降低机械辅助例数、缩短住院时间有帮助。
本研究样本量有限,为回顾性研究,且由于临床实际工作的局限,检验指标抽取时间不完全统一,同时亦无近期及远期随访统计资料,故结论有一定局限性。有待于更多前瞻性的研究进一步证实。
[1]Sato F,Kitamura T,Kongo M,et al.Newly diagnosed acute aortic dissection:characteristics,treatment modifications,and outcomes.Int Heart J,2005,46:1083-1098.
[2]张金良,荆全民.主动脉夹层病因学进展.中国心血管病研究,2009,7:152-155.
[3]丁旭,陈丽娟,金春杰,等.主动脉夹层的临床特征及治疗进展.中国医药,2012,7:247-249.
[4]陈洪喜,余国忠,吕庆连,等.主动脉夹层32例诊治分析.中国煤炭工业医学杂志,2011,15:195-197.
[5]He R,Guo DC,Estrera AL,et al.Characterization of the inflammatory and apoptotie cells in the aortas of patients witll ascending tlloracle aortic aneurysms and dissections.J Thorac Cardiovasc Surg,2006,131:671-678.
[6]陶少宇,李宛霞,齐协飞.右美托咪定在ICU患者镇静中的疗效分析.中国急救医学,2011,32:1103-1105.
[7]Anttila M,Penttila J,Helminen A,et al.Bioavailability of dexmedetomidine after extravascular doses in healthy subjects.Br J Clin Pharmacol,2003,56:691-693.
[8]Yang CL,Tsai PS,Huang CJ.Effects of dexmedetomidine on regulating pulmonary inflammation in a rat model of ventilator-induced lung injury.Acta Anaesthesiol Taiwan,2008,46:151-159.
[9]Lesur O,Kokis A,Hermans C,et al.Interleukin 2 involvement in early acute respiratory distress syndrome:relationship with polymorphonuelear neutrophil apoptosis and patient survival.Crit Care Med,2000,28:3814-3822.
[10]Prielipp RC,Wall MH,Tobin JR,et al.Dexmedetomidineinduced sedation in volunteers decreases regional and global cerebral blood flow.Anesth Analg,2002,95:1052-1059.
[11]Biceard BM,Goga S,de Beurs J.Dexmedetomidine and cardiac protection for non-cardiac surgery:a meta-analysis of randomized controlled trials.Anaesthesia,2008,63:4-14.
[12]Taniguchi T,Kufita A,Kobayashi K,et al.Dose-and timerelated effects of dexmedetomidine on mortality and inflammatory responsestoendotoxin-induced shock in rats.JAnesth,2008,22:221-228.
[13]Kumagai M,Horiguchi T,Nishikawa T,et al.Intmvenous dexmedetomidine decreases lung permeability induced by intraeranial hypertension in rats.Anesth Analg,2008,107:643-647.
[14]Penttila J,Helminen A,Anttila M,et al.Cardiovascular and parasympathetic effects of dexmetomidine in healthy subjects. Can J Physiol Pharm,2004,82:359-362.
The application of Dexmedetomidine in the preoperative hypoxemia in patients with aortic dissection
SHEN Fei,SU Xi,LIU Cheng-wei,et al.CCU,Wuhan Asia Heart Hospital,Wuhan 430022,China
Objective To investigate the application of Dexmedetomidine in the preoperative hypoxemia in patients with aortic dissection.MethodsBetween 2012 January to 2013 July,243 cases of acute aortic dissection(AAD)patients were observed,including 104 cases of Standford A type and 139 cases of Standford B type. All the patients were divided into two groups according to the usage of Dexmedetomidine or not.The C-reaction protein(CRP)level,cytokines level,erythrocyte sedimentation rate(ESR),white blood cell count and classification of neutrophils,inflammatory cytokines level,mechanical ventilation ratio,hospitalization days and Carbon dioxide retention ratio were analyzed between the two groups.ResultsThe total number of hypoxemia were 145 cases,68 cases in the Dexmedetomidine group and 77 cases in the control group.The inflammatory cytokines(IL-6,IL-8,TNF-α and so on)level of the Dexmedetomidine group was reduced after treatment and the difference were significant to the control group.The using of Dexmedetomidine can reduce hospitalization days[(17.0±13.8)d vs(19.9±16.2)d between Standford A type,P<0.05,(15±9.8)d vs(18.6±11.2)d between Standford type,P<0.05],improve the compliance of patients,and may not cause Carbon dioxide retention.ConclusionThe using of Dexmedetomidine in the preoperative hypoxemia in patients with aortic dissection can reduce inflammation reaction,decrease mechanical ventilation ratio and shorten hospitalization days without obvious clinical complications.
Aortic dissection; Hypoxemia; Dexmedetomidine; Inflammation reaction
430022 湖北省武汉市,武汉亚洲心脏病医院CCU
10.3969/j.issn.1672-5301.2016.01.019
R543.1
A
1672-5301(2016)01-0071-04
2015-09-10)
