邻菲啰啉和水杨酸构筑铜配合物的电化学行为及与DNA的相互作用
2016-09-10李小芳冯小强朱元成
李小芳,冯小强*,杨 声,朱元成
(1.天水师范学院化工学院,甘肃天水 741001; 2.定西师专化学系,甘肃定西 743000)
邻菲啰啉和水杨酸构筑铜配合物的电化学行为及与DNA的相互作用
李小芳1,冯小强1*,杨声2,朱元成1
(1.天水师范学院化工学院,甘肃天水 741001; 2.定西师专化学系,甘肃定西 743000)
合成了一种新型的三元铜配合物[Cu(phen)(SA)2]·H2O(phen=1,10-邻菲啰啉,SA=水杨酸),并以鲱鱼精DNA为靶点,通过紫外吸收光谱法、循环伏安法、差分脉冲伏安法和DNA粘度滴定实验,探讨了配合物与DNA的键合方式。结果表明,SA的羧酸根离子与Cu2+单齿配位,phen的两个氮原子与Cu2+呈双齿配位,形成的配合物在0.489 V/0.050 V处呈现一对明显的准可逆氧化还原峰,并且中心Cu2+在玻碳电极上的反应主要由扩散过程控制。配合物与DNA作用时,可观察到配合物的紫外光谱出现明显的减色效应,但是红移现象不明显,氧化还原峰的电流减小,峰电位发生正移,并且DNA的粘度随配合物的加入而增大。结论认为,配合物以嵌插方式与DNA发生作用形成1:1的复合物,但插入程度较弱(结合常数为1.55×104L·mol-1)。
水杨酸;1,10-邻菲啰啉;铜;DNA;相互作用
1 引 言
自从顺铂类抗癌药物成功地应用于临床后,对金属配合物的合成及与DNA之间的作用机制探讨成为诸多学者关注的焦点[1-2]。DNA是抗癌试剂的主要靶向分子,小分子可与DNA相互作用从而阻止癌细胞DNA的复制,导致癌细胞死亡,所以许多抗癌、治癌药物都以DNA为作用标靶来设计。药物分子发挥药效的能力与其嵌插结合DNA的作用方式以及作用程度呈正相关。引入具有平面构型的结构单元对核酸特定位点有选择性嵌入作用[3]。具有多环芳烃结构的1,10-邻菲罗啉含有较大范围的共轭效应和较好的刚性平面,与DNA双螺旋结构可以较好地匹配并呈现出良好的生物活性[4],因而成为研究核酸二级结构和设计以核酸为靶的抗癌药物的一类重要的化合物[5]。
铜是生物体内新陈代谢所必需的,同时还具有抗炎杀菌、抗癌抗凝血等功效。铜配合物与铜盐的混合物能有效抑制癌细胞增殖,诱导癌细胞凋亡,并且铜配合物的抗癌药性优于铂类抗癌药物[6]。因此,铜配合物的抗癌药性以及与DNA作用机制引起了无机药物学家和生物学家的广泛关注。华南农业大学学者[7]制备的铜配合物[Cu(H2O)(PyTA)2](ClO4)2[PyTA=2,4-二氨基-6(2-吡啶基)均三嗪]具有良好的抗菌活性,以插入模式与小牛胸腺DNA作用。西北大学学者[8]发现4-(1H-1,2,4-三唑-1-亚甲基)苯甲酸铜配合物表现出良好的抑菌效果,能更有效地促进质粒DNA(pUC18)裂解,能以插入方式与DNA结合。本课题组也通过研究发现[9],糠醛缩对氨基苯磺酸席夫碱Cu(Ⅱ)配合物以嵌插模式与DNA作用,有关生物功能活性的研究正在进行。
水杨酸易与金属形成稳定的配合物,其生物活性较水杨酸高且毒性降低[10]。基于以上所述,本文首次构筑了以1,10-邻菲啰啉、水杨酸为配体的三元铜配合物,并通过光谱法、电化学以及DNA粘度测定,从分子水平研究了三元铜配合物与鲱鱼精DNA的键合方式。有关1,10-邻菲啰啉-水杨酸-Cu配合物的合成以及与DNA作用机制的研究尚未见报道,该研究有助于筛选高效、低毒的抗癌新药,同时可为其在抗菌、抗癌药物及其他相关领域的应用提供理论依据。
2 实 验
2.1材料与仪器
鲱鱼精DNA(Sigma公司产品,A260/A280= 1.85)。TG-DTA分析仪(美国Perkin Elmere公司);Spectrum One 3.0型傅立叶红外光谱仪(美国Perkin Elmere公司);UV-2450紫外可见光谱仪(日本岛津公司);CHI660B型电化学工作站(上海辰华仪器有限公司)。
2.2配合物的合成
在圆底烧瓶中加入15 mL含49.6 mg水杨酸的水溶液,搅拌下加入5 mL含16 mg的NaOH(0.4 mmol)水溶液。将5 mL含64 mg的无水硫酸铜(0.4 mmol)水溶液继续加入到上述圆底烧瓶中,室温下搅拌30 min后,缓慢滴加15 mL含79.2 mg(0.4 mmol)1,10-邻菲罗啉的无水乙醇溶液,50℃下持续反应6 h。结束后抽滤除去沉淀,滤液于室温下静止4周后析出蓝色晶体,产率为58.3%。
2.3配合物与鲱鱼精DNA的作用
具体的紫外吸收光谱、电化学和粘度测定实验过程参照文献[11-12]。
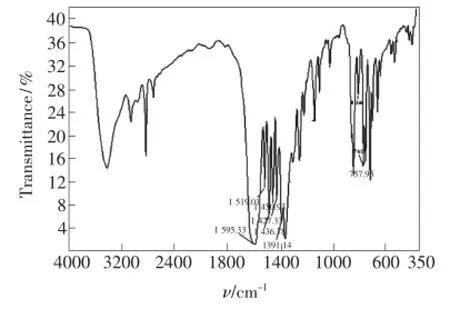
图1 配合物的红外光谱Fig.1 IR spectra of complex
3 结果与讨论
3.1配合物的表征
配合物的红外光谱如图1所示。配合物中仍存在自由配体水杨酸的啄(O—H)(phenol,1 483 cm-1),并在1 595,1 391 cm-1出现羧基的反对称伸缩振动自as(COO-)和对称伸缩振动自s(COO-),两者的差值△自为230,可推断水杨酸的羧酸根离子以单齿形式与Cu2+配位[13]。在405,430 cm-1出现了Cu—O的振动吸收峰[14],进一步表明羧基氧原子与Cu2+配位。自由配体phen在1 561 cm-1处=CN的伸缩振动峰在与Cu2+形成配合物后,向低波数移动了42 cm-1,说明phen的两个氮原子与Cu2+呈双齿配位,形成螯环[15]。
以二甲亚砜(DMSO)作为溶剂和参比,在200~400 nm测定了两种游离配体及配合物的紫外光谱,如图2所示。配体phen在265 nm处产生一个吸收峰,SA在200 nm处出现一个紫外吸收,均可归属为π-π*跃迁。但是,两个配体与Cu2+发生配位后,形成的配合物在266 nm和300 nm出现了两个宽吸收峰,明显不是两种配体各自吸收光谱的简单加和,表明phen和CA配体与Cu2+配位成键形成了新的配合物。
为了研究配合物的热稳定性,在氮气气氛下,以10℃·min-1的加热速度在室温~1 000℃范围内对配合物进行热重测试,结果如图3所示。配合物的热分解过程可分两个阶段:第一阶段,在200℃以下有一明显的失重,并在80.5℃时失重最大,失重率达3.2%(理论失重3.2%),是一分子结晶水的失去;第二阶段,在200~700℃出现失重台阶,有85.3%的失重,属于配合物中配体的完全氧化分解,在DTG曲线上位于283℃处有一明显的放热峰。温度持续升高时,热重曲线比较平缓,当温度升至1 000℃时,仍有11.5%的质量剩余(理论残余值为12.93%),最终分解产物应该是氧化铜。
Cu2+含量采用EDTA滴定法测定。元素分析结果(%):Cu 12.04(11.15),C 63.62(62.72),H 3.71(3.83),N 4.94(4.88)(括号内为理论值)。结合红外光谱、紫外光谱及热重分析结果的数据,可以确定配合物化学组成为[Cu(Phen)(SA)2]· H2O(Phen=1,10-邻菲啰啉,SA=水杨酸)。

图2 紫外吸收光谱Fig.2 UV absorption spectra

图3 配合物的热重分析曲线Fig.3 Thermogravimetric analysis curves of complex

图4 扫速对配合物循环伏安曲线的影响(a)及Ipa-v1/2关系曲线(b)Fig.4 Effect of scan rate on the CV curves of complex(a)and Ipa-v1/2relationship curve(b)
3.2配合物在玻碳电极上的电化学行为及与DNA的作用方式
在-1.2~1.6 V电位范围内扫描,发现配合物在玻碳电极表面有电化学响应,在0.489 V/0.050 V处存在一对准可逆电对,对应Cu(Ⅰ)/Cu(Ⅱ)的电子转移,如图4(a)所示。通过改变扫描速度,发现配合物的氧化还原峰电流随着扫描速度的不断增大而增大,并且峰电位随扫描速度的增大而稍有移动。在实验设定的扫描速率范围内(0.2~1.1 V/s),通过作图(图4(b))发现在0.489 V处的氧化峰电流与扫描速度的平方根间呈现良好的线性关系:Ipa(10-5A)=3.06-9.99v1/2(R=0.999),表明配合物在玻碳电极上的电化学行为主要由扩散过程控制。
3.3配合物与DNA之间的作用方式
3.3.1紫外光谱法
当小分子中加入DNA后,若能引起其吸收光谱发生减色效应和红移现象,说明小分子与DNA发生嵌插作用[16]。如图5所示:配合物于266 nm处的吸收峰在加入DNA后发生了明显的减色效应,但红移现象不明显(红移了2 nm)。根据这些信息,初步推断配合物与DNA发生了相互作用。
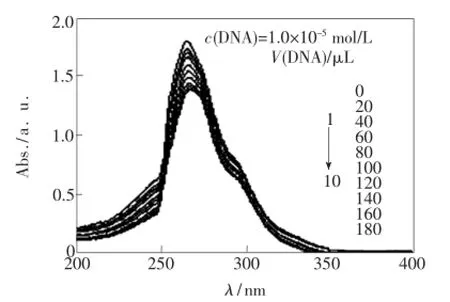
图5 DNA加入前后配合物的紫外吸收光谱Fig.5 UV absorption spectra of complex addition DNA before and after
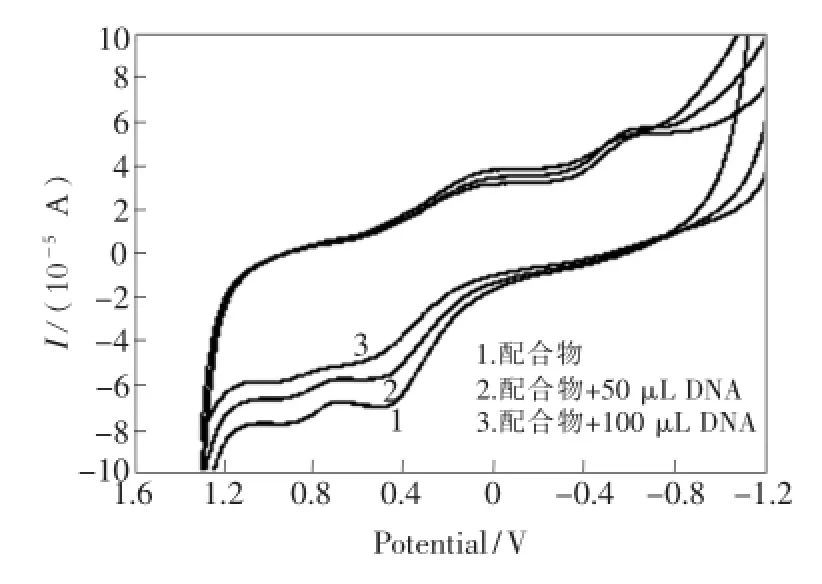
图6 DNA加入前后配合物的循环伏安图Fig.6 Cyclic voltammogram of complex addition DNA before and after
3.3.2电化学方法
在4 mL浓度为1.0 mg/mL的配合物溶液中,用1.0×10-5mol/L的DNA滴定,作用10 min后,扫描配合物的循环伏安曲线如图6所示。在配合物中加入DNA后,没有新峰出现,但是氧化还原峰的电流明显降低,且随着加入DNA量的增加而下降越大。配合物在0.489 V(峰电流为-6.944×10-5A)附近的氧化峰有正移趋势,但还原峰电位位移不明显。当滴加DNA体积分别为50 μL和100 μL时,配合物在0.489 V处的氧化峰分别正移至0.512 V和0.61 V处,说明式量电位也发生正移,峰电流分别降至-5.611×10-5A和-4.96×10-5A。根据文献[17]报道,如果配合物的式量电位在加入DNA后向正方向偏移,说明两者发生了插入作用。循环伏安图的变化,证明了配合物是以插入方式与DNA作用,形成了非电化学活性的复合物。
差分脉冲法的灵敏度高、分辨能力强。为了进一步验证前面得出的结论,我们采用差分脉冲法研究配合物与DNA的作用方式,如图7所示。浓度为1.0 mg/mL的配合物在0.116 8 V处的峰电流为-1.297×10-5A,在配合物溶液中滴加DNA后,峰电流逐渐降低,峰电位发生正移。当DNA滴加达到130 μL时,配合物峰电流降低至-5.493×10-6A,峰电位正移至0.127 3 V,正移了0.010 5 V。峰电流的降低可能是由于配合物插入到DNA的双螺旋结构中,对电子传递产生屏蔽作用所致。峰电位的移动可以作为判断DNA与电化学活性分子作用模式的依据之一。差分脉冲伏安图的变化再次表明配合物与DNA以嵌插作用结合,与以上研究结论一致。
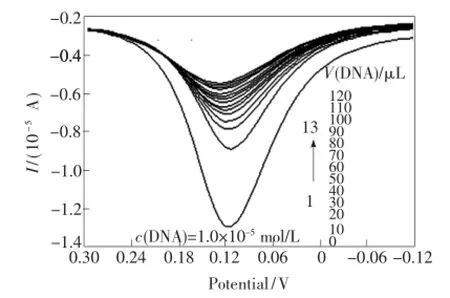
图7 加入DNA前后配合物的差分脉冲伏安图Fig.7 Differential pulse voltammograms of complex addition DNA before and after
Langmuir公式常用于研究DNA与小分子的相互作用,其数学表达式为:
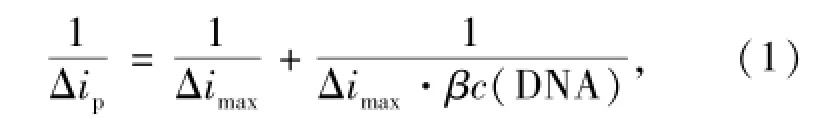
式中,△ip为DNA加入前后的峰电流变化值,△imax为峰电流变化的最大值,茁为结合常数。若配合物与DNA只形成一种简单的复合物,即1/△ip~1/c(DNA)n(结合比n=1,2,3)变化应为一直线,从直线截距和斜率可求结合常数茁。如图8所示,配合物中滴加DNA前后的峰电流下降值△ip的倒数与1/c(DNA)呈线性关系,线性方程为1/△ip=-170.4-109.6×1/c(DNA)(R= 0.994 8),表明配合物与DNA可形成1:1的复合物,结合比n=1,结合常数茁=1.55×104L· mol-1。一般来说,当结合常数大于105L·mol-1时,可认为化合物与DNA之间具有较强的插入作用。因此,上述实验结果再次说明配合物与DNA之间存在插入作用,但插入程度较弱。
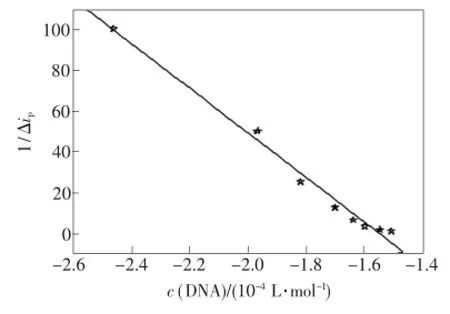
图8 1/△ip与1/c(DNA)的关系曲线Fig.8 Relationship of 1/△ipand 1/c(DNA)
3.3.3粘度法
DNA粘度随配合物加入量的变化如图9所示。随着配合物加入量的增加,DNA溶液的粘度不断增大。根据文献[18]报道,当配合物以插入方式作用DNA时,会导致DNA溶液的粘度增加。DNA粘度的变化趋势说明配合物能够插入到DNA双螺旋结构的内部,增加了DNA分子链的长度,最终导致DNA粘度逐渐增大。由此进一步确定配合物以插入方式与DNA作用,这与上述研究结果一致。

图9 配合物对DNA粘度的影响Fig.9 Influence of complex on DNA viscosity
4 结 论
确定合成的三元铜配合物化学组成为[Cu-(phen)(SA)2]·H2O(phen=1,10-邻菲啰啉,SA=水杨酸),配合物在0.489/0.050 V(氧化峰/还原峰)处呈现一对明显的准可逆氧化还原峰,并且在玻碳电极上的反应主要由扩散过程控制。采用紫外光谱、电化学方法以及DNA粘度测定方法,证实了配合物与DNA通过嵌插方式发生作用,形成1:1的复合物,两者的结合常数茁= 1.55×104L·mol-1。
[1]郑建华,刘俊,肖尧,等.基于水杨酰腙配体的二丁基锡配合物的合成、晶体结构、热稳定性及与DNA相互作用[J].应用化学,2015,32(5):562-569. ZHENG J H,LIU J,XIAO Y,et al..Synthesis,crystal structure,thermal stability and DNA interaction of the dibutytin complex based on salicylacylhydrazone[J].Chin.J.Appl.Chem.,2015,32(5):562-569.(in Chinese)
[2]王建辉,郭莉芹,阮文娟,等.Salen型铜(Ⅱ)和镍(Ⅱ)配合物的合成与电化学性质[J].应用化学,2014,31(3):303-309. WANG J H,GUO L Q,RUAN W J,et al..Synthesis and electrochemical properties of salen-type copper(Ⅱ)and nickel(Ⅱ)complexes[J].Chin.J.Appl.Chem.,2014,31(3):303-309.(in Chinese)
[3]SONG Y M,XU J P,DING L,et al..Syntheses,characterization and biological activities of rare earth metal complexes with curcumin and 1,10-phenanthro-line-5,6-dione[J].J.Inorg.Biochem.,2009,103(3):396-400.
[4]OZAKI T,SUZUKI Y,NANKAWA T,et al..Interactions of rare earth elements with bacteria and organic ligands[J]. J.Alloys Compd.,2006,408:1334-1338.
[5]MIAO T F,LI J,LIAO S Y,et al..Theoretical studies on the spectral and DNA-photocleavage properties of Co(Ⅲ)and Ru(Ⅱ)polypyridyl complexes[J].J.Mol.Struct.:Theochem,2010,957(1-3):108-113.
[6]MARZANO C,PELLEI M,TISATOF,et al..Copper complexes as anticancer agents[J].Anti-Cancer Agents Med. Chem.,2009,9:185-211.
[7]区志镔,黄山华,傅夏兵,等.2,4-二氨基-6-(2-吡啶基)均三嗪铜髤配合物的结构、抗菌活性及DNA作用[J].无机化学学报,2014,30(5):1017-1024. OU Z B,HUANG S H,FU X B,et al..Structure,antibacterial activities and DNA interaction of a copper(Ⅱ)complex derived from 2,4-Diamino-6-(2′-pyridyl)-1,3,5-triazine[J].Chin.J.Inorg.Chem.,2014,30(5):1017-1024.(in Chinese)
[8]李婕,熊萍萍,步怀宇,等.4-(1H-1,2,4-三唑-1-亚甲基)苯甲酸过渡金属配合物的合成、结构、抑菌活性及DNA裂解活性[J].物理化学学报,2014,30(7):1354-1362. LI J,XIONG P P,BU H Y,et al..Syntheses,structures,antifungal activities and DNA cleavage of transition metal coordination compounds with 4-(1H-1,2,4-triazol-1-ylmethyl)benzoic acid[J].Acta Physico-Chim.Sinica,2014,30(7):1354-1362.(in Chinese)
[9]李小芳,冯小强,杨声,等.席夫碱Cu(Ⅱ)配合物与鲱鱼精DNA的相互作用研究[J].化学研究与应用,2014,26(3):409-412. LI X F,FENG X Q,YANG S,et al..Interaction of Schiff base copper complex with herring sperm DNA[J].Chem. Res.Appl.,2014,26(3):409-412.(in Chinese)
[10]YANJANEYULU R Y,SWAMY R R P.Studies on some mixed ligand complexes of copper(Ⅱ)with 8-hydroxyquinoline and salicylic acids.Relation between stability constants and antimicrobial activity[J].J.Indian Chem.Soc.,1985,2(5):346-351.
[11]李小芳,冯小强,张宏伟,等.甲基丙烯酸-8-羟基喹啉-镧配合物的合成及与鲱鱼精DNA相互作用的光谱学研究[J].化学研究与应用,2014,26(9):1406-1410. LI X F,FENG X Q,ZHANG H W,et al..Synthesis and DNA-binding of La(Ⅲ)complex with methacrylic acid and 8-hydroxyquinoline[J].Chem.Res.Appl.,2014,26(9):1406-1410.(in Chinese)
[12]张万举,李延团,王芳,等.三元铜(Ⅱ)配合物Cu(IDA)(NBZIM)(H2O)与DNA相互作用研究[J].华中师范大学学报(自然科学版),2010,44(3):438-442. ZHANG W J,LI Y T,WANG F,et al..Studies on the DNA-binding property of a ternary copper(Ⅱ)complex Cu(IDA)(NBZIM)(H2O)[J].J.Huazhong Normal Univ.(Natural Sciences),2010,44(3):438-442.(in Chinese)
[13]何其庄,马树芝,许东芳.稀土酰基吡唑啉酮邻菲咯啉配合物的合成、表征及其生物活性[J].无机化学学报,2007,23(10):1723-1728. HE Q Z,MA S Z,XU D F.Synthesis,characterization and biological activity of rare earth complexes with acylpyrazolone and o-phenanthroline[J].Chin.J.Inorg.Chem.,2007,23(10):1723-1728.(in Chinese)
[14]杨艳红,李野,牛淑云,等.系列Ln(Ⅲ)配位聚合物(Ln:Eu,Sm,Tb,Gd)的合成及其荧光分析[J].应用化学,2010,27(9):1055-1060. YANG Y H,LI Y,NIU S Y,et al..Preparation and fluorescence of lanthanide(Ⅲ)coordination polymers(Ln:Eu,Sm,Tb,Gd)[J].Chin.J.Appl.Chem.,2010,27(9):1055-1060.(in Chinese)
[15]吴惠霞,忻驰洋,孙君燕,等.稀土掺杂镝(Ⅲ)乙酰丙酮邻菲咯啉三元配合物的合成和荧光性质[J].发光学报,2006,27(2):270-274. WU H X,XIN C Y,SUN J Y,et al..Syntheses and photolum inescence properties of Dy3+-acetylacetone-1,10-phenanthroline ternary complexes doped with rare earth ions[J].Chin.J.Lumin.,2006,27(2):270-274.(in Chinese)
[16]PYLE A M,REHMANN J P,MESHOYRER R,et al..Mixed-ligand complexes of ruthenium(Ⅱ):factors governing binding to DNA[J].J.Am.Chem.Soc.,1989,111:3051-3058.
[17]张芳,张前前,祝成坚,等.铜(Ⅱ)-苏氨酸-邻菲咯啉配合物的合成及其与DNA作用的光谱研究[J].光谱学与光谱分析,2005,25(9):1439-1442. ZHANG F,ZHANG Q Q,ZHU C J,et al..Synthesis and DNA binding spectroscopy studies of Cu(Ⅱ)-thr-phen[J]. Spectrosc.Spect.Anal.,2005,25(9):1439-1442.(in Chinese)
[18]周庆华,杨频.二(2-苯并咪唑亚甲基)胺合铜(Ⅱ)配合物与DNA作用方式的光谱研究[J].化学学报,2005,6(1):71-74.ZHOU Q H,YANG P.Study on the binding mode of a Cu(Ⅱ)complex with DNA[J].Acta Chim.Sinica,2005,6(1):71-74.(in Chinese)

李小芳(1983-),女,甘肃甘谷人,硕士,实验师,2009年于兰州大学获得硕士学位,主要从事功能高分子及有机稀土配位的研究。
E-mail:tslxffxq@163.com

冯小强(1979-),男,甘肃华亭人,硕士,副教授,2007年于兰州大学获得硕士学位,主要从事功能高分子方面的研究。
E-mail:fengxiaoqiang1979@163.com
Electrochemical Property and Interaction of DNA with 1,10-phenanthroline and Salicylic Acid Copper Complex
LI Xiao-fang1,FENG Xiao-qiang1*,YANG Sheng2,ZHU Yuan-cheng1
(1.College of Chemical Engineering and Technology,Tianshui Normal University,Tianshui 741001 China;2.Chemistry Department,Ding Xi Teachers蒺College,Dingxi 743000,China)
*Corresponding Author,E-mail:fengxiaoqiang1979@163.com
A new ternary complex of[Cu(phen)(SA)2]·H2O(phen=1,10-phenanthroline,SA=salicylic acid)was synthesized and the electrochemical behavior was studied.In addition,with hsDNA as the research target,the interaction between the complex and hsDNA was investigated by UV absorption spectroscopy,CV method,differential pulse voltammetry(DPV),and DNA viscosity titration experiment.The experiment results indicate that—COOH of SA and N of phen are liganded with Cu2+.Cyclic voltammetric shows that the complex has one pairs of redox peaks at 0.489 V/ 0.050 V,and the reaction of Cu2+on the electrode is controlled by diffusion.With the addition of hsDNA,the UV absorption peaks of complex red-shift and the intensity is weakened,the peak current decreases significantly and the potential moves positively,and the relative viscosity of hsDNA increases.It's concluded that[Cu(phen)(SA)2]·H2O and hsDNA bind by the mode of intercalation,the combining ratio and the binding constant are 1:1 and 1.55×104L·mol-1,respectively.
salicylic acid;1,10-phenanthroline;copper(Ⅱ);DNA;interaction
O614
A
10.3788/fgxb20163706.0744
1000-7032(2016)06-0744-07
2016-01-17;
2016-03-22
国家自然科学基金(51063006);天水师范学院“青蓝人才”工程和中青年教师科研项目(TSA1508)资助
