酯化改性淀粉纳米晶稳定的Pickering乳液及其油脂氧化稳定性
2016-09-10李琛,杨成
李 琛,杨 成
(江南大学食品胶体与生物技术教育部重点实验室,化学与材料工程学院,江苏无锡 214122)
酯化改性淀粉纳米晶稳定的Pickering乳液及其油脂氧化稳定性
李琛,杨成*
(江南大学食品胶体与生物技术教育部重点实验室,化学与材料工程学院,江苏无锡 214122)
通过辛烯基琥珀酸酐(OSA)与淀粉纳米晶(SNC)的酯化反应获得OSA改性淀粉纳米晶(OSA-SNC),以OSA-SNC为乳化剂,橄榄油为油相,制备出Pickering乳液,并探讨了OSA-SNC浓度、水相pH对乳液稳定性的影响。此外,通过与Tween-20稳定的乳液进行对比,研究了乳化剂浓度、水相pH对乳液油脂氧化稳定性的影响。研究表明,Pickering乳液的稳定性随着乳化剂浓度或者水相pH的增加而得到提高。OSA-SNC稳定乳液的油脂氧化稳定性显著优于Tween-20稳定的乳液;随着乳化剂浓度的增加,Tween-20稳定乳液的POV升高,而OSA-SNC稳定乳液的POV降低;Tween-20稳定乳液的POV随着水相pH的增大先降低再升高,而OSA-SNC稳定乳液的POV随着水相pH的增大而升高。
淀粉纳米晶,辛烯基琥珀酸酐,Pickering乳液,过氧化值
Pickering乳液是一种由固体颗粒吸附于油/水界面来稳定液滴的新型乳液,所用乳化剂被称为颗粒乳化剂[1]。与传统乳化剂相比,颗粒乳化剂在流体界面上的吸附几乎是不可逆的,因此颗粒乳化剂稳定的Pickering 乳液具有超级稳定性[2]。近年来,关于天然来源的颗粒乳化剂的研究越来越令人感兴趣。这些天然来源的颗粒乳化剂由于具有无毒、可降解以及优异的生物相容性而在食品、医药及化妆品领域有广阔的用途[3]。在食品与医药行业中,许多油脂有效成分都是以乳液的形式存在的[4]。而此类食品或药物在贮存期间,由于空气、光照、温度等因素的影响,很容易氧化酸败,产生异味,失去商品价值[5],因此如何提高油脂的氧化稳定性是亟需解决的问题。衡量油脂氧化稳定性的主要指标是氢过氧化物的含量,通常以过氧化值(POV)表示。通过对乳液POV的测定,有研究发现,乳液中油/水界面的微观结构可以影响油脂的氧化速率[6]。Kargar[7]等发现二氧化硅稳定的Pickering乳液由于具有在油/水界面上形成较厚颗粒壳层的能力而使油脂的氧化稳定性得到显著改善,通过进一步研究发现微晶纤维素颗粒(MCC)和改性淀粉颗粒(MS)稳定的Pickering乳液同样可以提高油脂的氧化稳定性[8]。因此,Pickering乳液在提高油脂氧化稳定性方面有着潜在的应用前景。
淀粉是自然界中存在的第二大天然高分子碳水化合物,淀粉在植物中主要以颗粒的形式存在。天然淀粉颗粒经酸或酶温和水解后可得到结晶度较高的纳米尺度颗粒,即淀粉纳米晶[9]。OSA改性淀粉是FDA认可的一种食品添加剂,拓展其在食品方面的应用具有较高的研究价值。本文采用可食用的OSA改性淀粉纳米晶制备出稳定的Pickering乳液,并对乳液POV的影响因素进行对比探讨,旨在提高乳液的油脂氧化稳定性。
1 材料与方法
1.1材料与仪器
淀粉纳米晶自制[9];橄榄油、Tween-20、浓硫酸、硫酸亚铁、甲醇、乙醇、正丁醇、氯化钡、异辛烷、异丙醇、过氧化氢国产分析纯试剂;辛烯基琥珀酸酐(OSA)Sigma公司产品。
S-4800型场发射扫描电子显微镜日本日立株式会社;ZetaPALS型Zeta电位及纳米粒度分析仪美国布鲁克海文仪器公司;VHX-1000C型超景深三维显微镜基恩士(香港)有限公司;FM200型实验室高剪切分散乳化机上海弗鲁克流体机械制造有限公司;TU-1901型双光束紫外可见分光光度计北京普析通用仪器有限责任公司。
1.2实验方法
1.2.1OSA改性淀粉纳米晶的制备准确吸取1.25 mL OSA置于25 mL容量瓶中,用无水乙醇定容,备用。精确称取1.0 g淀粉纳米晶置于烧杯中,加入200 mL去离子水,超声30 min得淀粉纳米晶分散液。用0.1 mol/L的氢氧化钠水溶液调节分散液pH为8.0,1 h内逐滴加入1.00 mL制备的OSA乙醇溶液,并用0.1 mol/L的氢氧化钠水溶液维持体系pH为8.0,25 ℃下酯化反应4 h后,用0.1 mol/L的盐酸水溶液调节体系pH为6.8,然后用80%体积分数的乙醇水溶液离心洗涤3次,无水乙醇离心洗涤3次,室温干燥后即得OSA改性淀粉纳米晶(OSA-SNC)。
1.2.2乳液的制备分别采用Tween-20和OSA-SNC作为乳化剂,精确配制5 mL质量浓度为0.25%、0.5%和1%的乳化剂水溶液,根据需求可采用0.1 mol/L的氢氧化钠水溶液或盐酸水溶液来进行pH的调节。然后加入5 mL橄榄油作为油相,用高剪切分散乳化机将混合溶液制备成乳液,乳化机转速为8000 r/min,乳化时间为2 min。
1.2.3乳液特性的测定按1.2.2的方法制备乳液,常温下静置30 d后通过显微镜对乳液液滴的粒径进行观察计算[10],可得表面平均直径(D3,2)和体积平均直径(D4,3)。此时,乳液界面的总表面积(S)和单位界面乳化剂质量(F)可分别通过公式(1)和(2)计算得到:
式(1)
式(2)
式中,V-乳液中橄榄油的体积;m-乳液中乳化剂的质量。
1.2.4乳液POV的测定按1.2.2的方法制备乳液,将乳液置于40 ℃的恒温干燥箱中储存以加速橄榄油的氧化过程。乳液制备完成后立即对其POV进行测定[4],并每隔1d来测定其POV的变化,共计10d。
2 结果与讨论
2.1OSA改性淀粉纳米晶的形貌
通过扫描电镜对OSA改性纳米晶的形貌进行观察,如图1所示。可以看出,通过酯化反应得到的OSA改性淀粉纳米晶呈不规则片状结构,粒径在40~100nm之间,同未改性的淀粉纳米晶相比,其颗粒形状和粒径大小并无明显区别[9]。

图1 OSA改性淀粉纳米晶的扫描电镜图Fig.1 SEM image of OSA-SNC
2.2乳液稳定性分析
2.2.1OSA-SNC浓度的影响在给定的乳化条件下,OSA-SNC浓度对乳液稳定性有着重要的影响。分别采用质量浓度为0.25%、0.5%和1%的OSA-SNC水分散液来制备Pickering乳液,通过显微镜观察乳滴的粒径,其结果如图2所示。可以看出,乳液所占的体积分数随着OSA-SNC浓度的增加而升高,分别为67%、77%和80%。同时,随着OSA-SNC浓度的增加,乳滴的粒径逐渐减小(表1),这是因为较多的OSA-SNC能够稳定表面积更大的油/水界面,进而增强了乳液的稳定性。

图2 不同浓度OSA-SNC 稳定Pickering乳液的显微镜照片Fig.2 The optical micrographs and photographs of Pickering emulsions stabilized by OSA-SNC at different concentrations注:a:0.25%;b:0.5%;c:1%。
2.2.2水相pH的影响在给定的乳化条件下,水相pH对乳液的稳定性也有较大的影响。制备水相pH分别为3.0、7.0和11.0的Pickering乳液(OSA-SNC质量浓度皆为0.5%),并通过显微镜观察乳滴粒径的变化,结果如图3所示。可以看出,随着水相pH的增大,乳滴粒径显著减小,因此乳液逐渐由黄色向乳白色转变。这是因为,随着水相pH的增大,OSA-SNC带电量明显升高(图4),导致颗粒之间的静电斥力增强,有效防止颗粒之间因形成氢键而造成的絮凝过程[11],使其可以更均匀的分布在液滴表面,从而稳定更大面积的油/水界面。此外,水相pH的改变也可能使颗粒的表面润湿性发生变化,进而对乳液的稳定性产生影响[12]。

图3 不同pH OSA-SNC稳定Pickering乳液的显微镜照片Fig.3 The optical micrographs and photographs of Pickering emulsions stabilized by OSA-SNC at different pH注:a:pH3.0;b:pH7.0;c:pH11.0。

图4 OSA-SNC在不同水相pH时的Zeta电位Fig.4 The Zeta potential of OSA-SNC at different pH values of aqueous
2.3乳液的油脂氧化稳定性分析
参照方法1.2.4对乳液的POV进行测定,从而对乳液油脂氧化稳定性的影响因素进行分析。分别通过Tween-20和OSA-SNC稳定的乳液,实验主要从乳化剂浓度和水相pH这两个方面对乳液的油脂氧化稳定性进行对比探讨。
2.3.1乳化剂浓度的影响由图5可以看出,乳液的POV都随着时间的延长而有所增加,这是由于乳液体系中的橄榄油被进一步氧化造成的。乳液静置10 d后,OSA-SNC稳定乳液的POV最大值(13.40 meq/kg)远小于Tween-20稳定乳液的POV最小值(17.86 meq/kg),这一结果表明OSA-SNC稳定乳液的油脂氧化稳定性显著高于Tween-20稳定的乳液。

图5 不同浓度的乳化剂稳定乳液的POV测定结果Fig.5 The POV of emulsions stabilized by different concentrations of emulsifiers
Tween-20稳定乳液的POV随着乳化剂浓度的增加而逐渐升高,这一结果与Fomuso等[13]的研究结果是类似的。这是因为乳滴粒径随着乳化剂的增加而减小(表1),造成橄榄油与水相接触的表面积S增大,油/水界面上自由基的传递过程加快,橄榄油更易于氧化腐败,从而导致其POV升高。但是,OSA-SNC稳定乳液的POV却随着乳化剂浓度的增加而逐渐降低。这是因为不同于分子乳化剂Tween-20,OSA-SNC是一种颗粒乳化剂。虽然随着乳化剂浓度的增加,乳液的界面总表面积S增大,但是OSA-SNC颗粒可以吸附在油/水界面上形成一层保护壳,大幅度降低了橄榄油与水溶液的接触面积,阻碍了油/水界面上的自由基传递过程,从而抑制了橄榄油的过氧化进程,使乳液的POV降低[14]。下面将从颗粒在油/水界面上的微观结构来进行详细阐述。

表1 不同浓度乳化剂稳定乳液的特性Table 1 The characterization of emulsions stabilized by different concentrations of emulsifiers
注:表中的POV为乳液静置10 d后的测定结果。
假设乳滴表面未被颗粒覆盖的总表面积为S0,那么与单位界面上未被颗粒覆盖的表面积ΔS0的关系满足下式:
S0=S×ΔS0
式(3)
由于OSA-SNC稳定乳液的POV随乳化剂浓度的增加而降低,这说明S0是逐渐减小的,因为S是逐渐增大的,因此ΔS0逐渐减小即单位界面上颗粒覆盖的表面积是逐渐增大的;若颗粒在乳滴表面的分布行为相同,那么单位界面上为覆盖更大面积的乳滴表面,乳液的F也应该是随乳化剂浓度(或S)的增加而增大。但是从表1中发现,乳液的F是先降低后增大的,这与理论不符,因此可以合理推断出,颗粒在乳滴表面的分布行为是随着浓度的增加而有所变化的。
从表1可以看出,当浓度从0.25%增加为0.5%时,乳液的S由0.515 m2迅速增大为1.415 m2,乳液的F却由0.0251 g/m2降低为0.0188 g/m2,但是其POV依然从13.40 meq/kg减小为12.84 meq/kg,这说明单位界面上0.0188 g OSA-SNC的覆盖面积(浓度为0.5%时)需要远大于0.0251 g OSA-SNC的覆盖面积(浓度为0.25%时)。推测认为,浓度为0.25%时,乳滴粒径较大,OSA-SNC只需要覆盖部分油/水界面即可稳定乳液[15],由于乳液的F较高,此时 OSA-SNC可能更倾向于多层聚集的吸附于油/水界面;而当浓度为0.5%时,OSA-SNC可以更加分散的吸附在乳滴表面从而覆盖更大面积的油/水界面(图6)。当浓度从0.5%增加为1%时,乳液的S由1.415 m2仅增大为1.569 m2,乳液的F却由0.0188 g/m2升高为0.0335 g/m2,但其POV仅从12.84 meq/kg减小为12.25 meq/kg。这是因为,当浓度增加为1%时,过多的OSA-SNC趋向于形成更厚的外壳来稳定乳液(图6),在之前的研究中也有类似的发现[12]。
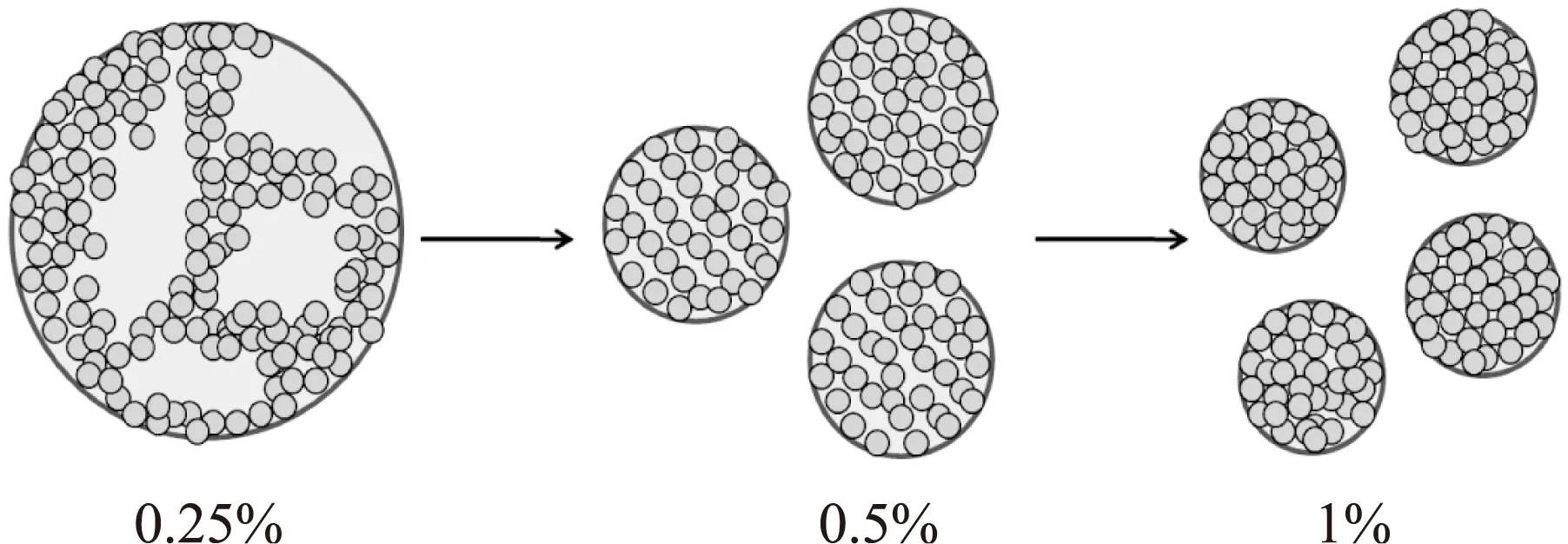
图6 OSA-SNC稳定乳液的油/水界面吸附示意图Fig.6 Schematic illustrations of the oil/water interfacial adsorption of OSA-SNC
2.3.2水相pH的影响参照方法1.2.2,分别采用浓度为0.5%的Tween-20和OSA-SNC作为乳化剂,制得水相pH分别为3.0、7.0和11.0的乳液,其POV的测定结果如图7所示。可以看出,乳液静置10 d后,OSA-SNC稳定乳液的POV最大值(18.89 meq/kg)远小于Tween-20稳定乳液的POV最小值(24.71 meq/kg),这一结果表明OSA-SNC稳定乳液的油脂氧化稳定性更加优异。

图7 不同水相pH时乳化剂稳定乳液的POV测定结果Fig.7 The POV of emulsions stabilized by emulsifiers at different pH values of aqueous
Tween-20稳定乳液的POV会随着水相pH的变化而改变,当pH从3.0增大为7.0时,其POV由28.55 meq/kg降低为24.71 meq/kg,这一变化趋势与Donnelly等[16]的研究相符,当pH进一步增加到11.0时,其POV由24.71 meq/kg增大为25.63 meq/kg。从表2中可以看出,Tween-20稳定乳液的POV变化趋势依然与S呈正相关,这一结果与乳化剂浓度的影响相同。还可以看出,OSA-SNC稳定乳液的POV随着水相pH的增大而升高,同时也和乳液的S呈正相关。但是,当pH为3.0时,乳液的F为其它两者的6倍左右(表2),但是其POV为18.19 meq/kg,相较于pH为7.0(18.77 meq/kg)和11.0(18.89 meq/kg)时的降低趋势并不明显。由于水相pH对乳液油脂氧化稳定性的影响较为复杂,目前很多研究的结果并不相同[17-19]。在本乳化体系中,我们认为乳液的POV主要是由两个因素来共同决定的:一方面,水相pH可以改变OSA-SNC的带电量,使颗粒的相互作用力发生变化,进而影响OSA-SNC在油/水界面上的吸附行为;另一方面,水相pH还可以改变OSA-SNC的表面润湿性[12],从而对颗粒在油/水界面上的吸附行为产生影响,进而影响乳液的油脂氧化稳定性。此外,OSA-SNC的带电量对油脂氧化过程中产生的自由基也有一定的清除作用[8]。

表2 不同水相pH时乳化剂稳定乳液的特性Table 2 The characterization of emulsions stabilized by emulsifiers at different pH values of aqueous
3 结论
本实验采用OSA酯化改性的SNC为乳化剂,橄榄油为油相,制备出稳定的Pickering乳液。实验条件下,OSA-SNC稳定乳液的液滴粒径随着乳化剂浓度或水相pH的增大而逐渐减小。OSA-SNC稳定乳液的油脂氧化稳定性显著优于Tween-20稳定的乳液。Tween-20稳定乳液的POV随着浓度的增大而升高,随着水相pH的增大先降低再升高;OSA-SNC稳定乳液的POV随着浓度的增大而降低,随着水相pH的增大而升高。
[1]周君,乔秀颖,孙康. Pickering 乳液的制备和应用研究进展[J]. 化学通报,2012,75(2):99-105.
[2]Binks B P. Particles as surfactants—similarities and differences[J]. Current Opinion in Colloid & Interface Science,2002,7:21-41.
[3]Lam S,Velikov K P,Velev O D. Pickering stabilization of foams and emulsions with particles of biological origin[J]. Current Opinion in Colloid & Interface Science,2014,19:490-500.
[4]余辉,陈洁. 可见分光光度法测定乳液过氧化值的研究[J]. 食品科学,2007,28(11):401-404.
[5]Coupland J N,McClements D J. Lipid oxidation in food emulsions[J]. Trends in Food Science & Technology,1996,7(3):83-91.
[6]Yuji H,Weiss J,Villeneuve P,et al. Ability of surface-active antioxidants to inhibit lipid oxidation in oil-in-water emulsion[J]. Journal of Agricultural and Food Chemistry,2007,55:11052-11056.
[7]Kargar M,Spyropoulos F,Norton I T. The effect of interfacial microstructure on the lipid oxidation stability of oil-in-water emulsions[J]. Journal of Colloid and Interface Science,2011,357:527-533.
[8]Kargar M,Fayazmanesh K,Alavi M,et al. Investigation into the potential ability of Pickering emulsions(food-grade particles)
to enhance the oxidative stability of oil-in-water emulsions[J].Journal of Colloid and Interface Science,2012,366:209-215.
[9]Li C,Sun P D,Yang C. Emulsion stabilized by starch nanocrystals[J]. Starch/Stärke,2012,64:497-502.
[10]Wege H A,Kim S,Paunov V N,et al. Long-term stabilization of foams and emulsions with in-situ formed microparticles from hydrophobic cellulose[J]. Langmuir,2008,24:9245-9253.
[11]Li C,Li Y X,Yang C,et al. Starch nanocrystals as particle stabilisers of oil-in-water emulsions[J]. Journal of the Science of Food and Agriculture,2014,94:1802-1807.
[12]Yan N Y,Masliyah J H. Effect of pH on adsorption and desorption of clay particles at oil-water interface[J]. Journal of Colloid and Interface Science,1996,181:20-27.
[13]Fomuso L B,Corredig M,Akoh C C. Effect of emulsifier on oxidation properties of fish oil-based structured lipid emulsions[J]. Journal of Agricultural and Food Chemistry,2002,50(10):2957-2961.
[14]Rayner M,Timgren A,Sjöö M,et al. Quinoa starch granules:a candidate for stabilising food-grade Pickering emulsions[J]. Journal of the Science of Food and Agriculture,2012,92(9):1841-1847.
[15]Li C,Li Y X,Yang C,et al. Pickering emulsions stabilized by native starch granules[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,431:142-149.
[16]Donnelly J L,Decker E A,McClements D J. Iron-catalyzed oxidation of menhaden oil as affected by emulsifiers[J]. Journal of Food Science,1998,61(6):997-1000.
[17]Mei L Y,McClements D J,Wu J,et al. Iron-catalyzed lipid oxidation in emulsion as affected by surfactant,pH and NaCl[J]. Food Chemistry,1998,61(3):307-312.
[18]Mancuso J R,McClements D J,Decker E A. The effects of surfactant type,pH,and chelators on the oxidation of salmon oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry,1999,47:4112-4116.
[19]Donnelly J L,Decker E A,McClements D J. Antioxidant activity of a rosemary extract and its constituents,carnosic acid,carnosol,and rosmarinic acid,in bulk oil and oil-in-water emulsion[J]. Journal of Agricultural and Food Chemistry,1996,44:131-135.
Pickering emulsion stabilized by starch nanocrystals modified by esterification and its lipid oxidation stability
LI Chen,YANG Cheng*
(The Key Laboratory of Food Colloids and Biotechnology,Ministry of Education,School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,China)
Starch nanocrystals modified by OSA(OSA-SNC)were prepared by esterification of octenyl succinic anhydride(OSA)and starch nanocrystals(SNC). Taking olive oil as oil phase,the Pickering emulsions stabilized by OSA-SNC were prepared and the effects of OSA-SNC concentration and pH value of aqueous on the stability of emulsions were discussed. Besides,the effects of emulsifier concentration and pH value of aqueous on the lipid oxidation stability of emulsions stabilized by OSA-SNC were also investigated compared to emulsions stabilized by Tween-20. The results showed that the stability of Pickering emulsions were increased with increasing OSA-SNC concentration or pH value of aqueous. The lipid oxidation stability of emulsions stabilized by OSA-SNC was significantly better than that of Tween-20. The POV of emulsions stabilized by Tween-20 was increased while that of OSA-SNC was decreased with increasing emulsifier concentration. The POV of emulsions stabilized by Tween-20 was first decreased and then increased with increasing pH value of aqueous,however,the POV of emulsions stabilized by OSA-SNC was increased with increasing pH value of aqueous.
starch nanocrystals;octenyl succinic anhydride;Pickering emulsion;peroxide value
2015-09-02
李琛(1988-),女,博士研究生,研究方向:应用化学,E-mail:lichenjndx@163.com。
杨成(1970-),男,博士,教授,研究方向:天然高分子,E-mail:cyang@jiangnan.edu.cn。
TS231
A
1002-0306(2016)05-0132-05
10.13386/j.issn1002-0306.2016.05.017
