卵转铁蛋白和乳铁蛋白的氧化稳定性的比较研究
2016-09-10刘建垒
黎 庆,刘建垒,景 浩
(中国农业大学食品科学与营养工程学院,北京 100083)
卵转铁蛋白和乳铁蛋白的氧化稳定性的比较研究
黎庆,刘建垒,景浩*
(中国农业大学食品科学与营养工程学院,北京 100083)
分析比较了卵转铁蛋白(Ovotransferrin,OVT)和乳铁蛋白(Lactoferrin,LF)的氧化稳定性。采用SDS-PAGE、蛋白溶解度、总巯基含量及羰基含量等检测方法,研究了OVT和LF在AAPH(2,2′-azobis(2-amidinopropane)hydrochloride)作用下的结构变化,以及其对ABTS和DPPH自由基的清除率。SDS-PAGE的结果表明:当AAPH浓度为5 mmol/L时,LF在较高分子量区域开始出现新条带;当AAPH浓度为20 mmol/L时,OVT在较低分子量区域(31~43 ku)才出现新条带;随着AAPH浓度进一步增大,OVT和LF主要条带密度明显降低,经AAPH作用后出现的新条带的密度都逐渐增高。当AAPH(20 mmol/L)作用1 h时,LF即在较高分子量区域出现新条带;在4 h时,OVT才在较低分子量区域出现新条带。当OVT和LF的浓度为2 mg/mL时,AAPH(20 mmol/L)可致OVT和LF同时出现新条带;LF随其浓度增大,在较高分子量区域出现的新条带的密度逐渐降低;OVT在4 mg/mL以上时,在较低分子量区域的新长带已不可见。随着AAPH(20 mmol/L)的作用时间延长(1~8 h),OVT和LF的溶解度、总巯基含量均逐渐下降,羰基含量均逐渐升高(p<0.05)。OVT和LF对ABTS和DPPH自由基清除率随着蛋白浓度增大而逐渐增大(p<0.05)。综上所述,LF较OVT更容易被AAPH氧化导致结构改变。
卵转铁蛋白,乳铁蛋白,氧化稳定性,AAPH,结构变化
OVT存在于蛋清中,含量约占蛋清蛋白总量的12%~13%,其分子量为78 ku且包含686个氨基酸残基,等电点为6[1]。LF存在于哺乳动物的乳汁中,人乳中LF含量为2~4 g/L,牛乳中含量为0.7 g/L,LF的分子量为80 ku且包含700个氨基酸残基,等电点为8.0[2-3]。OVT和LF的氨基酸序列、活性中心的三级结构及生物活性都很相似,都具有抗菌性、抗氧化性及免疫调节等活性[1-4]。目前,LF已作为一种补铁食品添加剂改善婴幼儿及孕妇普遍缺铁的状况,在食品中添加LF还可作为一种调节免疫功能保健成分等[5-6]。LF已添加至多种乳制品中,根据GB 2760-2007《食品添加剂使用卫生标准》的规定,在婴儿配方食品、较大婴儿和幼儿配方食品中的LF最大添加量达1.0 g/kg,LF的加入强化了配制食品的营养,使其更加接近于母乳营养[7]。鸡蛋中OVT的含量(12%~13%)远高于牛乳中LF含量(3%~5%),研究表明,贫血模型小鼠服用卵转铁蛋白补铁剂后,OVT能有效减少小鼠体内氧化导致的副作用,减缓机体的细胞损伤,可成为机体有益的成分被吸收和利用[8]。临床实验证明,婴儿服用含OVT的奶粉后,可防止肠炎感染,并无异源蛋白常有的过敏等不良反应[6]。
乳品和蛋品在加工与贮藏的过程中可发生蛋白质的氧化,乳蛋白氧化后不仅改变食品的风味,还导致其理化性质的改变,使得蛋白溶液浑浊度升高,巯基含量减少,羰基含量增加及表面疏水性增大等[9-12]。目前,关于蛋白质氧化对鸡蛋蛋白质尤其是其中的卵转铁蛋白结构和功能的影响,国内外都未见报道。因此,比较研究牛乳中LF和鸡蛋中OVT的氧化稳定性,有助于评价乳品和蛋品在储藏和加工中的质量变化。而目前关于两种蛋白的抗氧化性特点,主要集中于OVT或LF的抗氧化研究[13-14],关于两者氧化稳定性的比较研究还未见报道。
本文采用SDS-PAGE、蛋白溶解度、总巯基含量及羰基含量等检测方法,研究了OVT和LF在AAPH自由基氧化体系中发生的结构变化;采用ABTS和DPPH自由基的清除率等检测方法,研究了OVT和LF本身的抗氧化性,以此综合比较OVT和LF的氧化稳定性。
1 材料与方法
1.1材料与仪器
LF(Lactoferrin,LF,纯度≥95%,铁饱和度10%)由中国农业大学食品科学与营养工程学院任发政教授实验室馈赠;OVT(Ovotransferrin,OVT,Product Code:45BG-99)加拿大Neova公司馈赠(Abbotsford,BC,Canada);牛血清白蛋白第V组分(Bovine serum albumin fraction V,BSA,纯度≥98%,分子量67200 ku,Cat. No. 0332)美国Amresco公司;蛋白质染色液(Dye reagent concentrate,DRC)美国Bio-Rad公司;低分子量标准蛋白Marker(含6种标准蛋白,低分子量从大到小依次为:兔磷酸化酶B 97.4 ku、牛血清白蛋白66.2 ku、兔肌动蛋白43 ku、牛碳酸酐酶31 ku、人生长激素22 ku,批号 201205)中国科学院上海生命科学研究所;2,2-连氮-双-(3-乙基苯并噻唑啉-6-磺酸(2′ 2-azinobis-(3-ethybenzthiazoline-6-sulfonic acid),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-2-picryl-hydrazyl,DPPH)、2,2′-盐酸脒基丙烷(2,2′-azobis(2-amidinopr-opane)hydrochloride,AAPH)美国Sigma公司;其他试剂均为国产分析纯。
CU-420电热恒温水箱上海一恒科学仪器有限公司;HJ-1型磁力搅拌器江苏省金坛市荣华仪器制造有限公司;pHS-3C+型酸度计成都世纪方舟科技有限公司;QL-901型漩涡振荡器海门市其林贝尔仪器制造有限公司;680型酶标仪美国Bio-Rad公司;DYY-8C型电泳仪北京市六一仪器厂;DK-8AXX电热恒温水槽上海一恒科技有限公司;TGL-16 B型台式离心机上海安亭科学仪器厂;UV-1200型紫外可见分光光度计上海美谱达仪器有限公司。
1.2实验方法
1.2.1AAPH致蛋白氧化体系用磷酸盐缓冲液(pH7.4)(Phosphate buffered solution,PBS)的配制浓度为20 mg/mL的OVT和LF溶液及80 mmol/L的AAPH溶液,向15 mL离心管中依次加入0.5~2.5 mL的蛋白溶液、0.625~2.5 mL的AAPH溶液,最后加入PBS至总体积为5 mL。在氧化体系中,AAPH的终浓度为5~40 mmol/L,OVT和LF终浓度为2~10 mg/mL。在40 ℃水浴中温浴0~8 h后,将样品转移到-20 ℃冰柜保存,室温下水浴解冻待测。
1.2.2十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)参考刘建垒等[15]的方法,简述如下,用SDS-PAGE检测经AAPH作用后蛋白样品的结构变化。依次在凝胶板中加入7 mL的12 g/100 mL的分离胶和2 mL的5 g/100 mL的浓缩胶,插入15孔的电泳梳子,凝胶厚度为1 mm。将蛋白样品溶液稀释到2 mg/mL,取20 μL样品溶液与20 μL上样缓冲液(含2 g/100 mL SDS和2%(v/v)β-巯基乙醇,40%(v/v)甘油,0.02 g/100 mL溴酚蓝的Tris-HCl缓冲溶液,pH6.8)混匀,沸水加热5 min,样品未离心,每个上样孔内加样量为9 μL。先将起始电压设为80 V,当样品进入分离胶与浓缩胶交界处时,将电压调到120 V。当溴酚蓝指示剂跑到距胶底部5 mm时(约1.5 h),停止电泳。轻柔剥离胶片后,用考马斯亮蓝R-250染色液染色3 h,用脱色液脱色至条带清晰可见,用相机拍照,分析。在非还原性的SDS-PAGE的上样缓冲液中不加β-巯基乙醇(β-mercaptoethanol,β-ME),其他步骤同上。
1.2.3 溶解度的测定参考刘建垒等[15]的方法,将AAPH作用后的蛋白样品经6313 g离心10 min后,倾倒出上清液于另一1.5 mL的离心管中,去除沉淀。蛋白质含量用Bradford方法测定。吸取未离心的蛋白溶液和上清液各100 μL于96孔板中,加入100 μL的DRC染色液,在室温下充分混匀,静置5 min后,用酶标仪在595 nm下进行比色测定,用PBS作为空白对照。溶解度计算如下:
溶解度(%)=Ps/Pt×100
Ps:离心后的上清液中可溶性蛋白的含量(Soluble protein content,Ps);Pt:原液总蛋白质含量(Total protein content,Pt)。
1.2.4总巯基含量的测定参考刘建垒等[15]的方法,简述如下,所需储备液a.反应缓冲液(Reaction buffer,RB):含1 mmol/L EDTA的0.1 mol/L磷酸盐缓冲溶液,pH8.0;b.变性缓冲液(Denaturing buffer,DB):含6 mol/L盐酸胍,1 mmol/L EDTA的0.1 mol/L Na2HPO4的缓冲溶液pH8.0;c. Ellman’s溶液(Ellman’s reagent solution,ERS):用反应缓冲液配制10 mmol/L(4 mg/mL)的DTNB,现配现用。
用反应缓冲液配制浓度分别为0、0.25、0.5、0.75、1.0 mmol/L的半胱氨酸标准溶液,将样品溶液调pH至8.0。在离心管中分别加入20 μL的Ellman’s试剂溶液和1 mL的变性缓冲液,再依次加入100 μL的半胱氨酸标准溶液和蛋白样品,混匀,室温下暗处放置15 min后,以反应缓冲液(RB)为参比,测定412 nm处的吸光度。以半胱氨酸标准溶液的浓度对其吸光度做标准曲线,进而得到样品溶液的总巯基含量。
1.2.5羰基含量的测定参考刘建垒等[15]的方法,简述如下,取0.4 mL的蛋白样品于1.5 mL离心管中,加入0.4 mL 0.2% DNPH溶液(含2 mol/L HCl),漩涡震荡,充分混匀,对照组加入0.4 mL 2 mol/L的HCl,其余操作相同;将混合液在室温下避光放置10 min,每2 min漩涡震荡一次。加入0.2 mL 100%(m/v)的三氯乙酸(TCA,体系中最终含量为20%(m/v),2000×g离心2 min,小心去除上清液;加入1 mL的乙醇-乙酸乙酯(1∶1,v/v)混合溶液,漩涡震荡,使蛋白分散,立即在5000×g离心2 min,去除上清液,如此洗涤沉淀3次以除去游离的DNPH;再将所得沉淀溶解在1 mL 6 mol/L的盐酸胍(含20 mmol/L K3PO4,pH2.5)溶液中,37 ℃水浴15 min,使蛋白质完全溶解,6000×g离心3 min。以6 mol/L的盐酸胍(含20 mmol/L K3PO4,pH2.5)为空白,在370 nm下测上清液吸光度,并用Bradford法测上清液中的蛋白质的含量。
羰基计算公式按朗伯比尔定律:ΔA=ζbc,其中,ΔA为:A370样品-A370对照,ζ为产物腙的摩尔吸光系数,在此溶液中值为22000(mol/L)-1cm-1,b为比色皿光径,c为羰基浓度,羰基含量用nmol/mg蛋白质表示。
1.2.6ABTS自由基清除率测定参照董学艳等[16]的方法稍作修改,简述如下:将0.5 mL的14 mmol/L ABTS和0.5 mL的4.9 mmol/L过硫酸钾混合,使ABTS和过硫酸钾的终浓度分别为7 mmol/L和2.45 mmol/L。混合溶液在室温、避光条件下静置过夜,形成ABTS工作液,在使用前用水稀释20倍,使其在630 nm波长下的吸光值为0.50±0.02,形成ABTS工作液。在96孔板样品孔中加入10 μL一定浓度的OVT和LF溶液,以及90 μL ABTS自由基溶液(Asample),在颜色对照孔中加入10 μL样品、90 μL PBS作为样品颜色对照(Acontrol),在空白对照孔中加入10 μL PBS、90 μL ABTS工作液(Ablank)。600 r/min下,震荡4 min,在630 nm处读取吸光值(A),带入下式计算:
RSR(%)=[Ablank-(Asample-Acontrol)]/Ablank×100
式中:Ablank、Asample、Acontrol分别为对照孔、样品孔、空白孔在630 nm处吸光值。
1.2.7DPPH自由基清除率测定参照董学艳等[16]的方法稍作修改,简述如下:DPPH自由基工作液制备:称取0.0079 g DPPH溶于10 mL无水乙醇中,配制成浓度为2 mmol/L的储备液,使用前用无水乙醇稀释储备液浓度为0.1 mmol/L的DPPH-乙醇工作液;用PBS分别稀释OVT和LF储备液至浓度分别为0.05,0.1,0.2,0.4,0.6 mg/mL。
在实验组(Asample),取1.5 mL的离心管依次加入0.4 mL的0.1 mmol/L DPPH的乙醇溶液,0.2 mL不同浓度的LF或OVT;空白对照组(Ablank)加入0.4 mL 的0.1 mmol/L DPPH的乙醇溶液、0.2 mL的PBS;样品对照组(Acontrol)加入0.4 mL的乙醇溶液、0.2 mL不同浓度的LF或OVT;摇匀,然后立即混匀37 ℃水浴30 min,将每个离心管中的混合液加入至96孔板中,每个样品4个平行,测定混合溶液在520 nm处的吸光值,共测定3次。清除率按下式计算。
RSR(%)=[Ablank-(Asample-Acontrol)]/Ablank×100
式中:Ablank、Asample、Acontrol分别为对照孔、样品孔、颜色空白孔在520 nm处吸光值。
1.2.8统计分析所有实验均重复三次,结果以均值±标准差(Mean±SD)表示,实验数据采用Minitab 17.1.0软件进行单因素方差分析(one way analysis of variance,one-way ANOVA),进一步用Tukey多重比较确定各组数据间的显著性差异,显著水平为p<0.05。
2 结果与分析
2.1不同浓度的AAPH氧化所致的OVT和LF的结构变化
未经处理的OVT主要呈现一条密度较高的宽大条带,分子量在66.2~97.4 ku间,在较低分子量区域(43~66.2 ku)还出现了密度较低的拖尾条带。当AAPH浓度为5~10 mmol/L时,OVT的条带密度无明显变化;当AAPH浓度为20 mmol/L时,OVT在较低分子量区域(31~43 ku)出现了密度较低的新条带,伴随蛋白主要条带的密度明显降低;当AAPH浓度进一步增大(20~40 mmol/L),OVT在较低分子量区域出现的新条带的密度逐渐增高,蛋白主要条带的密度逐渐降低(图1A)。在非还原性电泳图谱中,未经处理时的OVT条带出现倾斜。当AAPH浓度为5~20 mmol/L时,OVT主要条带密度无明显变化;当AAPH浓度为30 mmol/L时,OVT在较低分子量区域(31~43 ku)才出现密度较低的新条带,伴随蛋白主要条带明显降低;随着AAPH浓度的增大,OVT新条带的密度无明显变化,蛋白主要条带的密度明显降低(图1B)。
未经处理的LF主要呈现一条密度较高的宽大条带,分子量在66.2~97.4 ku间,在较高分子量区域还出现了一条密度较低的条带。当AAPH浓度为5 mmol/L时,LF即在较高分子量区域出现了含有2条密度较低的大范围的弥散条带;随着AAPH浓度的增大(10~40 mmol/L),LF在较高分子量区域出现的新条带的密度逐渐增高,伴随蛋白主要条带的密度明显降低。在非还原性电泳图谱中,当AAPH浓度为5 mmol/L时,LF在较高分子量区域出现了新条带;随着AAPH浓度的增大(10~40 mmol/L),LF新条带的密度逐渐增高,伴随蛋白主要条带的密度明显降低,且新条带的密度较还原性电泳图谱中更高(图1B)。

图1 不同浓度的AAPH氧化所致OVT和LF结构变化的 SDS-PAGE图谱Fig. 1 SDS-PAGE patterns of ovotransferrin and lactoferrin at different concentrations of AAPH注:氧化体系中,AAPH的浓度为0~40 mmol/L,OVT和LF的浓度为2 mg/mL,40 ℃下水浴4 h。每孔加样9 μL。M:Marker(低分子质量标准蛋白)。A:+β-ME(上样缓冲液中添加β-巯基乙醇);B:-β-ME(上样缓冲液中不加β-巯基乙醇)。
AAPH在较高浓度(20 mmol/L)时,才导致OVT条带发生变化,而AAPH在较低浓度(5 mmol/L)即可导致LF条带发生变化。因此,LF较OVT更容易被AAPH氧化导致结构改变。
未处理的OVT在较低分子量区域出现了拖尾条带,可能是蛋白样品中混有较低分子量的杂蛋白,导致拖尾现象发生。当AAPH为20 mmol/L时,OVT在较低分子量区域出现了新条带,表明AAPH氧化导致OVT出现肽链断裂。AAPH产生的烷过氧自由基对谷氨酸和天门冬氨酸残基的攻击,导致氢原子转移,从而引发肽键的断裂。在·OH诱导的脯氨酸残基向2-吡咯烷酮转换过程中,也能发生蛋白质的断裂[17]。在非还原性电泳图谱中,未处理时的OVT条带出现倾斜,可能是标准蛋白中β-巯基乙醇对未加β-巯基乙醇的样品产生了干扰。未经处理的LF出现的高分子量区域的条带可能为LF中的不溶性的杂蛋白。当AAPH为5 mmol/L时,LF即在较高分子量区域即出现新条带,表明AAPH氧化导致LF分子间的交联和聚集。由于还原性电泳中采用β-巯基乙醇能切断蛋白质氧化过程中产生的二硫键,LF在还原性电泳中的高分子量区域还存在部分聚集条带,说明LF经AAPH作用后,形成既含有二硫键也有非二硫键形成的交联物,后者包括疏水相互作用和静电相互作用等非共价键[18]。研究表明,LF氧化形成聚合物的非共价结合位点位于LF铁结合中心位点附近;当受到自由基的攻击,LF结构发生变化,铁结合位点暴露,促进了分子间的非共价结合[11]。
2.2不同时间内AAPH氧化所致的OVT和LF的结构变化
当AAPH(20 mmol/L)作用1 h时,OVT条带相比未处理时无明显变化;在2 h时,OVT主要条带密度明显降低,且OVT在较低分子量区域无新条带的出现;在4 h时,OVT在较低分子量区域(31~43 ku)出现了密度较低的拖尾条带,伴随蛋白主要条带的密度明显降低;当AAPH作用时间进一步延长(6~8 h),OVT在较低分子量区域出现的新条带的密度变化不明显,蛋白主要条带的密度变化也不明显(图2A)。在非还原性电泳图谱中,当AAPH(20 mmol/L)作用4 h时,OVT在较低分子量区域(31~43 ku)出现了密度较低的拖尾条带,伴随蛋白主要条带的密度明显降低;随着AAPH作用时间进一步延长(4~8 h),OVT在较低分子量区域出现的新条带的密度变化不明显,蛋白主要条带的密度逐渐降低(图2B)。
当AAPH(20 mmol/L)作用1 h时,LF在较高分子量区域可见含有2条密度较低条带的大范围的弥散条带,伴随蛋白主要条带的密度明显降低;在2 h时,LF主要条带密度明显降低,在较高分子量区域出现的新条带的密度明显增高;随着AAPH作用时间的延长(4~8 h),LF在较高分子量区域出现的新条带的密度逐渐增高,蛋白主要条带的密度进一步明显降低(图2A)。在非还原性电泳图谱中,LF在较高分子量区域形成的聚集条带的密度较还原性电泳图谱中更高,随着AAPH作用时间延长,蛋白主要条带的密度逐渐降低(图2B)。
当AAPH作用1 h时,即可导致LF条带发生变化,而经AAPH作用2 h时,才导致OVT条带发生变化。因此,LF较OVT更容易被AAPH氧化导致结构改变。

图2 不同时间内AAPH氧化所致的OVT和LF的 结构变化的SDS-PAGE图谱Fig.2 SDS-PAGE patterns of ovotransferrin and lactoferrin during different oxidation time注:氧化体系中,AAPH的浓度为20 mmol/L,OVT和LF的浓度都为2 mg/mL,40 ℃下水浴,分别于0,1,2,4,6,8 h取样,样品都置于-20 ℃条件下冻存待测;每孔加样9 μL。M:Marker(低分子质量标准蛋白);A:+β-ME(上样缓冲液中添加β-巯基乙醇);B:-β-ME(上样缓冲液中不加β-巯基乙醇)。
2.3AAPH体系中改变OVT和LF浓度对其结构变化的影响
在AAPH(20 mmol/L)作用下,OVT浓度为2 mg/mL时,在较低分子量区域(31~43 ku)出现了密度较低的新条带,伴随蛋白主要条带密度明显降低;当OVT浓度为4 mg/mL时,OVT在较低分子量区域的新条带已不可见,蛋白主要条带的密度增高;当OVT浓度进一步增大(4~10 mg/mL),OVT条带密度变化不明显(图3A)。在非还原性电泳图谱中,OVT为2 mg/mL时,蛋白主要条带密度最低;随OVT浓度增大(4~10 mg/mL),OVT主要条带的密度无明显变化(图3B)。
在AAPH(20 mmol/L)作用下,LF浓度为2 mg/mL时,在较高分子量区域出现含有2条密度较低条带的大范围的弥散条带,伴随蛋白主要条带密度明显降低;当LF浓度为4 mg/mL时,LF在较高分子量区域出现的新条带的密度变化不明显,蛋白主要条带的密度明显增高;当LF浓度进一步增大(4~10 mg/mL),LF在较高分子量区域形成的新条带的密度进一步逐渐降低,蛋白主要条带的密度进一步逐渐增高;10 mg/mL时,LF在较高分子量区域形成的新条带依然存在,蛋白主要条带的密度相较未处理时无明显变化(图3A)。在非还原性电泳图谱中,LF在较高分子量区域出现的新条带的密度随LF浓度的增大而逐渐降低,非还原性电泳图谱中聚集条带的密度比还原性电泳图谱中的更高。
在AAPH作用下,蛋白浓度为2 mg/mL时,OVT和LF均出现明显的条带变化;随蛋白浓度增大(4~10 mg/mL),LF在较高分子量区域出现的新条带的密度进一步逐渐降低,而OVT在较低分子量区域的新条带已不可见。因此,LF较OVT对AAPH氧化作用更敏感。

图3 AAPH体系中改变OVT和LF浓度对其结构变化的 SDS-PAGE图谱Fig.3 SDS-PAGE patterns of ovotransferrin and lactoferrin in AAPH system at different concentrations注:氧化体系中,AAPH的浓度为20 mmol/L,OVT和LF的浓度分别为2~10 mg/mL,40 ℃下水浴4 h;上样前,不同浓度的蛋白样品都稀释成2 mg/mL,每孔加样9 μL。OVTO和LFO中O表示original,即未被氧化的OVT和LF,M:Marker(低分子质量标准蛋白);A:+β-ME.上样缓冲液中添加β-巯基乙醇;B:-β-ME.上样缓冲液中不添加β-巯基乙醇。
2.4AAPH氧化所致OVT和LF的物理化学特性的变化
OVT的溶解度随着AAPH(20 mmol/L)作用时间的延长(1~4 h)而逐渐下降,当AAPH作用4 h时,OVT的溶解度相比未处理时下降了8.9%;由4 h延至6 h时,OVT的溶解度再无明显降低;AAPH作用时间延至8 h时,溶解度相比未处理时下降了13.7%。LF的溶解度随着AAPH作用时间的延长(1~4 h)而逐渐下降;当AAPH作用4 h时,LF的溶解度相比未处理时下降了10.2%;由4 h延长至8 h时,其溶解度又逐渐降低;在8 h时,LF的溶解度相比未处理时下降了16.8%。随着AAPH作用时间延长,OVT和LF的溶解度均逐渐下降,两种蛋白的溶解度值相近。
当AAPH(20 mmol/L)作用1 h时,OVT的巯基含量比未经处理时降低了15.4%;由1 h延至2 h时,OVT的巯基含量再无显著下降;由2 h延至4 h时,OVT的巯基含量进一步显著下降;在4 h时,OVT的巯基含量与未处理时相比下降了42.3%;AAPH作用时间延至8 h时,巯基含量比未处理时下降了65.4%。当AAPH(20 mmol/L)作用1 h时,LF的巯基含量比未经处理时下降了15.4%;由1 h延至4 h时,LF的巯基含量再无明显下降;当AAPH作用时间延至8 h时,LF的巯基含量又进一步显著下降,在8 h时,OVT的巯基含量比未经处理时下降了64.3%。随着AAPH作用时间延长,OVT和LF的总巯基含量均逐渐下降。OVT和LF的总巯基含量值及下降程度相近。
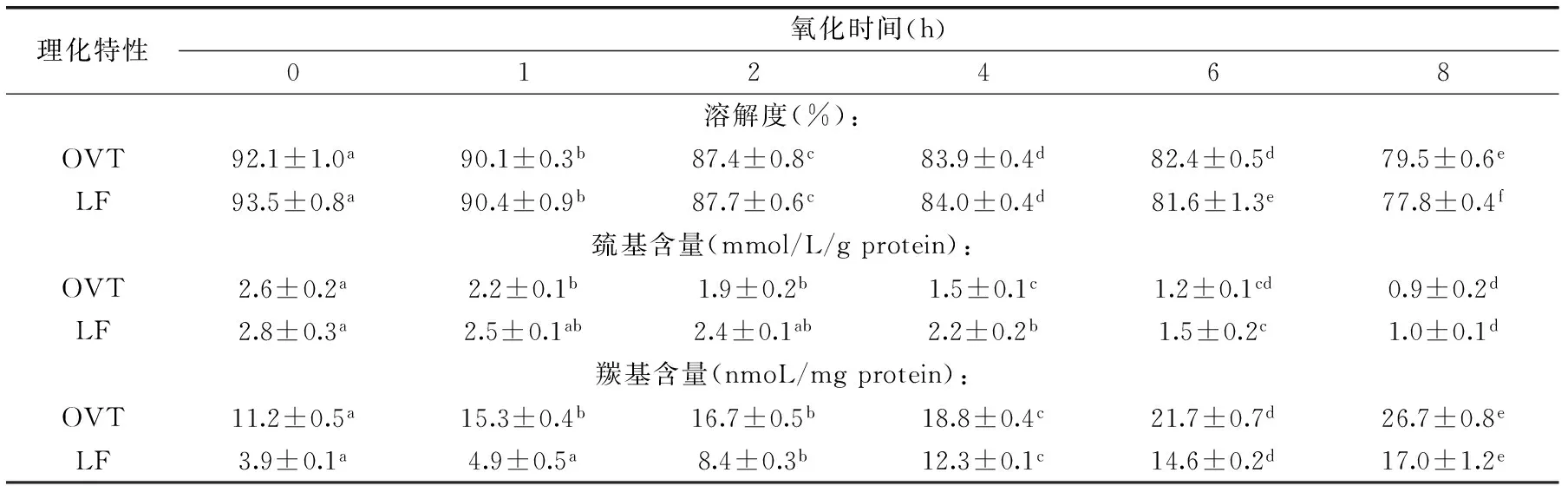
表1 不同时间内AAPH氧化所致OVT和LF的物理化学特性的变化Table 1 Changes in physiochemical properties of ovotransferrin and lactoferrin at different times in AAPH system
注:氧化体系中,AAPH的浓度为20 mmol/L,OVT和LF的浓度分别为6 mg/mL,在40 ℃分别水浴1,2,4,6,8 h,0 h的蛋白为未处理的蛋白溶液。表中数据为平均值±标准差,a~d表示同一行不同数据间差异显著(p<0.05)。
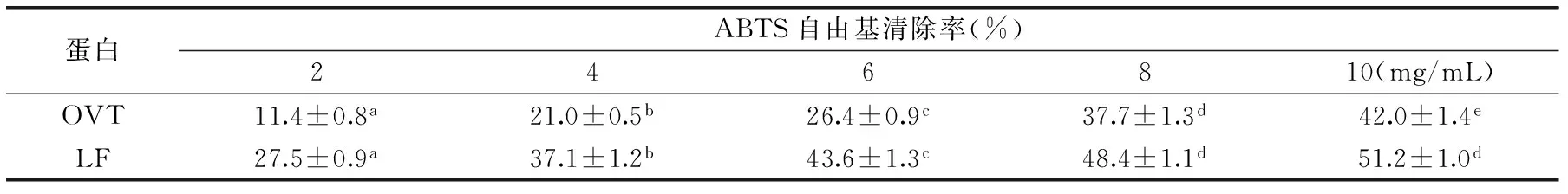
表2 不同浓度OVT和LF对ABTS自由基的清除率Table 2 ABTS radical scavenging rates of ovotransferrin and lactoferrin at different concentrations
注:OVT和LF的浓度分别为2,4,6,8,10 mg/mL,a~e为同一行中不同数据间的差异显著(p<0.05)。

表3 不同浓度OVT和LF对DPPH自由基的清除率Table 3 DPPH radical scavenging rates of ovotransferrin and lactoferrin at different concentrations
注:OVT和LF的浓度分别为0.05,0.1,0.2,0.4,0.6 mg/mL,a~d为表中同一行不同数据间的差异显著(p<0.05)。
当AAPH(20 mmol/L)作用1 h时,OVT的羰基含量比未经处理时升高了36.6%;由2 h延至8 h时,羰基含量逐渐显著升高;在8 h时,OVT的羰基含量比未处理时升高了138%。当AAPH(20 mmol/L)作用1 h时,LF的羰基含量相比未经处理时无明显升高;由2 h延长至8 h时,羰基含量逐渐显著升高;在8 h时,LF的羰基含量比未经处理时升高了340%。随着AAPH作用时间延长,OVT和LF的羰基含量均逐渐升高,OVT的羰基含量出现变化的时间较LF的早,但LF的羰基含量升高幅度比OVT的大。AAPH所致OVT和LF的羰基含量变化方式不同,但OVT与LF相比,其羰基含量更高。
当AAPH浓度为20 mmol/L时,随着其作用时间延长,OVT和LF的溶解度下降程度相近。蛋白质溶解度可用来简单地表征蛋白质氧化聚集和变性程度,低浓度的AAPH使得OVT和LF主要形成可溶性的聚合物,随着蛋白质氧化程度的进一步加大,非共价交联可使得可溶性聚集物进一步发生聚集,最终形成不溶性聚集体,导致氧化后的蛋白质溶解度降低[19]。随着AAPH作用时间延长,OVT和LF的总巯基含量下降程度相近。经AAPH氧化后,蛋白分子的球状结构展开,半胱氨酸残基暴露,被氧化成二硫键,导致氧化后的巯基含量下降[11]。随着AAPH作用时间延长,LF的羰基含量升高程度比OVT的大,LF氧化后羰基含量升高的主要原因可能是氨基酸侧链的直接氧化[20],而OVT羰基含量升高的原因可能是肽链在有自由基存在的条件下发生断裂,其氨基酸残基功能基团与其它蛋白的相关基团(如来自赖氨酸残基的自由氨基)反应生成共价交联生成稳定的羰基衍生物[17]。
2.5OVT和LF的自由基清除率
OVT浓度为2 mg/mL时,其对ABTS自由基的清除率为11.4%;随着OVT的浓度增大(2~10 mg/mL),其对ABTS自由基的清除率逐渐显著增大;当浓度为10 mg/mL时,OVT对ABTS自由基的清除率相比2 mg/mL时升高了270%。LF浓度为2 mg/mL时,其对ABTS自由基的清除率为27.5%,随着LF浓度增大,其对ABTS自由基的清除率也逐渐增大,10 mg/mL时,LF对ABTS自由基的清除率相比2 mg/mL时升高了86.2%。可看出,随着OVT和LF浓度递增,其ABTS自由基清除率也都逐渐显著增大。在相同蛋白浓度下,LF的ABTS自由基清除率均高于OVT的,但随着浓度增大,OVT的ABTS自由基清除率的升高幅度远高于LF的。OVT和LF对ABTS自由基清除的作用特点不同,LF较OVT对ABTS自由基清除率较高。
OVT在浓度为0.05 mg/mL时,其对DPPH自由基的清除率为22.4%;随着OVT浓度的增大,其对DPPH自由基的清除率再无显著增高;0.6 mg/mL时,其对DPPH自由基的清除率相比0.05 mg/mL时升高了70%。LF在浓度为0.05 mg/mL时,其对DPPH自由基的清除率为27.3%;随着LF浓度的增大,其对DPPH自由基的清除率逐渐显著增高,0.6 mg/mL时的DPPH自由基清除率相比0.05 mg/mL时升高了55.3%。可看出,随着OVT和LF浓度递增,其DPPH自由基清除率也都逐渐显著增大。在相同蛋白浓度下,LF的ABTS自由基清除率均高于OVT的,但随着浓度升高,OVT的DPPH自由基清除率的升高幅度高于LF的。OVT和LF对DPPH自由基清除的作用特点不同,LF较OVT对ABTS自由基清除率高。
3 结论
增大AAPH浓度及延长AAPH作用时间均会促进OVT和LF的氧化,增大蛋白的浓度,会减弱AAPH对OVT和LF的氧化作用。AAPH氧化对OVT可导致其肽链的断裂,对LF可导致其分子间的交联和聚集。AAPH氧化使OVT和LF的溶解度下降,总巯基含量减少,羰基含量显著升高。OVT和LF还具有自由基清除作用。OVT和LF对ABTS和DPPH自由基清除率随着蛋白浓度增大而逐渐增大。AAPH在较高浓度时,才导致OVT条带发生变化,而AAPH在较低浓度时,即可导致LF条带发生变化;LF与OVT相比,其条带更易发生变化。在AAPH作用下,蛋白浓度较低时,OVT和LF均出现明显的条带变化;随蛋白浓度增大,LF在较高分子量区域出现的新条带的密度进一步逐渐降低,而OVT在较低分子量区域的新条带已不可见。因此,LF较OVT更容易被AAPH氧化导致结构改变。
[1]Wu J,Acero-Lopez A. Ovotransferrin:Structure,bioactivities,and preparation[J]. Food Res Int,2012,46:480-487.
[2]Gonzalez-Chavez S A,Arevalo-Gallegos S,Rascon-Cruz Q. Lactoferrin:structure,function and applications[J]. Int J Antimicrob Ag,2009,33:301.e1-301.e8.
[3]刘猛,杜明,孔莹莹,等. 牛乳LF的纯化及热处理对其分子特性的影响[J]. 食品科学技术学报,2013,31(2):26-30.
[4]Mazurier J,Metz-Boutigue M H,Jolles J,et al. Human lactotransferrin:molecular,functional and evolutionary comparisons with human serum transferrin and hen ovotransferrin[J]. Experientia,1983,39:135-141.
[5]罗献梅,陈代文,张克英. 乳铁蛋白及其活性肽的营养生理作用及应用前景[J]. 饲料工业,2005,26(2):5-9.
[6]马学会,冯自科,张国磊,等. 乳铁蛋白营养作用[J]. 动物生产,2006,42(5):60-62.
[7]张林田,陈小雪,魏建华,等. 反相高效液相色谱法检测食品添加剂乳铁蛋白[J]. 食品研究与开发,2010,31(8):130-132.
[8]宗艳,赵春贵,黄登宇. 卵铁蛋白铁生物补铁剂对贫血模型小鼠的影响[J]. 药物生物技术,2007,14(3):212-214.
[9]Cui X,Xiong Y,Kong B,et al. Hydroxyl radical-stressed whey protein isolate:chemical and structural properties[J]. Food and Bioprocess Technol,2012,5(6):2454-2461.
[10]Kristo E,Hazizaj A,Corredig M. Structural changes imposed on whey proteins by UV irradiation in a continuous UV light reactor[J]. J Agr Food Chem,2012,60(24):6204-6209.
[11]Brisson G,Britten M,Pouliot Y. Heat-induced aggregation of bovine lactoferrin at neutral pH:effect of iron saturation[J]. Int Dairy J,2007,17:617-624.
[12]崔旭海,孔保华. 蛋白质氧化及其对乳蛋白结构与功能性的影响[J].中国乳品工业,2008,36(1):44-47.
[13] Kim J,Moon S H,Ahn D U,et al. Antioxidant effects of ovotransferrin and its hydrolysates[J]. Poultry. Sci,2012,91:2747-2754.
[14]Wang Y Z,Xu C L,An Z H,et al. Effect of dietary bovine lactoferrin on performance and antioxidant status of piglets[J]. Anim Feed Sci Tech,2008,140:326-336.
[15]刘建垒,景浩. Fenton体系的优化及其对酪蛋白的氧化作用[J].食品科学,2014,35(13):74-79.
[16]董学艳,姚慧芳,景浩,等. 牛血清白蛋白和槲皮素在不同溶剂中相互作用特征及抗氧化性的研究[J].光谱学与光谱学分析,2014,34(1):162-166.
[17]Garrison W M. Reaction mechanisms in the radiolysis of peptides,polypeptides and proteins[J]. Chem Rev,1987,87:381-398.
[18]Grune T,Jung T,Merker K,et al. Decreased proteolysis caused by protein aggregates,inclusion bodies,plaques,lipofuscin,ceroid,and ‘aggresomes’ during oxidative stress,aging and disease[J]. Int J Biochem Cell B,2004,36(12):2519-2530.
[19]吴伟,华欲飞. 蛋白质氧化对大豆蛋白结构和凝胶性质的影响[M].南京:江南大学,2010,3.
[20]Feeney R E,Blankenhorn G,Dixon B F. Carbonyl-amine reactions in protein chemistry[J]. Adv Protein Chem,1975,29:135-203.
Comparison of ovotransferrin and lactoferrin in oxidative stability
LI Qing,LIU Jian-lei,JING Hao*
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
Oxidative stability was compared between ovotransferrin(OVT)and lactoferrin(LF). 2,2′-azobis(2-amidinopropane)hydrochloride(AAPH)was used to induce OVT and LF oxidation,and their chemical and structural changes were assessed by sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE),solubility,contents of total sulfhydryl and carbonyl,and free radical scavenging activity on ABTS(2,2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)and DPPH(diphenyl picryl hydrazinyl radical)free radicals. Results showed that AAPH(5 mmol/L)induced new protein bands of LF at the high molecular weight area,while AAPH(20 mmol/L)induced the new protein bands of OVT at the low molecular weight area on SDS-PAGE. The density of the new protein bands of OVT and LF increased significantly with the increasing of AAPH concentrations,while the density of their original bands decreased significantly. At 20 mmol/L AAPH,the new protein bands of LF appeared at 1 h,while the new protein bands of OVT appeared at 4 h. At 20 mmol/L AAPH,the new protein bands of OVT and LF appeared at 2 mg/mL,and the density of their original bands decreased significantly. The new protein bands of LF decreased gradually from 2 mg/mL to 10 mg/mL,while the new protein bands of OVT disappeared from 4 mg/mL to 10 mg/mL.When OVT and LF were incubated with AAPH(20 mmol/L)for up to 8 h,their solubility and total sulfhydryl content were gradually decreased,and carbonyl content were gradually increased. Scavenging activity of OVT and LF on ABTS and DPPH free radicals was increased with increasing OVT and LF concentrations. In conclusion,LF was oxidized by AAPH easier than OVT that led to their structural changes.
ovotransferrin;lactoferrin;oxidative stability;AAPH;structural changes
2015-08-31
黎庆(1991-),女,硕士研究生,研究方向:蛋白质的结构和功能分析,E-mail: m13011824370@163.com。
景浩(1957-),男,博士,教授,研究方向:营养与食品安全,E-mail:haojing@cau.edu.cn。
“十二五”农村领域国家科技计划课题子课题(2012BAD28B08)。
TS201.2
A
1002-0306(2016)05-0091-07
10.13386/j.issn1002-0306.2016.05.010
