户太八号葡萄酒优势酿酒酵母的选育研究
2016-09-09葛含静杨苗苗陕西学前师范学院生物科学与技术系陕西西安710100
葛含静,杨苗苗(陕西学前师范学院生物科学与技术系,陕西西安710100)
户太八号葡萄酒优势酿酒酵母的选育研究
葛含静,杨苗苗
(陕西学前师范学院生物科学与技术系,陕西西安710100)
为得到西安地区特有葡萄品种——户太八号自然发酵过程中的优势酿酒酵母菌株,首先利用YEPD培养基从其自然发酵各时期的醪液中筛选得到155株酵母菌,再利用WL营养琼脂培养基进行表型鉴定,得到102株酿酒酵母。再经发酵性能和耐受力(酒精度、糖浓度、酸浓度、SO2浓度)的测定,菌株NJ7的发酵指标最好,以其小试发酵户太八号桃红葡萄酒,酒液理化指标与感官评价都优于商品化酿酒酵母D254,具备工业化发酵应用潜力。
酿酒酵母;发酵性能;耐受力
葡萄酒香气成分多达上千种,其中400多种是由酵母菌发酵产生[1]。不同的酵母菌作用各不相同,使葡萄酒具有不同的风味特征,赋予葡萄酒不同的品质及风味,它们是决定葡萄酒质量的重要因素之一[2-3]。酿酒酵母(Saccharomyces cerevisiae)是葡萄酒酿造过程中的主要微生物,可修正酒精发酵过程中的香气成分,还可产生特殊的发酵香气[4]。各种葡萄酒发酵过程中接种的酿酒酵母不同,因而代谢途径有所差异,发酵香气也不同,具有独特的游离香气,使葡萄酒具有各自独特的香气特征[5-7]。然而目前,许多葡萄酒企业大量使用进口活性酿酒酵母,如此一来,虽然葡萄酒的发酵速率和产品质量得以稳定,却导致产品品质同质化严重,大大降低了本土酿酒酵母对葡萄酒香气成分的贡献[8-9]。
西安地区具有规模化的葡萄种植基地,蕴藏着丰富的本土酵母资源。户太八号是西安地区特有的葡萄品种。通过对其自然发酵过程中酿酒酵母特性的研究,选育出优势酿酒酵母菌种,从而为生产地域特色的葡萄酒提供良好的菌种保证。
1 材料
1.1材料
2013年9月中旬从西安市白鹿原葡萄产区采集成熟的户太八号葡萄果实,自然酿造制酒;商品酿酒酵母D254。
1.2培养基
富集培养基[10]:葡萄糖5%,(NH4)2SO40.2%,KH2PO40.25%,MgSO4·7H2O 0.1%,FeSO4·7H2O 0.01%,酵母膏0.05%,灭菌后加Na2SO330 mg/L。如制固体培养基,加琼脂2%。
分离培养基(YEPD培养基):酵母膏1%,蛋白胨2%,葡萄糖2%。如制固体培养基,加琼脂2%。保藏培养基与活化培养基同分离培养基。
WL营养琼脂培养基[11]:酵母浸粉0.4%,蛋白胨0.5%,葡萄糖5%,琼脂2%。无机盐类:KH2PO40.055%,KCl 0.042 5%,CaCl20.0125%,MgSO40.0125%,FeCl30.002 5%,MnSO40.000 25%,溴酚绿22 mg/L,pH5.5。
所有培养基均在121℃高压灭菌15 min后备用。
2 方法
2.1酿酒酵母的筛选
将成熟度良好的户太八号葡萄破碎,装入2个2 L灭菌的发酵瓶中,每瓶装1 200 mL,25℃自然发酵,其中一瓶加入40mg/L SO2作对照,做2组平行试验。在发酵的前、中、后期分别量取酒样10mL,加入到100mL液体富集培养基中,25℃、170 r/min培养24 h,用无菌生理盐水按不同浓度梯度稀释,吸取0.2 mL,均匀涂布于分离培养基平板,25℃培养72 h,选择菌落生长良好且密度适宜的平板,随机挑取10个~20个单菌落进行转接,并多次划线培养以获得纯酵母菌株,保藏于试管斜面,4℃冰箱保存。
将保藏的酵母菌种接种于5 mL YEPD液体培养基,25℃、170 r/min活化24 h,划线接种于WL营养琼脂培养基,25℃培养72 h,观察并记录单菌落特征。根据酿酒酵母在WL营养琼脂培养基上的特殊的菌落特征,筛选出酿酒酵母。
2.2优势酿酒酵母的筛选
初筛:向大试管中加入杜氏发酵管,再加入25 mL新鲜户太八号葡萄汁,灭菌后接入活化的酿酒酵母,并加入40 mg/L SO2,25℃培养。以杜氏管法测定发酵菌株的起酵时间、气味、发酵力以及凝聚性,作为发酵性能的指标。以空白作对照。
复筛:向1 L新鲜户太八号葡萄汁接入3%初筛菌株种子液,并加入40 mg/L SO2,定时摇瓶,25℃恒温培养。以12 h为时间间隔进行称重,直到恒重(失重小于0.2 g/d)即停止发酵。以酒香、酒精度、总酸、凝聚性、总糖以及发酵力作为复筛指标。以空白作对照。
2.3酿酒酵母的耐受力测定
按3%接种量分别向不同无水乙醇浓度(6%、9%、 12%、15%、18%,体积分数)、SO2浓度(50、100、150、200、250 mg/L)、酒石酸浓度(8%、10%、12%、15%、20%)和葡萄糖浓度(100、200、300、400、500 g/L)的10 mL户太八号葡萄汁中接入活化的酿酒酵母菌液,25℃培养48 h,以杜氏管法测定酵母的耐受力。按3%接种量接入复选的酵母菌液,分别于10、15、20、25、30、35℃做发酵试验,全程定时测定发酵速率。以商品化酵母D254为对照。
2.4小试发酵生产户太八号桃红葡萄酒
在装有10 L新鲜户太八号葡萄浆果的发酵罐中按1.0%接种量接种酿酒酵母,筛选出优势菌株,并加入40 mg/L的SO2,25℃温度条件下发酵5 d后进入终止期,酒样经5 000 r/min离心后,测定酒精度、总酸、总糖、单宁、色度、花色苷和总酚的含量;以葡萄酒的滋味、澄清度、酒体香气和酒体的色泽作为葡萄酒的感官指标。以D254作对照。
3 结果与讨论
3.1酿酒酵母的筛选与鉴定
将从户太八号葡萄酒自然发酵过程中筛选的155株酵母菌接种于WL营养琼脂培养基,培养72 h后,筛选出102株在WL营养琼脂培养基平板上呈奶油色,略带淡绿,球形突起,表面光滑,不透明的菌株,具有典型酿酒酵母的形态特征。
大量文献表明,WL营养琼脂培养基对葡萄酒自然发酵过程中的绝大多数酵母菌具有很好的鉴别力[12-15]。更有文献表明,WL营养琼脂培养基对酿酒酵母的鉴别准确度可达100%[16-18]。为了进一步验证鉴定的准确性,从102株上述菌株中随机挑选3株进行5.8S ITS序列鉴定,确定为酿酒酵母。综上,可以确定,通过WL营养琼脂培养基筛选出的102株酵母菌为酿酒酵母。3.2优势酿酒酵母的筛选
对102株酿酒酵母进行初筛,选出起酵快、繁殖力强、发酵性能良好的酿酒酵母菌株NJ1、NJ3、NJ7、NJ12、NJ24共5株,结果见表1(略去弃用的150株酵母菌初筛指标)。

表1 优势酿酒酵母初筛结果Table 1 The results of primarily screening for good Saccharomyces cerevisiae
将这5株酵母进行复筛,结果见表2。
可以看出:SO2对NJ1和NJ24有明显的抑制作用,且它们产酒香气一般,残糖量大,故弃用;NJ12残糖量较大,可能是生长代谢过程中受到了SO2和酒精的抑制,亦弃用;选择残糖量低、酒精度高、发酵力强和产酒香气良好的NJ3和NJ7为最终复筛菌株。
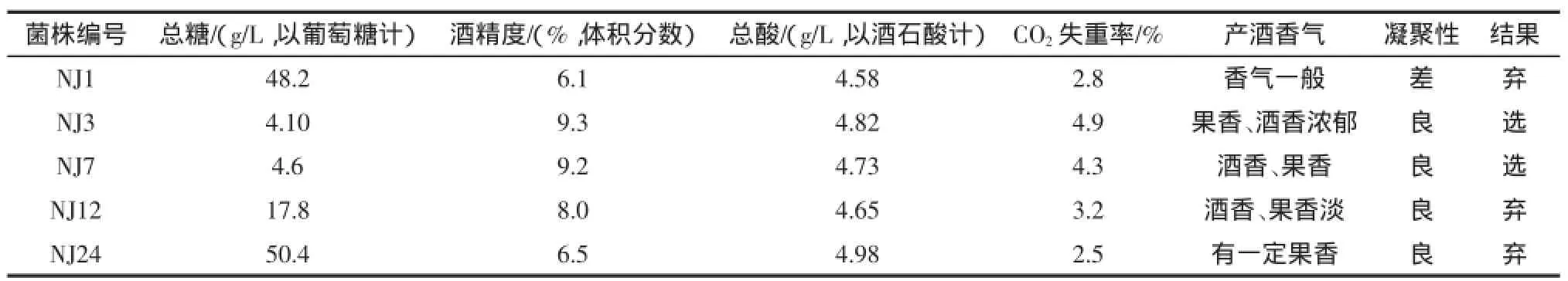
表2 优势酿酒酵母复筛结果Table 2 The results of re-screening for good Saccharomyces cerevisiae
3.3复筛酿酒酵母的耐受性能比较
3.3.1酒精耐受试验
接种16 h后,酒精度对菌株NJ7与D254发酵延迟时间影响不大,但菌株NJ3酒精耐受性能较差,见图1。

图1 复筛酿酒酵母酒精浓度耐受试验Fig.1 Alcohol tolerance tests for re-screening strains and contrast strain D254
由图1可知,酒精度为18%时,发酵完全被抑制;酒精度为15%时,NJ7与D254有极为缓慢的发酵;酒精度在9%~12%时,发酵速率急剧下降;酒精度在6%~9%时,对发酵速率影响不大。工业化葡萄酒酿造过程中酒精度一般为10%~13%,3株菌在此酒精度时均能够持续发酵[19]。
3.3.2糖浓度耐受试验
3株酿酒酵母均有较广的糖浓度耐受范围,见图2。
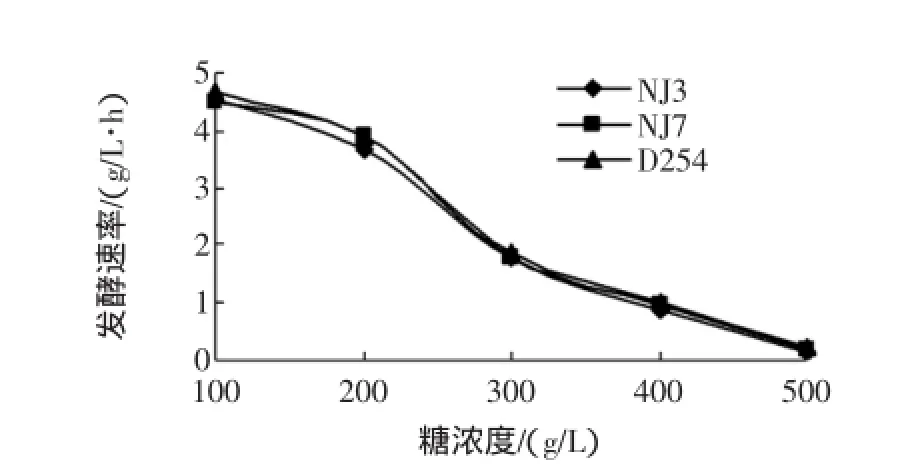
图2 复筛酿酒酵母糖浓度耐受试验Fig.2 Sugar tolerance tests for re-screening strains and contrast strain D254
由图2可知,糖浓度在100 g/L~300 g/L区间,发酵速率均显著降低;当含糖量增加到400 g/L时,发酵延迟,发酵速率减缓,发酵时间增加,发酵受到了明显的抑制;糖浓度为500 g/L时,发酵现象均不明显,发酵受到进一步抑制。因此,3株菌糖耐受性都良好。
3.3.3酒石酸耐受试验
3株酿酒酵母均有较强的酸耐受性能,见图3。
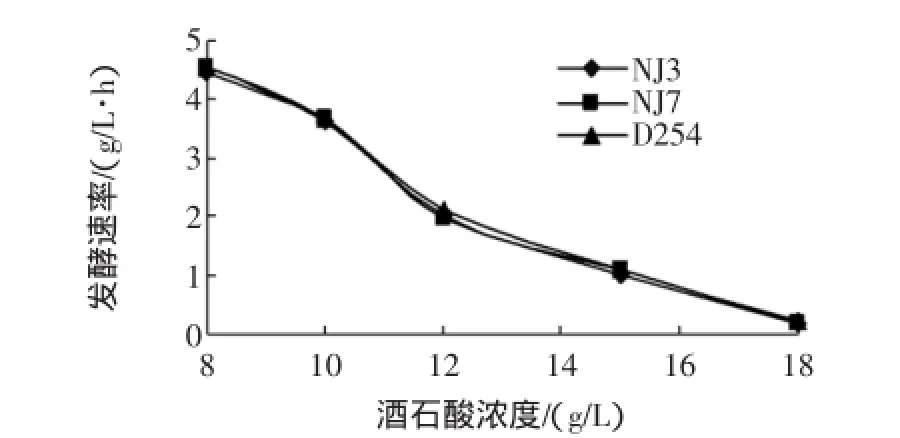
图3 复筛酿酒酵母酒石酸浓度耐受试验Fig.3 Tartaric acid tolerance tests for re-screening strains and contrast strain D254
由图3可知,3株菌起酵时间基本一致;随着酒石酸浓度逐渐增加,3株菌发酵速率均呈逐渐降低趋势;当酒石酸含量在10 g/L~12 g/L时,发酵速率降幅最大。因此,3株酵母的酸耐受性能都较强。
3.3.4SO2耐受试验
3株酿酒酵母对SO2均有较好的耐受性,见图4。
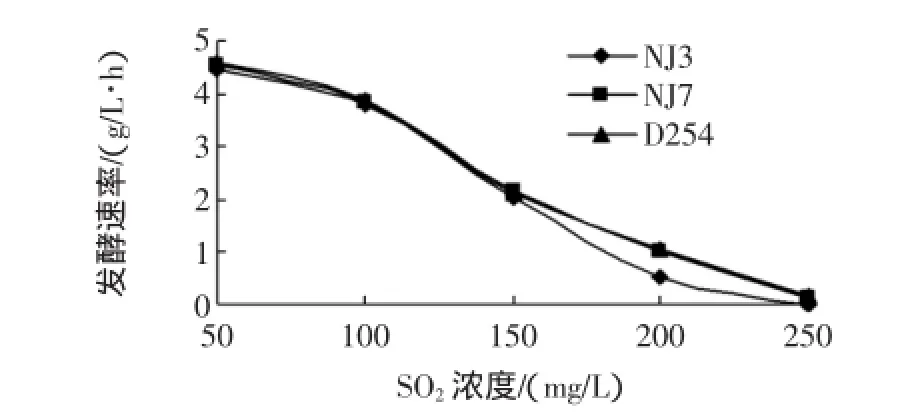
图4 复筛酿酒酵母SO2浓度耐受试验Fig.4 SO2tolerance tests for re-screening strains and contrast strain D254
由图4可知,SO2浓度在50 mg/L~150 mg/L时,起酵时间均随SO2浓度升高而增长,但发酵速率均呈降低趋势;SO2浓度在100 mg/L~150mg/L时,发酵速率急剧降低;SO2浓度达到200 mg/L时,发酵受到明显抑制,发酵速率进一步降低,NJ3发酵速率降幅更快;当SO2浓度为250 mg/L时,发酵几乎完全被抑制;NJ3耐SO2性能较差,其发酵受SO2浓度影响比较明显。然而,SO2在葡萄汁中添加量一般为60 mg/L,3株菌在此SO2浓度下均可持续发酵[20]。
3.3.5温度对发酵速率的影响
3株酿酒酵母的发酵温度范围均较宽,见图5。

图5 复筛酿酒酵母发酵温度试验Fig.5 Fermentation temperature tests for re-creening strains and contrast strain D254
由图5可知,在10℃~35℃温度区间,3株菌均能发酵;10℃时发酵较慢,随着温度逐渐上升,发酵速率均呈上升趋势,在25℃时达到最高,之后陡然下降;在25℃~30℃时,发酵周期相对较短。故,3株菌均有较宽的发酵温度范围,可耐受较高温度。
综合4个耐受性试验和不同温度下发酵性能试验的结果可知:酵母菌种NJ7在酒精耐受试验、耐糖试验、耐酸试验及SO2耐受试验中,综合耐受性能接近D254;酿酒酵母NJ3在耐糖及耐酸方面与NJ7和D254不相上下,但在耐酒精和耐SO2方面明显低于NJ7和D254,故弃用NJ3。最终确定NJ7为优势户太八号葡萄酒酿酒酵母。
3.4小试发酵生产户太八号桃红葡萄酒
酿酒酵母NJ7和D254所酿葡萄酒的理化指标测定结果见表3,感官评定结果见表4。

表3 葡萄酒理化指标Table 3 Properties of wine
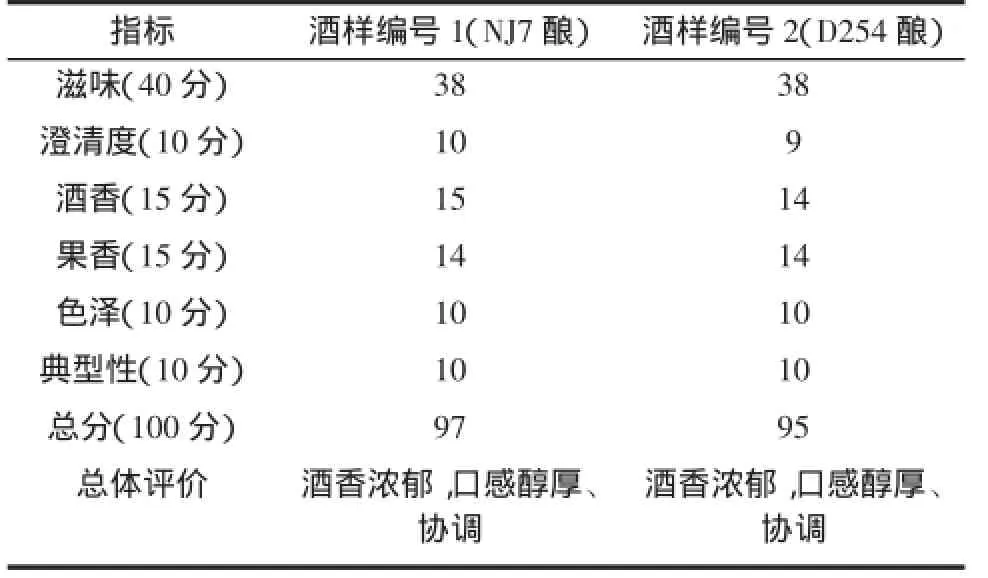
表4 葡萄酒感官评定Table 4 Sensory evaluations of wine
由表3和表4可知:酿酒酵母NJ7与D254发酵所得葡萄酒各项理化指标差异不太显著,除菌株NJ7发酵后酒样的色度和花色苷含量略低于商品酵母D254发酵的酒样,其余理化指标均高于D254发酵的酒样;两者感官评定基本一致。综合分析各指标结果,菌株NJ7的发酵葡萄酒参数高于商品化酵母D254,具有产业化应用价值。
4 结论
从西安产区户太八号葡萄自然发酵醪液中优选出了酿酒酵母NJ7,用于户太八号桃红葡萄酒酿造试验,结果显示酿酒酵母菌株NJ7发酵酒样参数较好,香气浓郁,各项指标接近商品化酿酒酵母,具备工业化葡萄酒酿造应用潜力。
[1]De Lerma N L,Peinado R A.Use of two osmoethanol tolerant yeast strain to ferment must from Tempranillo dried grapes effect on wine composition[J].International Journal of Food Microbiology,2011,145:342-348.
[2] Viana F,Belloch C,Vallés S,et al.Monitoring a mixed starter of Hanseniaspora vineae-Saccharomyces cerevisiae in natural must:Impact on 2-phenylethyl acetate production[J].International Journal of Food Microbiology,2011,151:235-240
[3]Ye M,Yue T,Yuan Y,et al.Production of yeast hybrids for improvement of cider by protoplast electro fusion[J].Biochemical Engineering Journal,2013,81:162-169
[4]Li X,Chan L J,Yu B,et al.Fermentation of three varieties of mango juices with a mixture of Saccharomyces cerevisiae and Williopsis saturnus var.mrakii[J].International Journal of Food Microbiology,2012,158:28-35
[5]Comitini F,Gobbi M,Domizio P,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J].Food Microbiology,2011,28:873-882
[6]Varela C,Torrea D,Schmidt S A,et al.Effect of oxygen and lipidsupplementation on the volatile composition of chemically defined medium and Chardonnay wine fermented with Saccharomyces cerevisiae[J].Food Chemistry,2012,135:2863-2871
[7] Herrero O,Ramon D,Orejas M.Engineering the Saccharomyces cerevisiae isoprenoid pathway for de novo production of aromatic monoterpenes in wine[J].Metabolic Engineering,2008,10:78-86
[8]刘天明,王可,李记明,等.天然酵母菌株对赤霞珠葡萄酒香气构成的影响[J].中国酿造,2010(11):171-174
[9]苑伟,王学锋,刘延琳.优选酿酒酵母菌株发酵性能研究[J].中国酿造,2010(9):48-52
[10]王慧,张立强,刘天明,等.产地葡萄酒优良酵母菌株的筛选及鉴定[J].酿酒科技,2007(9):29-34
[11]Cavazza A,Grando M S,Zini C.Rilevazione della flora microbica dimostie vini[J].Vignevini,1992,9:17-20
[12]程仕伟,韩鹏,赵慧,等.赤霞珠葡萄自然发酵过程中的酿酒酵母筛选及其发酵特性[J].酿酒科技,2015(3):16-19
[13]刘兴艳,潘军,顾一洪,等.四株野生酵母菌株耐受性的研究[J].食品工业科技,2015(1):151-155,167
[14]张珍,韩舜愈,王婧,等.祁连葡萄酒产区葡萄酒相关野生酵母菌株的分离及初步分类[J].食品工业科技,2013(8):179-182
[15]李双石,陈晶瑜,韩北忠,等.中国本土葡萄酒酵母种群多样性分布的研究进展[J].中国酿造,2011(12):4-8
[16]杨莹,徐艳文,薛军侠.WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J].微生物学杂志,2007,27(5):75-78
[17]薛军侠,徐艳文,杨莹.WL培养基在酿酒酵母筛选中的应用[J].中国酿造,2007(9):36-39
[18]赵静静,李艳.沙城产区酿酒酵母多样性研究[J].食品科学,2012,33(5):224-228
[19]Biasi R,Deiana M,Guina T,et al.Wine consumption and intestinal redox homeostasis[J].Redox Biology,2014,2:795-802
[20]Christ K L,Burritt R L.Critical environmental concerns in wine production:an integrative review[J].Journal of Cleaner Production,2013,53:232-242
Screening of Good Saccharomyce scerevisiae from Wine Fermented with No.8 Hutai Grapes
GE Han-jing,YANG Miao-miao (Department of Biology Science and Technology,Shaanxi Xueqian Normal University,Xi'an 710100,Shaanxi,China)
In order to screen good Saccharomyce scerevisiae strain from spontaneous fermentation with No.8 Hutai Grape,which was the unique species in Xi'an.Firstly,155 yeasts strains were isolated with Yeast Extract Peptone Dextrose medium(YEPD medium)during spontaneous fermentation.And then,102 Saccharomyce scerevisiae strains were screened on Wallerstein Laboratory Nutrient Agar(WL agar)by phenotypic identification.Finally,strain NJ7 was screened as good Saccharomyce scerevisiae by tests of fermentation characteristics and tolerance to alcohol,sugar,acid and SO2.Additionally,small-scale volume production of No.8 Hutai wine with strain NJ7 was carried out.The results showed that the wine sample made by strain NJ7 had even better properties and sensory evaluations than the commercial yeast D254,so has potential applications in wine brewing industry.
Saccharomycescerevisiae;fermentationcharacteristics;tolerance
10.3969/j.issn.1005-6521.2016.15.045
陕西学前师范学院博士研究生科研专项项目(2014DS001);陕西省科技厅自然科学基础研究计划项目(2016JQ3036);陕西省科技厅农业科技创新与攻关项目(2016NY-204)
葛含静(1981—),女(汉),讲师,博士,研究方向:粮食工程与发酵技术创新。
2015-04-09
