灰树花多糖的分离纯化及体外抗肝癌作用研究
2016-09-09张媛媛孟梦王明飞王春玲天津科技大学食品工程与生物技术学院教育部食品营养与安全重点实验室天津300457
张媛媛,孟梦,王明飞,王春玲(天津科技大学食品工程与生物技术学院教育部食品营养与安全重点实验室,天津300457)
基础研究
灰树花多糖的分离纯化及体外抗肝癌作用研究
张媛媛,孟梦,王明飞,王春玲*
(天津科技大学食品工程与生物技术学院教育部食品营养与安全重点实验室,天津300457)
利用超声破碎、水提醇沉、葡聚糖凝胶过滤层析等方法,对灰树花子实体多糖进行分离得到多糖组分GFD-1。高效液相色谱分析表明,GFD-1是分子量为29.574 kDa的多糖均一组分。利用显色试验、紫外光谱、红外光谱及原子力显微镜分析,GFD-1为不含还原性羰基、酚羟基、游离或结合蛋白质、核酸类物质的非淀粉类α-吡喃多糖,其糖链高度在0.5nm~1nm。GFD-1能够显著抑制人肝癌细胞HepG2的增殖,并呈剂量依赖关系,IC50为94 μg/mL,但其对于正常肝脏细胞L-02无明显影响;通过AO/EB双染,经GFD-1作用的HepG2细胞呈典型凋亡形态学特征;经流式细胞仪分析,HepG2细胞被阻遏在S期。上述结果可知,初步确定分离纯化的GFD-1是一种具有抗肿瘤活性的均一多糖组分,为开发天然抗肿瘤物质和进一步分析其抗肿瘤作用机制提供了参考。
灰树花;多糖;分离纯化;抗肿瘤
灰树花[Grifola frondosa(Dicks,ex Fr)S.F.Gray],又名贝叶多孔菌、千佛菌、栗子蘑、云蕈、莲花菌等,日本称之舞茸[1],美国称之林鸡,隶属担子菌亚门、层菌纲、非褶菌目、多孔菌科、树花菌属,其肉质脆嫩,味如鸡丝,营养丰富,且含有生物活性物质,能烹调出各种美味菜肴,是近年来开发的一种研究价值的食药两用菌。由于其产量大、栽培简单,目前在全球各地广泛分布[1]。上世纪80年代以来,国内外学者从灰树花菌丝体和子实体中提取了包括MT-2、MD-组分、D-组分、Grifolan、X-组分和LELFD在内的数十种活性多糖,结果表明其具有明显的生理活性[2],主要包括抗肿瘤、抗HIV病毒、降血糖及增强免疫力功能[3-4]等,已成为生物学、药学和食品科学等各研究领域的热点。
肿瘤是严重危害人类生命的疾病,其死亡率仅次于心血管疾病,因此对肿瘤的研究一直是医药学重点内容之一。肝细胞癌(HCC)是死亡的第三大常见原因癌[5],手术仅能治疗很小一部分患者的病症,而如此高的死亡率及低治愈率,使得找到有效预防及治疗肝癌的控制剂变得十分必要。现阶段对灰树花多糖的抗肿瘤活性研究主要集中于肺癌、卵巢癌[6]、膀胱癌等作用;但针对抗肝癌活性研究的报道还较少。本研究分离纯化出一种具有明显抗肝癌(HepG2)活性的均一灰树花多糖组分GFD-1,并集中对其结构和抗肝癌活性进行了研究,为进一步深入研究其构效关系和生物活性提供一定的理论参考。
1 材料与方法
1.1材料与仪器
灰树花子实体:购自浙江庆元黄田食用菌种植基地;人体正常肝细胞L-02:购自中国医科大学,天津科技大学食品卫生与安全研究室保存;人体肝癌细胞株HepG2:天津医科大学馈赠,天津科技大学食品安全与卫生研究室保存。
VECTOR22傅立叶变换红外光谱仪:德国布鲁克仪器公司;LGJ35冷冻干燥机:军事医学科学院实验仪器厂;高效液相色谱仪:日本岛津;TS100倒置相差显微镜:日本Nikon;MK-3酶标仪:Thermo。
1.2试剂
葡聚糖凝胶、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、核糖核酸酶溶液:Sigma;杜尔伯科改良伊格尔高糖培养基:Hyclone;胎牛血:Gibco;碘化丙啶(PI)、溴化乙锭(EB)、吖啶橙(AO):Amresco;其他试剂均为国产分析纯。
1.3方法
1.3.1灰树花子实体多糖的提取
取灰树花子实体烘干、粉碎,将其粉末溶于80℃热水(料液比1∶20,g/mL)超声60 min;90℃热水浸提10 h,将提取液以7 000 r/min离心10 min;重复离心两次收集上清,将溶液浓缩至原溶液体积的2/5~3/5后加入3倍体积80%乙醇,4℃过夜,醇沉;将此溶液7 000 r/min离心20 min,收集醇沉物,经无水乙醇、丙酮、乙醚依次洗涤后冷冻干燥得子实体多糖粗品。
1.3.2灰树花子实体多糖的分离纯化
取灰树花粗多糖溶于水,采用Sevage法脱蛋白,将脱色后的多糖溶液装于超滤杯中,以0.2 MPa左右的压力通过截留分子量为10 kDa的超滤膜,将超滤杯中的溶液继续以0.2 MPa左右的压力通过截留分子量为50 kDa的超滤膜继续超滤,收集两组分即粗略制得分子量在10 kDa至50 kDa多糖溶液。多糖溶液离心,取上清经0.45 μm微孔滤膜过滤。上样于Sephadex-G75色谱柱(26 mm×300 mm),每10 min收集一管,利用苯酚-硫酸法测定各管多糖含量,合并洗脱峰并真空浓缩冷冻干燥,得多糖均一组分(GFD-1)。
1.3.2.1灰树花多糖GFD-1相对分子质量测定
将GFD-1样品制成10mg/mL多糖溶液,用0.22μm的微孔滤膜过滤备用,采用高效凝胶渗透色谱法(HPLC)检测其相对分子质量。选用分离葡聚糖的分子量范围为10kD~80kDa的ShodexOHpakSB-803HQ凝胶色谱柱,以三蒸水为流动相,调整流速为0.8 mL/min,设定柱温30℃,待基线平稳后,上样10 μL,示差检测器检测。
1.3.2.2灰树花多糖GFD-1理化性质的测定
采用斐林试剂反应、双缩脲反应、硫酸咔唑反应、碘反应、三氯化铁反应、苯酚硫酸法对灰树花多糖GFD-1组分进行理化性质的测定分析。
1.3.2.3紫外扫描(UV)
将多糖样品配制成1mg/mL的溶液,在波长190 nm~400 nm范围内进行扫描。
1.3.2.4红外光谱定性分析(IR)[7-8]
将玛瑙研钵用蒸馏水洗净、自然干燥,加入100 mg干燥的KBr研磨成细粉,实验组加入1 mg GFD-1多糖样品混合均匀研磨至2 μm以下的颗粒。在擦拭干净的压片模具里放入研磨好的粉末,将其堆积成中间高、四周低的小山形,加压约15 s制成透明薄片。以纯KBr薄片为空白,测空白背景,再将试样薄片置于光路中,测定样品红外光谱。
1.3.2.5原子力显微镜(AFM)观察GFD-1结构[9]
将云母片表层撕去,用乙醇及超纯水进行清洗、晾干。将多糖样品用超纯水配制成100 μg/mL的溶液点在云母片上,置于干燥器中晾干后,在原子力显微镜下观察并在轻敲模式下记录结果。
1.3.3灰树花多糖GFD-1抗肿瘤活性研究
1.3.3.1细胞体外增殖抑制实验(MTT)[10]
待培养结束后,将96孔板从培养箱中取出,向各孔中加入0.5 mg/mL MTT溶液20 μL,继续置于培养箱中培养4 h后,吸去上清液,每孔加入DMSO 150 μL,充分振荡酶标板使甲臜溶解;用酶标仪检测各孔吸光度A值,检测波长为570 nm,参比波长为630 nm。

式中:A对照组为未经GFD作用的细胞吸光度值;A试验组为利用GFD-1作用细胞组的吸光度值。
1.3.3.2灰树花多糖GFD-1抗肿瘤形态学观察(AO/ EB)双染
细胞培养结束后,用70%的冰乙醇固定15 min,加入等体积混合的AO、EB染色液于37℃避光孵育20 min,用PBS洗去残留染液,沥干液体,盖在载玻片上用LSCM观察细胞形态变化并采集细胞图像。
1.3.3.3流式细胞术分析细胞凋亡率及细胞周期[11]
待培养结束后,用70%冰乙醇4℃固定18 h,用核糖核酸酶溶液(1.0 g/L)在37℃水浴中处理30 min后,加入75 μmol/L碘化丙啶(PI)250 μL,4℃避光染色30 min,流式细胞仪对着色细胞进行分选检测并检测细胞凋亡率,激发波长为488 nm,发射波长为630 nm。
2 结果与分析
2.1GFD-1相对分子质量及纯度鉴定
通过Sephadex G-75葡聚糖凝胶色谱图(图1)结果分析,以苯酚-硫酸法作洗脱曲线,洗脱曲线峰型为单一对称峰,说明GFD-1为均一多糖。

图1 GFD-1葡聚糖凝胶洗脱曲线Fig.1 Sephadex G-75 chromatographic separation of GFD-1
利用高效液相色谱测定GFD-1的分子量范围,结果如图2所示。
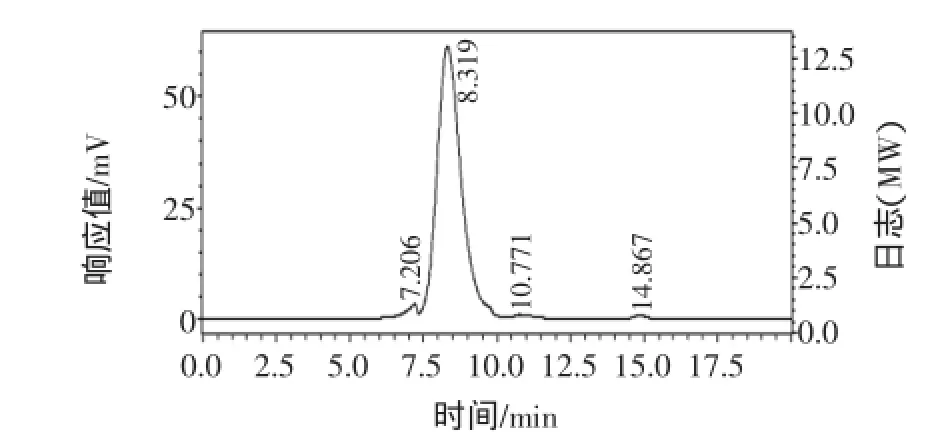
图2 GFD-1高效液相色谱图Fig.2 Analysis and detection of GFD-1 by HPLC
多糖图谱有单一对称主峰,峰面积比为91.57%,进一步证明GFD-1为性质均一的多糖类物质,分子量校正曲线所用标准品为Dextran系列,测得多糖分子量为29.574 kDa。
2.2GFD-1理化性质分析
灰树花多糖GFD-1冷冻干燥后为白色絮状固体,易溶于沸水,可溶于稀酸、稀碱、稀盐溶液,不溶于乙醇、甲醇、氯仿、丙酮、正丁醇等有机溶剂。斐林试剂反应阴性,说明分子中不含有游离态羰基结果;双缩脲反应阴性,证明了不含蛋白质类物质;硫酸-咔唑反应阳性,说明含有糖醛酸;碘-碘化钾反应阴性,说明不含淀粉类物质;三氯化铁反应阴性,说明不含酚类或鞣质;苯酚-硫酸反应阳性,证明为糖类物质。上述显色实验证实,GFD-1为不含有还原性羰基和酚羟基的非淀粉类多糖。
2.3紫外光谱检测
对灰树花多糖GFD-1进行190 nm~800 nm紫外光谱全波长扫描,结果如图3所示。

图3 GFD-1紫外扫描图谱Fig.3 UV scanning of GFD-1
GFD-1在199 nm有最大吸收峰,在260 nm和280 nm均无明显的光吸收,说明GFD-1不含游离结合的蛋白质、核酸类物质,此结果与双缩脲实验结果相吻合。
2.4红外光谱检测
采用傅立叶红外光谱(FT-IR)分析GFD-1的官能团、结构特征、糖残基及其构型情况,结果如图4。
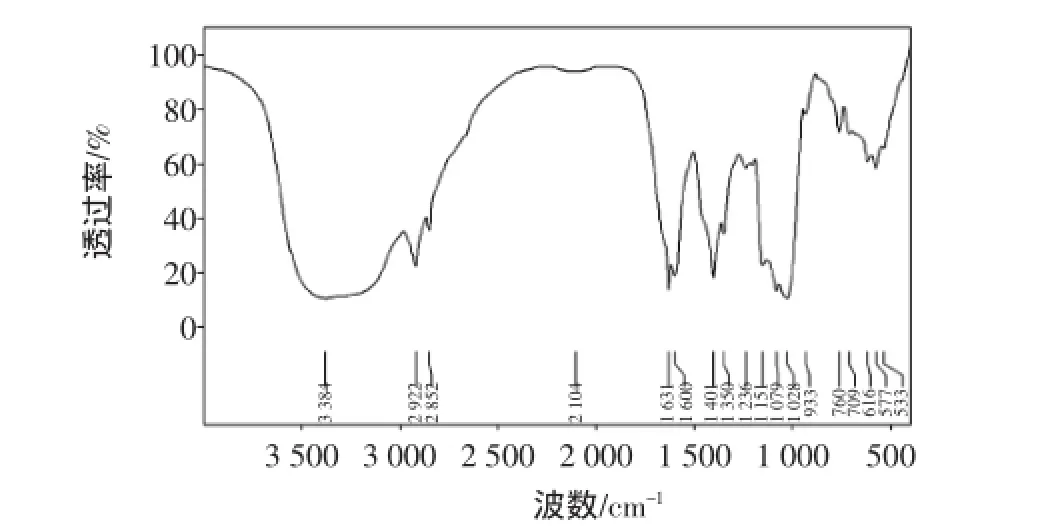
图4 GFD-1红外分析图谱Fig.4 IR spectroscopic analysis of GFD-1
图谱中3 384 cm-1处的宽峰O-H的伸缩振动、2 922 cm-1~2 852 cm-1是C-H的伸缩振动,这一区域的吸收峰是糖类的特征吸收峰;1 700 cm-1~1 775 cm-1处无吸收,表明样品中没有羧基结构,即多糖不含有葡萄糖醛酸,是一种中性糖;1 631 cm-1~1 600 cm-1(C=O)及1 401 cm-1(C-H)处均为多糖的特征吸收峰。1 200 cm-1~1 000 cm-1间比较大的4个峰是C-O伸缩振动,由于呋喃型糖环在此区间上只有两个强吸收峰,说明GFD-1糖环构型为吡喃型;933 cm-1的吸收峰是D型吡喃葡萄糖的非对称环伸缩振动的特征吸收峰;β型糖苷键的吸收峰在890 cm-1左右处,据此推断760 cm-1的吸收峰糖苷键可能为α型,以上说明灰树花多糖GFD-1可能为α-吡喃多糖。
2.5原子力显微镜观察GFD-1
原子力显微镜(AFM)结果如图5所示。

图5 GFD-1的原子力显微镜分析Fig.5 AFM analysis of GFD-1
可以在视野下看到纵横交错的多糖GFD-1分子的多分支链状结构,形成立体多层网状,证明GFD-1具有多糖分子典型的多分支结构;并且根据AFM图可以看出GFD-1是由长度在0.5 nm~1.0 nm左右的糖链组成。
综合上述结果分析可知,实验室分离纯化得到的GFD-1灰树花多糖单一组分为分子量29 574、不含还原性羰基、酚羟基、游离或结合蛋白质、核酸类物质、糖链高度在0.5 nm~1 nm左右的非淀粉类α-吡喃多糖。
2.6细胞体外增殖抑制实验(MTT)
利用浓度10 μg/mL~100 μg/mL的GFD-1作用于细胞48 h后,其MTT实验结果如图6。
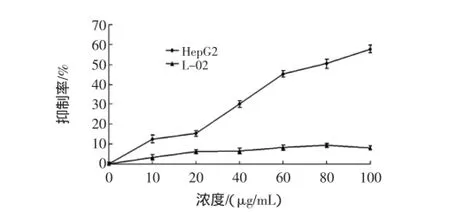
图6 GFD-1对HepG2和L-02的体外抑制作用(MTT)Fig.6 Cell inhibition and proliferation tests of GFD-1 on HepG2 cells and L-02 cells(MTT)
GFD-1可明显抑制HepG2细胞的增殖,且抑制率随浓度的增加而增加,呈剂量依赖关系。而在此浓度范围内,GFD-1对人体正常肝细胞L-02生长抑制较小。以上实验结果表明,GFD-1能特异性地杀灭肿瘤细胞,而对人体正常细胞的毒副作用较小。通过式(1)计算经不同浓度的GFD-1处理细胞48 h后对HepG2细胞的抑制率,利用SPSS软件分析得出其对HepG2细胞的半抑制浓度(IC50)为94 μg/mL。
2.7AO/EB双染检测细胞凋亡
AO染料能透过完整的细胞膜与DNA结合,使细胞呈绿色荧光;EB染料只能透过受损的细胞膜与DNA结合,使细胞核呈橘红色荧光。采用94 μg/mL的GFD-1作用于HepG2细胞AO/EB双染结果如图7所示。

图7 AO/EB双染观察GFD-1诱导HepG2细胞凋亡(40×10)Fig.7 Observation of GFD-1-induced apoptosis in HepG2 cells by AO/EB staining(40×10)
正常细胞(图7A)胞膜完整,细胞被染成均匀的绿色荧光,无凋亡形态改变;经GFD-1作用48 h后,细胞呈晚期凋亡形态:核染色质固缩,被致密浓染成亮绿色或黄绿色荧光,部分细胞胞膜皱缩起泡,即出现凋亡小体(如箭头所示),图中可见部分坏死细胞呈橘红色浓染,细胞核、细胞质界限模糊(如箭头所示)。AO/EB双染结果说明,GFD-1可引起HepG2细胞发生核固缩或核碎裂等特征诱导的细胞凋亡。
2.8流式细胞术分析细胞凋亡率和细胞周期
利用流式细胞仪对GFD-1作用的HepG2细胞进行凋亡率及细胞周期的检测,结果如图8和表1所示。
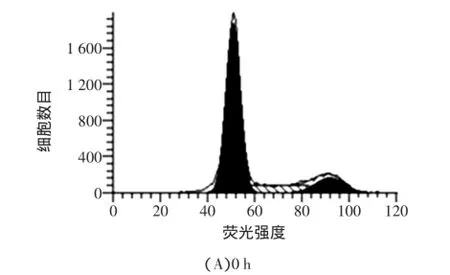

图8 GFD-1对HepG2凋亡率的影响Fig.8 Effect of GFD-1 on apoptosis and cell cycle of HepG2 cells

表1 GFD-1对HepG-2细胞凋亡率及细胞周期影响Table 1 Effect of GFD-1 on apoptosis and cell cycle of HepG2 cells
由检测结果可知,HepG2细胞经94 μg/mL GFD-1处理48 h后,细胞凋亡率从1.89%增加至39.27%,说明GFD-1可以诱导HepG2细胞发生凋亡。通过结果也可以发现,其细胞周期也发生了明显变化,与G0/G1期和G2/M期细胞数比例下降不同,S期细胞数比例从15.82%高至52.18%,由此判定HepG2细胞被阻断在S期。S期在细胞周期中是进行DNA合成的阶段,说明GFD-1致使HepG2细胞不能正常合成DNA,从而抑制HepG2细胞的正常生长增殖。
3 结论
通过水提醇沉、冻干、脱蛋白及超滤分离后经过Sephadex G-75葡聚糖凝胶柱色谱得到灰树花多糖单一组份GFD-1。通过高效液相色谱证明GFD-1为性质均一的多糖类物质,并且测定了多糖分子量。利用显色实验、紫外光谱、红外光谱及原子力显微镜初步分析该均一多糖组分GFD-1为不含还原性羰基、酚羟基、游离或结合的蛋白质、核酸类物质的非淀粉类α-吡喃多糖,糖链高度在0.5 nm~1 nm左右。
细胞体外增殖抑制实验(MTT)表明GFD-1在一定浓度范围内能够显著抑制肝癌细胞株HepG2的生长,并呈时间依赖,IC50为94 μg/mL;用相同浓度GFD-1分别作用HepG2细胞和人体正常肝细胞L-02时,GFD-1对人体正常肝细胞影响较小,即GFD-1可以选择性地抑制肝癌细胞和人体正常细胞。流式细胞术(FCM)检测经GFD-1处理的HepG2细胞发生了S期阻滞,并诱导细胞发生凋亡。通过染色对细胞进行形态学观察发现:GFD-1作用HepG2细胞后,细胞呈现出明显的凋亡形态学改变,即GFD-1能诱导HepG2细胞发生凋亡。
灰树花多糖构效关系有待进一步深入研究,拟在本实验研究基础上,对灰树花多糖的单糖组成及其连接方式等进行后续研究,阐明灰树花多糖的构效关系,从而为灰树花多糖的深度开发利用提供科学参考。
[1]Rout D,Mondal S,Chakraborty I,et al.The structure of a polysaccharide from Fraction-Ⅱof an edible mushroom,Pleurotus florida [J].Carbohydr Res,2006,341(8):995-1002
[2]庞菲.灰树花化学成分及抗肿瘤细胞增殖作用研究[D].上海:华东师范大学,2010
[3]CUI Fengjie,LI Yin,XU Yingying,et al.Induction of apoptosis in SGC-7901 cells by polysaccharide-peptide GFPS1b from the cultured mycelia of Grifola frondosa GF9801[J].Toxicology In Vitro,2007,21(3):417-427
[4]MASUDA Y,ITO K,KONISHI M,et al.A polysaccharide extracted from Grifola frondosa enhances the anti-tumor activity of bone marrow-derived dendritic cell-based immunotherapy against murine colon cance[J].Cancer Immunol Immunother,2010,59(10):1531-1541
[5]Whang Peng J,Cheng A L,Hsu C,et al.Clinical development and future direction for the treatment of hepatocellular carcinom[J].J Exp Clin Med,2010,2(3):93-103
[6]吕耀凤,霍颖倩.灰树花多糖治疗卵巢癌体外实验观察[J].滨州医学院学报,2012,35(4):241-247
[7]阳佛送,李雪华.多糖结构研究的方法和进展[J].食品科技,2008,33(3):200-203
[8]迟桂荣,马歌丽.微生物多糖在食品工业及医药方面的应用[J].山东商业职业技术学院学报,2005,5(4):89-91
[9]Willemsen O H,Snel M,Cambi A,et al.Biomolecular interactions measured by atomic force microscopy[J].Biophysical Journal,2000,79(6):3267-3281
[10]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].Journal of Immunological Methods,1983,1(2):55-63
[11]Seewaldt V L,Kim J H,Parker M B,et al.Dystegulated expression of cyclinD1 in normal human mammary epithelial cells inhibits alltransretinoic acid-mediated G0/G1 phase arrest and differentiation [J].Experimental Cell Res,1999,249(1):70-85
Isolation,Purification and in Vitro Antitumor Activity of Polysaccharides GFD-1 from Grifola frondosa
ZHANG Yuan-yuan,MENG Meng,WANG Ming-fei,WANG Chun-ling
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
A polysaccharide GFD-1 from Grifola frondosa fruiting bodies had been purified by sonication,water extraction,alcohol precipitation and Sephadex gel filtration chromatograp.By HPLC,GFD-1 was a kind of polysaccharide homogeneous components and its molecular weight was 29.574 kDa.The results of the color experiment,ultraviolet spectroscopy,infrared spectroscopy and atomic force microscope analysis illustrated that GFD-1 was a kind of non-starch α-pyran polysaccharide without reductive carbonyl,phenolic hydroxyl,free or a combination protein and nucleic acid;its sugar chain height was 0.5 nm-1 nm.GFD-1 inhibited proliferation of HepG2 cells in a dose-dependent manner,the IC50of GFD-1 was 94 μg/mL;it had no significant effect on the cell viability of humor normal liver L-02 cells.Meanwhile,in the presence of with GFD-1,HepG2 cells showed typical apoptotic morphological features through the AO/EB double staining.Flow cytometry analysis suggested that HepG2 cells were repressed at the phase S by GFD-1.These results showed that GFD-1 purified from Grifola frondosa possesses anti-tumor regulation effect,serving a reference basis to develop natural anticancer drugs and further analyse the anti-tumor mechanism of GFD-1.
Grifola frondosa;polysaccharide;isolationandpurification;antitumoractivity
10.3969/j.issn.1005-6521.2016.15.001
“十二五”国家科技支撑计划(2012BADB33B04);国家自然科学基金(31000768)
张媛媛(1987—),女(汉),博士研究生,研究方向:食品生物技术。
2015-08-27
