中外药物临床试验知情同意书中妊娠告知差异的研究*
2016-09-08徐娜娜陈瑞芳温改艳阳国平黄志军项玉霞中南大学湘雅三医院临床药理中心湖南长沙410013979893427qqcom
徐娜娜,陆 瑶,陈瑞芳,温改艳,阳国平,黄志军,项玉霞,李 莹,袁 洪,彭 艳(中南大学湘雅三医院临床药理中心,湖南长沙410013,979893427@qq.com)
中外药物临床试验知情同意书中妊娠告知差异的研究*
徐娜娜,陆瑶,陈瑞芳,温改艳,阳国平,黄志军,项玉霞,李莹,袁洪,彭艳**
(中南大学湘雅三医院临床药理中心,湖南长沙410013,979893427@qq.com)
目的探讨中外药物临床试验知情同意书中妊娠告知内容和告知形式的差异。方法收集中南大学湘雅三医院伦理委员会近5年审批的中外药物临床试验知情同意书,参考国内外相关法则,归纳知情同意书中妊娠告知的要素标准和告知形式,通过分析要素完整性、各要素告知率及告知形式采用率,比较中外知情同意书中妊娠的告知内容和告知形式的差异。结果本次研究共抽取知情同意书177份,其中中国107份,国外70份。中国知情同意书妊娠告知完整的比例低于国外(19%vs.56%,P=0.000)。与国外相比,中国告知率较低的要素有:妊娠风险研究(32%vs.73%,P=0.000)、随访期妊娠检查(33%vs.56%,P=0.002)和避孕措施(22%vs.53%,P=0.000)。结论中国药物临床试验知情同意书妊娠告知完整性低于国外,其中妊娠风险研究、随访期妊娠检查和避孕措施具有明显的告知缺陷;中国知情同意书妊娠告知形式相比较差。
药物临床试验;知情同意书;妊娠告知
药物临床试验是以人为对象的生物医学研究,必须对受试者的安全和权益予以充分的保障[1]。知情同意书是保障人类受试者各项权利的重要方式,也是研究者履行告知义务的主要形式[2]。知情同意书中对妊娠的告知涉及到孕妇、胎儿等的风险和受益,关乎到受试者,尤其是女性知情同意权等权益的实现,是知情同意书中需充分告知的重要内容[3]。但目前,国内外关于妊娠告知研究较少,关注度较低。因此,本研究调查了2009年11月~2015年1月经中南大学湘雅三医院伦理委员会审批的177份国内外药物临床试验知情同意书,探究中外药物临床试验知情同意书中妊娠告知内容和告知形式的差异,以提升中国药物临床试验对妊娠告知的重视度,完善知情同意书中的妊娠告知。
1 资料和方法
1.1一般资料
收集2009年11月~2015年1月中南大学湘雅三医院伦理委员会审批的中外II~IV期药物临床试验知情同意书共177份,其中中国107份,外国70份。排除了避孕药等生殖系统药物的临床试验知情同意书。
1.2方法
1.2.1研究的依据和法则。
世界医学大会《赫尔辛基宣言》申明医学研究的基本原则必须始终尊重受试者,保护受试者自身的权利;受试者必须对研究项目有充分的了解。国际医学科学组织委员会《人体生物医学研究国际道德指南》规定对于妇女参加的临床研究,申办者或研究者应以妊娠试验确认可能的受试对象未受孕,并在研究开始之前采取有效的避孕方法。在研究前告知试验对受试者本人、受试者的配偶或伴侣的健康或幸福带来的风险,并参考了国内外学者刘沈林[3]、Kristine E. Shield[4]、Murray Joseph Casey[5]等对知情同意书中妇女参加临床试验风险告知、孕妇的纳入与排除和避孕措施告知等的研究。
1.2.2调查内容的设计。
参考以上依据和法则以及国内外相关文献,归纳知情同意书中妊娠告知的八个要素:①早期妊娠风险研究情况;②妊娠妇女不允许参加试验申明;③育龄妇女筛选期妊娠检查;④随访期妊娠检查;⑤受试者进行避孕申明;⑥避孕措施;⑦避孕时间;⑧女性受试者或男性受试者伴侣研究期间怀孕的处理。
分析本次研究的177份知情同意书,总结妊娠告知的三种形式,定义如下:①独立告知:将妊娠作为独立的内容集中进行告知;②分散告知:将妊娠分散于正文的内容中进行告知;③“分散+独立”告知:分散告知并辅以独立的内容用以补充,或独立告知加以分散的内容作为强调。
1.2.3研究的操作流程。
按照以上的设计标准,两个研究员独立进行告知要素和告知形式审查,并将审查结果交于第三方研究员核对,对于核对过程中发现的不一致结果,三个研究员协商裁决。本过程中的研究员均进行了规范的培训并取得GCP证件。
1.2.4调查评价方法。
内容完整性评价:对照以上八个要素,统计每份知情同意书中妊娠要素的数目,将其作为评价完整性的指标:若告知要素达到7~8个,则定义为“完整”,告知5~6个定义为“相对完整”,仅告知0~4个定义为“缺失”。
各要素缺失评价:统计中外知情同意书中每一条要素的告知率,比较各要素缺失情况。
告知形式评价:对照以上三种告知形式,统计中外知情同意书中各告知形式的采用率,比较告知形式差异。
1.2.5统计学方法。
使用SPSS18.0软件进行统计学分析,数据结果用频数(频率)表示,计数资料进行Χ2检验。
2 结果
2.1一般资料
本次研究的中外药物临床试验知情同意书共177份,其中中方107份,国外70份,对双方知情同意书的一般资料(包括临床试验药物类别和剂型)进行统计,结果详见表1,中外试验药物类别和剂型无统计学差异(P>0.05),本次研究的中外知情同意书具有可比性。
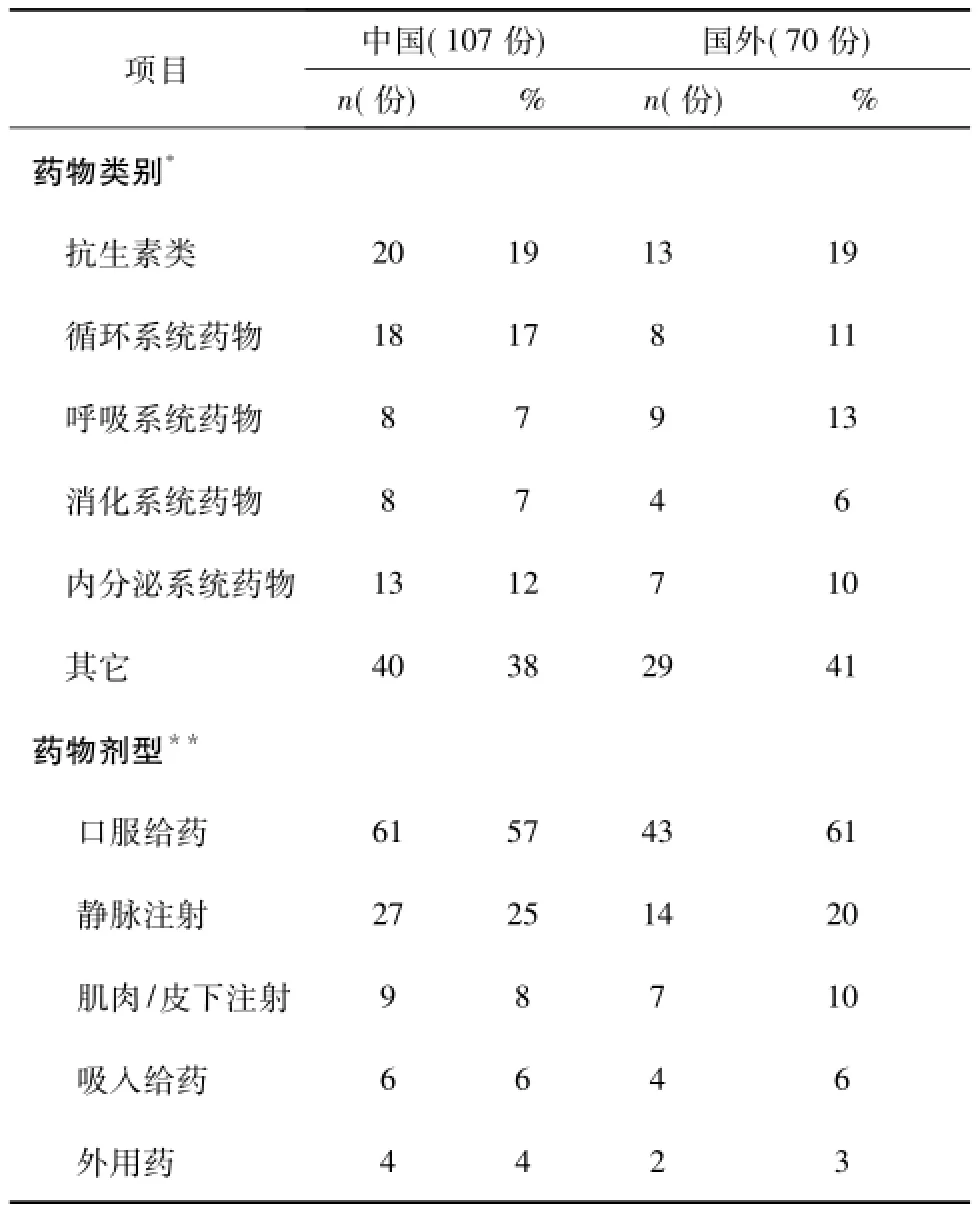
表1 中西方药物临床试验知情同意书的一般资料
2.2中外知情同意书中妊娠告知完整性差异
知情同意书中妊娠告知完整的比例中国为19%,国外为56%;妊娠告知缺陷的比例中国为49%,国外为14%,双方统计学差异较大(P= 0.000)。
对8项要素分别进行统计(结果见表2),中国知情同意书中每条要素的告知率均低于国外,尤其是妊娠风险研究、随访期妊娠检查、避孕措施的告知率非常低,分别为32%、33%、22%,而国外这3项的告知率分别为73%、56%、53%,明显高于中国,中外具有统计学差异(P<0.05)。
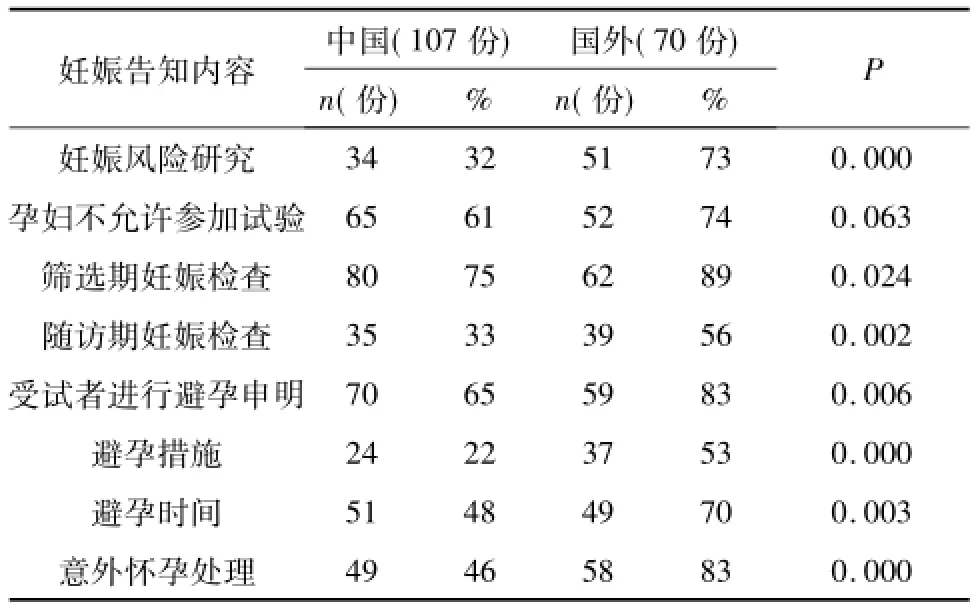
表2 中外知情同意书各项妊娠要素告知率差异
2.3中外知情同意书中妊娠告知形式的差异
中国主要的告知形式为分散告知(58%),而独立告知(5%)和“独立+分散”告知(26%)所占比例较少;国外主要的告知形式为分散告知(44%)和“独立+分散”告知(53%),独立告知仅1.5%,中外所采用的告知形式具有统计学差异(P=0.01)。
3 讨论
3.1知情同意书中妊娠告知的重要性
妊娠不仅仅关乎到女性受试者,也涉及到男性受试者伴侣,是与所有受试者都密切相关的重要告知信息。新药临床试验中大多数药物对孕妇和胎儿具有潜在、未知的风险,Lo和Friedman等[6]调查了美国1980到2000年内批准上市药物的致畸性,表明仅仅6.4%的药物对妊娠妇女是安全的。因此,临床试验中孕妇是否允许参加、针对妊娠该采取哪些措施、女性受试者意外怀孕如何处理等问题都是知情同意书中必须强调的重要内容。妊娠的风险不同于其他不良反应等的风险,具有潜在性和严重性的特点,一旦处理不慎将给孕妇、胎儿带来无法弥补的灾难,同时也会给申办方、研究者等造成巨大的损失[7]。因此,知情同意书中给予充分的妊娠告知,一方面,便于受试者权衡利弊,对是否参加试验做出理性抉择,从而保障受试者权益;另一方面,可避免潜在危害带来的不必要纠纷,也是对研究者和申办方的一种保护[8]。
3.2中国药物临床试验知情同意书中妊娠告知内容的缺陷
知情同意书和伦理委员会的审查是保障药物临床试验过程中受试者权益的主要措施[9]。本次研究结果表明,中国药物临床试验知情同意书中妊娠告知完整性明显低于国外,说明国外研究者在撰写知情同意书时充分考虑了妊娠这一特殊情况,并给予了较大重视;同时,也可说明国外伦理机构对于知情同意书的审查较严格,涵盖了妊娠这一容易被忽视的内容[10]。中国对于妊娠告知缺陷的比例高达49%,其中缺失严重的要素有:妊娠风险研究、随访期妊娠检查和避孕措施,告知率不到40%,明显低于国外。下面针对这三项进行详细讨论:
①在国外,73%的知情同意书明确告知了早期妊娠风险的研究情况,而中国早期妊娠风险的告知率仅为32%。《人体生物医学研究国际道德指南》第16条明确指出[11],知情同意书中对妊娠妇女及胎儿风险的详尽讨论,是使妇女能对参与临床试验做出理性选择的前提。药物在展开临床研究之前应先进行动物试验中的妊娠风险研究,并将风险结果在知情同意书中给予告知,即使前期研究资料不足也应在知情同意书中告知“妊娠风险未知且可能具有潜在致畸性”这一信息。只有当女性受试者充分了解了妊娠的风险,才能合理评估风险和利益,最终做出理性抉择。中国对妊娠风险的告知不充分,严重阻碍了受试者健康、安全和权益的实现。
②随访期妊娠检查可排除试验过程中怀孕的情况,也便于意外怀孕时及时处理,所以在妊娠告知中不可或缺。但是,中外相关文献[12-13]表明研究者、伦理审查机构等对筛查期的早孕检查关注度较高,而对随访期妊娠试验重视不够。这与本研究结果一致:与筛选期妊娠试验相比,中、外对于随访期妊娠试验告知率都较低。加强随访期妊娠检查的告知不仅是中国研究者和伦理委员会需给予关注的问题,也是国际药物临床试验过程中应引起重视的方面。
③知情同意书中是否该对避孕措施进行规定具有一定争议,Toby L.Schonfeld等[14]认为从受试者自主权的伦理角度出发,应使受试者自行选择避孕方式。但是,从受试者安全的角度考虑,由于试验药物等因素的影响,某些避孕方法或避孕药物可能失效或避孕效果降低,从而造成潜在的伤害;从研究者角度出发,未能采取有效的避孕措施导致女性受试者妊娠而退出试验,会加大研究的成本,降低研究的有效性[15],因此,研究者应对避孕方法进行规定。解决这一争议最合理的办法便是:研究者在知情同意书中将试验过程中可使用的有效避孕方法详细罗列出来,然后受试者再根据自身的情况,如身体状况或宗教信仰等进行自主选择,从而达到研究者和受试者在避孕方式选择上的协调统一。西方一半以上的知情同意书告知了避孕措施,而中方告知率仅22%。分析其原因,笔者认为西方的宗教信仰对此起到一定作用,因此在知情同意书中详细告知避孕方式,可有效避免宗教信仰冲突。
3.3中外药物临床试验知情同意书妊娠告知形式差异
药物临床试验知情同意书告知内容较多,信息含量较大,通常按照试验流程分为不同方面进行告知,如试验药物简介、研究性质和目的、研究程序、风险与不适、受益等[16],妊娠告知应贯穿于整个试验过程中,这便是分散告知的一种形式。在妊娠分散告知时,很容易造成这一重要信息湮没于知情同意书繁杂的内容中,导致受试者对于妊娠信息接受不充分,从而违背了知情同意过程中充分理解的原则[17]。为提高妊娠告知的合理性和有效性,可在知情同意书中给予妊娠独立的板块,将其作为单独的方面进行告知,因此,“分散+独立”的告知形式应运而生。在这一告知形式中独立部分并非是分散部分的重复和赘余,相反是对妊娠的强调和补充。可在独立部分详细告知避孕措施、意外怀孕处理等知情同意书中其他部分未能告知的信息。Cathy A.Coyne等[18]对简化的知情同意书进行研究,发现简化的知情同意书降低了受试者们对知情告知内容的理解。Sato K等[19]将详细的知情同意书与标准的知情同意书进行对比分析,结果表明试验者们对详细知情同意书的理解度和满意度均高于标准知情同意书。因此,从充分告知和完全理解的原则[19]考虑,“独立+分散”的告知形式优于独立告知或分散告知,是一种科学、合理的告知形式。
中国研究者在进行妊娠告知时主要采用分散告知的形式,而“独立+分散”的告知形式采用率低;但是国外“独立+分散”告知形式所占比例最高。中国应学习国外,加大“独立+分散”形式告知的比例,完善中国知情同意书中妊娠的告知形式,如此才能在妊娠告知内容完整性一定时,使受试者对妊娠信息的接收度最大化。
4 结论
与国外相比,中国药物临床试验知情同意书在妊娠告知内容和告知形式上都存在欠缺。中国妊娠告知内容完整性低与国外,其中妊娠风险研究、随访期妊娠检查和避孕措施严重缺失;国外的妊娠告知形式优于中国。中国药物临床试验研究者和伦理委员会应借鉴国外,补充妊娠告知内容、完善告知形式,以提升妊娠告知的完整性和科学性,保障受试者权益。
[1]国家食品药品监督管理局.药物临床试验质量管理规范[EB/OL].(2003-08-06)[2015-07-10].http://www.sfda.gov.cn/WS01/ CL0288/24473.html.
[2]郑逸飞,姜柏生,张馥敏,等.论药物临床试验中知情同意权的内涵及保护[J].中国卫生事业管理,2011(4):278-280.
[3]刘沈林,汪秀琴,熊宁宁.临床试验的伦理审查:妇女和孕妇[J].中国临床药理学与治疗学,2006,11(4):477-480.
[4]Kristine E.Shields,Anne Drapkin Lyerly.Exclusion of Pregnant Women FromIndustry-Sponsored Clinical Trials[J].Obstetrics&Gynecology,2013,122(5):1077-1081.
[5]Murray Joseph Casey,Richard O'Brien,Marc Rendell,et al.Ethical Dilemma of Mandated Contraception in Pharmaceutical Research at Catholic Medical Institutions[J].The American Journal of Bioethics,2012,12(7):34-37.
[6]Lo WY,Friedman JM.Teratogenicity of recently introduced medications in human pregnancy[J]. Obstetrics&Gynecology,2002,100(3):465 -473.
[7]Lori Allesee,Colleen M.Gallagher,Pregnancy and Protection:The Ethics of Limiting a Pregnant Woman's Participation in Clinical Trials[J]. Journal of Clinical Research&Bioethics,2011,2(108):1-6.
[8]李莹,临床试验和生物医学实验中人体受试者的保护问题和对策[J].中国医学伦理学,2005,18(2):46-48.
[9]胡晋红.论医学研究知情同意的伦理审查[J].中国医学伦理学,2014,27(2):180-182.
[10]Pramod M.Lad,Rebecca Dahl.Audit of the Informed Consent Process as a Part of a Clinical Research Quality Assurance Program[J].Science and Engineering Ethics,2014,20(2):469-479.
[11]擎燕,熊宁宁,吴静.人体生物医学研究国际道德指南[J].中国临床药理学与治疗学,2003,8(1):107-110.
[12]张育玮,黄艳春,薛立明,等.浅谈药物或医疗器械临床试验过程中的妊娠[J].中国医药生物技术,2015,10(1):87-89.
[13]Toby Schonfeld,Kendra K.Schmid,Joseph S. Brown,et al.A Pregnancy Testing Policy for Women Enrolled in Clinical Trials[J].IRB:Ethics &Human Research,2013,35(6):9-15.
[14]Toby L.Schonfeld,N.Jean Amoura,Julie A. Stoner,et al.Women and Contraception in Research:A Pilot Study[J].Journal of Women's Health,2009,18(4):507-512.
[15]William D.Winkelman,David I.Shalowitz,Typical-Use Contraception andPharmaceutical Research[J].The American Journal of Bioethics,2012,12(7):42-43.
[16]周鹍,刘文娜,石磊.临床研究中知情同意书的设计与应用[J].现代药物与临床,2010,25(3):183-185.
[17]赵西巨.知情同意:要素构成与过程优化[J].中国医学伦理学,2005,18(3):13-17.
[18]Cathy A.Coyne,Ronghui Xu,Peter Raich,et al. Randomized,Controlled Trial of an Easy-to-Read Informed Consent Statement for Clinical Trial Participation:A Study of the Eastern Cooperative Oncology Group[J].Journal of Clinical Oncology,2003,21(5):836-842.
[19]Sato K,Watanabe T,Katsumata N.Satisfying the needs of Japanese cancer patients:a comparative study of detailed and standard informed consent documents[J].Clinical Trials,2014,11(1):86-95.
〔修回日期2016-01-03〕
〔编辑曹欢欢〕
Study on the Differences of Pregnancy Informs between Chinese and Foreign Informed Consent Form in Drug Clinical Trial
XU Nana,LU Yao,CHEN Ruifang,WEN Gaiyan,YANG Guoping,HUANG Zhijun,XIANG Yuxia,LI Ying,YUAN Hong,PENG Yan
(Clinical Pharmacology Center,The Third Xiangya Hospital of Central South University,Changsha 410013,China,E-mail:979893427@qq.com
)
Objective:To explore and discuss the differences of pregnancy contents and inform formats in informed consent form(ICF)for the drug clinical trial between China and foreign countries.Methods:We collected Chinese and foreign ICFs for drug clinical trial that had been audited by the Ethics Committee of the third Xiangya Hospital for the past five years.Based on the relevant domestic and foreign law,we concluded the element standards and inform formats about pregnancy inform.By analyzing the integrity of the whole elements,the inform rate of every element and the using rate of every inform format,we compared the differences of pregnancy contents and inform formats between Chinese ICFs and foreign ICFs.Results:The total number of ICFs was 177 in this study,including 107 Chinese ICFs and 70 foreign ICFs.The integrity rate of pregnancy in Chinese ICFs was statistically lower than them in foreign ICFs(19%vs.56%,P=0.000).Compared with foreign ICFs,the low informed elements were the study of the pregnancy risk(32%vs.73%,P=0.000),the pregnancy test during the following -up period(33%vs.56%,P=0.002)and the measurements for contraception(22%vs.53%,P=0.000). Conclusion:The integrity level of pregnancy content in Chinese ICFs was lower than that of the foreign ICFs.And the three elements including pregnancy risk study,pregnancy test during the following-up period and measurements for contraception was obviously defected.Pregnancy informing forms of informed consent in China was inferior to abroad.
Drug Clinical Trial;Informed Consent Form;Pregnancy Inform
R-052
A
1001-8565(20165)02-0293-05
2015-10-27〕
