人参炔醇抑制胰腺癌干细胞的增殖及自我更新
2016-09-08黄文斯王颖朱丽宋廉刘嫣方张礼荣周月鹏王冬青朱海涛
黄文斯 王颖 朱丽 宋廉 刘嫣方 张礼荣 周月鹏 王冬青 朱海涛
人参炔醇抑制胰腺癌干细胞的增殖及自我更新
黄文斯王颖朱丽宋廉刘嫣方张礼荣周月鹏王冬青朱海涛
目的探讨人参炔醇对胰腺癌干细胞增殖及自我更新的影响。方法胰腺癌PANC1细胞在干细胞体系培养液中培养成干细胞,用流式细胞术检测胰腺癌干细胞的CD133+细胞比例。以72、144、287 nmol/L人参炔醇处理干细胞12、24、48 h,采用CCK8法检测细胞成活率;通过克隆形成实验观察287 nmol/L人参炔醇处理胰腺癌干细胞48 h后的集落数量;采用蛋白质印迹法检测细胞增殖相关蛋白Ki67、PCNA及自我更新相关蛋白β-catenin的表达。结果经干细胞培养体系培养的胰腺癌PANC1细胞的CD133+细胞比例为(9.70±0.59)%,显著高于常规培养对照组的(2.11±0.25)%,差异有统计学意义(P<0.001)。人参炔醇呈浓度及时间依赖性减少胰腺癌干细胞的存活率,对照组及72、144、287 nmol/L人参炔醇处理48 h组细胞的存活率分别为100%、(63.32±2.37)%、(49.91±2.13)%、(41.37±2.01)%,差异有统计学意义(P<0.001);对照组及287 nmol/L人参炔醇处理48 h组细胞的集落形成数分别为(611±25)、(280±16)个,人参炔醇处理组集落形成数显著减少,差异有统计学意义(P<0.001);对照组细胞Ki67、PCNA、β-catenin表达量分别为0.376±0.012、0.772±0.026、0.219±0.018,人参炔醇处理组分别为0.183±0.010、0.453±0.009、0.148±0.006,处理组的蛋白表达量均较对照组显著下降,差异有统计学意义(P值均<0.001)。结论人参炔醇可抑制胰腺癌PANC1干细胞的增殖及自我更新,其机制可能与下调Ki67、PCNA表达,阻断Wnt/β-catenin信号通路有关。
胰腺肿瘤;干细胞;人参炔醇;细胞增殖
Fund program:National Natural Science Foundations of China(81502663);Social Development Projects of Jiangsu Province(BE2015668);Natural Science Foundations of the Higher Education Institutions of Jiangsu Province(14KJD310001);Jiangsu University Clinical Key Special Funds(JDLCZX005);Zhenjiang Social Development Projects(SH2014053)
胰腺癌是消化道恶性肿瘤之一,其预后差,且易复发,因此成为当今医学上治疗较棘手的疾病[1-4]。尽管现在放、化疗都在普遍应用,但胰腺癌患者的5年生存率仍低于5%,平均生存期也只有4~6个月[5-7],因此寻找胰腺癌的致病因素并予以解决至关重要。有研究表明,干细胞与胰腺癌的发生、预后及治疗的抵抗性密切相关[8]。故针对胰腺癌干细胞的治疗或许能成为治疗胰腺癌的切入点。人参炔醇具有细胞毒性,通过对细胞周期的阻滞从而达到抗肿瘤作用[9]。本研究观察人参炔醇对胰腺癌干细胞的增殖及自我更新能力的影响,探讨其成为新的治疗胰腺癌药物的可能性。
材料与方法
一、材料
人胰腺癌细胞株PANC1购自中科院上海细胞研究所。人参炔醇(纯度>98%)购自上海亿林生物科技有限公司,CCK8试剂盒购于南京诺维赞生物技术公司,结晶紫由江苏大学实验室友情提供,FBS、B27、EGF、bFGF均购自GIBCO公司,抗Ki67、PCNA、β-catenin、β-actin抗体及二抗均购于武汉博士德生物工程有限公司。
二、方法
1.干细胞培养及鉴定:PANC1细胞复苏后常规培养至对数生长期,将有血清培养液换为无血清DMEM-F12培养液,待细胞贴壁后换为含B27(与培养液容积比为1∶50)、10 nmol/ml EGF、20 nmol/ml bFGF无血清培养液,每隔3 d换1次,7 d传代1次。此为干细胞组。
CD133为干细胞的表面标志物,故检测CD133+细胞以鉴定干细胞。取培养3周的胰腺癌干细胞用胰酶消化,用含10% FBS的DMEM-F12培养液中和后1 000 r/min离心5 min,PBS洗涤两遍,细胞悬浮于200 μl PBS,加入2 μl CD133抗体,4℃避光孵育30 min,1 000 r/min离心5 min,PBS洗涤后上流式细胞仪检测CD133+的胰腺癌干细胞比例,以常规培养的PANC1细胞作为对照组。
2.细胞增殖检测:收集干细胞组细胞,接种于96孔板,每孔5×103个细胞,常规培养24 h后分别加入72、144、287 nmol/L的人参炔醇,以未加人参炔醇处理的干细胞作为对照组,分别培养0、12、24、48 h,每组每时间点设5个复孔。培养到时间点时各孔加入1/10培养液容积的CCK8,混合后置37℃、5% CO2的细胞培养箱避光孵育1 h,上酶标仪测各孔在波长450 nm的吸光度值(A450值)。以对照组细胞成活率为100%,计算人参炔醇处理组的细胞成活率。
3.克隆形成实验:收集干细胞组细胞,接种于6孔板中,培养24 h后加入287 nmol/L人参炔醇2 ml继续培养48 h。收集细胞,再以每孔1 000个细胞接种于6孔板中培养2周,以未加人参炔醇处理的干细胞作为对照组。培养结束后用PBS洗涤2次,结晶紫染色5 min,再用PBS洗涤2次,肉眼直接计数。
4.Ki67、PCNA、β-catenin蛋白表达检测: 取经287 nmol/L人参炔醇处理48 h的胰腺癌干细胞及未处理的对照组干细胞,应用细胞裂解液裂解提取细胞蛋白,定量后取40 μg常规行蛋白质印迹法检测细胞Ki67、PCNA、β-catenin蛋白表达,以β-actin作为内参。抗Ki67、PCNA、β-catenin抗体工作浓度1∶1 000,稀释的辣根过氧化物酶标记的二抗工作浓度1∶2 000。最后用ECL化学发光,X片曝光、显影、定影。采用WB灰度扫描软件获取条带灰度值,以目的条带与内参条带的灰度值比表示蛋白相对表达量。
三、统计学处理
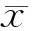
结 果
一、胰腺癌干细胞的比例
贴壁的胰腺癌PANC1细胞在干细胞培养体系培养后,逐渐形成类球形悬浮的胰腺癌干细胞团(图1)。干细胞组、对照组胰腺癌PANC1细胞中CD133+干细胞比例分别为(9.70±0.59)%、(2.11±0.25)%,干细胞组显著高于对照组,差异有统计学意义(t=-20.557,P<0.001,图2)。
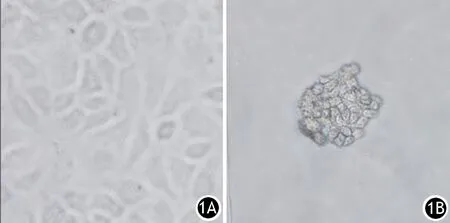
图1 对照组(1A)、干细胞组(1B)培养3周的细胞
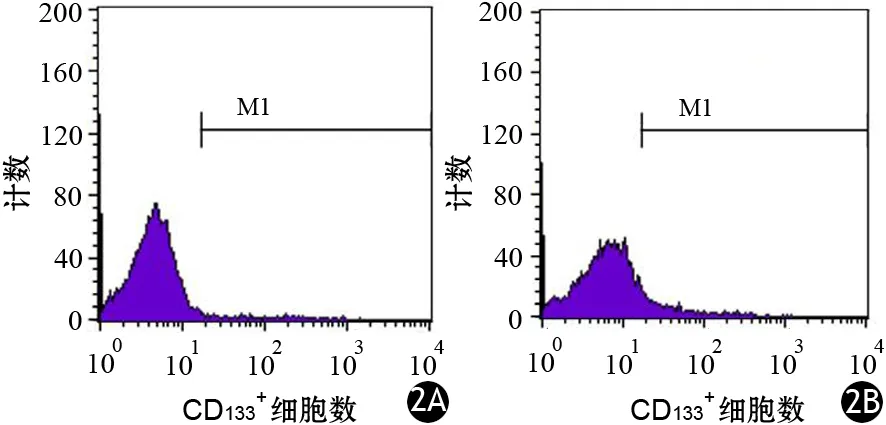
图2 对照组(2A)、干细胞组(2B)CD133+细胞(流式细胞术)
二、人参炔醇对胰腺癌干细胞增殖的影响
人参炔醇呈浓度及时间依赖性抑制PANC1干细胞的增殖,以287 nmol/L人参炔醇处理48 h的增殖抑制作用最显著(表1)。
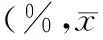
表1 不同浓度人参炔醇处理后干细胞的生存率±s)
注:与对照组比较,aP<0.05
三、人参炔醇对胰腺癌干细胞集落形成的影响
对照组、人参炔醇处理组细胞集落形成数分别为(611±25)、(280±16)个。人参炔醇处理后集落形成数显著减少,差异有统计学意义(t=11.640,P<0.001,图3)。

图3 对照组(3A)、人参炔醇处理组(3B)的细胞集落
四、人参炔醇对细胞Ki67、PCNA、β-catenin蛋白表达的影响
对照组细胞增殖及自我更新相关蛋白Ki67、PCNA、β-catenin表达量分别为0.376±0.012、0.772±0.026、0.219±0.018,人参炔醇处理组分别为0.183±0.010、0.453±0.009、0.148±0.006,处理组的蛋白表达均较对照组显著下降,差异有统计学意义(t值分别为20.682、17.061、5.881,P值分别为<0.001、<0.001、<0.01,图4)。
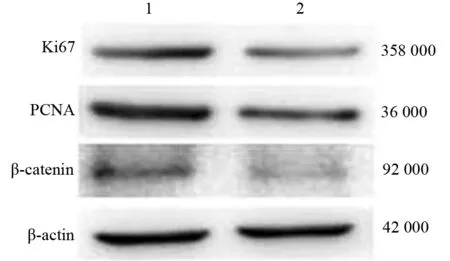
图4对照组(1)、干细胞组(2)Ki67、PCNA、β-catenin蛋白表达(蛋白质印迹法)
讨 论
肿瘤干细胞占肿瘤细胞总数的0.01%~2.00%,其具有多分化潜能、自我更新和高致瘤等特性,在肿瘤的发生、发展及复发中起关键作用[10]。由于肿瘤干细胞对化疗及放疗有抵抗性,所以针对肿瘤干细胞的治疗可能是临床上治疗肿瘤的一个切入点[11]。胰腺癌干细胞被认为可能是胰腺癌转移和耐药的决定因素,诱导胰腺癌干细胞失去自我更新能力有可能预防胰腺癌的发生和发展[12]。CD133+细胞具有高成瘤性、自我更新和多向分化的干细胞特性,故CD133+细胞提示为胰腺癌干细胞[13]。
人参炔醇是聚乙炔醇类化合物的一种[14],具有抗癌、抗菌和神经保护作用,其对恶性细胞的亲和性较正常细胞更强,所以对恶性细胞的生长抑制作用更强[15]。
本研究应用人参炔醇处理胰腺癌干细胞,结果显示人参炔醇呈浓度及时间依赖性抑制胰腺癌干细胞的增殖,细胞克隆形成数量显著减少,提示人参炔醇能显著抑制肿瘤干细胞的增殖及自我更新能力。
Ki67及PCNA蛋白是评判肿瘤分级与预后的参考物,也是肿瘤增殖的有效标志物[16-18]。β-catenin是Wnt/β-catenin信号通路中的关键蛋白,而Wnt/β-catenin信号通路在干细胞的自我更新过程中发挥重要作用。本研究结果显示,人参炔醇处理后胰腺癌干细胞Ki67、PCNA及β-catenin表达量显著降低,进一步证实人参炔醇对胰腺癌干细胞的增殖及自我更新具有抑制作用。
[1]Bao B, Wang Z, Ali S, et al. Notch-1 induces epithelial-mesenchymal transition consistent with cancer stem cell phenotype in pancreatic cancer cells[J]. Cancer Lett, 2011, 307(1): 26-36. DOI: 10.1016/j.canlet.2011.03.012.
[2]Yin T, Wei HJ, Gou SM, et al. Cancer stem-like cells enriched in panc-1 spheres possess increased migration ability and resistance to gemcitabine[J]. Int J Mol Sci, 2011, 12(3): 1595-1604. DOI: 10.3390/ijms12031595.
[3]张太平,曹喆,赵玉沛.胰腺癌的化疗与放疗[J].中华消化外科杂志,2015,14(8):619-622.DOI:10.3760/cma.j.issn.1673-9752.2015.08.006.
[4]杨尹默.胰腺癌外科治疗的热点与难点[J].中华消化外科杂志,2015,14(8):612-614.DOI:10.3760/cma.j.issn.1673-9752.2015.08.004.
[5]Bapat AA, Hostetter G, Von Hoff DD, et al. Perineural invasion and associated pain in pancreatic cancer[J]. Nat Rev Cancer, 2011, 11(10): 695-707. DOI: 10.1038/nrc3131.
[6]Vincent A, Herman J, Schulick R, et al. Pancreatic cancer[J]. Lancet, 2011, 378(9791):607- 620. DOI: 10.1016/S0140-6736(10)62307-0.
[7]Conroy T, Gavoille C, Adenis A. Metastatic pancreatic cancer: old drugs, new paradigms[J]. Curr Opin Oncol, 2011, 23(4): 390-395.DOI: 10.1097/CCO.0b013e3283473610.
[8]Fitzgerald TL, McCubrey JA. Pancreatic cancer stem cells: Association with cell surface markers, prognosis, resistance, metastasis and treatment[J]. Adv Biol Regul, 2014, 56: 45-50. DOI: 10.1016/j.jbior.2014.05.001.
[9]Nie BM, Yang LM, Fu SL, et al. Protective effect of panaxydol and panaxynol on sodium nitroprusside-induced apoptosis in cortical neurons[J]. Chem Biol Interact, 2006, 160(3): 225-231. DOI:10.1016/j.cbi.2006.02.001.
[10]李德冠, 王小春, 孟爱民. 肿瘤干细胞靶向治疗[J]. 中国药理学通报, 2009, 25(6): 701-703. DOI:10.3321/j.issn:1001-1978.2009.06.001.
[11]Zhao RC, Zhu YS, Shi Y. New hope for cancer treatment: exploring the distinction between normal adult stem cells and cancer stem cells[J]. Pharmacol Ther, 2008, 119(1): 74-82. DOI: 10.1016/j.pharmthera.2008.04.008.
[12]刘俊,裘正军,庄瑜,等. 干细胞在胰腺癌中的研究进展[J]. 现代生物医学进展, 2009,9(14): 2752-2755.
[13]Bohlmann F, Zdero C, Franke H. Naturally occurring coumarin derivatives. IX. The constituents of the genus Gerbera[J]. Chem Ber, 1973,106(2):382-387.
[14]段贤春,汪永忠,居靖,等. 人参炔醇研究进展[J]. 安徽医药, 2008, 12(1): 1-3.
[15]Hermann PC, Huber SL, Herrler T, et al. Distinct populations of cancer stem cells determine tumor growth ahd metastatic activity in human pancreatic cancer[J].Cell Stem Cell, 2007, 1(3):313-323. DOI: 10.1016/j.stem.2007.06.002.
[16]Dowsett M, Smith IE, Ebbs SR, et al. Prognostic value of Ki67 expression after short-term presurgical endocrine therapy for primary breast cancer[J]. J Natl Cancer Inst, 2007, 99(2): 167-170.
[17]Koljonen V, Tukiainen E, Haglund C, et al. Proliferative activity detected by Ki67 correlates with poor outcome in merkel cell carcinoma[J]. Histopathology, 2006, 49(5): 551-553. DOI:10.1111/j.1365-2559.2006.02511.x.
[18]Dirim A, Haberal AN, Goren MR, et al. VEGF, COX2 and PCNA expression in renal cell carcinoma subtypes and their prognositic value[J]. Int Urol Nephrol, 2008, 40(4): 861-868. DOI: 10.1007/s11255-008-9362-7.
(本文编辑:屠振兴)
Panaxynol inhibited the proliferation and self-renewal of stem cells in pancreatic cancer
HuangWensi,WangYing,ZhuLi,SongLian,LiuYanfang,ZhangLirong,ZhouYuepeng,WangDongqing,ZhuHaitao.
DepartmentofRadiology,AffiliatedHospitalofJiangsuUniversity,Zhenjiang212000,China
Correspondingauthor:ZhuHaitao,Email:zhht25@163.com
ObjectiveTo investigate the influence of panaxynol on pancreatic cancer stem cells′ proliferation and self-renewal. MethodsPANC1 cells were cultured in stem cell culture system to induce the formation of stem cells, and the proportion of CD133+pancreatic cancer stem cells was detected by FCM. Cultured pancreatic stem cells were treated with panaxynol at different concentrations of 0, 72, 144, 287 nmol/L for 0, 12, 24, 48 h. CCK8 kit was used to detect the cell survival. The colony formation experiment detected the number of colonies after being cultured with 287 nmol/L panaxynol for 48 h. Western blot was used to detect the expression of proliferation-related protein Ki67, PCNA and self-renewal related protein β-catenin. ResultsThe CD133+proportion of pancreatic cancer stem cells was (9.70±0.59)%, which was statistically higher than that [(2.11±0.25)%] in the control group (P<0.001). Panaxynol can decrease the survival rates of pancreatic cancer stem cells in a dosage and time dependent manner. The survival rate of stem cells in control, 72,144, 287 nmol/L panaxynol group was 100%, (63.32±2.37)%,(49.91±2.13)% and (41.37±2.01)% after cultured for 48 h, which had statistically significant difference among different groups (P<0.001). The number of colonies in the control and 287 nmol/L panaxynol group was(611±25) and(280±16). Colonies in panaxynol group were fewer than those in the control group with statistically difference(P<0.001). The expression of Ki67, PCNA and β-catenin were 0.376±0.012, 0.772±0.026 and 0.219±0.018 in the control group and were 0.183±0.010, 0.453±0.009 and 0.148±0.006 in panaxynol group, respectively. The results indicated that Ki67, PCNA and β-catenin were down-regulated by panaxynol treatment and the differences were statistically significant (P<0.01). ConclusionsPanaxynol can inhibit the proliferation and self-renewal of pancreatic cancer stem cells. These effects may be related to downregulating Ki67, PCNA and blocking Wnt/β-catenin signaling pathway.
Pancreatic neoplasms;Stem cells;Panaxynol;Cell proliferation
10.3760/cma.j.issn.1674-1935.2016.04.002
212000江苏镇江,江苏大学附属医院影像科(黄文斯、王颖、朱丽、宋廉、张礼荣、周月鹏、王冬青、朱海涛);镇江市第一人民医院检验科(刘嫣方)
朱海涛,Email: zhht25@163.com
国家自然基金(81502663);江苏省社会发展项目(BE2015668);江苏省高校自然基金(14KJD310001);江苏大学临床重点专项基金(JDLCZX005);镇江市社会发展项目(SH2014053)
2015-06-11)
