青蒿琥酯在大鼠体内外抗肝纤维化的作用
2016-09-07彭龙希高思楠李艳芸方步武天津医科大学总医院药剂科天津000天津市第一中心医院器官移植中心移植ICU天津0019天津市肿瘤医院天津0000第四军医大学唐都医院陕西西安7100天津医科大学生物化学与分子生物学系天津医科大学药理学系天津00070
彭龙希,高思楠,王 媛,闫 静,李艳芸,方步武(1.天津医科大学总医院药剂科,天津 000;.天津市第一中心医院器官移植中心移植ICU,天津 0019;.天津市肿瘤医院,天津 0000;.第四军医大学唐都医院,陕西西安 7100;.天津医科大学生物化学与分子生物学系,.天津医科大学药理学系,天津 00070)
青蒿琥酯在大鼠体内外抗肝纤维化的作用
彭龙希1,6,高思楠2,王媛3,闫静4,李艳芸5,方步武6
(1.天津医科大学总医院药剂科,天津300052;2.天津市第一中心医院
器官移植中心移植ICU,天津300192;3.天津市肿瘤医院,天津300060;4.第四军医大学唐都医院,陕西西安710032;5.天津医科大学生物化学与分子生物学系,6.天津医科大学药理学系,天津300070)
网络出版时间:2016-4-26 11:06网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160426.1106.026.html
目的观察青蒿琥酯(artesunate,Art)对大鼠肝纤维化的治疗作用及其对大鼠原代肝星状细胞(hepatic stellate cells,HSCs)增殖的影响,并探讨其作用机制。方法建立牛血清白蛋白(bovine serum albumin,BSA)免疫性肝纤维化大鼠模型,分为正常对照组、模型对照组及青蒿琥酯低、中、高剂量组;给药组分别给予不同剂量的青蒿琥酯灌胃,正常和模型对照组给予同体积蒸馏水灌胃,每日1次,连续2个月;酸水解法检测其肝组织胶原蛋白含量,测定血清白蛋白(albumin,Alb)、丙氨酸氨基转移酶(alanine amino transferase,ALT)及天门冬氨酸氨基转移酶(aspartate amino transferase,AST)水平;苏木精-伊红染色法 (hematoxylin-eosin staining,HE染色)和胶原染色法对肝组织切片染色。分离大鼠HSCs,以培养活化HSCs。用MTT法测定HSCs增殖率,消化法测定细胞培养上清液中的羟脯氨酸(hydroxyproline,Hyp)含量,Western blot和RT-PCR法检测HSCs p53表达。结果与正常对照组相比,模型对照组大鼠血清Alb水平降低(P<0.05),ALT、AST水平增高(P<0.05);与模型对照组相比,青蒿琥酯低、中、高剂量组血清AST水平降低(P<0.05),大鼠肝组织胶原蛋白含量降低(P<0.05)。青蒿琥酯对培养活化的HSCs有抑制作用,且呈剂量和时间依赖性(P<0.05);青蒿琥酯作用24 h后,HSCs分泌羟脯氨酸减少(P<0.05),p53 mRNA表达增加(P<0.05)。结论青蒿琥酯在大鼠体内、体外均有抗肝纤维化作用,该作用与其增加HSCs p53的表达有关。
青蒿琥酯;肝纤维化;牛血清白蛋白;肝星状细胞;细胞增殖;p53
肝纤维化是继发于各种慢性肝损伤之后组织修复过程中的代偿反应,是“慢性肝炎-肝纤维化-肝硬化”这一发展过程的枢纽环节[1]。在肝纤维化形成的过程中,肝星状细胞(hepatic stellate cells,HSCs)的激活和增殖是发病的中心环节[2],阻止HSCs的增殖活化有可能阻断肝纤维化的进程[3]。但目前临床上仍无疗效确切且不良反应少的抗肝纤维化药物。青蒿琥酯(artesunate,Art)化学名为二氢青蒿素-1,2-α-琥珀酸单酯,是具有倍半萜内酯类青蒿素的衍生物,具有广泛的药理作用[4-5],如抗肿瘤、抗乙型肝炎病毒、解毒保肝、抗肝纤维化、调节免疫功能等。
本课题组以往研究证实[6],Art能预防BSA诱导的肝纤维化,但其是否具有治疗BSA诱导的肝纤维化作用尚不清楚,目前对Art抗肝纤维化的机制了解也较少。本实验拟探讨Art治疗BSA免疫性大鼠肝纤维化的作用,以及对培养活化的原代HSCs的抑制纤维发生的作用,并初步探讨其作用机制。
1 材料与方法
1.1动物与试剂SPF级健康Wistar大鼠,由军事医学科学院实验动物中心提供。青蒿琥酯由广西桂林南药股份有限公司赠予,DMEM与胎牛血清(Hyclon),链酶蛋白酶E(Roche),羟脯氨酸、Alb、ALT 及AST测定试剂盒(南京建成生物工程研究所),βactin抗体、细胞核蛋白与细胞质蛋白抽提试剂盒(碧云天生物技术研究所),p53抗体(Invitrogen),PCR引物由上海生工生物工程公司合成。
1.2青蒿琥酯抗BSA免疫性大鼠肝纤维化的体内实验
1.2.1模型制备及分组采用BSA免疫性肝纤维化大鼠模型,SPF级Wistar大鼠60只(♀♂各半),随机取8只为正常对照组,其余52只用于造模。以9 g·L-1BSA弗氏不完全佐剂乳化液经足跖皮下多点致敏注射5次后,通过琼脂平板双向扩散法检测大鼠血清中的抗BSA抗体。取抗体阳性者,尾静脉攻击注射BSA生理盐水,每周2次,剂量由每次每只2 mg(0.4 mL)递增至每次每只3.4 mg(0.4 mL),共计15次。随机处死10只造模大鼠,经肝组织形态学观察与胶原蛋白含量测定证实造模成功后,即对其余42只造模大鼠按体重随机区组法分为4组,分别为:模型对照组、青蒿琥酯低、中、高剂量组(3.2、9.6、28.8 mg·kg-1),给药组药物浓度均按10 mL·kg-1体质量灌胃,正常组和模型组灌胃同体积蒸馏水,每日1次,连续2个月。
1.2.2肝组织胶原蛋白和血清Alb、ALT及AST水平的测定将脱水脱脂的肝组织研磨成粉,105℃干燥直至恒重,称取40 mg肝粉,酸水解法于波长558nm处测吸光度值(A值);由已知羟脯氨酸浓度的标准液的A值建立标准曲线,根据测试液的A值计算出肝组织内的羟脯氨酸浓度。再将Hyp(mg/ g)乘以系数22.38(6 000/50×7.46/40)(μg/mg= mg/g,胶原蛋白/肝干粉)换算为肝组织胶原蛋白含量。按试剂盒说明测定大鼠血清Alb、ALT、AST水平。
1.2.3肝组织形态学观察取肝右叶相同部位肝组织,10%甲醛溶液固定,石蜡包埋,常规切片,HE染色和胶原染色。胶原染色采用Ponceau S/Victoria blue B染色法,肝纤维化程度的分期及计分标准见文献[7]。
1.3青蒿琥酯抗肝纤维化的体外实验
1.3.1HSCs的分离、培养及鉴定300~400 g Wistar大鼠经乌拉坦腹腔注射麻醉后消毒,0.8 g· L-1链酶蛋白酶50 mL与0.5 g·L-1胶原酶50 mL原位灌流消化肝脏,细胞悬液经8%、12%和18% Nycodenz梯度离心(1 450×g,20 min,4℃),于8%与12%的梯度界面获取HSCs,调整细胞密度为5×105,接种于培养瓶中,以含20%FBS的DMEM培养。倒置相差显微镜下观察新鲜分离的细胞形态和生长特征。细胞爬片以免疫细胞化学法,即GFAP/FITC、actin/TRITC、DAPI染色进行细胞鉴定。
1.3.2不同浓度青蒿琥酯对HSCs增殖影响的观察采用MTT法,取对数生长的HSCs,以3×107· L-1密度接种于96孔培养板,每孔100 μL,培养24 h,分别加入不同浓度的青蒿琥酯使其终浓度分别为125、150、175、200、225 μmol·L-1,设空白对照组,每组6个复孔,分别孵育24、48、72 h,用酶标仪测各孔吸光度值(A570nm值),按以下公式计算细胞抑制率(inhibition rate,IR),IR/%=(空白对照组A 值-实验组A值)/空白对照组A值×100%。
1.3.3细胞培养上清液中羟脯氨酸检测取对数生长的HSCs以5×108·L-1的密度接种于6孔板,分别设有空白对照组、给药组(浓度分别为150、175、200 μmol·L-1)。培养24 h后,收集细胞上清,按试剂盒说明书进行操作。
1.3.4青蒿琥酯对大鼠原代HSCs p53表达的影响
取对数生长的HSCs以5×108·L-1的密度接种于6孔板,分别设有空白对照组、给药组(浓度分别为150、175、200 μmol·L-1)。培养24 h后,经胞核裂解液裂解细胞,BCA蛋白定量试剂盒测定核蛋白含量,取15 μg核蛋白上样,12%SDS-PAGE分离蛋白质,电转移至PVDF膜,5%脱脂牛奶室温封闭2 h。一抗(1∶1 000)4℃孵育过夜,二抗(1∶2 000)2 h,超敏ECL化学发光试剂盒显色,胶片曝光,显影定影后扫描,经图像分析系统读取条带面积和灰度,以目的条带与内参条带灰度值之比作为半定量标准,重复3次。取对数生长的HSCs,按上述方法分组,并给予相同处理,培养24 h后提取细胞内总RNA,然后逆转录合成cDNA,采用20μL反应体系进行PCR反应。目的基因p53(上游引物为5'-GTTCCGAGAGCTGAATGAGG-3',下游引物为5'-TTTTATGGCGGGACGTAGAC-3'),扩增片段长125 bp;内参GAPDH(上游引物为5'-CGTCTTCACCACCATGGAGA-3',下游引物为 5'-CGGCCATCACGCCACAGTTT-3'),扩增片段长299 bp。应用凝胶成像分析系统进行电泳图像的采集,并对p53 mRNA、GAPDH mRNA的PCR产物光密度和面积进行半定量分析,计算p53 mRNA、GAPDH mRNA的光密度积分,以二者比值代表HSCs中p53 mRNA的相对表达量。

Tab 1 Effect of Art on liver tissue collagen,serum Alb,ALT and AST levels in immuno-injured hepatic fibrosis rats induced by BSA
2 结果
2.1青蒿琥酯对BSA免疫性肝纤维化大鼠肝组织胶原蛋白和血清Alb、ALT及AST水平的影响
与正常组比较,模型对照组大鼠血清Alb水平降低(P<0.05),ALT、AST水平增高(P<0.05);青蒿琥酯各剂量组均能降低大鼠血清 AST水平(P<0.05);高剂量组能降低大鼠血清ALT水平(P<0.05)。与正常组比较,模型对照组大鼠肝组织胶原蛋白含量增高(P<0.01);与模型对照组比较,各治疗组大鼠肝组织胶原蛋白含量均降低(P<0.05),见Tab 1。
2.2青蒿琥酯对BSA免疫性肝纤维化大鼠肝组织形态学的影响胶原染色结果显示,正常组大鼠肝组织仅于汇管区及中央静脉有少量胶原纤维存在;模型对照组大鼠肝组织中胶原纤维明显增多,分布广泛,多位于汇管区及血管周围,并向肝小叶内延伸,相互连接形成较粗大的纤维间隔,包绕肝细胞形成大小不等、形状不规则的假小叶;青蒿琥酯中、高剂量组大鼠肝组织中有少量纤维组织增生,仅分布于汇管区及血管周围;青蒿琥酯低剂量组大鼠肝组织中增生的纤维自汇管区及中央静脉向四周延伸,但纤维间隔薄,未形成完全连接,不完全分割肝小叶,与模型组比较则明显减少。HE染色结果显示,模型对照组大鼠肝组织正常结构被破坏,肝索排列紊乱,可见界板及中央静脉周围肝细胞坏死及较多炎症细胞浸润;肝细胞肿胀变性,多为脂肪变,部分呈气球样变,细胞边界不清,胞质不均、嗜酸性小体形成或胞质出现大量空泡;汇管区结缔组织不同程度增生扩大,向小叶内延伸,将肝小叶分隔成大小不等的肝细胞团,可见假小叶形成;各治疗组肝组织结构破坏不明显,肝细胞变性坏死程度减轻,纤维成分减少,汇管区结缔组织增生减轻,可见少量炎症细胞浸润(Fig 1)。各组大鼠肝纤维化程度分期及计分比较见Tab 2。
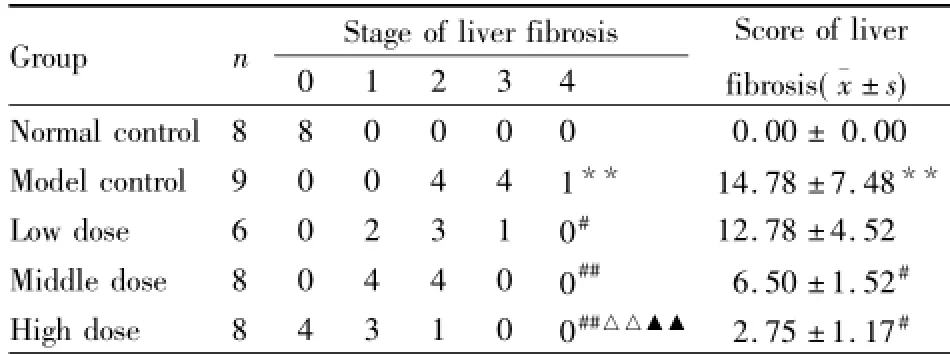
Tab 2 Stage and score of liver fibrosis in each group
2.3HSCs的分离、培养及鉴定倒置荧光显微镜下观察新分离的HSCs呈圆形,折光性强,远小于肝细胞,但大于枯否细胞和红细胞,胞质内含有丰富的脂滴,内含典型的折光颗粒。4 h后,多数细胞已贴壁,胞质内脂滴明显;48h后,细胞呈扁圆、椭圆形,少数细胞已开始伸展;3~4 d后,贴壁细胞伸展,胞体增大,形态多样,一部分细胞已呈现多角伪足、星状外形的典型形态。10 d后,细胞逐渐融合,形成单层。随培养天数增加及细胞增殖,胞质中脂滴逐渐减少,细胞形态由星形向梭形变化,类似成纤维细胞。第2代HSCs细胞GFAP/FITC、actin/TRITC染色呈阳性,且阳性细胞数>99%。见Fig 2。
2.4青蒿琥酯对HSCs增殖的影响青蒿琥酯抑制HSCs增殖,且呈浓度、时间依赖性,见Tab 3。
2.5青蒿琥酯对HSCs羟脯氨酸分泌量的影响青蒿琥酯作用24 h后,各给药组细胞分泌羟脯氨酸水平降低,与对照组比较,差异有统计学意义(P<0.01),见Tab 4。
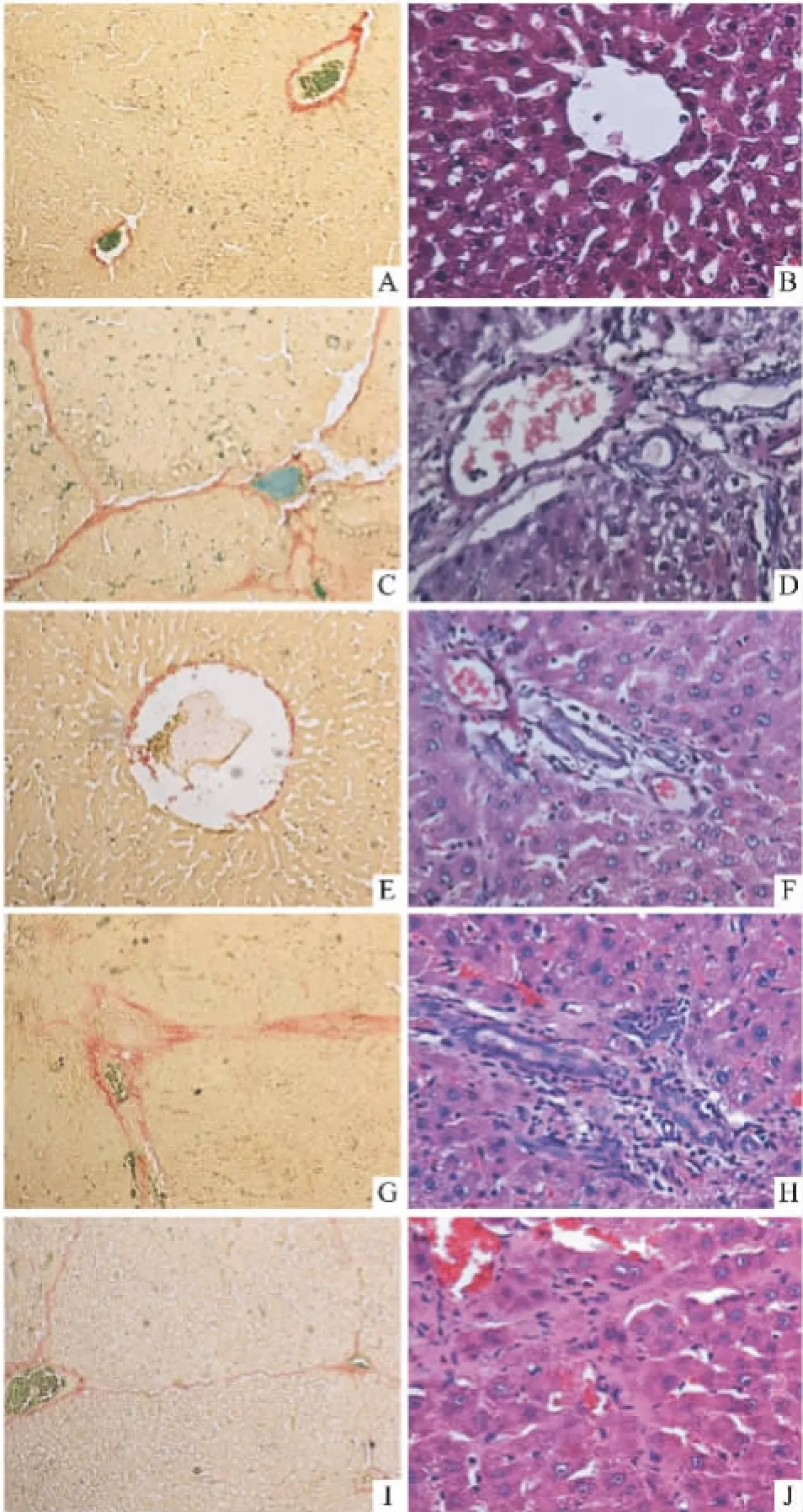
Fig 1 HE and collagen staining of liver tissue

Fig 2 HSCs identification
Tab 3 Inhibition rate of Art on HSCs under different concentrations and time(±s,n=6)

Tab 3 Inhibition rate of Art on HSCs under different concentrations and time(±s,n=6)
0.01 vs 24 h;▲▲P<0.01 vs 48 h
Art/Inhibition rate/% μmol·L-124 h 48 h 72 h 125 6.06±1.44 9.61±4.82 75.59±4.82▲▲150 21.47±5.57 26.97±9.28 92.60±1.18▲▲175 42.00±7.36## 70.53±6.77##△△ 94.61±0.90▲▲200 67.12±4.55** 87.55±2.40**△△ 94.91±4.04 225 79.83±3.67 94.91±0.99△△95.32±0.25##P<0.01 vs 150 μmol·L-1;**P<0.01 vs 175 μmol·L-1;△△P<
Tab 4 Effects of Art on secretion of hydroxyproline of HSCs(±s,n=6)
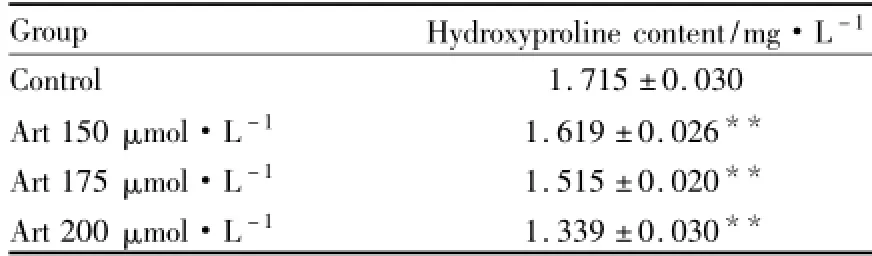
Tab 4 Effects of Art on secretion of hydroxyproline of HSCs(±s,n=6)
**P<0.01 vs control
Group Hydroxyproline content/mg·L-1Control 1.715±0.030 Art 150 μmol·L-1 1.619±0.026**Art 175 μmol·L-1 1.515±0.020**Art 200 μmol·L-1 1.339±0.030**
2.6青蒿琥酯对HSCs p53表达的影响青蒿琥酯150、175、200 μmol·L-1分别作用HSCs 24 h后,p53表达明显增加,与对照组比较差异有统计学差异(P<0.01),且随着药物浓度的增加而增加。HSCs对照组的p53表达极少,各给药组p53 mRNA表达水平较对照组明显升高(P<0.05),各治疗组之间差异未见统计学意义,见Fig 3。

Fig 3 Effects of Art on p53 protein(A)and mRNA(B)expression
3 讨论
肝纤维化是指由于各种致病因子的刺激,肝脏中胶原蛋白等ECM的增生与降解失去平衡,导致肝脏内纤维结缔组织异常沉积的病理过程[8]。目前抗肝纤维化的主要策略包括:治疗原发病,抑制ECM增生,促进ECM降解,抑制HSCs活化与诱导其凋亡。激活的HSCs产生一些促纤维发生的细胞因子和生长因子,这些因子通过旁分泌和自分泌效应持续存在于肝纤维发生的过程中。因此,针对HSCs的治疗是预防和治疗肝纤维化的关键环节[9]。
青蒿素是我国发现的第一个被国际公认的天然药物,以此为基础合成了多种衍生物如青蒿琥酯、蒿甲醚及双氢青蒿素。其中水溶性的青蒿琥酯具有广谱抗寄生虫作用,如抗疟原虫、血吸虫及肺孢子虫等,是高效、低毒的抗疟药,且吸收好、分布广、代谢和排泄快;陆续发现其有广泛的药理作用,如抗肿瘤、抗病毒、调节免疫功能等[10-12]。本课题组的前期研究表明青蒿琥酯具有抗肝纤维化作用,并从调节基质金属蛋白酶、诱导HSCs凋亡、上调神经酰胺的生成等环节探讨了其抗肝纤维化的作用机制[13-14]。
本文体内研究发现,青蒿琥酯灌胃给药能降低BSA免疫性肝纤维化大鼠肝组织胶原蛋白含量及血清AST和ALT水平;模型对照组大鼠界板及中央静脉周围肝细胞坏死伴炎性细胞浸润,由胶原纤维等构成的纤维间隔伸入肝小叶,甚至形成假小叶,经青蒿琥酯治疗后,胶原纤维增生程度明显减轻,甚至仅在汇管区和中央静脉有少量纤维增生,各治疗组肝纤维化程度分期和计分均减低。同时,青蒿琥酯在体外能明显抑制培养活化的HSCs的增殖,且抑制作用呈浓度和时间依赖性;并能降低培养活化的HSCs分泌羟脯氨酸,表明青蒿琥酯具有抑制肝纤维化发生的作用。
需要指出的是,BSA免疫性大鼠肝纤维化模型的死亡率与动物质量、个体差异及操作技术等有关,如尾静脉注射速度过快时易致死亡,对BSA敏感者易死亡。本文造模大鼠的总死亡率达40.4%,包括造模期间的死亡率,治疗过程中的死亡率,后者又包括灌胃不当引起的动物死亡等,但并非由于药物的毒性导致的死亡。另外,AST水平在用药组之间未见统计学差异,其原因有待进一步研究。
P53基因定位于17p13.1,长约20 kb,含11个外显子,转录的mRNA长2.8 kb,其产物为p53蛋白,由393个氨基酸构成。p53在正常细胞中表达量极低,但是当细胞受到如低氧、紫外线照射、化合物刺激后,其表达量快速急剧增加并被激活,由于含有一段序列专一性DNA转录结合序列,作为转录因子,p53可调节多种靶基因的表达,从而影响细胞周期、凋亡、分化、静息、DNA损伤、血管生成和肿瘤转移的抑制以及其他功能[15-16]。p53是细胞生长的“监控器”,是细胞生长的重要负调节蛋白,通过阻滞细胞周期和诱导细胞凋亡来抑制细胞增殖。Weng等[17]发现,p53的缺失促进了肝纤维化和肿瘤在 Alb-Mcl-1-/-鼠中的发展,表明 p53激活了Alb-Mcl-1-/-肝脏从而促进肝细胞的生存。本文实验显示,青蒿琥酯能明显提高p53 mRNA及其蛋白在HSCs的表达,从而抑制HSCs增殖及胶原蛋白合成等,也就抑制了肝的纤维发生。
总之,青蒿琥酯通过增加p53在HSCs的表达,发挥了体内、外的抗肝纤维化作用。这一研究结果为进一步研究青蒿琥酯在肝纤维化治疗方面提供了必要的实验依据,对肝纤维化的治疗有着积极的意义。
[1]Dubuisson L,Desmouliere A,Decourt B,et al.Inhibition of rat liver fibrogenesis through noradrenergic antagonism[J].Hepatology,2002,35(2):325-31.
[2]Friedman S L.Molecular regulation of hepatic fibrosis,an integrated cellular response to tissue injury[J].J Boil Chem,2000,275(4):2247-50.
[3]Yu J,Zhang S,Chu E S,et al.Peroxisome proliferator-activated receptors gamma reverses hepatic nutritional fibrosis in mice and suppresses activation of hepatic stellate cells in vitro[J].Int J Biochem Cell Biol,2010,42(6):948-57.
[4]Yang N D,Tan S H,Ng S,et al.Artesunate induces cell death in human cancer cells via enhancing lysosomal function and lysosomal degradation of ferritin[J].J Biol Chem,2014,289(48):33425-41.
[5]郭颖,郭建华,符航,等.青蒿琥酯对人大肠癌Lovo细胞侵袭影响的初步研究[J].中国药理学通报,2016,32(1):60-3
[5]Guo Y,Guo J H,Fu H,et al.Preliminary of research of effect of artesunate on invasion of human colon cancer Lovo cells[J].Chin Pharmacol Bull,2016,32(1):60-3.
[6]方步武,来丽娜,林雅军,等.青蒿琥酯抗四氯化碳致大鼠肝纤维化的作用[J].中国药理学通报,2005,21(6):762-3.
[6]Fang B W,Lai L N,Lin Y J,et al.Effects of artesunate on rat hepatic fibrosis induced dy CCl4[J].Chin Pharmacol Bull,2005,21(6):762-3.
[7]王泰龄,刘霞.慢性肝炎炎症活动度及纤维化程度计分方案[J].中华肝脏病杂志,1998,6(4):195-7.
[7]Wang T L,Liu X.A semiquantitative scoring system for assessment of hepatic inflammation and fibrosis in chronic viral hepatitis [J].Chin J Hepatol,1998,6(4):195-7.
[8]Hong I H,Park S J,Goo M J,et al.JNK1 and JNK2 regulate α-SMA in hepatic stellate cells during CCl4-induced fibrosis in the rat liver[J].Pathol Int,2013,63(10):483-91.
[9]Seto W K,Lee C F,Lai C L,et al.A new model using routinely available clinical parameters to predict significant liver fibrosis in chronic hepatitis B[J].PLoS One,2011,6(8):e23077.
[10]Button R W,Lin F,Ercolano E,et al.Artesunate induces necrotic cell death in schwannoma cells[J].Cell Death Dis,2014,16 (5):e1466.
[11]Okoye T C,Akah P A,Ezike A C,et al.Immunomodulatory effects of Stachytarpheta cayennensis leaf extract and its synergistic effect with artesunate[J].BMC Complement Altern Med,2014,5 (14):376.
[12]Sharma B N,Marschall M,Rinaldo C H.Antiviral effects of artesunate on JC polyomavirus replication in COS-7 cells[J].Antimicrob Agents Chemother,2014,58(11):6724-34.
[13]Xu Y,Liu W,Fang B,et al.Artesunate ameliorates hepatic fibrosis induced by bovine serum albumin in rats through regulating matrix metalloproteinases[J].Eur J Pharmacol,2014,10(5):1 -9.
[14]马淑晶,张晓燕,徐亚洁,等.青蒿琥酯通过上调神经酰胺抑制肝星状细胞增殖并诱导其凋亡[J].天津医科大学学报,2014,7(20):253-6.
[14]Ma S J,Zhang X Y,Xu Y J,et al.Artesunate inhibits the proliferation of hepatic stellate cells and induces apoptosis by upregulating ceramide[J].J Tianjin Med Univ,2014,7(20):253-6.
[15]Helton E S,Chen X.p53 modulation of the DNA damage response [J].J Cell Biochem,2007,100(4):883-96.
[16]Stiewe T.The p53 family in differentiation and tumorigenesis[J]. Nat Rev Cancer,2007,7(3):165-8.
[17]Weng S Y,Yang C Y,Li C C,et al.Synergism between p53 and Mcl-1 in protecting from hepatic injury,fibrosis and cancer[J].J Hepatol,2011,54(4):685-94.
Effect of artesunate on rat liver fibrogenesis in vitro and in vivo
PENG Long-xi1,GAO Si-nan2,WANG Yuan3,YAN Jing4,LI Yan-yun5,FANG Bu-wu6
(1.Dept of Pharmacy,Tianjin Medical University General Hospital,Tianjin300052,China;2.Transplant Intensive Care Unit,
Dept of Organ Transplantation,Tianjin First Center Hospital,Tianjin300192,China;3.Tianjin Medical University Cancer Institute&Hospital,Tianjin 300060,China;4.Tangdu Hospital,Xi’an710032,China;5.Dept of Biochemistry and Molecular Biology,6.Dept of Pharmacology,Tianjin Medical University,Tianjin 300070,China)
AimTo study the effect of artesunate on immuno-injured hepatic fibrosis induced by bovine serum albumin in rat model and the effect of artesunate on hepatic stellate cells(HSCs)proliferation,so as to provide experimental evidence for clinical application of artesunate and the treatment of hepatic fibrosis. MethodsThe model of immuno-injured hepatic fibrosis induced by bovine serum albumin was established in Wistar rats.Rats were randomly divided into 5 groups:normal group,model group,low dose of artesunate,middle dose of artesunate and high dose of artesunate.Drugs were given to the corresponding therapeutic groups,and then were continued once a day for two months.Distilled water was given to the rats of normal and model groups according to the same method.Liver tissues were used for measuring the content of collagen,the rat serum activities of albumin(Alb),alanine aminotransferase(ALT)and aspartate aminotransferase(AST).Liver tissue’s pathological changes were observed by HE and collagen staining.Isolated and cultured rat primary HSCs in the flask for 10 days to make cells activated,MTT assay was used to detect rate of cellular proliferation;concentration of hydroxyproline in supernatant was detected by digestive method;the expression of p53 was investigated by Western blot and RT-PCR.ResultsSerum levels of Alb in model group were significantly lower(P<0.05),and levels of ALT and AST in model group were significantly higher(P<0.05)compared with normal group.Levels of AST in low,middle and high dose groups(3.2,9.6,28.8 mg·kg-1)were significantly lower(P<0.05)compared with model group,and levels of ALT in high dose groups were significantly lower(P<0.01)compared with model group.The contents of collagen in model groups were significantly higher(P<0.01)compared with normal group,while the contents of collagen in therapy groups significantly decreased(P<0.05)compared with model group. Activated HSCs treated with various concentrations of artesunate(150,175,200 μmol·L-1)were inhibited on dose and time-effect relationships.Production/ secretion of hydroxyproline decreased after HSCs was treated by artesunate for 24 h;the expression of p53 was up-regulated showed by Western blot and RT-PCR in artesunate treated cells.ConclusionArtesunate brings about anti-fibrosis in vitro and in vivo by increasing the expression of p53.
artesunate;hepatic fibrosis;bovine serum albumin;hepatic stellate cells;cell proliferation;p53
10.3969/j.issn.1001-1978.2016.05.013
A
1001-1978(2016)05-0658-06
R-332;R284.1;R322.47;R329.24;R575.205.31
2016-01-06,
2016-02-01
国家自然科学基金资助项目(No 30772856)
彭龙希(1986-),女,硕士,药师,研究方向:药理学,E-mail:plx258123@sina.com;方步武(1962-),男,博士,教授,博士生导师,研究方向:中药药理学,通迅作者,E-mail:fangdch@aliyun.com