CUS致大鼠抑郁行为涉及TNF-α及IDO-HAAO通路激活
2016-09-07伏箫燕李海燕蒋青松邱红梅重庆医科大学药理学教研室重庆市生物化学与分子药理学重点实验室重庆400016
伏箫燕,李海燕,崔 婷,蒋青松,邱红梅(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016)
CUS致大鼠抑郁行为涉及TNF-α及IDO-HAAO通路激活
伏箫燕,李海燕,崔婷,蒋青松,邱红梅
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆400016)
网络出版时间:2016-4-26 11:06网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160426.1106.014.html
目的研究慢性不可预见刺激(chronically unpredictable stress,CUS)致大鼠抑郁行为与肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、吲哚胺2,3-双加氧酶(indole-2,3-dioxygenase,IDO)及3-羟氨苯甲酸双加氧酶(3-hydroxyl amino acid oxygenase,HAAO)蛋白表达的关系。方法♂Sprague Dawley(SD)大鼠30只,随机分为对照组和模型组,采用孤养结合CUS连续刺激28 d建立大鼠抑郁症模型;以旷场实验和被动游泳实验评价大鼠抑郁行为,以Western blot法检测大鼠前脑皮层和海马TNF-α、IDO及HAAO蛋白表达。结果与对照组大鼠相比,模型组被动游泳实验不动时间明显延长(P<0.01)、旷场实验得分明显降低(P<0.01)、前脑皮层和海马的TNF-α、IDO及HAAO蛋白表达均明显升高(P<0.05)。结论CUS诱导大鼠产生抑郁行为,其机制可能与激活脑内TNF-α及下游IDO-HAAO通路有关。
抑郁症;慢性不可预见刺激;肿瘤坏死因子α;吲哚胺2,3-双加氧酶;3-羟氨苯甲酸双加氧酶;细胞因子
抑郁症是一种临床常见的精神障碍性疾病,以少动、思维缓慢、兴趣缺失、记忆力减退等为主要特征,严重者甚至出现自杀倾向[1]。抑郁症发病机制复杂,涉及遗传、环境、表观遗传学等众多因素。研究显示,单胺类神经递质系统功能紊乱、下丘脑-垂体-肾上腺轴功能失调、脑源性神经营养因子不足、氧化应激损伤等都与抑郁症发生密切相关[2]。目前临床常用的抗抑郁药物如5-羟色胺(serotonin,5-HT)再摄取抑制剂、去甲肾上腺素(norepinephrine,NE)再摄取抑制剂等都是通过作用于单胺递质系统相应靶点,调节突触间隙递质水平而发挥治疗作用,但这类机制很难解释其药物延迟性效应。因此深入研究抑郁症发病机制,寻找药物治疗新靶点迫在眉睫。
最新研究显示,抑郁症与免疫激活和炎症因子的释放增加密切相关[3]。临床研究发现,抑郁症患者血中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,INF-γ)、白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)水平明显增高,动物实验研究发现,腹腔注射脂多糖可诱导小鼠产生抑郁行为、TNF-α拮抗剂依那西普可明显改善小鼠的抑郁行为[4-6],提示免疫激活、炎症反应及细胞因子释放涉及抑郁症的发生发展。TNF-α是一种由多核巨细胞产生的细胞因子,具有免疫调节、介导炎症反应等功能。近年来研究发现,TNF-α在抑郁症发生中发挥着重要作用。TNF-α作为一种重要的促炎因子,可诱导IL、INF等其他促炎细胞因子的生成和释放,引起炎症的级联放大反应。吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase,IDO)是一种细胞内的含亚铁血红素的酶,在催化色氨酸沿犬尿氨酸途径代谢过程中起着限速酶的作用[7]。生理状态下,IDO呈低水平表达,但在免疫激活、炎症或感染过程中,细胞因子如TNF-α释放增多,可诱导其明显表达并过度激活,催化色氨酸沿犬尿氨酸途径代谢,使合成5-HT的色氨酸耗竭,5-HT生成减少,诱发和(或)加重抑郁症[8-9]。目前,最新临床和基础研究结果均显示,IDO过表达和(或)活性增强与抑郁症的发生密切相关,但不足以证明炎症因子、IDO与抑郁症之间的相互关系[10-11]。同时,IDO过度激活的犬尿氨酸途径还可生成大量3-羟犬尿氨酸,并在3-羟氨苯甲酸双加氧酶(3-hydroxyl amino acid oxygenase,HAAO)的作用下代谢生成喹啉酸,3-羟犬尿氨酸和喹啉酸均具有神经毒性作用,也可能参与了抑郁症的发生[12-13]。因此,本研究采用孤养结合CUS建立大鼠抑郁模型,观察大鼠前脑皮层和海马炎症因子TNF-α及IDO、HAAO表达变化是否参与了抑郁症的发生。
1 材料与方法
1.1实验动物清洁级♂Sprague Dawley(SD)大鼠30只,体质量180~220 g,由重庆医科大学动物中心提供,医学动物许可证号:SYXK(渝)2012-0001。
1.2主要试剂与仪器BCA蛋白浓度测定试剂盒、RIPA裂解液(上海碧云天生物技术公司);anti-TNF-α、anti-IDO、anti-HAAO抗体(英国Abcam公司);ECL化学发光试剂盒(美国Pierce公司);Sigma低温高速离心机:德国 Sigma公司(型号:3K30);台式离心机:上海市安亭科学仪器厂(型号:TGL-16C);超低温冰箱:日本Sanyo公司;凝胶成像系统:美国Bio-Rad公司(型号:170-1870);Western blot垂直电泳仪:美国Bio-Rad公司。
1.3方法
1.3.1动物分组和模型建立♂ SD大鼠30只,5 只/笼,自由饮水和摄食,在室温(25±1)℃、通风良好的环境下适应性喂养1周后,随机分为对照组和模型组。对照组大鼠5只/笼,自由摄食饮水,不予刺激。模型组大鼠1只/笼,采用孤养结合CUS方式建立抑郁动物模型。参照本实验室前期建模方法[14],采用的刺激方式包括4℃冰水浴5 min,45℃热水浴5 min,禁饮禁食24 h,潮湿垫料24 h,倾斜24 h,昼夜颠倒,电击5 min,噪音3 h,闪频3 h,水平振荡10 min,夹尾1 min,共11种刺激,每天随机给予1种刺激,连续刺激28 d,4 d内同种刺激不重复出现,使动物不可预知。
1.3.2被动游泳实验(forced swim test,FST)参考文献[15]并加以改进,测试时将大鼠放入高60 cm、直径20 cm、水深30 cm的透明圆柱形玻璃缸内,维持水温(24±1)℃。测试时间7 min,记录后5 min大鼠累计不动时间。
1.3.3旷场实验(open-field test,OFT)参照文献[16]并加以改进,采用内壁为黑色的100 cm×100 cm×40 cm木质敞箱进行测定,木箱底部均分为25 个20 cm×20 cm的方格。实验开始时将大鼠置于木箱底部中央格,观察并记录5 min内大鼠水平运动得分(四爪均进入的穿越格子数)和垂直运动得分(后肢直立次数)、理毛次数及大小便,将各项得分相加即为旷场实验得分。实验结束后,清理粪便并用酒精清洁敞箱,以免大鼠遗留气味对下次测试的影响。实验必须在安静昏暗的环境下进行。
1.3.4皮层和海马TNF-α、IDO、HAAO蛋白表达测定末次刺激24 h后,每组取大鼠5只,4%水合氯醛麻醉后断头取脑,于冰浴上分离前脑皮层和海马并置于EP管中,-80℃保存备用。测定时,将前脑
皮层和海马组织取出并剪碎、碾磨、裂解、提取蛋白,采用BCA试剂盒测定蛋白浓度。采用Western blot方法检测大鼠前脑皮层和海马的的TNF-α、IDO、HAAO的蛋白表达。上样量每孔30 μg,依次进行SDS-PAGE凝胶电泳、转膜、室温5%脱脂牛奶封闭2 h,一抗 4℃孵育过夜,洗膜,二抗室温下孵育(TNF-α、IDO 1 h,HAAO 25 min),洗膜(HAAO需室温下孵育三抗35 min后再洗膜),ECL显色,凝胶成像仪成像后,用Image Lab软件(Bio-Rad)分析结果。以β-actin为内参校正蛋白表达。
2 结果
2.1CUS对大鼠行为的影响被动游泳实验结果显示,与对照组大鼠相比,模型组大鼠被动游泳不动时间明显延长(P<0.01),见Fig 1A。旷场实验结果显示,与对照组大鼠相比,模型组大鼠旷场实验得分明显降低(P<0.01),见Fig 1B。提示CUS成功诱导大鼠产生焦虑、绝望等抑郁样行为。

Fig 1 Effect of CUS on rat behaviors in FST and OFT(±s,n=15)
2.2CUS对大鼠前脑皮层和海马TNF-α蛋白表达的影响与对照组大鼠相比,模型组大鼠前脑皮层和海马TNF-α蛋白表达均明显增加(P<0.05),见Fig 2。提示CUS致大鼠产生抑郁行为时,炎症因子TNF-α表达明显升高。

Fig 2 Effect of CUS on TNF-α protein expression in rat brain(±s,n=5)
2.3CUS对大鼠前脑皮层和海马IDO蛋白表达的影响与对照组大鼠相比,模型组大鼠前脑皮层和海马IDO蛋白表达均明显增加(P<0.05),见Fig 3。提示CUS诱导的抑郁症大鼠脑内IDO表达明显升高。

Fig 3 Effect of CUS on IDO protein expression in rat brain(±s,n=5)
2.4CUS对大鼠前脑皮层和海马HAAO蛋白表达的影响与对照组大鼠相比,模型组大鼠前脑皮层和海马HAAO蛋白表达均明显增加(P<0.05),见Fig 4。提示CUS抑郁大鼠脑内HAAO表达明显升高。
3 讨论
抑郁症发病机制复杂,涉及单胺递质系统功能和HPA轴功能紊乱、氧化应激损伤、神经营养因子表达下降、免疫调节异常等多种病理生理学改变,但机制尚未完全阐明。动物模型是研究抑郁症发病机制和抗抑郁药物的有效手段之一,其中CUS模型可模拟人在社会生活中遇到的各种不可预见刺激,是目前广泛采用的动物研究模型之一[17]。本研究采用CUS建立大鼠抑郁模型,研究抑郁症的其他相关发病机制。FST和OFT是评价大鼠抑郁行为的有效指标,FST通过检测大鼠在狭小环境的不动时间,反映大鼠的绝望抑郁状态;OFT通过检测大鼠在新异环境中的探究行为,反映大鼠的焦虑抑郁状态。本研究结果显示,与对照组大鼠相比,模型组大鼠被动游泳实验不动时间明显延长、旷场实验得分明显降低,提示CUS诱导大鼠出现焦虑、绝望样抑郁行为。
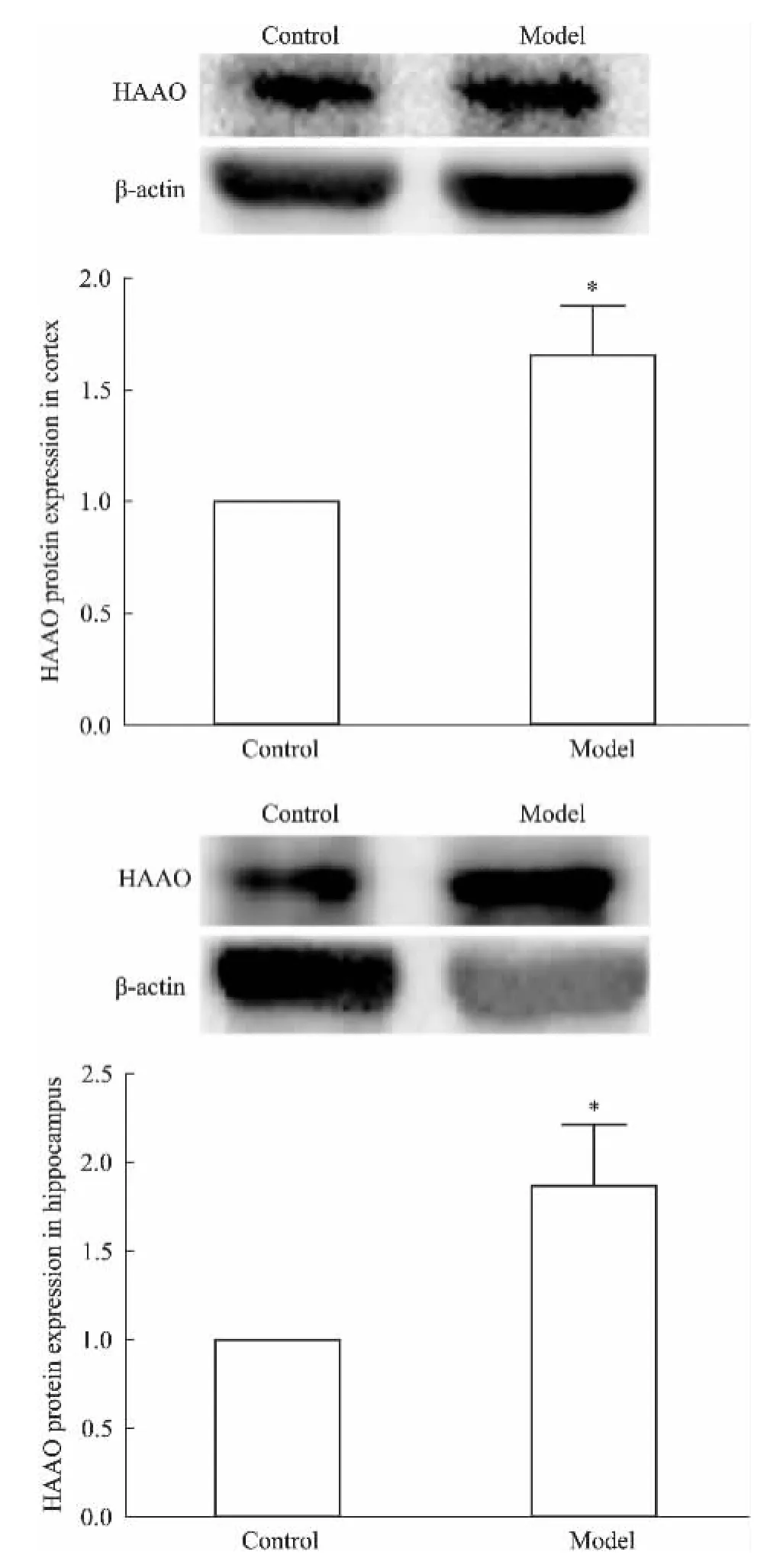
Fig 4 Effect of CUS on HAAO protein expression in rat brain(±s,n=5)
抑郁症的“单胺递质假说”和“细胞因子假说”都是目前比较公认的抑郁症发病机制。前者认为突触间隙的5-HT及NE水平低下是导致抑郁症发病的重要原因;后者认为免疫激活、炎症反应及细胞因子活化和释放增多是抑郁症发病的重要原因。Maes等[8]于2011年提出新的“5-HT假说”,认为免疫激活诱导IDO活化致色氨酸耗竭、5-HT合成不足及下游毒性代谢产物增加均参与了抑郁症的发生。色氨酸是脑内合成5-HT的前体物质,主要通过两条途径进行代谢,即色氨酸-5-HT通路和色氨酸-犬尿氨酸通路。色氨酸羟化酶是脑内合成5-HT的限速酶,本实验室前期研究已证实,色氨酸羟化酶表达下调参与大鼠抑郁症的发生[18]。IDO是肝脏以外唯一可催化色氨酸沿犬尿氨酸途径代谢的限速酶。生理情况下,IDO呈低水平表达,但当炎症、感染等免疫激活时,细胞因子TNF-α、IFN-γ等的释放可诱导IDO激活,催化色氨酸沿犬尿氨酸途径代谢明显增多,导致合成5-HT的前体物质色氨酸耗竭,进而致5-HT合成不足,参与抑郁症的发生。Maes等[8]研究发现,抑郁症患者细胞因子分泌明显增多、IDO活性明显增强;O'Connor等[5-6]发现,IFN-γ、TNF等炎症细胞因子可上调IDO表达诱导小鼠的抑郁样行为,而应用IDO拮抗剂1-MT可明显抑制小鼠抑郁症样行为的产生。本研究结果显示,与对照组大鼠相比,模型组大鼠前脑皮层和海马TNF-α、IDO蛋白表达均明显升高,提示CUS诱导大鼠抑郁行为与脑内免疫激活和炎症因子释放并诱导IDO激活密切相关。与此同时,犬尿氨酸途径代谢产物也可能对神经细胞产生毒性作用。在色氨酸-犬尿氨酸代谢途径中,犬尿氨酸可在犬尿氨酸羟化酶的作用下代谢为3-羟犬尿氨酸,后者在3-羟基犬尿氨酸酶作用下代谢为3-羟氨苯甲酸,最后在HAAO作用下最终代谢为喹啉酸。3-羟犬尿氨酸和喹啉酸都具有明显的神经毒性,前者可导致单胺氧化酶活性增强和氧自由基生成增多,加速单胺类神经递质的代谢并加重机体的氧化应激损伤[19];后者可作用于N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体,促进谷氨酸释放,发挥兴奋毒作用[20]。本研究结果显示,与对照组大鼠相比,模型组大鼠前脑皮层和海马HAAO蛋白表达明显升高,提示CUS诱导大鼠抑郁行为与脑内HAAO过表达密切相关。
[1]刘佳莉,苑玉和,陈乃宏.抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193-6.
[1]Liu J L,Yuan Y H,Chen N H.Research progress in treatment of depression[J].Chin Pharmacol Bull,2011,27(9):1193-6.
[2]Ménard C,Hodes G E,Russo S J.Pathogenesis of depression:insights from human and rodent studies[J].Neuroscience,2015,5 (3):138-62.
[3]Udina M,Moreno-España J,Capuron L,et al.Cytokine-induced depression:current status and novel targets for depression therapy [J].CNS Neurol Disord Drug Targets,2014,13(6):1066-74.
[4]Kim Y K,Na K S,Shin K H,et al.Cytokine imbalance in the pathophysiology of major depressive disorder[J].Prog Neuropsychopharmacol Biol Psychiatry,2007,31(5):1044-53.
[5]O'Connor J C,André C,Wang Y,et al.Interferon-gamma and tumor necrosis factor-alpha mediate the upregulation of indoleamine 2,3-dioxygenase and the induction of depressive-like behavior in mice in response to bacillus Calmette-Guerin[J].J Neurosci,2009,29(13):4200-9.
[6]O'Connor J C,Lawson M A,André C,et al.Lipopolysaccharideinduced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice[J].Mol Psychiatry,2009,14(5):511-22.
[7]von Bubnoff D,Bieber T.The indoleamine 2,3-dioxygenase (IDO)pathway controls allergy[J].Allergy,2012,67(6):718-25.
[8]Maes M,Leonard B E,Myint A M,et al.The new‘5-HT’hypothesis of depression:cell-mediated immune activation induces indoleamine 2,3-dioxygenase,which leads to lower plasma tryptophan and an increased synthesis of detrimental tryptophan catabolites(TRYCATs),both of which contribute to the onset of depression[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35 (3):702-21.
[9]Hepgul N,Mondelli V,Pariante C M.Psychological and biological mechanisms of cytokine induced depression[J].Epidemiol Psichiatr Soc,2010,19(2):98-102.
[10]Hashmi A M,Butt Z,Umair M.Is depression an inflammatory condition?A review of available evidence[J].J Pak Med Assoc,2013,63(7):899-906.
[11]Dobos N,de Vries E F,Kema I P,et al.The role of indoleamine 2,3-dioxygenase in a mouse model of neuroinflammation-induced epression[J].J Alzheimers Dis,2012,28(4):905-15.
[12]Chen Y,Guillemin G J.Kynurenine pathway metabolites in humans:disease and healthy states[J].Int J Tryptophan Res,2009,2:1-19.
[13] Plangar I,Majlath Z,Vecsei L.Kynurenines in cognitive functions:their possible role in depression[J].Neuropsychopharmacol Hung,2012,14(4):239-44.
[14]胡小娅,费慧芝,蒋心惠,等.改善氧化应激平衡和逆转NET 及5-HTT表达异常涉及文拉法辛的抗抑郁作用[J].中国药理学通报,2014,30(6):848-52.
[14]Hu X Y,Fei H Z,Jiang X H,et al.Improving oxidative stress response and reversing abnormal expression of hippocampus NET and 5-HTT involved in anti-depressive effect of venlafaxine[J].Chin Pharmacol Bull,2014,30(6):848-52.
[15]Makino M,Kitano Y,Komiyama C,et al.Human interferon-α increases immobility in the forced swimming test in rats[J].Psychopharmacology,2000,148:106-10.
[16]Bai M,Zhu X,Zhang Y,et al.Abnormal hippocampal BDNF and miR-16 expression is associated with depression-like behaviors induced by stress during early life[J].PLoS One,2012,7(10):e46921.
[17]Overstreet D H.Modeling depression in animal models[J].Methods Mol Biol,2012,829:125-44.
[18]汪丽佳,邱红梅,蒋心惠,等.CUS致大鼠抑郁行为涉及单胺递质合成酶表达下调[J].中国药理学通报,2015,31(4):527-31.
[18]Wang J L,Qiu H M,Jiang X H,et al.Down-regulation of monoamine neurotransmitter synthetase expression involved in CUS-induced depression of rats[J].Chin Pharmacol Bull,2015,31 (4):527-31.
[19]Okuda S,Nishiyama N,Saito H,et al.3-Hydroxykynurenine,an endogenous oxidative stress generator,causes neuronal cell death with apoptotic features and region selectivity[J].J Neurochem,1998,70(1):299-307.
[20] Pérez-De La Cruz V,Carrillo-Mora P,Santamaría A.Quinolinic acid,an endogenous molecule combining excitotoxicity,oxidative stress and other toxic mechanisms[J].Int J Tryptophan Res,2012,5:1-8.
TNF-α mediated activation of IDO pathway involved in mechanism of depression in rats induced by CUS
FU Xiao-yan,LI Hai-yan,CUI Ting,JIANG Qing-song,QIU Hong-mei
(Dept of Pharmacology,Chongqing Key Laboratory of Biochemistry and Molecular Pharmacology,Chongqing Medical University,Chongqing400016,China)
AimTo investigate the relationship between the depression-like behaviors of rats induced by chronically unpredictable stress(CUS)and the protein expression of tumor necrosis factor alpha(TNF-α),indole-2,3-dioxygenase(IDO)and 3-hydroxyl amino acid oxygenase(HAAO).MethodsThirty male Sprague Dawley(SD)rats were randomly divided into control group and model group.CUS plus solitary condition were used to establish the depression model.The open field test(OFT)and the force swimming test (FST)were used to evaluate the depression-like behaviors of rats;Western blot was used to determinethe protein expressions of TNF-α,IDO and HAAO in the prefrontal cortex and hippocampus of rats.Results Model group rats showed obvious depression-like behaviors with increasing immobile time in FST(P<0.01)and decreasing locomotive activity in OFT(P<0.01),and up-regulating the protein expression of TNF-α,IDO and HAAO in the prefrontal cortex and hippocampus significantly(P<0.05),compared with control group rats.ConclusionThe depression-like behaviors of rats induced by CUS may be associated with the activation of IDO-HAAO pathway mediated by TNF-α.
depression;CUS;TNF-α;IDO;HAAO;cytokines
10.3969/j.issn.1001-1978.2016.05.007
A
1001-1978(2016)05-0620-06
R-332;R322.81;R749.42;R977.3;R977.6
2015-12-26,
2016-01-28
国家自然科学基金资助项目(No 31400881);重庆市教委科学技术项目(No KJ1400208)
伏箫燕(1992-),女,硕士生,研究方向:神经精神药理学,E-mail:447811112@qq.com;邱红梅(1978-),女,博士,副教授,研究方向:神经精神药理学,通讯作者,E-mail:qiuhongmei@cqmu.edu.cn
