表皮生长因子受体在肾血管性高血压大鼠心血管重构中的作用
2016-09-07滕文浩姜雯雯向继洲广州医科大学药学院广东广州51136华中科技大学同济医学院基础医学院药理学系湖北武汉30030药物靶点研究与药效学评价湖北省重点实验室湖北武汉30030华中科技大学同济医学院附属协和医院麻醉科湖北武汉300
冯 梅,滕文浩,姜雯雯,向继洲,3,刘 慧,3,杨 磊(1.广州医科大学药学院,广东广州51136;.华中科技大学同济医学院基础医学院药理学系,湖北武汉30030;3.药物靶点研究与药效学评价湖北省重点实验室,湖北武汉30030;.华中科技大学同济医学院附属协和医院麻醉科,湖北武汉300)
表皮生长因子受体在肾血管性高血压大鼠心血管重构中的作用
冯梅1,2,滕文浩2,姜雯雯2,向继洲2,3,刘慧2,3,杨磊4
(1.广州医科大学药学院,广东广州511436;2.华中科技大学同济医学院基础医学院药理学系,湖北武汉430030;3.药物靶点研究与药效学评价湖北省重点实验室,湖北武汉430030;4.华中科技大学
同济医学院附属协和医院麻醉科,湖北武汉430022)
网络出版时间:2016-4-26 11:06网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160426.1106.016.html
目的表皮生长因子受体(EGFR)是一种受体型酪氨酸激酶,参与调节多种重要的细胞功能。既往研究表明,EGFR在促进心肌肥大和血管平滑肌细胞增殖中发挥了重要作用。本实验拟观察EGFR是否参与了肾血管性高血压心血管重构。方法本实验采用经典的“两肾一夹”(2K1C)Goldblatt肾性高血压大鼠模型,观察血压、左室心指数和心血管系统组织病理学变化,采用免疫组织化学和Western blot检测心肌和主动脉EGFR以及磷酸化ERK的表达。结果术后2周,2K1C大鼠收缩压急剧升高;6周后,左室心指数增加,心肌间质胶原纤维增生,胸主动脉内中膜增厚,表明肾血管性高血压诱导了心血管重构。与假手术组相比,2K1C大鼠心肌和主动脉EGFR表达增加,且与收缩压升高的程度相关(P<0.05)。磷酸化ERK 1/2的水平也明显上调。结论EGFR及下游激酶ERK 1/2参与了肾血管性高血压大鼠心血管重构,并与高血压的严重程度相关。
两肾一夹(2K1C);肾血管性高血压;心血管重构;表皮生长因子受体;MAPK;大鼠
高血压导致的心血管疾病严重危害人类健康和生命,已成为一个重大的全球性公共卫生问题。在过去的半个世纪,尽管高血压的治疗进展显著,但是高血压的患病率仍在全世界范围内明显增长[1-2]。高血压发病机制复杂,近年来证实,高血压及其并发症的发生发展与心血管重构密切相关[3]。心血管重构包括血管重构和心肌重构,是一种严重的高血压并发症。心肌重构虽然在病程初为有利的适应性反应,但长时间的心肌肥大将导致扩张性心肌病、心力衰竭甚至死亡[4]。肾血管性高血压(renovascular hypertension,RVH)是各种原因造成肾动脉狭窄或阻塞后产生的继发性高血压,是仅次于肾脏疾病导致继发性高血压的第2位原因。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种受体型蛋白酪氨酸激酶,广泛表达于包括心脏和血管的正常组织,是调控许多基本的细胞生物过程如分化、增殖、迁移等的重要因子[5]。EGFR过表达或过度刺激可以导致细胞生长紊乱和组织重构。虽然研究表明,EGFR参与了某些继发性高血压所致的心肌肥大和血管平滑肌细胞增殖的发生发展[6],但在肾血管性高血压中的作用迄今尚未见报道。因此,本实验采用“两肾一夹”(two-kidney,one-clip,2K1C)Goldblatt大鼠模型,探讨EGFR在肾血管性高血压心血管重构中的作用及机制。
1 材料与方法
1.1试剂与仪器抗EGFR、ERK兔多克隆抗体(Santa Cruz),抗p-ERK兔多克隆抗体(Cell Signa-ling),抗GAPDH鼠单克隆抗体(Abcam),BCA蛋白测定试剂盒、辣根过氧化物酶标记的羊抗兔IgG、羊抗小鼠IgG(Thermo),超敏ECL化学发光试剂盒(碧云天生物技术研究所),UltraSensitiveTMS-P免疫组化染色试剂盒(福州迈新生物技术开发有限公司),其余试剂为国产分析纯。智能无创血压计(Softron BP-98A,日本软隆株式会社),显微镜成像系统(Olympus)。
1.2实验动物清洁级♂Sprague-Dawley(SD)大鼠,体质量180~200 g[许可证SCXK(鄂)No.2004-0007],由华中科技大学同济医学院实验动物中心提供。动物分笼饲养,自由饮水摄食,室温控制在23~25℃。适应性饲养1周后,将大鼠随机分为假手术组和2K1C模型组。
1.3“两肾一夹”高血压大鼠模型的建立按照文献中经典的肾动脉钳夹方法制备2K1C Goldblatt肾性高血压大鼠模型,具体操作如下[7]:SD大鼠手术前禁食12 h,质量浓度为200 g·L-1乌拉坦腹腔注射麻醉后,常规腹部备皮,消毒,于剑突下1.5 cm行腹部正中切口暴露左肾,在近腹主动脉端左肾动脉起始部0.5 cm处放置内径为0.20~0.25 mm的自制U型铝夹,右侧肾脏不触及。术后3日内肌注青霉素30 000 U/只。假手术组大鼠除不套铝夹外,其余手术步骤均相同。术后每周测量大鼠体重和血压各1次,共饲养6周。
1.4大鼠血压的测定采用智能无创血压计检测大鼠清醒状态下尾动脉血压,测量前大鼠全身和鼠尾局部预热10~15 min后开始测量。每只大鼠重复测量5次,每次间隔不少于1 min,取平均值[8]。术前预先测定收缩压3 d。然后,在每周的同一时刻点检测血压直到实验结束。术前最后一次血压作为统计学比较时的基础血压。术前收缩压以11.0~16.0 kPa为正常范围,术后血压较术前高4.0 kPa以上并且同时大于或等于20.0 kPa,手术侧肾脏无梗死、萎缩或纤维化者为高血压模型复制成功[9]。
1.5左室肥大的检测所有大鼠6周末处死后迅速开胸取出心脏,4℃预冷的生理盐水清洗、滤纸吸干,称重,计算心指数[心脏重量(heart weight,HW)与体重(body weight,BW)之比]。然后去除大血管残根、左、右心房和右心室游离壁,保留左心室及室间隔,电子天平精确称重作为左心室重量。左心室重量指数(left ventricular mass index,LVMI)为左心室重量(left ventricular weight,LVW)与体重(body weight,BW)之比。计算左心室重量指数和心指数以评价左心室肥厚程度。
1.6心脏和胸主动脉的病理形态学检测大鼠处死后,迅速取出胸主动脉和心脏置于预冷的质量浓度为40 g·L-1多聚甲醛中4℃固定24 h。石蜡包埋、切片、苏木精-伊红染色,光学显微镜下观察并拍片,ImageJ软件测量胸主动脉内中膜厚度(intima-media thickness,IMT),即从管腔内表面到中膜和外膜之间的内表面的距离,每条动脉随机取5个横切面,取平均值。另外,心肌纤维化的程度采用Masson染色法来检测[10]。
1.7免疫组化检测大鼠主动脉EGFR采用即用型S-P免疫组化染色试剂盒,步骤如下:脱蜡、水化、抗原修复,每张切片依次加入50 μL过氧化酶阻断溶液、正常动物血清孵育10 min后,抗EGFR抗体4℃孵育过夜。次日依次加入生物素标记的IgG抗体和链霉菌抗生物素-过氧化物酶溶液,室温下孵育15 min。最后加入二甲苯联苯胺(DAB)溶液,显微镜下观察3~10 min后终止显色反应,苏木精复染、脱水、透明、封片。结果判定:EGFR阳性表达细胞质及细胞膜呈棕黄色颗粒,阴性表达细胞呈蓝紫色。
1.8心肌EGFR、p-ERK和ERK的Western blot检测心肌Western blot的分析如前所述[11]。取大鼠心尖部组织约100 mg剪碎,加入RIPA裂解液在冰浴上匀浆。4℃ 12 000×g离心收集上清液,BCA法测定蛋白含量。50 μg蛋白样品加样,恒压电泳后转移至NC膜上,牛血清白蛋白中室温封闭1 h。NC膜分别用兔抗EGFR、p-ERK、ERK抗体、鼠抗GAPDH抗体4℃孵育过夜,辣根过氧化物酶标记IgG室温孵育1 h;ECL显色、压片。采用ImageJ图像分析软件进行半定量分析。
2 结果
在2K1C大鼠组,3只大鼠在实验过程中死亡,另外3只没有出现高血压排除在研究之外。因此,共有20只大鼠用于后续实验,其中2K1C组9只,假手术组11只。
精准扶贫的根本是公共财政资金。赣州作为一个欠发达地区,怎样把有限的资金集中在刀刃上,是一个很大的考验。
2.12K1C大鼠收缩压2K1C和假手术组所有大鼠基础血压值相似[(15.5±1.8)kPa vs(15.7± 2.0)kPa],术后2周,2K1C大鼠收缩压急剧升高达21.3 kPa以上,与假手术组相比差异有显著性[(22.1±5.8)kPa vs(15.6±1.7)kPa,P<0.01],至6周末实验结束时,2K1C组大鼠收缩压较基础血压升高33.6%(Fig 1,P<0.01),以上结果表明肾血管性高血压大鼠模型建立成功。

Fig 1 Systolic blood pressure measured with a tail-cuff at pre-and post 2K1C operation periods
2.22K1C大鼠左心室重量指数的变化左心室重量指数(LVMI)是反映左室肥大最直观的指标之一。所有大鼠生长情况相似,各组之间实验末的体重和心指数没有明显差异(数据未显示)。与假手术组相比,2K1C大鼠左心室重量指数增加了18%左右(Tab 1、Fig 2A,P<0.05)。

Tab 1 Changes of left ventricular mass index at pre-and post 2K1C operation periods
2.3心肌HE染色心肌HE染色结果如Fig 2B所示,假手术组心肌纤维排列成束,心肌细胞染色均匀,分支走行清楚;心肌细胞的间隙均匀,肌束内见少量结缔组织。肾血管性高血压大鼠心肌存在多种高血压和心肌梗死的病理改变。心肌细胞排列紊乱,分支走行不规则,染色不均匀,心肌纤维肿胀甚至断裂,细胞间隙变窄,肌束内可见局灶性纤维组织增生,炎细胞浸润。在高倍视野中可见心肌细胞肥大、坏死,细胞核消失,空泡形成。
2.4心肌胶原纤维心脏胶原纤维沉积导致的纤维化如Fig 2C所示。Masson染色的心肌切片光镜下观察,胶原纤维呈蓝色,心肌细胞呈红色。假手术组大鼠心肌壁内小血管外膜或周围可见少量胶原纤维,走行规则,不向周围间质延伸。心肌间质内仅有少量胶原沉积。高血压大鼠心肌内血管周围的胶原增生明显,长距离延伸至间质中。心肌细胞间胶原异常堆积,排列散乱,呈栅栏状紧裹心肌细胞。
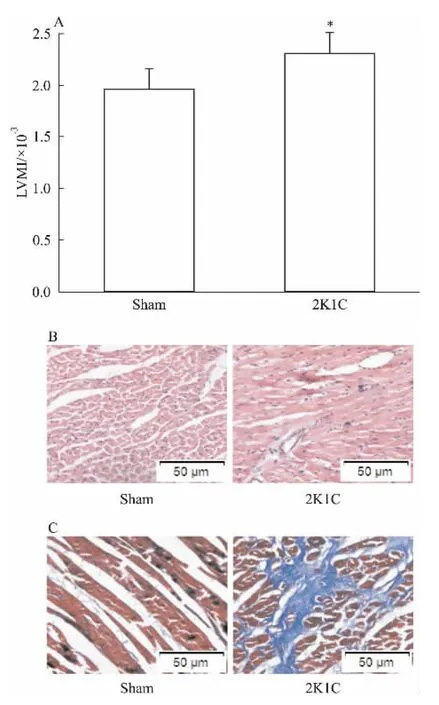
Fig 2 Changes of heart in 2K1C rats
2.5肾血管性高血压大鼠胸主动脉病理形态学变化实验6周末,胸主动脉HE表明(Fig 3A),假手术组胸主动脉各层结构正常,中膜可见完整、丰富的弹力纤维。肾血管性高血压大鼠胸主动脉内膜有断裂;中膜细胞排列紊乱,较明显的细胞肿胀、疏松、淡染,内膜下细胞空泡样变、胞核固缩;外膜较多炎细胞浸润,以淋巴细胞为主;病变严重处中膜全层空泡样变,中膜明显变薄,弹力纤维消失,细胞核淡染,溶解消失、结构破坏等梗死样变。除此之外,2K1C高血压模型组的血管中膜厚度高于假手术组(Fig 3B,P<0.05)。

Fig 3 Morphological changes of aorta in 2K1C rats(n=6)
2.62K1C大鼠心肌EGFR的表达为了探讨EGFR是否参与了2K1C肾血管性高血压大鼠心血管的重构,本实验采用Western blot的方法检测了大鼠心肌EGFR蛋白的表达。结果显示,与假手术组相比,2K1C大鼠心肌EGFR表达明显增加(Fig 4A、4B,P<0.05)。
为评价EGFR表达与血压的相关性,按照收缩压的水平将2K1C大鼠分为2组:第1组收缩压低于20.0 kPa,第2组收缩压高于20.0 kPa,每组的平均血压分别为(18.1±0.9)kPa(n=4)和(23.0± 4.4)kPa(n=5)。每组EGFR与GAPDH的比值如Fig 4C所示。与假手术组相比,两组EGFR的表达均增加,而且第2组的EGFR/GAPDH的比值要高于第1组(P<0.05)。以上结果表明,随着血压升高,心肌EGFR蛋白的表达也相应增强。
2.72K1C大鼠心肌ERK的表达ERK 1/2是EGFR的下游激酶,同时ERK 1/2信号通路是参与细胞增殖的重要途径。研究发现,ERK 1/2在心肌肥大和纤维化的发生发展中具有重要的作用[12]。

Fig 4 Change of EGFR expression in rat heart after 2K1C operation.
因此,我们进一步探讨了MAPK-ERK信号通路是否参与了肾血管性高血压诱导的心肌重构。Western blot(Fig 5A)和定量分析(Fig 5B、5C)的结果显示,与假手术组相比,2K1C高血压大鼠心脏ERK的磷酸化水平增加(P<0.01),其中第2组pERK/ERK的比值高于第1组(P<0.01)。这些结果表明,2K1C高血压大鼠EGFR的下游激酶ERK表达也发生了相应改变。
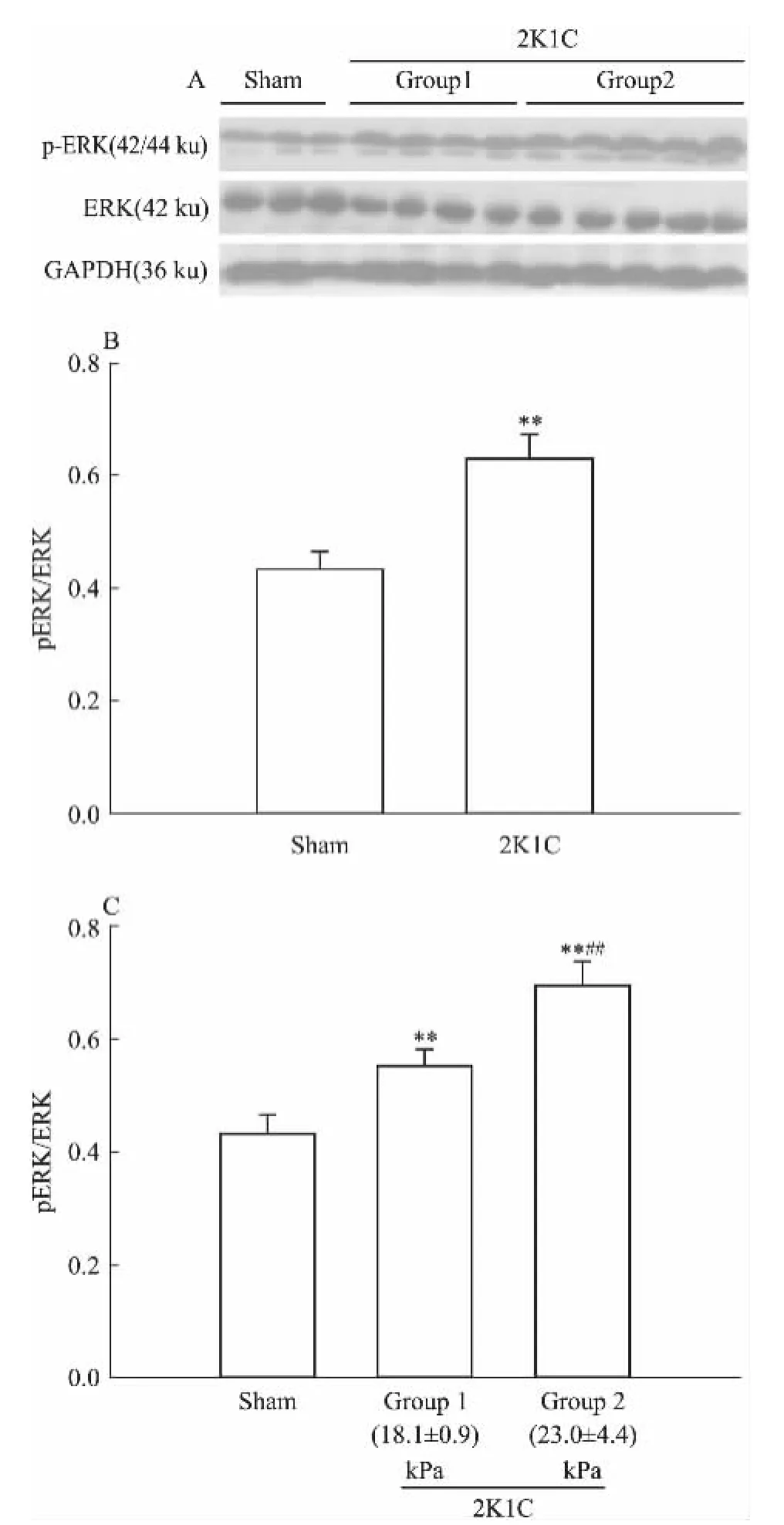
Fig 5 Change of the activation of ERK in rat heart after 2K1C operation
2.82K1C大鼠胸主动脉EGFR的表达我们进一步检测了胸主动脉EGFR的表达。免疫组化分析显示,2K1C大鼠胸主动脉EGFR表达以血压依赖性的方式明显增强,尤其在血管的内膜和中膜。反之,假手术组EGFR表达水平较低(Fig 6)。此结果提示EGFR可能参与了2K1C肾血管性高血压血管重构的发生。

Fig 6 Change of EGFR expression in rat aorta after 2K1C operation
3 讨论
本研究结果表明,2K1C大鼠心肌和主动脉中EGFR及其下游激酶ERK 1/2表达上调,并且与高血压的严重程度相关。EGFR可能参与了肾血管性高血压大鼠心血管重构的发生和发展。
肾血管性高血压的发病率为1%~10%,在恶性高血压合并肾功能不全者的患者可达30% ~40%。由于这类高血压可以通过内外科治疗得到有效控制,肾脏病变和肾功能在一定程度上具有可逆性,因此深受临床医生的重视。“两肾一夹”型肾血管性高血压大鼠模型成模迅速稳定、操作简单、存活率高,而且易并发左室肥厚,在高血压动物实验中应用广泛。由于肾脏灌注压下降,导致肾素过度释放并持续激活肾素-血管紧张素-醛固酮系统,这种情况类似2K1C的高血压动物模型的发生机制。本研究采用高肾素型高血压的2K1C大鼠模型,术后6周,15只中有9只形成了稳定的高血压。
心血管重构是高血压性心血管疾病的共同病理基础,也是决定高血压患者预后的主要因素之一。在一系列病理学参数中,LVMI是反映左室肥大最直观的指标之一,动脉中膜厚度最能直接反映血管壁的重构程度。在本实验中我们发现,2K1C高血压大鼠不仅左心室指数增大,心肌间质和血管周围均存在明显纤维化,而且主动脉中膜明显增厚,提示“两肾一夹”高血压模型伴有明显的心血管重构现象。
EGFR是一种受体型酪氨酸激酶,高度表达于多种肿瘤细胞上,在调节恶性肿瘤的生长和增殖中起着重要的作用。因此,EGFR与肿瘤的相关性以及以它为靶点的肿瘤靶向治疗一直是肿瘤研究领域的热点问题[13]。近来有研究显示,EGFR对于促进胚胎期心脏的发育及维持成体心脏的功能方面都具有重要的意义,参与了多种心脏病理过程的发生发展[14-15]。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)通过激活生长相关性信号转导通路在心血管重构中发挥着关键作用。研究发现,AngⅡ诱导有丝分裂,促进心肌生长是由EGFR活化介导的。本实验的Western blot和免疫组化的结果表明,2K1C大鼠心肌和主动脉的EGFR表达明显上调,而且与高血压的程度存在着相关性。这些结果为EGFR参与肾血管性高血压所致的心血管重构提供了直接证据。
对各种生长因子来说,酪氨酸激酶激活在有丝分裂的信号转导通路中是基本的步骤。在EGFR下游的信号转导通路中,MAPKs/ERK通路是介导细胞增殖、分化最重要的酪氨酸激酶通路。大量研究报道,EGFR通过激活ERK在自发性高血压和Ang II诱导的左室肥大中起着重要的作用。我们的研究也发现,2K1C大鼠心肌中磷酸化ERK的表达水平呈血压依赖性的上调,其变化趋势与EGFR一致。因此,EGFR参与肾血管性高血压心血管重构的机制可能部分是通过激活MAPK/ERK信号通路,EGFR可能是防治肾血管性高血压心血管重构的新靶点。
[1]Ibrahim M M,Damasceno A.Hypertension in developing countries[J].Lancet,2012,380(9841):611-9.
[2]Chobanian A V.Shattuck Lecture.The hypertension paradox-more uncontrolled disease despite improved therapy[J].N Engl J Med,2009,361(9):878-87.
[3]周文婷,王雪飞,邬利娅·伊明,等.榅桲总黄酮对自发性高血压大鼠心肌肥厚的抑制作用及机制研究[J].中国药理学通报,2015,31(11):1540-6.
[3]Zhou W T,Wang X F,Yiming W,et al.Effect of total flavonoids of Cydonia oblonga Mill.on myocardial hypertrophy in spontaneously hypertensive rats and mechanisms[J].Chin Pharmacol Bull,2015,31(11):1540-6.
[4]Cokkinos D V,Pantos C.Myocardial remodeling,an overview [J].Heart Fail Rev,2011,16(1):1-4.
[5]Ceresa B P,Peterson J L.Cell and molecular biology of epidermal growth factor receptor[J].Int Rev Cell Mol Biol,2014,313:145 -78.
[6]Li Y,Levesque L O,Anand-Srivastava M B.Epidermal growth factor receptor transactivation by endogenous vasoactive peptides contributes to hyperproliferation of vascular smooth muscle cells of SHR[J].Am J Physiol Heart Circ Physiol,2010,299(6):H1959-67.
[7]Alam M A,Chowdhury M R,Jain P,et al.DPP-4 inhibitor sitagliptin prevents inflammation and oxidative stress of heart and kidney in two kidney and one clip(2K1C)rats[J].Diabetol Metab Syndr,2015,7:107.
[8]Pfeffer J M,Pfeffer M A,Frohlich E D.Validity of an indirect tail-cuff method for determining systolic arterial pressure in unanesthetized normotensive and spontaneously hypertensive rats [J].J Lab Clin Med,1971,78(6):957-62.
[9]Huang W C,Wu J N.Blunted renal responses to atrial natriuretic peptide and its reversal by unclipping in one-kidney,one clip Goldblatt hypertensive rats[J].J Hypertens,1997,15(2):181 -9.
[10]Wang Y,Wang L,Zhang F,et al.Inhibition of PARP prevents angiotensinⅡ-induced aortic fibrosis in rats[J].Int J Cardiol,2013,167(5):2285-93.
[11] Feng M,Xiang J Z,Ming Z Y,et al.Activation of epidermal growth factor receptor mediates reperfusion arrhythmias in anaesthetized rats[J].Cardiovasc Res,2012,93(1):60-8.
[12]Ruppert C,Deiss K,Herrmann S,et al.Interference with ERK (Thr188)phosphorylation impairs pathological but not physiological cardiac hypertrophy[J].Proc Natl Acad Sci USA,2013,110 (18):7440-5.
[13]Russo A,Franchina T,Ricciardi G R,et al.A decade of EGFR inhibition in EGFR-mutated non small cell lung cancer(NSCLC):old successes and future perspectives[J].Oncotarget,2015,6 (29):26814-25.
[14]Sun X,Liang J,Yao X,et al.The activation of EGFR promotes myocardial tumor necrosis factor-α production and cardiac failure in endotoxemia[J].Oncotarget,2015,6(34):35478-95.
[15]Liang D,Zhong P,Hu J,et al.EGFR inhibition protects cardiac damage and remodeling through attenuating oxidative stress in STZ-induced diabetic mouse model[J].J Mol Cell Cardiol,2015,82:63-74.
Epidermal growth factor receptor involvement in
cardiovascular remodeling in renovascular hypertensive rats
FENG Mei1,2,TENG Wen-hao2,JIANG Wen-wen2,XIANG Ji-zhou2,3,LIU Hui2,3,YANG Lei4
(1.School of Pharmaceutical Sciences,Guangzhou Medical University,Guangzhou511436,China;2.Dept of Pharmacology,School of Basic Medicine,Tongji Medical College,Huazhong University of Science and Technology,Wuhan430030,China;3.Key Laboratory for Drug Target Researches and Pharmacodynamic Evaluation of Hubei Province,Wuhan430030,China;4.Dept of Anesthesiology,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan430022,China)
AimTo determine the possibilities andmechanisms of EGFR,a receptor protein tyrosine kinaseassociated with many important cellular processes responsible for cardiovascular remodeling in renovascular hypertensive rats.Methods2K1C hypertensive rats were used in the present study.Blood pressure was measured with the tail-cuff method.LVMI and histopathological changes in the cardiovascular system were analysed.EGFR expressions of aorta and myocardium as well as phosphorylation levels of ERK in hypertensive rats were detected by immunohistochemistry and Western blot analysis,respectively.ResultsSystolic blood pressure was markedly increased 2 weeks after 2K1C surgery.Cardiovascular remodeling induced by hypertension was confirmed by elevated LVMI,proliferation of collagen fibers in myocardial interstitium,histopathological changes in cardiovascular system and increased IMT of thoracic aorta 6 weeks after 2K1C surgery.Compared with sham rats,EGFR expression in the ventricular myocardium of 2K1C rats was significantly increased at 6 weeks(P<0.05),and the EGFR/GAPDH ratio was higher in 2K1C rats with higher systolic blood pressure(P<0.05).Phosphorylation level of ERK 1/2 was upregulated correspondingly in 2K1C rats(P<0.01).Increased EGFR expression was also found in aortas of 2K1C rats,particularly in tunica intima and media.ConclusionEGFR and its down-stream kinases ERK 1/2 are involved in cardiovascular remodeling in association with the severity of hypertension in renovascular hypertensive rats.
two-kidney,one-clip(2K1C);renovascular hypertension;cardiovascular remodeling;epidermal growth factor receptor;mitogen-activated protein kinases;rat
10.3969/j.issn.1001-1978.2016.05.008
A
1001-1978(2016)05-0625-07
R-332;R331.31;R331.32;R392.11;R544.1;R977.3
2016-01-25,
2016-02-26
国家自然科学基金资助项目(No 81370299);中央高校基础研究基金(No 2012QN135);广州医科大学博士启动基金(No 2012C04)
冯梅(1971-),女,博士,讲师,研究方向:心血管药理学,E-mail:fengmei20134@yahoo.com;杨磊(1973-),男,硕士,副主任医师,研究方向:心血管麻醉学,通讯作者,E-mail:yanglliuh@sina.com