青蒿-鳖甲药对配伍治疗系统性红斑狼疮小鼠的代谢组学研究
2016-09-07谢志军温成平浙江中医药大学基础医学院浙江杭州30053浙江省医学科学院安全性评价研究中心浙江杭州3003
陈 娟,邓 军,周 佳,谢志军,甘 静,温成平(.浙江中医药大学基础医学院,浙江杭州 30053;.浙江省医学科学院安全性评价研究中心,浙江杭州 3003)
青蒿-鳖甲药对配伍治疗系统性红斑狼疮小鼠的代谢组学研究
陈娟1,邓军2,周佳1,谢志军1,甘静1,温成平1
(1.浙江中医药大学基础医学院,浙江杭州310053;2.浙江省医学科学院安全性评价研究中心,浙江杭州310013)
网络出版时间:2016-4-26 11:06网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160426.1106.052.html
目的研究系统性红斑狼疮(SLE)小鼠(MRL/lpr)经青蒿-鳖甲药对治疗后血清代谢物的变化,探讨SLE发病及药物作用机制。方法采集对照组、SLE模型组和青蒿-鳖甲药对治疗组(低、高剂量组)小鼠的血清样本,应用高效液相色谱-四级杆-飞行时间质谱联用系统(HPLC-Q-TOF/ MS),对样本进行代谢图谱分析。应用Mass Hunter和MPP软件处理数据,数据模式识别采用有监督的偏最小二乘法-判别分析(PLS-DA)。结果代谢组学分析发现,SLE模型小鼠存在较明显的脂代谢紊乱。与模型组相比,药物组可以改善狼疮鼠体内脂质代谢异常,影响SLE疾病血栓的发生发展;并且可以改善SLE小鼠急性期的炎症反应,减少其病理损害。结论青蒿-鳖甲药对通过调节SLE小鼠的脂质代谢及炎症反应对其发挥一定的治疗作用。
青蒿-鳖甲药对;系统性红斑狼疮;小鼠;血清;代谢组学;液相色谱-四级杆-飞行时间质谱
药对是中药配伍形式中的一种,从某种角度上讲,药对的配伍与应用具有特别的意义。所谓中药药对又称对药、对子药、姐妹药,专指临床上常用的相对固定的两味药物的配伍形式,是中药配伍中的最小单位[1]。由于研究单味药难以反映出其在复方中的真实作用,而复方由于药味多,作用关系复杂,对其研究也难以得出准确结论。“药对”作为药配伍中的雏形,对其研究恰好可以弥补上述不足。复方中的核心药对,在中药理论中具有相互增效并调和药性,引药归经的作用。
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫性疾病。研究认为,SLE的发生主要由于先天肾阴亏虚,以致五脏之精生化乏源,形成以阴虚内热为本的狼疮体质[2]。根据病因病机特点,结合症状分析,及古代医家选方用药特点,辨证论治,范永升等[3]确立了解毒祛瘀滋阴疗法,按照以法制方的原则,通过处方、药物筛选及临床经验,确立解毒祛瘀滋阴方,青蒿、鳖甲为该方的核心组分,两药相配,有“青蒿不能直入阴分,有鳖甲领之入也;鳖甲不能独出阳分,青蒿领之出也”之妙。
代谢组学借助高通量、高灵敏度与高精确度的现代技术,分析生物样本如血液、尿液中的内源性代谢物,可以根据代谢物的变化,发现生物标志物,阐明药物作用的整体效应,包括协同作用,其思想具有与中医理论整体观念相一致的特点。作为系统生物学的重要组成部分,代谢组学已被广泛应用于各类复杂疾病的作用机制研究[4]。其中,超高效液相质谱联用(UPLC/Q-TOFMS)是目前用于分析的一种强有力的方法[5]。本实验拟选择解毒祛瘀滋阴方中的青蒿、鳖甲作为药对配伍,应用代谢组学技术研究其干预狼疮鼠后血清代谢标志物的变化规律,筛选、鉴定与疾病相关的代谢标记物,探讨青蒿-鳖甲药对对SLE的治疗机制。
1 材料
1.1实验动物2月龄C57BL/6小鼠12只,MRL/ lpr狼疮鼠36只,由上海斯莱克实验动物有限责任公司提供,实验动物生产许可证号:SCXK(沪)2012-0002,实验用基础饲料由浙江中医药大学动物实验中心提供[6]。
1.2实验药品与试剂青蒿、鳖甲生药材由浙江中医药大学饮片厂提供。青蒿鳖甲提取液由浙江中医药大学附属医院制剂室制备(浓度:含生药量0.5 g每毫升),-20℃保存备用[6]。甲酸(分析纯,阿拉丁公司),甲醇(色谱级,美国Tedia公司),乙腈(色谱级,美国Tedia公司),质谱参比液和校准液为美国安捷伦公司所提供。
1.3实验仪器1260 infinity高效液相色谱仪,E-clipse Plus C18色谱柱,Agilent 6520 Q-TOF/MS质谱系统,均购自美国Agilent公司;Centrifuge 5417R高速冷冻离心机(德国,Eppendorf公司);Milli-Q Biocel纯水仪(美国,Millipore公司);Mass Hunter软件(美国,Agilent Technologies公司);Mass Profiler Professional(MPP)软件(美国,Agilent Technologies公司)。
2 方法
2.1动物实验36只MRL/lpr小鼠♀,12只C57BL/6小鼠♀,由浙江中医药大学动物实验中心饲养(SPF级)。适应性喂养1周后,分为对照组(C57BL/6小鼠)、模型组及青蒿-鳖甲治疗组(低、高剂量)。对照组及模型组每日灌胃生理盐水1次,每只0.5 mL。低、高剂量组以相当于正常成人每日用量5、10倍剂量给药,分别为0.1、0.2 mL· (10 g)-1(水煎液),每日1次,连续饲养用药2个月。采血前小鼠禁食12 h,眼球取血,收集血液3 000 r·min-1离心15 min,分离血清,-80℃保存备用[6]。
2.2血清样本前处理血清样本在室温下解冻后,离心后取出100 μL,加入300 μL乙腈沉淀蛋白[7],涡旋震荡1 min,静置10 min,然后4℃低温高速离心10 min(12 000 r·min-1),400 μL血清样品用0.22 μm微孔滤膜过滤,弃去初始滤液,样品即可进行液相质谱分析。从4个实验组样本中抽取等体积血清混合制成质控样本,前处理方法与待测样本相同。
2.3色谱条件与质谱条件依据本实验室前期建立的条件进行优化,最终确定的色谱条件:流动相A 为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液,采用梯度洗脱(0~2 min,20%B;2~13 min,20%~75%B;13~18 min,75% ~85%B;18~25 min,85%~95%B),后运行时间为5 min。自动进样器温度为4℃,柱温为35℃。
对质谱系统进行优化,优化后的主要参数是:采用电喷雾离子源ESI正离子模式。扫描范围m/z 50 ~1 000,干燥气为N2,干燥气温度为350℃,正离子模式毛细管电压分别为4 000 V,碎裂电压为170 V,锥孔电压为65 V,雾化器压力为275.8 kPa。使用Centroid模式保存质谱数据,数据采集速率为2 spectrum·s-1。数据采集过程中,参比液实时监测校准质谱系统。二级质谱数据采集时,碰撞能分别设置为40 eV,二级质谱采集速率为2 spectrum·s-1[8]。
2.4数据处理使用Agilent Mass Hunter分析软
件中分子特征提取 (molecular feature extraction,MFE)处理代谢物信息。提取离子丰度阈值为200,基峰丰度阈值为1 000,正离子模式加和离子种类为[M+H]+。提取后代谢物信息包括保留时间、精确质量数和丰度,将提取后的数据转存为CEF格式文件,利用MPP软件进行数据预处理。使用PLS-DA的载荷图筛选出对分类贡献较大的化合物,进一步通过 VIP(variable importance in projection)值(>1.5)确定生物标志物,利用方差分析对数据进行统计学分析。利用PLS-DA对数据矩阵进行模式识别。根据精确的质量数和二级质谱图,利用METLIN、HMDB和PubChem等数据库鉴定潜在标记物。
3 结果
3.1LC-MS分析如Fig 1所示,实验得到各组血清样本的TIC图之间存在一定差异。为保证数据的可靠性,在采集过程中,每间隔8个样本进样一次质控样本,以监测系统的稳定性。分析质控样本的TIC图,分保留时间(前、中、后),采用5个特征峰的离子精确质量、保留时间和峰面积数据。结果显示,所选特征峰的保留时间偏移<0.01 min,各个峰面积RSD<10%,精确质量的数漂移值小于2 ppm。由此可见,在血清样本数据采集过程中,系统稳定,采集数据可靠。
3.2数据分析对4组小鼠的代谢图谱进行PCA主成分分析(Fig 2),发现SLE模型组和对照组明显地分离,说明2组小鼠血清中代谢物种类或者数量上存在一定差异。在此基础上,我们进一步采用PLS-DA对各组数据进行分型,由得分图结果可以看出(Fig 3),SLE组较对照组有明显的向左偏移。青蒿-鳖甲配伍治疗后,代谢图谱偏移得到有效的缓解,治疗组与对照组在得分图中趋于靠近,表明代谢产物差异相对减小,说明青蒿-鳖甲药对配伍对SLE小鼠有治疗作用。
3.3差异代谢物的鉴定根据差异代谢物的精确相对分子质量和二级质谱图,鉴定差异代谢物。其中10种差异代谢物得到鉴定(Tab 1),各个差异代谢物在各组中的峰面积变化如Fig 4所示。
3.4代谢物变化趋势血清中代谢物的变化趋势反映了机体代谢变化,SLE发病或药物干预都可能会引起正常代谢图谱的改变。对照组和SLE模型组的PLS-DA分析,鉴定出10个SLE的代谢标记物(Tab 1),分析这些代谢标记物在给药前后相对含量的变化(Fig 4),发现在SLE模型组中代谢标记物含量与对照组相比差异有显著性(P<0.05),说明SLE对小鼠血清中代谢物含量有较大的影响。青蒿-鳖甲药对治疗组小鼠代谢标记物中,血小板活化因子(Lyso-PAF C-16,enantio-PAF C-16)、L-α-溶血卵磷脂(L-α-Lyso phosphatidylcholine)、G9a/ GLP组蛋白甲基转移酶抑制剂(UNC0638)、L-丁酰基肉碱(Butyryl-L-carnitine,C4)、前列腺素 B3 (PGB3)和乙烷磺酸[(Z)-2-tetracos-15-enamido ethanesulfonic acid]较SLE模型组含量差异有显著性(P<0.05),代谢标记物含量回调作用明显。这些代谢标记物含量的回调,体现了青蒿-鳖甲药对配伍对SLE模型小鼠疾病代谢的调节作用。
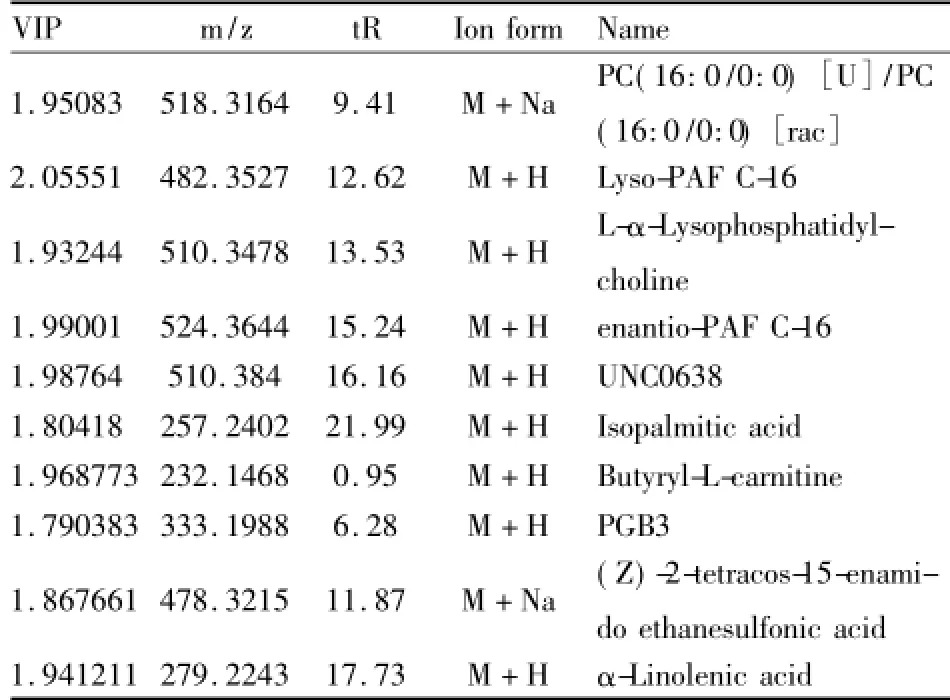
Tab 1 Identification results of differential metabolites
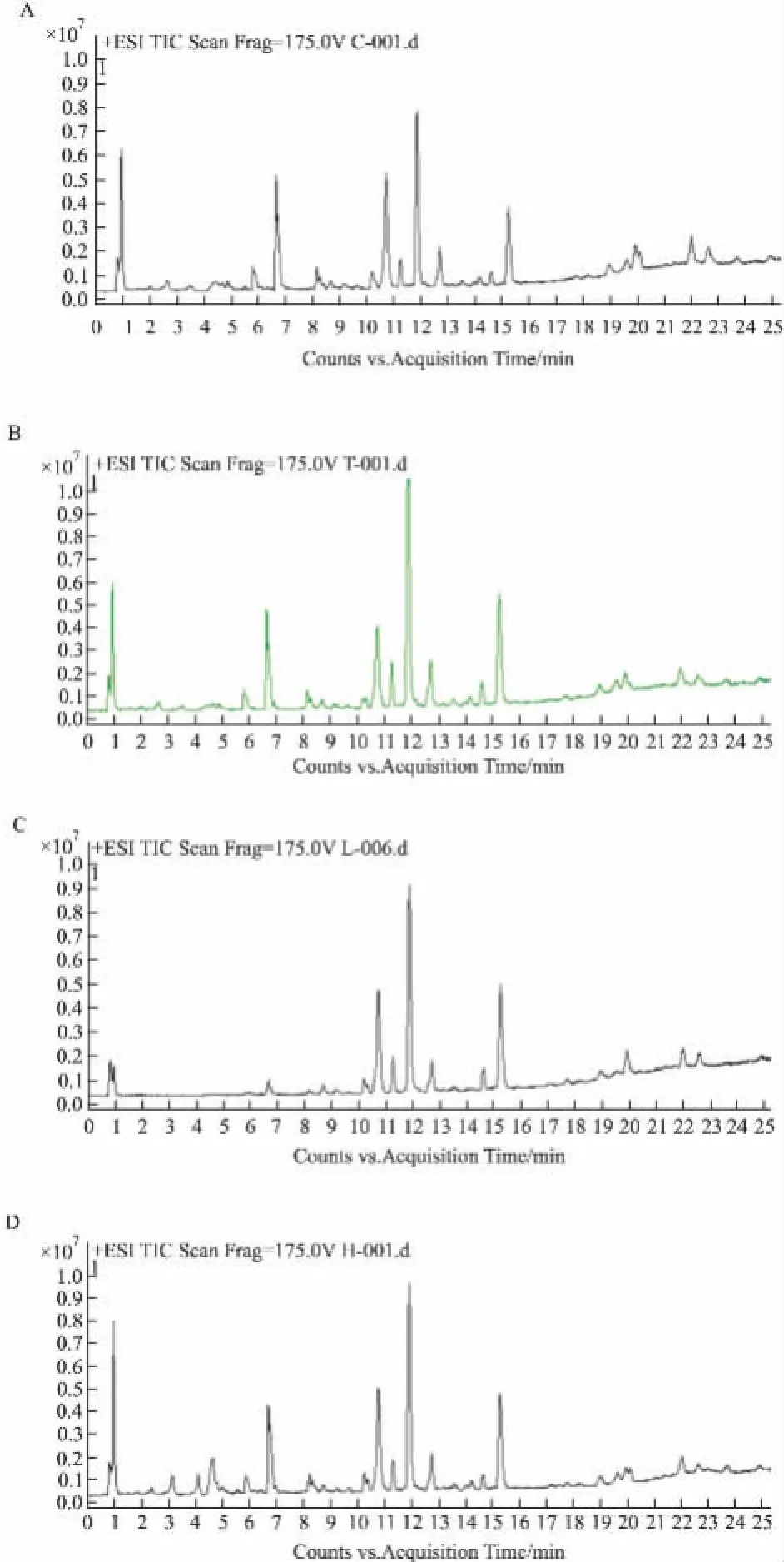
Fig 1 Representative TIC chromatograms of control group(A),SLE model group(B)and Qinghao-Biejia treatment group[low(C)and high(D)dose]

Fig 2 Score plots of PCA analysis in positive ion mode

Fig 3 Score plots of PLS-DA analysis in positive ion mode
4 讨论
正常组小鼠、模型狼疮鼠及给药组狼疮鼠的血清经过PCA和PLS-DA分析,结合图谱表明,与模型组相比,青蒿-鳖甲治疗组可以降低狼疮鼠体内L-α-溶血卵磷脂(溶血磷脂1,LPC)的含量。溶血磷脂是磷脂的降解产物,由于最常用的磷脂为卵磷脂,因而溶血磷脂一般是指LPC,其具有高度细胞毒性,可破坏细胞膜的磷脂层。体内卵磷脂代谢产生LPC的过程由磷脂酶A1和磷脂酶A2催化。磷脂酶A2可催化甘油磷脂的第2位酯键断裂,生成溶血磷脂
Fig 4Charts of different metabolite peak area*P<0.05,**P<0.01 vs SLE model 1,即L-α-溶血卵磷脂。磷脂酶A2参与自身免疫病的病理损伤过程,它又与自由基的产生密切相关。有研究表明,SLE患者体内磷脂酶A2活性较正常人升高,且活动期较非活动期增高,可能的机制为磷脂酶A2水解膜磷脂产生的LPC及其代谢产物,产生多器官损害[9-10]。本研究结果显示,模型组血清中LPC含量较正常组明显升高,结合以上观点,可以判断与SLE疾病的发展有密切关系,青蒿-鳖甲治疗组干预后LPC水平明显下调,说明该药对的干预可以减弱LPC对细胞的毒性作用和对器官的损害,有助于SLE疾病的缓解和治疗。
补体系统是机体免疫应答过程中的一个重要的效应系统,具有溶病毒、溶细胞、溶菌等免疫调节作用,并有清除免疫复合物以及炎症介质作用。C4是补体经典激活途径的一个重要组分。补体的各组分在不同激活物的作用下,可循经典途径或替代途径被顺序活化,参与机体的特异性和非特异性效应机制;同时,补体活化也可能导致对机体组织的损伤。研究发现,补体异常与SLE疾病的发生发展有密切的关系。无论临床观察还是动物实验均证实,补体成分在SLE发病中的作用具有双重性,一方面补体蛋白缺陷或水平低下个体易患SLE,补体的存在对抵抗SLE的发生提供一定的保护作用;另一方面,补体活化的直接作用和对免疫细胞功能的影响可加重SLE的病理损害,影响SLE病程的发展和临床表现[11]。本研究结果表明,模型组小鼠C4表达水平升高,C4含量升高常见于风湿热的急性期。经典理论认为,自身抗原和抗体结合形成免疫复合物,进而激活补体,造成炎症反应和组织损伤。提示可能与狼疮鼠急性期炎症相关,而青蒿-鳖甲治疗组尤其是高剂量组明显降低了C4的含量,提示青蒿鳖甲药对可以改善SLE小鼠急性期的炎症反应,减少其病理损害。该结果进一步证实了我们前期的研究成果[6],发现青蒿-鳖甲药对能抑制小鼠血清中炎性因子IL-6的分泌,明显降低血清中IFN-γ的水平,从而减少了因自身免疫复合物的分泌而造成的病理性损害[12]。
血小板活化因子(platelet activating factor,PAF)主要由中性粒细胞、血小板和巨噬细胞等产生,是具有广泛生物活性的磷脂类递质,参与人体多种生理、病理过程。PAF需和PAF受体结合才能产生生物活性。SLE患者经常合并动、静脉血栓形成,是血栓栓塞性疾病的高危因素。2009年,美国研究1 930例SLE病例的结果显示,22%的SLE患者合并动、静脉血栓。SLE发生血栓性疾病的危险性是其它风湿性疾病的9.6倍[13-14]。临床和实验证实,血栓形成的病理过程会伴有不同程度的血小板活化,活化的血小板释放出许多生物活性物质,这些活性物质可以使SLE体内的免疫复合物沉积于小血管内膜、肾小球基底膜、关节等部位,激活补体引起炎症等[13]。且有报道研究发现,PAF水平与SLE疾病活动性指数相关,可作为评估SLE病情活动性的指标之一[15]。本研究结果发现,高剂量药物治疗组可以明显降低Lyso-PAF C-16和enantio-PAF C-16的水平,因此推测青蒿-鳖甲干预后可以抑制PAF的活化,从而影响SLE血栓的发生发展。
由必需脂肪合成而来的前列腺素,可以使细胞对激素变得敏感。必需脂肪的缺乏,或者将必需脂肪转换成前列腺素的营养素(如维生素B3、维生素C和生物素等)的缺乏,都会造成与激素失调相关的症状。狼疮鼠模型组前列腺素B3(PGB3)与正常对照组相比明显降低,但药物组干预后PGB3水平明显升高,恢复正常,提示青蒿-鳖甲可以改善SLE引起的激素水平紊乱的状况。
综上所述,通过运用代谢组学技术鉴定疾病及用药后狼疮鼠血清差异代谢物,发现青蒿-鳖甲药对配伍作用后影响了体内一些疾病相关代谢物,尤其是脂质代谢和免疫相关因子,推测其可能为药物作用的关键靶点,为治疗SLE疾病复方的开发和进一步研究奠定了理论基础。
(致谢:本文实验在浙江中医药大学基础医学院中医临床基础研究所完成,在整个研究完成过程中得到了温成平教授、丁兴红教授、孔宏伟副研究员及谢志军副研究员的悉心指导和热忱帮助,在此深表谢意!)
[1]杨鸿珠,龚雨萍.中药药对的研究进展与研究[J].中国中西医结合杂志,2010,30(2):218-20.
[1]Yang H Z,Gong Y P.Research progress and thinking of Chinese herbal medicine[J].Chin J Integr Tradit West Med,2010,30 (2):218-20.
[2]徐莉,季巾君,范永升,等.解毒祛瘀滋肾方对MRL/lpr狼疮小鼠肾组织GRα的调控作用研究[J].中国中西医结合杂志,2011,31(11):1527-30.
[2]Xu L,Ji J J,Fan Y S,et al.Study on the regulation of Jiedu Quyu Zishen Recipe on glucocorticoid receptor α in the renal tissue of MRL/Ipr mice[J].Chin J Integr Tradit West Med,2011,31 (11):1527-30.
[3]范永升,温成平,吴国琳,等.解毒祛瘀滋阴法对系统性红斑狼疮类固醇性骨质疏松症的防治作用研究[J].中华中医药杂志,2005,20(11):667.
[3]Fan Y S,Wen C P,Wu G L,et al.Investigation into preventive and therapeutic effects of Jieduquyuziyin methods in treating corticosteroid osteoporosis in systemic lupus erythematosus[J].China J Tradit Chin Med Pharm,2005,20(11):667.
[4]卢伟,马晓丽,兰怡.两色金鸡菊醇提物对自发性高血压大鼠尿液的代谢组学研究[J].中国药理学通报,2014,30 (9):1311-5.
[4]Lu W,Ma X L,Lan Y.Effect of alcohol extract from Coreopsis tinctoria Nutt.on spontaneous hypertension rats by metabolomic methods[J].Chin Pharmacol Bull,2014,30(9):1311-5.
[5]Ma Y,Zhang P,Yang Y,et al.Metabolomics in the elds of oncology:a review of recent research[J].Mol Biol Rep,2012,39:7505-11.
[6]甘静,谢志军,陈娟,等.青蒿-鳖甲药对配伍对MRL/lpr狼疮小鼠IL-6、IFN-γ分泌及狼疮性肾炎病理改变的影响[J].江西中医药大学学报,2015,27(4):69-71.
[6]Gan J,Xie Z J,Chen J,et al.Effects of Qinghao-Biejia group on the production of IL-6,IFN-γ and pathologic change of lupus nephritis in MRL/lpr mice[J].J Jiangxi Univ Tradit Chin Med,2015,27(4):69-71.
[7] 张璠璠,王宇光,梁乾德,等.基于UPLC-TOF-MS研究冰片对丹参酮ⅡA在大鼠体内药代动力学的影响[J].中国药理学通报,2014,30(6):862-6.
[7]Zhang F F,Wang Y G,Liang Q D,et al.UPLC-TOF-MS based profiling approach in evaluation of effect of borneol on pharmacokinetics of Tanshinone IIA in mice[J].Chin Pharmacol Bull,2014,30(6):862-6.
[8] 胡金波,谷恒存,丁兴红,等.基于HPLC-Q-TOF/MS的代谢组学方法用于解毒祛瘀滋阴方对系统性红斑狼疮干预作用的研究[J].中国中药杂志,2013,38(21):3747-52.
[8]Hu J B,Gu H C,Ding X H,et al.Study on intervention effect of Jieduquyuziyinprescriptionsystemiclupuserythematosusby HPLC-Q-TOF/MS[J].China J Chin Mater Med,2013,38(21):3747-52.
[9]李翠奇,陈服文,饶汉珍.SLE患者血清过氧化脂质和维生素E与磷脂酶A2活性的检测[J].中华皮肤科杂志,2000,33 (2):125.
[9]Li C Q,Chen F W,Rao H Z.Detection of serum lipid peroxide and vitamin E and phospholipase A2 activity in SLE patients[J]. Chin J Dermatol,2000,33(2):125.
[10] Pruzangki W,Vadas P.Phospholipase A2-a mediator between proximal and distal effectors of inflammation[J].Immunol Today,1991,12(5):143-6.
[11]毛立群,郭小芹.补体在系统性红斑狼疮中的作用[J].国外医学内科学分册,2006,33(4):157-9.
[11]Mao L Q,Guo X Q.The role of complement in systemic lupus erythematosus[J].Foreign Med Sci(Sect Intern Med),2006,33 (4):157-9.
[12]张丽明,段姚尧,董小青.Th22细胞及其效应因子IL-22与炎症性皮肤病关系的研究进展[J].中国药理学通报,2014,30 (7):905-7.
[12]Zhang L M,Duan Y R,Dong X Q.Research progress of Th22 and IL-22 in inflammatory skin disorders[J].Chin Pharmacol Bull,2014,30(7):905-7.
[13]马新骏,张爱华,李小亮,等.血小板活化和内皮细胞损害对系统性红斑狼疮影响的临床研究[J].血栓与止血学,2013,19 (1):9-11.
[13]Ma X J,Zhang A H,Li X L.The study on the activation of platelet and injury of endothelial cell effects on systemic lupus erythematosus[J].Chin J Thromb Hemo,2013,19(1):9-11.
[14]Kaiser R,Cleveland C M,Criswell L A.Risk and protective factors for thrombosis in systemic lupus erythematosus results from a large multi-ethnic cohort[J].Ann Rheum Dis,2009,68(2):238-41.
[15]徐祖森,蔡华华.系统性红斑狼疮患者血浆血小板活化因子水平及其与血浆脂质过氧化物水平关系的研究[J].中国麻风皮肤病杂志,2005,21(6):429-31.
[15]Xu Z S,Cai H H.The study of plasma level of platelet activating factor and its relationship with plasma lipid peroxidation in systemic lupus erythematosus[J].China J Lepr Skin Dis,2005,21(6):429-31.
Metabonomic study of traditional Chinese herb pair,
Qinghao-Biejia in treating systemic lupus erythematosus mice
CHEN Juan1,DENG Jun2,ZHOU Jia1,XIE Zhi-jun1,GAN Jing1,WEN Cheng-ping1
(1.College of Basic Medical Science,Zhejiang Chinese Medical University,Hangzhou310053,China;2.Safety Evaluation Research Center,Zhejiang Academy of Medical Sciences,Hangzhou310013,China)
AimsTo study the changes of serum metabolites in systemic lupus erythematosus(SLE)mice (MRL/lpr)by treatment of Qinghao-Biejia and to explore the pathogenesis of SLE and mechanism of drug action.MethodsThe serum samples of control group,SLE model group and Qinghao-Biejia treatment group (low and high dose)were collected,the metabolic profile of samples was analyzed by high performance liquid chromatography-quadrupole-time of flight mass spectrometry system(HPLC-Q-TOF/MS).Software of Mass Hunter and Mass Profiler Professional(MPP)were used to process the data.A supervised mode of partial least squares-discriminant analysis(PLS-DA)was applied to recognize the data pattern.Results There were obvious disorders of lipid metabolism in SLE model.Compared with control group,Qinghao-Biejia treatment group improved lipid metabolism,affected the thrombosis development of SLE;and Qinghao-Biejia treatment group reduced the pathological damage by improving inflammatory acute phase of SLE in mice.ConclusionQinghao-Biejia treatment plays a therapeutic role in repairing the imbalance by multidimensional metabolic pathways in SLE mice.
traditional Chinese herb pair,Qinghao-Biejia;systemic lupus erythematosus;mice;serum;metabonomics;high performance liquid chromatography coupled with Q-TOF/MS
10.3969/j.issn.1001-1978.2016.05.026
A
1001-1978(2016)05-0727-06
R-332;R282.74;R289.1;R344;R364.5;R446.11;R593.241.053.1
2016-01-08,
2016-02-06
国家公益性行业科研专项(No 2015468001);国家自然科学基金资助项目(No 81373633,81273680);浙江省重大科技专项(No 2014C03062-1);浙江省科技厅公益性应用研究计划项目(No 2013C37100)
陈娟(1984-),女,博士,讲师,研究方向:中西医药理学,中医药系统生物学,E-mail:mytw_00@163.com;温成平(1972-),男,博士,教授,博士生导师,研究方向:中医防治风湿性免疫疾病,通讯作者,E-mail:wengcp@ 163.com
