肝动脉血流动力学检测对肝癌、肝硬化的诊断价值及临床意义
2016-09-06露娜甘孜藏族自治州州人民医院超声科四川甘孜626000
露娜甘孜藏族自治州州人民医院超声科,四川甘孜626000
肝动脉血流动力学检测对肝癌、肝硬化的诊断价值及临床意义
露娜
甘孜藏族自治州州人民医院超声科,四川甘孜626000
目的探讨肝动脉血流动力学检测对肝癌、肝硬化的诊断价值。方法将102例患者按照最终诊断结果分为肝癌组48例和肝硬化组54例,另选择同期在医院体检的健康人群50例作为对照组,采用彩色多普勒超声诊断系统检测各组受试对象肝动脉内径及血流频谱,并计算肝动脉血流量。结果肝癌组、肝硬化组肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量均高于对照组,其中肝癌组肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于肝硬化组,差异有统计学意义(P<0.05)。块状型肝癌肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于结节性肝癌和小肝癌,其中结节性肝癌肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于小肝癌,差异有统计学意义(P<0.05)。肝硬化C级患者肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于B级和A级肝硬化,其中B级肝硬化肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于A级肝硬化,差异有统计学意义(P<0.05)。结论肝硬化和肝癌均存在血流动力学异常变化,肝动脉动力学变化能够作为肝硬化和肝癌的危险信号之一,可作为早期诊断的依据。
肝动脉;血流动力学;肝癌;肝硬化;临床诊断
Oncol Prog,2016,14(5)
肝癌是临床上常见的恶性肿瘤,调查显示我国每年约有15万人死于肝癌,占全世界肝癌死亡人数的50%以上[1];肝癌已经成为人类健康的头号杀手。肝癌的恶性程度高,疾病进展快,预后差,因此早诊断、早治疗是改善患者预后,降低病死率的主要措施。肝癌属于富血管肿瘤,在肿瘤发展早期即有丰富的血流动力学特征,其中肝动脉是肝癌血供的主要来源[2-3];在肝癌的不同时期,肝动脉血流动力学均有不同的特点,因此通过观测肝动脉血流动力学的变化水平,有助于肝癌的早期诊断。本研究拟对肝癌、肝硬化患者肝动脉血流动力学、血管形态等特征进行分析,旨在探讨其中的规律,进而为肝癌的诊断提供依据,研究结果总结如下。
1 对象与方法
1.1研究对象
本研究经医院伦理委员会审核批准。选择2012年5月至2015年5月在甘孜藏族自治州州人民医院就诊的102例肝癌或肝硬化患者作为研究对象。纳入标准:①所有患者入组时均经手术活检、病理切片及CT检查确诊;②患者临床资料及检查报告齐全;③研究方案告知患者或家属,并签署知情同意书。排除标准:①肝血管破裂,合并严重腹腔积液或其他影响影像检查的疾病;②凝血功能异常,肝脏切除或近1个月内存在大型手术史者。按照最终诊断结果分为肝癌组48例和肝硬化组54例,其中肝癌组男31例,女17例,年龄31~79岁,平均(53.1±6.8)岁;按照大体形态分类[4]将肝癌分为小肝癌11例,结节性肝癌19例和块状型肝癌18例。肝硬化组男33例,女21例,年龄35~85岁,平均(53.3±7.1)岁;按照肝功能Child-Pugh分级标准[5]分为A级14例,B级27例,C级13例。另选择同期在医院体检肝功能无异常的健康人群50例作为对照组,男29例,女21例,年龄28~87岁,平均(52.9±5.8)岁。3组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2方法
所有受检者均于清晨空腹进行超声检查,取仰卧位,选择美国GE公司LOGIQ 7彩色多普勒超声诊断系统,设置线阵探头频率8~12 MHz,使用二维超声先观察肝脏的形态、大小、内部回声、血管走行等。在平静呼吸情况下嘱患者屏住呼吸,再用频谱多普勒检查肝固有动脉内径及血流频谱,调节脉冲重复频率,并调整取样线的角度,确保多普勒轴线与血管的夹角<60°,记录肝动脉血流最高流速、最低流速、平均流速和阻力指数;每个血流频谱至少测量3次,取3次测量的平均值。计算肝动脉血流量。
1.3统计学方法
采用SPSS 21.0统计学-软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3组肝动脉血流动力学比较
肝癌组、肝硬化组肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量均高于对照组,差异有统计学意义(P<0.05);肝癌组肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量又高于肝硬化组,差异有统计学意义(P<0.05)。(表1)
2.2不同类型肝癌患者肝动脉血流动力学比较
块状型肝癌肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于结节性肝癌和小肝癌,差异有统计学意义(P<0.05);结节性肝癌肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量又高于小肝癌,差异有统计学意义(P <0.05)。(表2)
2.3不同分级肝硬化患者肝动脉血流动力学比较
肝硬化C级患者肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于B级和A级,差异有统计学意义(P<0.05);B级肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量又高于A级,差异有统计学意义(P<0.05)。(表3)
表1 3组肝动脉血流动力学比较(±s)
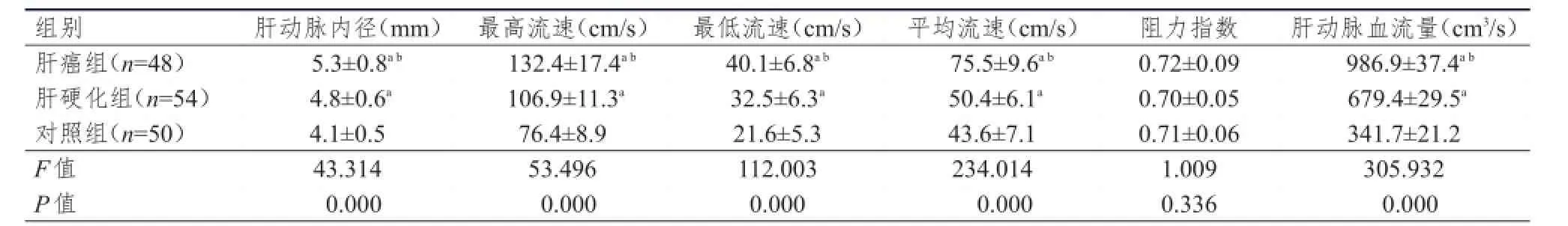
表1 3组肝动脉血流动力学比较(±s)
注:a与对照组比较,P<0.05;b与肝硬化组比较,P<0.05
组别肝癌组(n=48)肝硬化组(n=54)对照组(n=50)F值P值肝动脉内径(mm)5.3±0.8a b4.8±0.6a4.1±0.5 43.314 0.000最高流速(cm/s)132.4±17.4a b106.9±11.3a76.4±8.9 53.496 0.000最低流速(cm/s)40.1±6.8a b32.5±6.3a21.6±5.3 112.003 0.000平均流速(cm/s)75.5±9.6a b50.4±6.1a43.6±7.1 234.014 0.000阻力指数0.72±0.09 0.70±0.05 0.71±0.06 1.009 0.336肝动脉血流量(cm3/s)986.9±37.4a b679.4±29.5a341.7±21.2 305.932 0.000
表2 不同类型肝癌肝动脉血流动力学比较(±s)
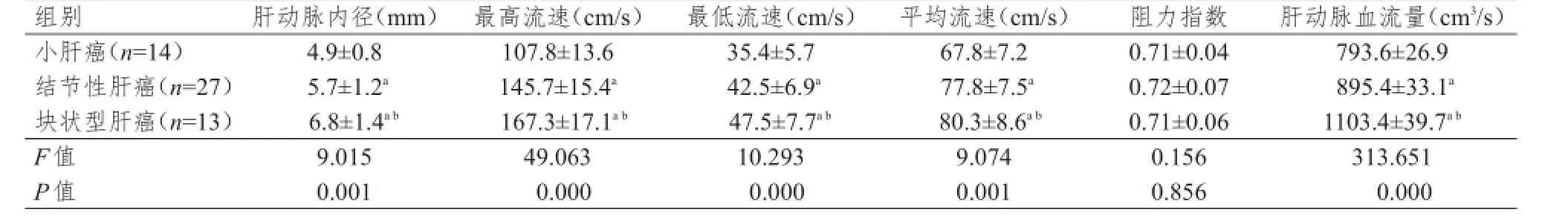
表2 不同类型肝癌肝动脉血流动力学比较(±s)
注:a与小肝癌组比较,P<0.05;b与结节性肝癌组比较,P<0.05
组别小肝癌(n=14)结节性肝癌(n=27)块状型肝癌(n=13)F值P值肝动脉内径(mm)4.9±0.8 5.7±1.2a6.8±1.4a b9.015 0.001最高流速(cm/s)107.8±13.6 145.7±15.4a167.3±17.1a b49.063 0.000最低流速(cm/s)35.4±5.7 42.5±6.9a47.5±7.7a b10.293 0.000平均流速(cm/s)67.8±7.2 77.8±7.5a80.3±8.6a b9.074 0.001阻力指数0.71±0.04 0.72±0.07 0.71±0.06 0.156 0.856肝动脉血流量(cm3/s)793.6±26.9 895.4±33.1a1103.4±39.7a b313.651 0.000
表3 不同级别肝硬化肝动脉血流动力学比较(±)
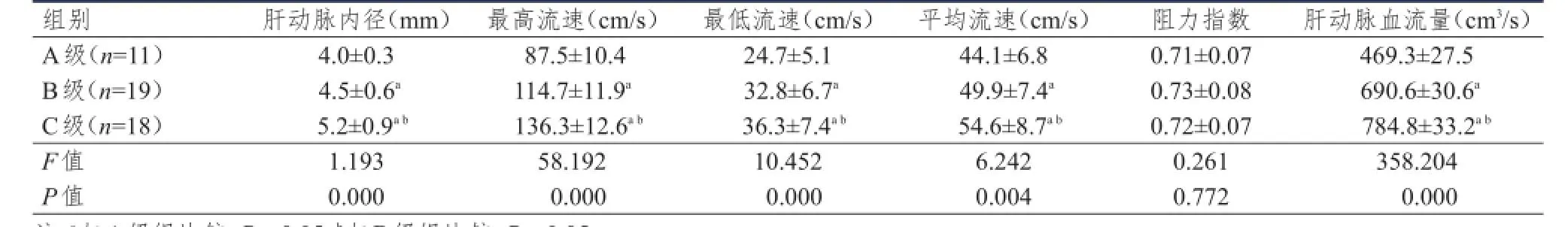
表3 不同级别肝硬化肝动脉血流动力学比较(±)
注:a与A级组比较,P<0.05;b与B级组比较,P<0.05
组别A级(n=11)B级(n=19)C级(n=18)F值P值肝动脉内径(mm)4.0±0.3 4.5±0.6a5.2±0.9a b1.193 0.000最高流速(cm/s)87.5±10.4 114.7±11.9a136.3±12.6a b58.192 0.000最低流速(cm/s)24.7±5.1 32.8±6.7a36.3±7.4a b10.452 0.000平均流速(cm/s)44.1±6.8 49.9±7.4a54.6±8.7a b6.242 0.004阻力指数0.71±0.07 0.73±0.08 0.72±0.07 0.261 0.772肝动脉血流量(cm3/s)469.3±27.5 690.6±30.6a784.8±33.2a b358.204 0.000
3 讨论
肿瘤的生长依赖于新生血管的形成,血管生成可发生于肿瘤发展的任何阶段,但每个阶段血管的形成密度、血流量和血管走行不完全一致。因此有学者认为通过观察肿瘤血管的密度和血流动力学,有助于评价肿瘤生长的阶段和预后[6]。肝癌是临床上常见的恶性肿瘤,其血供主要来源于动脉。Hsieh等[7]证实肝癌血管的调控机制与正常血管不同,如肿瘤内部血管内膜不完整,平滑肌相对较少等,导致血管扭曲或呈囊状,因此在超声下多表现出杂乱无章、血管丰富、血流动力学不稳定等特征,这亦是超声诊断肝癌的病理基础。但是有学者提出,肝硬化与肝癌,特别是与肝硬化合并肝癌血流特征存在交叉的特征,导致超声对肝硬化和肝癌的诊断可能存在一定困难[8]。肝硬化发生时肝动脉会代偿性扩张,因而门静脉高压的肝硬化血流量也明显增加,因此如何辨别两种血流动力学的异同,对提高肝癌诊断具有重要意义。
本研究显示肝癌组、肝硬化组肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量均高于正常对照组,提示肝癌、肝硬化血流量均较正常人群丰富。基础研究证实,肝癌血管的形成主要由两种机制调控:一种是肝窦壁中的内皮细胞转化为毛细血管,并进一步发展成小动脉;另一种是在血管生成因子的调控下诱导新生血管形成;随着瘤体的生长,其所需要的血供增加,导致血管形成增多;体现在超声图像上为血管密度增加,血流信号丰富[9]。发生肝硬化时,由于肝功能代谢功能降低,导致NO、胰高血糖素等活性物质进入血液循环,从而扩张血管平滑肌,血液亦处于高动力状态,心排出量也明显增加。然而肝硬化所导致的肝脏缺氧状态会诱导小肠、脾胃等功能区出现动静脉瘘,从而增加门静脉血氧含量,这些因素均能补偿肝脏的缺氧状况,导致肝硬化血流量不及肝癌丰富。Chen等[10]也证实肝硬化时的组织弹性降低会压迫微小动脉,抑制血流的流畅性,导致肝动脉血流减少,从而在超声上体现出血流动力学不如肝癌丰富。
魏瑞雪等[11]报道随着肿瘤体积的增大,形态异常的血管逐渐增多,细小血管分支也明显增多,表现出病灶血流丰富,并走行迂曲、扩张。肝癌属于富血供肿瘤,随着肿块的增加,所需要的营养物质、血流也越多,作为肝癌主要血供来源的肝动脉,其血流量必然会明显增加,从而满足肿瘤生长的需要。国外研究证实瘤体直径≤2.0 cm的肝癌其血供显著低于瘤体直径为2~3 cm的肿瘤[12]。丁红等[13]也证实,早期肝癌主要由肝动脉和门静脉共同供血,随着肝癌的不断发展,门静脉血流逐渐降低,而肝动脉血流开始增加。本研究亦显示块状型肝癌肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于结节性肝癌和小肝癌,说明肿瘤体积与血流动力学有关。而肝硬化C级患者肝动脉内径、最高流速、最低流速、平均流速和肝动脉血流量高于B级和A级,提示随着肝功能分级增加,血流量也呈上升趋势。肝硬化越严重,弹力纤维明显减少,其血管壁也越薄,导致血流阻力降低,血流加快和血管内径增加[14-15]。在研究中甚至可以发现部分肝硬化C级患者血流动力学与小肝癌非常接近。因此肝动脉血流动力学变化能够作为肝硬化和肝癌的危险信号之一,并为早期诊断提供依据。
综上所述,肝硬化和肝癌均存在血流动力学异常变化,且随着病情加重,血流动力学指标也随之发生变化,监测患者肝动脉血流动力学可能为早期诊断肝癌、肝硬化提供参考依据。
[1]陈建国,张思维,陈万青,等.中国2004-2005年全国死因回顾抽样调查肝癌死亡率分析[J].中华预防医学杂志,2010,44(5):383-389.
[2]Kobayashi S,Nagano H,Marubashi S,et al.Hepatectomy based on the tumor hemodynamics for hepatocellular carcinoma:a comparison among the hybrid and pure laparoscopic procedures and open surgery[J].Surg Endosc,2013,27 (2):610-617.
[3]陈骏,席玮,武贝,等.经动脉化疗栓塞联合索拉非尼治疗肝癌的肝动脉血流动力学DSA图像[J].介入放射学杂志,2014,23(7):584-587.
[4]陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008.
[5]Albers I,Hartmann H,Bircher J,et al.Superiority of the Child-Pugh classification to quantitative liver function tests for assessing prognosis of liver cirrhosis[J].Scand J Gastroenterol,1989,24(3):269-276.
[6]吕校平,司芩,钱晓莉,等.超声造影评估原发性与转移性小肝癌的血流动力学比较研究?[J].临床肿瘤学杂志,2015,(9):829-832.
[7]Hsieh MC,Hsu HT,Hsiao PC,et al.Role of VEGF-C gene polymorphisms in susceptibility to hepatocellular carcinoma and its pathological development[J].J Clin Lab Anal,2014,28(3):237-244.
[8]王竹,刘广健,吕明德,等.超声造影定量分析评估门静脉癌栓对肝癌血流动力学的影响[J].中山大学学报(医学科学版),2014,35(3):396-401.
[9]Sharma BK,Srinivasan R,Kapil S,et al.Serum levels of angiogenic and anti-angiogenic factors:Their prognostic relevance in locally advanced hepatocellular carcinoma[J]. Mol Cell Biochem,2013,383(1-2):103-112.
[10]Chen L,Shi Y,Jiang CY,et al.Coexpression of PDGFR-alpha,PDGFR-beta and VEGF as a prognostic factor in patients with hepatocellular carcinoma[J].Int J Biol Markers,2011,26(2):108-116.
[11]魏瑞雪,王文平,姚秀忠,等.复发性肝细胞肝癌超声造影与MRI增强血流动力学对比研究[J].中华超声影像学杂志,2012,21(11):953-956.
[12]Murotani K,Kawai N,Sato M,et al.Optimal injection rate and volume of contrast medium for observing hemodynamics of a hepatocellular carcinoma structure model [J].Radiol Phys Technol,2013,6(1):78-85.
[13]丁红,王文平,魏瑞雪,等.超声造影评估初发性与复发性小肝癌的血流动力学比较研究[J].中华临床医师杂志(电子版),2013,7(2):546-549.
[14]Endo T,Kozaka K,Kobayashi S,et al.Hemodynamics and progression of a hypervascular focus In a borderline lesion of hepatocellular carcinoma:analysis angiographyassisted CT and histopathology[J].Jpn J Radiol,2014,32 (2):69-79.
[15]刘典美,邵伟光,郑传利,等.彩色多普勒超声对门静脉癌栓肝动脉血流动力学变化的研究[J].中国医师进修杂志,2012,35(23):33-35.
The application of hepatic artery hemodynamics detection in diagnosis of liver cancer and cirrhossiiss
LU Na
Department of Ultrasonography,People's Hospital of Ganzi,Ganzi 626000,Sichuan,China
ObjectivectiveTo explore the role and clinical significance of hepatic artery hemodynamics detection in liver cancer and cirrhosis patients.MethodsthodsA total of 102 patients were stratified as liver cancer group(n=48)and cirrhosis group(n=54),according to respective final diagnosis,and another 50 cases of healthy adults who had taken physical examination at the same period were included as the control group;the diameter and blood flow spectrum of the liver artery in each group were detected by color Doppler ultrasound,and the hepatic arterial blood flow was calculated.ResultesultThe diameter of hepatic artery,the highest,lowest,and average blood flow velocity,and blood flow volume in the liver cancer group and cirrhosis group were significantly higher than those in the control group(P<0.05),with higher observations in liver cancer group compared with the cirrhosis group(P<0.05),and those measures were higher in massive liver cancer than those with nodular hepatic carcinoma and small hepatocellular carcinoma(P<0.05),with higher observations in nodular hepatic carcinoma than those in small liver cancer(P<0.05).The diameter of hepatic artery,the highest,lowest,and average blood flow velocity and blood flow volume were highest in grade C of liver cirrhosis,followed by those in grade B and then grade A,and all differences were statistically significant(all P<0.05).ConclusionusionThe changes of hepatic hemodynamics are both observed in cirrhosis and liver cancer,which may be used as predictors for early diagnosis.
rdshepatic artery;hemodynamics;hepatocellular carcinoma;liver cirrhosis;clinical diagnosis
R735. 7
A
10.11877/j.issn.1672-1535.2016.14.05.22
2015-11-23)
