Ⅰ期卵巢交界性肿瘤剥除术后复发危险因素分析
2016-09-06康海利段微首都医科大学附属北京妇产医院妇瘤科北京16
康海利 段微首都医科大学附属北京妇产医院妇瘤科,北京 16
Ⅰ期卵巢交界性肿瘤剥除术后复发危险因素分析
康海利 段微#
首都医科大学附属北京妇产医院妇瘤科,北京 1000060
目的探讨年轻卵巢交界性肿瘤患者行肿物剥除术后复发的危险因素。方法回顾性分析49例行卵巢肿瘤剥除术,年龄<35岁,术后病理为Ⅰ期的卵巢交界性肿瘤(BOT)患者的临床及随访资料,分析术后复发的危险因素。结果随访患者中共7例复发,5年生存率为100%,无复发生存率为91.8%,不同年龄、分期、是否存在间质浸润患者术后复发情况比较,差异无统计学意义(P>0.05);黏液性肿瘤及微乳头型卵巢交界性肿瘤患者复发比例高于浆液性肿瘤及非微乳头型肿瘤患者,差异有统计学意义(P<0.05)。结论Ⅰ期BOT单侧病变患者,若术中冰冻结果为黏液性或微乳头型肿瘤,宜行患侧附件切除术;双侧病变患者,若无上述危险因素可行双侧卵巢肿物剥除术,若存在上述危险因素可行单侧附件切除术+对侧卵巢肿物剥除术。
卵巢交界性肿瘤;保留生育功能;卵巢肿物剥除术;复发
Oncol Prog,2016,14(5)
卵巢交界性肿瘤(borderline ovarian tumor,BOT)这一概念在1973年被提出并应用至今,其组织学上具有一定的核分裂象及异形性,但缺乏破坏性间质浸润,生物学行为介于卵巢良性肿瘤与恶性浸润性肿瘤之间。其发病率约为2.5/10万,占卵巢上皮性肿瘤的10%~15%[1]。常见的病理类型包括卵巢交界性浆液性肿瘤(serous BOT,SBOT)和卵巢交界性黏液性肿瘤(mucinous BOT,MBOT)[2]。Ⅰ期、Ⅱ期、Ⅲ期的5年生存率分别为99%、98%、96%,10年生存率分别为97%、90%、88%[3]。BOT总体发病年龄为35~40岁,较卵巢恶性肿瘤早10年,因此保留生育功能和维持女性激素分泌对大部分患者来说有重要意义。BOT病变往往局限于卵巢,50%~80%的患者在诊断时为Ⅰ期,对于早期患者,手术方式可为卵巢肿瘤剥除术或患侧附件切除术,但对于两种术式的选择尚无明确指征。本文回顾性分析了49例年轻卵巢交界性肿瘤患者的临床病理特征、手术方式及其预后转归情况,以期确定合适的指征指导临床治疗。
1 资料与方法
1.1一般资料
选取2005年1月至2011年3月于首都医科大学附属北京妇产医院妇瘤科行卵巢肿瘤剥除术,年龄<35岁,术后病理为Ⅰ期BOT的患者共49例,入选患者均具有完整的临床资料和随访资料,年龄12~35岁,平均(27.5±5.2)岁。其中SBOT 31例,MBOT 18例。49例患者中,初次就诊原因包括下腹部包块28例(57%),腹胀5例(10%),腹痛4例(8%),月经改变4例(8%),肿瘤压迫症状(包括尿频、排尿困难、排便困难)1例(2%)。超声检查结果提示单纯囊肿5例,囊实性肿物44例。采用国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2014年卵巢癌分期标准,按照手术及病理资料重新分期,其中ⅠA期29例,ⅠB 期9例,ⅠC1期3例,ⅠC2期4例,ⅠC3期4例。
1.2治疗方法
手术途径采用经腹或腹腔镜手术,包括单侧卵巢囊肿剥除术,双侧卵巢囊肿剥除术,盆腔淋巴结清扫,腹主动脉旁淋巴结取样,腹膜多点活检,大网膜切除术,阑尾切除术等。结合手术分期、病理结果及患者个人意愿等选择是否化疗,共2例患者应用紫杉醇+卡铂化疗。
1.3辅助检查
所有患者均于本院行经阴道超声或腹部超声进行检查,血流阻力指数(resistance index,RI)范围为0.35~0.74,RI<0.40界定为低阻血流。术前均行肿瘤标志物CA125、CA199检查,正常值范围分别为0~30.2 U/ml、0~30.9 U/ml。
1.4随访
每3~6个月进行一次临床检查、超声检查、血清肿瘤标志物检测,如超过2年未行检查定为失访,随访截止日期为2016年3月。
1.5统计学方法
应用SPSS19.0统计软件对数据进行统计分析,采用Kaplan-Meier法进行生存分析,通过logrank检验进行影响因素分析,以P<0.05表示差异有统计学意义。
2 结果
2.1术后复发的危险因素分析
49例患者中肿瘤发生在左侧19例(38.8%),右侧22例(44.9%),双侧8例(16.3%)。超声检查中肿瘤最大径线<5 cm共5例,5~10 cm共17例,>10 cm共27例。13例患者为低阻血流。
49例患者术前CA125平均值为70.14 U/ml (6.4~998.7 U/ml),高于参考范围者 16例(32.7%),其中SBOT 11例,MBOT 5例;CA199平均值为50.02 U/m(l1.2~850.1 U/ml),高于参考范围者11例,其中SBOT 4例,MBOT 7例。
手术采用腹腔镜手术患者14例(28.6%),经腹手术患者35例(71.4%),其中单侧卵巢肿物剥除术41例,双侧卵巢肿物剥除术8例,盆腔淋巴结清扫10例,腹主动脉旁淋巴结取样2例,大网膜切除4例,腹膜多点活检20例,阑尾切除术2例。
术中冰冻结果肿瘤为微乳头型1例,术后病理为微乳头型共7例(14.3%)。术后病理结果提示为SBOT者31例(63.3%),MBOT者18例(36.7%)。腹腔积液/腹腔冲洗液可见肿瘤细胞共4例。
平均随访时间88.4个月,其中7例患者复发,无死亡患者。7例复发患者中2例术后接受紫杉醇+卡铂化疗;6例原位复发,1例对侧复发;复发均局限于卵巢,5例为卵巢内复发,2例卵巢表面存在肿瘤;复发后4例进行卵巢囊肿剥除术,3例行患侧附件切除术;1例患者二次复发,再次行卵巢囊肿剥除术,随访2年未出现复发征象;所有复发患者病理均与前次相近,未出现恶变或浸润性种植。
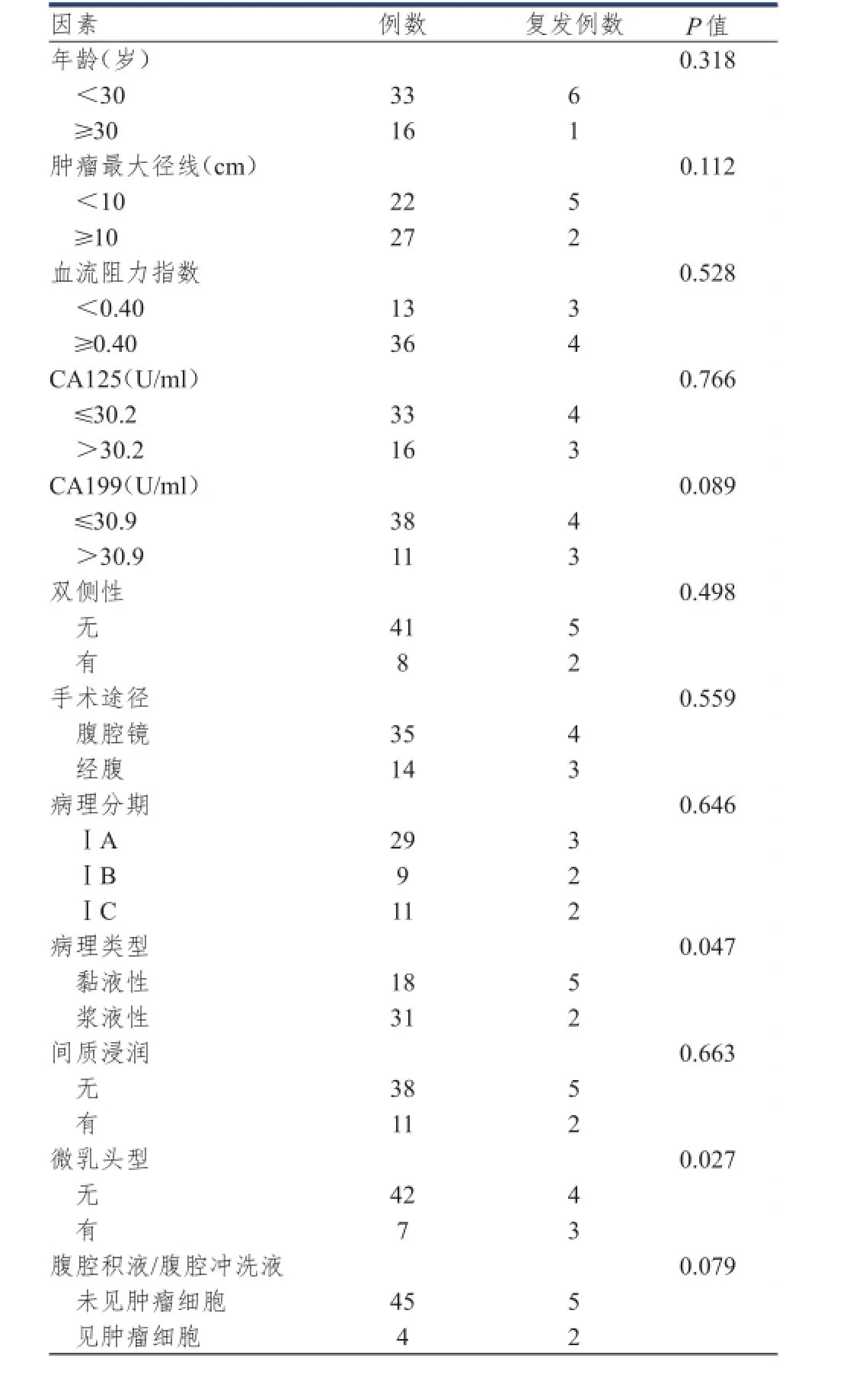
表1 卵巢交界性肿瘤剥除术后复发的危险因素分析
将卵巢交界性肿瘤剥除术后复发的可能危险因素(表1)进行单因素分析,分析结果显示,不同年龄,肿瘤大小,肿瘤血流阻力指数,肿瘤标志物CA125及CA199,肿瘤是否双侧,手术方式,病理分期,是否存在间质浸润,腹腔积液/腹腔冲洗液中是否存在肿瘤细胞患者术后复发情况比较,差异均无统计学意义(P>0.05);黏液性肿瘤及微乳头型卵巢交界性肿瘤患者复发比例较高,与浆液性肿瘤及非微乳头型肿瘤患者间的差异具有统计学意义(P<0.05)。
2.2生存情况分析
49例患者5年生存率为100%,5年无复发生存率为91.8%,5年复发率为20.4%(图1)。术后妊娠的患者为14例。出现不孕症状的患者为5例。
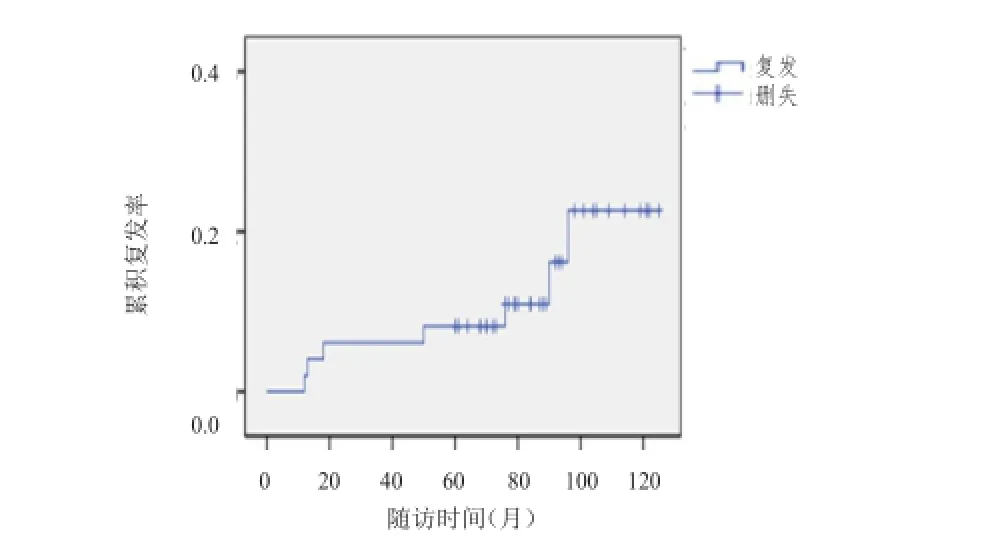
图1 卵巢交界性肿瘤剥除术后复发生存曲线
3 讨论
美国国家综合癌症网络(NCCN)卵巢癌指南建议对于BOT早期患者,可在全面分期手术时仅行患侧附件切除术,保留子宫和对侧附件,全面分期手术包括腹腔积液或腹腔冲洗液细胞学检查及腹膜多点活检、横结肠下大网膜切除术,MBOT还应切除阑尾。就我国而言,随着二胎政策的施行,生育年龄存在后移,对于育龄期女性来说保留生育功能变得越来越重要,绝大部分患者对于切除患侧卵巢存在恐惧心理,希望保留完整的生殖系统,并且切除患侧卵巢可能影响远期内分泌功能,因此,患者及家属更倾向于接受卵巢肿物剥除术。并且从复发及生育的角度,我们认为肿物剥除术也是可以接受的。首先,文献报道卵巢肿物剥除术是BOT复发的高危因素之一,不同的手术方式,包括单侧卵巢肿物剥除术、单侧附件切除术、双侧卵巢肿物剥除术、单侧附件切除术+对侧卵巢肿物剥除术,复发率分别为25.6%、12.5%、25.6%、26.1%[4]。尽管剥除术明显增加手术复发的概率,复发时间提前,但几乎所有学者都认为其对于总生存期无明显影响。Uzan等[5]随访了26例Ⅰ期BOT复发患者,首次复发均为BOT和(或)非浸润性腹膜种植,仅2例在二次、三次复发后为转移浸润癌。Trimble等[3]和Morice等[6]也认为Ⅰ期BOT进展为癌的概率<1%~3%。Trillsch等[7]研究发现,≤40岁BOT患者虽然更易复发,但复发部位常常在卵巢组织内,而且恶变概率较>40岁组明显降低,即便复发,仍然可以再次甚至第三次行保留生育功能手术[8]。其次,Kanat-Pektas等[9]发现单侧BOT行剥除术与术后妊娠成功概率的相关系数为0.587,P=0.001,提示剥除术可保留更多的卵巢组织,在保留生育功能方面更为理想。Palomba等[10]报道了双侧BOT患者实施双侧肿瘤剔除术和卵巢切除术生育结局的对比,该研究表明双侧肿瘤剔除术后生育率(自发怀孕或应用助孕技术后怀孕)高达93.3%,能更好地满足患者的生育要求。本研究希望明确卵巢肿物剥除术后复发的危险因素,可以对手术方式的选择提供帮助。
本研究的结果提示,复发的危险因素包括MBOT及微乳头型。其他研究也认为微乳头型SBOT是复发的影响因素[11-15]。Longacre等[12]随访了276例SBOT患者后发现,微乳头型SBOT不仅复发概率增加,其较典型SBOT更易出现浸润性种植(P=0.008),并且总体生存率更低(P=0.004)。Koskas等[16]和Nomura等[17]认为MBOT并非“安全”疾病,其10年进展为浸润性肿瘤的比例为13%,如果病理结果为MBOT,应行患侧附件切除术,这是唯一减少复发的方法。本研究中CA125超出范围者为16例(32.7%,16/49),MBOT术前超出正常范围的5例(27.8%,5/18),SBOT为11例(35.4%,11/31),CA125在两种类型肿瘤中的异常表达率比较,差异无统计学意义(P>0.05);术前CA199超出范围为11例(22.4%,11/49),MBOT超出范围的7例(38.9%,7/18),SBOT为4例(12.9%,4/31),差异无统计学意义(P>0.05)。由此可见,对于Ⅰ期卵巢交界性肿瘤,肿瘤标志物并不能作为术前判断肿瘤类型的准确指标。冰冻结果可以在术中有助于明确BOT病理类型;术中冰冻回报微乳头型1例,而术后病理结果提示微乳头型达7例,符合率仅14.3%,但准确率100%,因此术中冰冻提示微乳头型可作为复发危险因素的判断指标。
综上所述,笔者认为对于Ⅰ期的BOT患者,可行全面分期手术,单侧病变患者如术中冰冻结果为黏液性交界性肿瘤或微乳头型,应行患侧附件切除术;双侧病变患者若无上述因素可行双侧卵巢肿物剥除术,若存在上述危险因素可行单侧附件切除术+对侧卵巢肿物剥除术。
[1]Mink PJ,Sherman ME,Devesa SS.Incidence patterns of invasive and borderline ovarian tumors among white women and black women in the United States.Results from the SEER Program,1978—1998[J].Cancer,2002,95(11):2380-2389.
[2]Hart WR.Borderline epithelial tumors of the ovary[J].Mod Pathol,2005,18(2):S33-50.
[3]Trimble CL,Kosary C,Trimble EL.Long-term survival and patterns of care in women with ovarian tumors of low malignant potential[J].Gynecol Oncol,2002,86(1):34-37.
[4]Vasconcelos I,de Sousa Mendes M.Conservative surgery in ovarian borderline tumours:a meta-analysis with emphasis on recurrence risk[J].Eur J Cancer,2015,51(5):620-631.
[5]Uzan C,Muller E,Kane A,et al.Fertility sparing treatment of recurrent stage I serous borderline ovarian tumours[J]. Hum Reprod,2013,28(12):3222-3226.
[6]Morice P,Uzan C,Fauvet R,et al.Borderline ovarian tumour:pathological diagnostic dilemma and risk factors for invasive or lethal recurrence[J].Lancet Oncol,2012,13(3):e103-115.
[7]Trillsch F,Mahner S,Woelber L,et al.Age-dependent differences in borderline ovarian tumours(BOT)regarding clinical characteristics and outcome:results from a subanalysisoftheArbeitsgemeinschaftGynaekologische Onkologie(AGO)ROBOT study[J].Ann Oncol,2014,25 (7):1320-1327.
[8]Chen R,Zhu T,Yu H,et al.Retrospective analysis of the clinical outcomes in 12 recurrent borderline ovarian tumor patients with second fertility-sparing surgery[J].Zhonghua Fu Chan Ke Za Zhi,2014,49(4):254-259.
[9]Kanat-Pektas M,Ozat M,Gungor T,et al.Fertility outcome after conservative surgery for borderline ovarian tumors:a single center experience[J].Arch Gynecol Obstet,2011,284 (5):1253-1258.
[10]Palomba S,Falbo A,Del NS,et al.Ultra-conservative fertility-sparing strategy for bilateral borderline ovarian tumours:an 11-year follow-up[J].Hum Reprod,2010,25 (8):1966-1972.
[11]Deavers MT,Gershenson DM,Tortolero-Luna G,et al.Micropapillary and cribriform patterns in ovarian serous tumors of low malignant potential:a study of 99 advanced stage cases[J].Am J Surg Pathol,2002,26(9):1129-1141.
[12]Longacre TA,McKenney JK,Tazelaar HD,et al.Ovarian serous tumors of low malignant potential(borderline tumors):outcome-based study of 276 patients with longterm(>or=5-year)follow-up[J].Am J Surg Pathol,2005,29(6):707-723.
[13]B ristow RE,Gossett DR,Shook DR,et al.Recurrent micropapillary serous ovarian carcinoma[J].Cancer,2002,95 (4):791-800.
[14]Prat J,De Nictolis M.Serous borderline tumors of the ovary:a long-term follow-up study of 137 cases,including 18 with a micropapillary pattern and 20 with microinvasion [J].Am J Surg Pathol,2002,26(9):1111-1128.
[15]Slomovitz BM,Caputo TA,Gretz HF,et al.A comparative analysis of 57 serous borderline tumors with and without a noninvasive micropapillary component[J].Am J Surg Pathol,2002,26(5):592-600.
[16]Koskas M,Uzan C,Gouy S,et al.Prognostic factors of a large retrospective series of mucinous borderline tumors of the ovary(excluding peritoneal pseudomyxoma)[J]. Ann Surg Oncol,2011,18(1):40-48.
[17]Nomura K,Aizawa S,Hano H.Ovarian mucinous borderline tumors of intestinal type without intraepithelial carcinoma:are they still tumors of low malignant potential?[J]. Pathol Int,2004,54(6):420-424.
Prognostic factors associated with recurrence after ovarian cystectomy of stage Ⅰborderline ovarian tumoorrss
KANG Hai-li DUAN Wei#
Department of Gyrecology Oncology,Beijing Obstetrics and Gynecology Hospital,Capital Medical University,Beijing 100006,China
ObjectivectiveTo evaluate the prognostic factors regarding recurrence after ovarian cystectomy of young pa tients with stage I borderline ovarian tumors(BOT).Methodethod49 patients(age<35 years old)who underwent ovarian cystectomy with surgically confirmed stage I BOT were included in the analysis,of which the clinical and follow-up pro files were analyzed to determine risk factors concerning postoperative recurrence.ResultesultOf all patients,7 had relapse 5-year survival rate was 100%,recurrence-free survival rate was 91.8%;high risk factors for recurrence after cystectomy of BOT were mucinous tumors and micro-papillary type(both P<0.05)rather than age,stage,or stromal invasion(P>0.05).ConclusionusionFor stage I BOT patients with unilateral lesion,and intraoperative frozen histological result shows mucinous borderline tumors or micro-papillary type,then ipsilateral oophorectomy is acceptable;for patients with bilater al lesions while were absent of those risk factors stated above,then bilateral ovarian tumor cystectomy is feasible;other wise,ipsilateral oophorectomy and contralateral ovarian tumor cystectomy should be considered.
rdsborderline ovarian tumor;preservation of fertility;ovarian tumor cystectomy;recurrence
R737.31
A
10.11877/j.issn.1672-1535.2016.14.05.15
(corresponding author),邮箱:31212603li@gmail.com
2016-04-07)
