阿米福汀对直肠癌同步放化疗患者的保护作用
2016-09-06牛楠杨明丽陈威曾越灿吴荣中国医科大学附属盛京医院第二肿瘤科沈阳1122
牛楠 杨明丽 陈威 曾越灿 吴荣中国医科大学附属盛京医院第二肿瘤科,沈阳1122
阿米福汀对直肠癌同步放化疗患者的保护作用
牛楠 杨明丽 陈威 曾越灿 吴荣#
中国医科大学附属盛京医院第二肿瘤科,沈阳1100220
目的探讨阿米福汀(AMI)对直肠癌同步放化疗患者的保护作用。方法选取经病理组织学证实的直肠癌患者80例,随机分为治疗组和对照组,每组各40例。所有患者均予盆腔适形调强放射治疗及口服卡培他滨同步化疗。治疗组在同步放化疗基础上加用AMI治疗,观察两组患者的不良反应,并进行对比分析。结果治疗组Ⅱ~Ⅳ级急性直肠炎的发生率为12.5%,明显低于对照组的32.5%,差异具有统计学意义(P<0.05);两组患者均无Ⅲ~Ⅳ级泌尿系统不良反应发生;治疗组中性粒细胞减少发生率为22.5%,明显低于对照组的45%,差异具有统计学意义(P<0.05)。AMI相关不良反应有:低血压2例,Ⅲ级呕吐2例,面部温热感1例;无因AMI相关不良反应而中断治疗者。结论AMI可预防或减轻放化疗带来的不良反应,值得临床推广应用。
阿米福汀;直肠癌;适形调强放疗;保护作用
Oncol Prog,2016,14(5)
近年来,直肠癌发病率逐年增加,每年有超过100万的新发病例,居恶性肿瘤谱的第4位。美国国家综合癌症网络(NCCN)指南推荐对Ⅱ期、Ⅲ期直肠癌患者予手术为主,辅助放化疗的综合治疗方案,可降低肿瘤局部复发率,延长患者无病生存期。但在盆腔放疗过程中常伴有放射性直肠炎、放射性膀胱炎及骨髓抑制等不良反应。最新临床研究表明,接受盆腔肿瘤放疗的患者,放射性肠炎的发生率可高达20%[1-3]。阿米福汀(Amifostine,AMI)是世界上第一个被国际权威机构认可的广谱细胞保护药,在放化疗中能选择性地保护正常组织免受损伤,并且不影响放化疗的疗效[4-5]。本研究收集了近3年来就诊的直肠癌患者,应用AMI联合同步放化疗,探讨AMI对直肠癌同步放化疗患者的保护作用。
1 对象与方法
1.1研究对象
本研究经医院伦理委员会批准,选取2012年6月至2015年6月在中国医科大学附属盛京医院治疗的直肠癌患者80例,按照数字列表法随机分为治疗组及对照组,每组各40例。纳入标准:疾病临床分期为Ⅱ期以上;预计生存期≥12周;ECOG体力状况(PS)评分≤2分;血常规、心电图、肝肾功能等基本正常;治疗前所有患者均知情同意并签署知情同意书。排除标准:合并肝肾等重大脏器疾病;合并其他重症疾病者。所有患者均采用全直肠系膜切除术,同时结合其他术式,且经组织病理学确诊为直肠腺癌,其中5例有肝脏局部转移,同时行肝局部切除术。治疗组患者:男25例,女15例,年龄39~75岁,中位年龄61岁;2例患者PS评分为2分;病理类型为高分化腺癌的有16例,中低分化腺癌24例;临床分期为Ⅱ期16例,Ⅲ期21例,Ⅳ期3例(肝转移)。对照组患者:男23例,女17例,年龄42~74岁,中位年龄60.5岁;3例患者PS评分为2分;病理类型为高分化腺癌的有18例,中低分化腺癌22例;临床分期为Ⅱ期18例,Ⅲ期20例,Ⅳ期2例(肝转移)。两组患者性别、年龄、病理类型、PS评分、临床分期等基本特征比较差异均无统计学意义(P>0.05),具有可比性,详见表1。
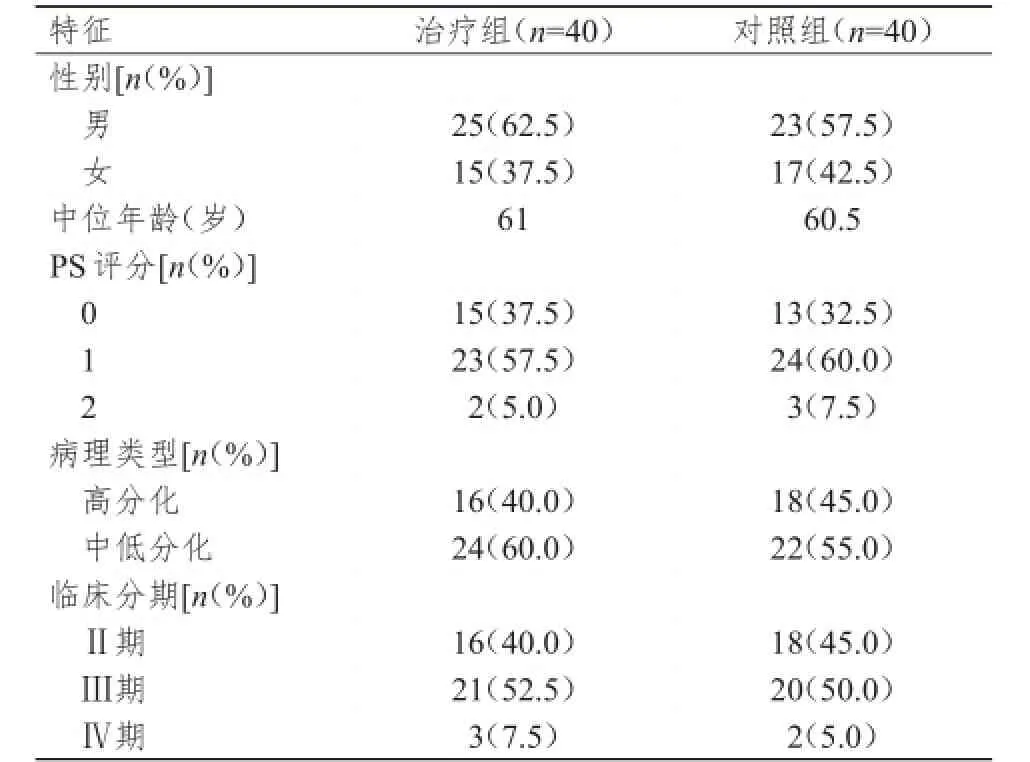
表1 两组患者的基本特征
1.2治疗方法
80例患者均采用适形调强放射治疗:经模拟CT定位,取俯卧位,腹下垫镂空泡沫,水解热塑膜体罩固定。靶区为左右髂总、髂内、髂外淋巴区,骶前区,全部直肠、肛管及1/3~1/2膀胱体积。总放射剂量为50 Gy,每次1.8~2 Gy,5次/周,持续5周左右。所有患者从放疗第1天开始同步口服卡培他滨825 mg/m2,每天2次,每周5 d,直至放疗结束。40例治疗组患者在同步放化疗基础上加用AMI:放疗前30 min应用AMI 300 mg/m2静脉滴注,15 min滴注完毕。观察患者有无低血压或恶心呕吐等不良反应发生,随后可进行放疗并口服卡培他滨1次治疗。
1.3观察指标
①下消化道反应:根据急性放射损伤标准(RTOG)将消化道反应分为0~Ⅳ级。每日观察记录患者便次、质地,有无便血及出血程度,有无肛门疼痛及疼痛程度,观察放射性直肠炎发生情况,共随访3个月。②泌尿系统反应:根据RTOG分级标准分为0~Ⅳ级,放疗过程中每日观察记录患者有无尿频、尿急、尿痛、排尿困难及血尿等,观察放射性膀胱炎发生情况。③骨髓抑制、转氨酶升高、神经病变等不良反应:每周复查血常规、肝肾功能等化验指标。根据2003年美国国立癌症研究所通用不良事件术语标准(NCI-CTCAE)3.0版的分级标准,将不良反应分为0~Ⅳ级。④AMI相关不良反应:低血压,在每日早晚及静脉滴注AMI前监测基础血压,且于AMI滴注结束后需再次测量血压,以判断有无药物相关性低血压发生,若收缩压明显降低应立即停药(表2);低血钙:于治疗前、治疗时每周及治疗后监测血钙值,观察患者有无面部温热感及皮疹等。

表2 输注AMIAMI收缩压降低值停药标准(mm Hgmm Hg)
1.4统计学方法
采用SPSS13.0统计软-件进行数据分析。计量资料采用均数±标准差(±s)表示,计数资料采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1两组患者急性直肠炎及膀胱炎发生情况比较
所有入选患者均按计划完成治疗。治疗组未出现Ⅲ~Ⅳ级急性直肠炎,Ⅱ级急性直肠炎的发生率为12.5%(5/40),其余患者无消化道反应或可耐受,且无需药物处理。对照组出现2例Ⅲ级急性直肠炎患者,经药物止泻,调整肠道菌群及胃肠外营养等治疗后好转,均可继续完成治疗。治疗组患者Ⅱ~Ⅳ级急性直肠炎发生率为12.5%,明显低于对照组的32.5%(13/40),两组间差异有统计学意义(χ2=3.02,P<0.05)。
治疗组患者均为0~Ⅰ级急性膀胱炎,其中2例为Ⅰ级急性膀胱炎;对照组39例患者为0~Ⅰ级急性膀胱炎,其中2例为Ⅰ级急性膀胱炎,且出现Ⅱ级急性膀胱炎1例。两组患者急性膀胱炎发生情况比较,差异无统计学意义(χ2=0.82,P>0.05),且均无Ⅲ~Ⅳ级泌尿系统不良反应发生,详见表3。

表3 两组的直肠炎及膀胱炎发生情况
2.2两组患者其他不良反应比较
对所有患者进行不良反应评价,结果显示,治疗组中性粒细胞减少发生率为22.5%,明显低于对照组的45.0%,比较差异具有统计学意义(P<0.05);治疗组贫血、血小板减少、呕吐、乏力发生率分别为20.0%、17.5%、20.0%、27.5%,对照组分别为22.5%、25.0%、12.5%、25.0%,两组差异比较均无统计学意义(P>0.05);两组患者转氨酶升高及外周神经病变发生率比较差异亦无统计学意义(P>0.05)。
2.3两组患者AAMMII相关不良反应比较
治疗组患者均完成治疗,未出现因AMI不良反应而中断治疗者。输注AMI时出现2例低血压,但收缩压降低值均未达到停药标准,嘱患者平卧休息后血压在半小时内恢复正常,可继续放疗;2例患者出现AMI相关性Ⅲ级呕吐,应用5-HT3受体拮抗剂及地塞米松止吐,胃肠外营养等治疗后缓解;面部温热感症状出现1例,且患者可耐受;未发现患者药物相关性低血钙及皮疹发生。
3 讨论
AMI是一种有机硫代磷酸类化合物,本身无保护作用,其通过膜碱性磷酸酯酶作用脱磷酸成为有活性的代谢产物WR-1065,从而对正常组织产生选择性保护作用[3]。由于机体正常组织细胞大多处于需氧环境,pH值高,细胞膜碱性磷酸酯酶活性较强,AMI可快速转化为WR-1065,与射线产生的有害自由基结合,保护正常组织细胞。而人体肿瘤组织细胞大多数处于缺氧环境,pH值较低,碱性磷酸酯酶活性相对较弱,WR-1065在肿瘤组织中浓度极低,故AMI对肿瘤组织无保护作用[3]。许多体外动物实验证实,AMI对胃肠黏膜组织、唾液腺、骨髓、睾丸、肺、肝脏、肾脏及皮肤均有放射防护作用[4-5]。国内外多项Ⅱ期临床研究证实AMI可显著减少放化疗导致的相关骨髓、肝肾、黏膜、神经及心脏不良反应,并且不影响治疗效果[6-13]。
本研究应用AMI联合放化疗治疗直肠癌,通过观察急性直肠炎、急性膀胱炎及骨髓抑制等不良反应发生率,探讨AMI对直肠癌同步放化疗患者的保护作用。治疗组Ⅱ~Ⅳ级急性直肠炎的发生率为12.5%,明显低于对照组的32.5%,差异有统计学意义(P<0.05)。两组患者急性膀胱炎发生率均较低,差异无统计学意义(P>0.05)。我国学者马文等[14]的Ⅱ期临床研究探讨AMI对盆腔肿瘤放疗患者膀胱黏膜的保护作用,结果与本研究相似。Panteliadou等[15]研究结果显示,应用AMI 1000 mg患者消化及泌尿系统等不良反应发生率最低,表明AMI可降低侵袭性膀胱癌大剂量超分割放疗的不良反应。Kouloulias等[16]的临床研究证实,直肠灌注AMI优于静脉注射治疗,可降低盆腔放疗过程中急性直肠炎的发生率。因此探讨不同给药方式及不同剂量AMI的临床应用还有待今后的进一步研究。
对于患者其他不良反应比较,本研究仅观察到中性粒细胞减少发生率在两组间比较差异有统计学意义(P<0.05)。研究表明AMI不仅对放化疗所致骨髓损伤有保护作用,而且在造血干细胞移植过程中可促进骨髓造血重建,还可以联合促红细胞生成素治疗骨髓增生异常综合征[17]。
多项研究表明,AMI用在放化疗前15~30 min静脉给药效果最佳,常用剂量为250~350 mg/m2,主要不良反应有恶心呕吐和低血压,其他不良反应包括颜面潮红、低血钙、眩晕、嗜睡等[18-19]。本研究发现Ⅲ级呕吐2例,经止吐及胃肠外营养等治疗后缓解,随后每次应用AMI前均预防性应用5-HT3受体拮抗剂,于第1天用药前30 min予患者静脉注射盐酸帕洛诺司琼0.25 mg,1~3 d用药前分别静脉滴注地塞米松16、8、8 mg,止吐效果良好,患者最终顺利完成治疗。Rades等[20]推荐在应用大剂量AMI前或对于不良反应敏感患者,应适当给予补液,地塞米松和5-HT3受体拮抗剂等治疗,以减少不良反应发生。
综上所述,阿米福汀可避免或减轻放化疗带来的不良反应,值得临床推广应用。今后可以进一步探讨不同给药方式及不同剂量阿米福汀的临床应用,以为临床治疗提供更多帮助。
[1]Kalaiselvan R,Theis VS,Dibb M,et al.Radiation enteritis leading to intestinal failure:1994 patient-years of experience in a national referral centre[J].Eur J Clin Nutr,2014,68(2):166-170.
[2]夏红强,金冶宁.Amifostine在恶性肿瘤放疗中的应用[J].现代肿瘤医学,2009,17(4):774-776.
[3]戴丹丹,刘孟娟,叶晓春.氨磷汀的临床应用概况[J].海峡药学,2014,26(5):79-80.
[4]Kanter M,Topcu-tarladcalisir Y,Uzalc C.Role of amifostine on acute and Late radiation nephrotoxicity:a histopathological study[J].In Vivo,2011,23(25):77-85.
[5]Caloglu M,Yurut-Caloglu V,Durmus-Altun G,et al.Histopathological and scintigraphic comparisons of the protective effects of L-carnitine and amifostine against radiationinduced late renal toxicity in rats[J].Clin Exp Pharmacol Physiol,2009,53(36):523-530.
[6]潘辉林,黄岩,宋慧胜,等.氨磷汀对行化疗的肿瘤患者的保护作用[J].实用癌症杂志,2011,26(3):306-308.
[7]赵衍.阿米福汀在非小细胞肺癌放疗中对正常组织的保护研究[J].临床肺科杂志,2014,19(11):2050-2052.
[8]魏妙华,徐益元,陈健苗,等.GP方案单用与联合氨磷汀方案在晚期恶性肿瘤化疗不良反应中的比较[J].中国临床药学杂志,2015,24(1):39-42.
[9]Koukourakis MI,Simopoulos C,Pitiakoudis M,et al.Hypofractionated accelerated radiotherapy,cytoprotection and capecitabine in the treatment of rectal cancer:a feasibility study[J].Anticancer Res,2008,28(5B):3035-3040.
[10]Koukourakis MI.Amifostine in clinical oncology:current use and future applications[J].Anticancer Drugs,2002,13 (3):181-209.
[11]胡丹红,刘俏,石小姑,等.XELOX化疗联合阿米福汀治疗Ⅲ期结直肠癌的临床观察和护理[J].浙江实用医学,2012,17(4):309-310;312.
[12]Katsanos KH,Briasoulis E,Tsekeris P,et al.Randomized phase II exploratory study of prophylactic amifostine in cancer patients who receive radical radiotherapy to the pelvis[J].J Exp Clin Cancer Res,2010,29:68.
[13]Koukourakis MI,Giatromanolaki A,Tsoutsou P,et al.Bevacizumab,capecitabine,amifostine,and preoperative hypofractionated accelerated radiotherapy(HypoArc)for rectal cancer:a Phase II study[J].Int J Radiat Oncol Biol Phys,2011,80(2):492-498.
[14]马文,蔡宏懿,缪国英,等.氨磷汀对盆腔肿瘤放疗患者肠道和膀胱黏膜的保护作用[J].中国药房,2015,26(17):2394-2396.
[15]Panteliadou M,Giatromanolaki A,Touloupidis S,et al. Treatment of invasive bladder cancer with conformal hypofractionated accelerated radiotherapy and amifostine (HypoARC)[J].Urol Oncol,2012,30(9):813-820.
[16]Kouloulias VE,Kouvaris JR,Pissakas G,et al.Phase II multicenter randomized study of amifostine for prevention of acute radiation rectal toxicity:Topical intrarectal versus subcutaneous application[J].Int J Radiat Oncol BiolPhys,2005,62(11):486-493.
[17]董伟民,曹祥山,凌云,等.氨磷汀在异基因造血干细胞移植预处理中的保护作用[J].现代医学,2011,39(1):71-73.
[18]Lu P,Fan QX,Wang LX,et al.Prophylactic effect of amifostine on oxaliplatin-related neurotoxicity in patients with digestive tract tumors[J].Ai Zheng,2008,27(10):1117-1120.
[19]Mazeron JJ,European Society for Therapeutic Radiology and Oncology(ESTRO).[Minutes of the 23th meeting of the European Society for Therapeutic Radiology and Oncology Amsterdam,24-28 October 2004][J].Cancer Radiother,2005,9(2):122-126.
[20]Rades D,Fehlauer F,Bajrovic A,et al.Serious adverse effects of Amifostine during radiotherapy in head and neck cancer patients[J].Radiother Oncol,2004,70(3):261-264.
Protective effect of amifostine in the concurrent radiochemotherapy for patients with rectal carcinoommaa
NIU Nan YANG Ming-li CHEN Wei ZENG Yue-can WU Rong#
Department of Medical Oncology,Shengjing Hospital of China Medical University,Shenyang 110022,China
ObjectivectiveTo observe the protective effects of amifostine in the concurrent radiochemotherapy for patients with rectal carcinoma.Methodethod80 patients with pathologically confirmed rectal carcinoma were randomized into study group or control group,with 40 cases in each.All patients were treated by general treatment of intensity modulated radiation therapy(IMRT)and oral capecitabine concurrent chemotherapy.While the patients in the study group were given intravenous amifostine additionally on the basis of general treatment,the adverse reactions in both two groups were observed and comparatively analyzed.ResultesultThe incidence of acute proctitis of gradeⅡ~Ⅳwas 12.5%,significantly lower in the study group compared with the control group at 32.5%(P<0.05);no acute cystitis of gradeⅢ~Ⅳwas found in neither groups;the incidence of neutropenia was 22.5%in study group,which was significantly lower than that of control group at 45%(P<0.05).Amifostine-related adverse reactions included:2 cases of hypotension,2 cases of gradeⅢvomiting,1 case of flush;none of the subjects were discontinued due to amifostine-related adverse reactions.Conclusionusion Amifostine is effective in preventing or reducing side effects induced by radiochemotherapy,which is clinically practicable.
rdsamifostine;rectal carcinoma;intensity modulated radiation therapy;protective effect
R735. 3
A
10.11877/j.issn.1672-1535.2016.14.05.08
(corresponding author),邮箱:wur@sj-hospital.org
2016-01-28)
