杜仲叶水提液除杂工艺的优化
2016-09-06王柏强何效平曾芝兰江承平川北医学院附属医院药剂科四川南充637000川北医学院药学院四川南充637000
王柏强, 刘 福*, 何效平, 曾芝兰, 江承平(.川北医学院附属医院药剂科,四川南充637000;2.川北医学院药学院,四川南充637000)
杜仲叶水提液除杂工艺的优化
王柏强1,2, 刘 福1,2*, 何效平1, 曾芝兰1, 江承平1,2
(1.川北医学院附属医院药剂科,四川南充637000;2.川北医学院药学院,四川南充637000)
目的 优选杜仲叶水提液的除杂工艺。方法 采用高速离心法、醇沉法、壳聚糖絮凝沉淀法、ZTC絮凝沉淀法、壳聚糖絮凝澄清-高速离心法、ZTC絮凝澄清-高速离心法对杜仲叶水提液进行澄清处理,筛选出适宜的澄清方法。以绿原酸保留率、鞣质和蛋白质去除率以及药液澄明度为评价指标,在单因素试验基础上,应用正交试验设计优化澄清工艺。结果 最佳澄清方法是壳聚糖絮凝澄清-高速离心法,该方法处理后提取液有效成分保留率为89.5%,蛋白质和鞣质去除率为分别为54.4%和57.5%,澄明度和稳定性良好。结论 壳聚糖絮凝澄清-高速离心法可作为杜仲叶水提取液的最佳澄清工艺,其稳定可行,而且有效成分损失少。
杜仲;叶;水提液;除杂;单因素试验;正交试验
杜仲平压片收载于原卫生部颁药品标准 《中药成方制剂》(第11册),为杜仲Eucommia folium叶经提取纯化后加工制成的片剂[1],用于治疗高血压、头晕目眩、腰膝酸痛、筋骨痿软等症。原生产工艺中采用水提醇沉法除杂[2],虽能去除部分蛋白质,但对鞣质效果较差,而且需要耗费大量乙醇,成本较高,周期长。为了降低生产成本,提高产品质量,本实验以杜仲叶水提液为研究对象,以绿原酸保留率、鞣质和蛋白质去除率以及药液澄明度为评价指标,在单因素试验基础上,应用正交试验设计优选最佳除杂工艺。
1 仪器与试药
1.1仪器 10A高效液相色谱仪、SPD-10A紫外检测器(日本岛津公司);Hypersic C18色谱柱(250 mm×4.6 mm,5μm);TG16-WS高速离心机 (湘仪离心机有限公司);HI303磁力搅拌器 (汇尔仪器设备有限公司);RE-52AA旋转蒸发器 (上海亚荣生化仪器厂)。
1.2试药 杜仲叶由重庆医药公司提供,经川北医学院药学院李生茂讲师鉴定为杜仲科植物杜仲Eucommia uimoides O1iv.的干燥叶。绿原酸对照品 (中国食品药品检定研究院,批号0753-200413);壳聚糖 (上海华凯科技贸易公司);ZTC1+1(天津振天成科技有限公司)。乙腈为色谱纯;其他试剂均为分析纯。
2 方法与结果
2.1澄清工艺考察 以绿原酸保留率、鞣质和蛋白质去除率以及药液澄明度为评价指标,采用高速离心法、醇沉法、壳聚糖絮凝沉淀法、ZTC絮凝沉淀法、壳聚糖絮凝澄清-高速离心、ZTC絮凝澄清-高速离心法对杜仲叶水提液进行澄清工艺研究。首先对各方法进行单因素考察,然后在各法最优条件下进行澄清处理,以筛选出最佳除杂方法。
2.1.1提取液制备 按处方称取6个处方量杜仲叶,加水煎煮3次,第1次加10倍量水煎煮1 h,剩下2次加8倍量水煎煮45 min,滤过,合并滤液,减压浓缩,均分成6份,备用。
2.1.2高速离心法 取 “2.1.1”项下提取液一份,置于10 000 r/min离心机中离心20 min,取上层清液,加水定容。
2.1.3醇沉法 取 “2.1.1”项下提取液一份,加5倍量乙醇搅拌,静置过夜,滤过,滤液浓缩至无醇味,加水定容。
2.1.4壳聚糖絮凝沉淀法[3-5]称取壳聚糖粉末1 g,加入1%醋酸溶液100 mL,搅拌后静置24 h,即得1%壳聚糖溶液。取 “2.1.1”项下提取液一份,调节pH值至5,加热恒温至60℃,按0.3 g/L用量加入1%壳聚糖溶液,于100 r/min转速下搅拌5min,静置,滤过,定容。
2.1.5ZTC絮凝沉淀法 配制澄清剂溶液[6]。方法为称取ZTC澄清剂A组份1.0 g,加少量纯化水搅成糊状,再加纯化水至100 mL,溶胀24 h,搅拌后脱脂棉过滤,即得1%黏胶液。按相同方法,将B组份用1%醋酸溶液配制成1%黏胶液。
取 “2.1.1”项下提取液一份,加热恒温至60℃,按1.0 g/L用量加入B组份,搅匀,再按0.5 g/L用量加入A组份,在100 r/min转速下搅拌5 min,静置,滤过,定容。
2.1.6 壳聚糖絮凝澄清-高速离心法 取“2.1.1”项下提取液一份,调节pH值至5,加热恒温至60℃,按0.3 g/L用量加入1%壳聚糖溶液,于100 r/min转速下搅拌5 min,静置,然后于10 000 r/min离心机中离心20 min,取上清液,加水定容。
2.1.7ZTC絮凝澄清-高速离心法 取“2.1.1”项下提取液一份,加热恒温至60℃,按1.0 g/L用量加入ZTC1+1絮凝剂B组份,搅匀,再按0.5 g/L用量加入ZTC1+1絮凝剂A组份,在100 r/min转速下搅拌5 min,静置,然后于10 000 r/min离心机中离心20 min,取上清液,加水定容。
2.2绿原酸含有量的测定[7]
2.2.1色谱条件 Hypersic C18色谱柱(250 mm×4.6 mm,5μm);流动相为乙腈-0.4%磷酸水溶液 (13∶87);体积流量1.0 mL/min;检测波长327 nm;柱温25℃。
2.2.2对照品溶液的制备 精密称取干燥至恒重的绿原酸对照品10 mg,50%甲醇溶解并定容至50 mL棕色量瓶中,即得0.2mg/mL对照品溶液。
2.2.3供试品溶液的制备 精密量取原药液和6种方法制得的样品各0.5 m L,置于10 mL量瓶中,50%甲醇定容,摇匀,0.45μm微孔滤膜滤过,取续滤液,即得。
2.2.4线性关系考察 精密量取绿原酸对照品溶液0.1、1、5、8、10 mL,置于10 mL量瓶中,50%甲醇稀释并定容至刻度,摇匀,0.45μm微孔滤膜滤过,在 “2.2.1”项色谱条件下进样测定。以峰面积为纵坐标 (y),溶液质量浓度为横坐标 (c)进行线性回归,得回归方程y= 31 820c+10 791(r=0.999 9),表明绿原酸在 2. 0~200μg/mL范围内线性关系良好。
2.2.5样品含有量测定 精密吸取对照品与供试品溶液各20μL,注入液相色谱仪,记录峰面积,计算绿原酸的含有量。绿原酸保留率=(除杂后药液中绿原酸含有量/提取液中绿原酸含有量)×100%。
2.3鞣质含有量的测定[8-10]采用以磷钼钨酸为显色剂,干酪素为鞣质吸附剂,没食子酸为对照品的磷钼钨酸比色法。在碱性条件下加入磷钼钨酸,采用紫外分光光度法于760 nm波长处分别测定样品溶液中总多酚和不被吸附多酚的含有量,计算样品中鞣质的含有量。鞣质去除率=[(1-除杂后药液中鞣质含有量 /提取液中鞣质含有量)]×100%。
2.4蛋白质含有量的测定[11-12]采用灵敏度高的Bradford法,以考马斯亮兰G-250染料在酸性溶液中与蛋白质结合后,于595 nm波长处测定样品的吸光度值,计算样品中蛋白质的含有量。蛋白质去除率=(1-除杂后药液中蛋白质含有量/提取液中蛋白质含有量)×100%。
2.5筛选结果 采用综合评分法[13-14],选择绿原酸保留率、鞣质和蛋白质去除率以及药液澄明度作为评价指标,权重系数分别为0.5、0.2、0.2、0.1。澄清度评分标准为混浊1分,较澄清2分,澄清3分,综合评分=绿原酸保留率×50+鞣质去除率×20+蛋白质去除率×20+(澄清度得分/最澄清得分) ×10。结果见表1。由表可知,澄清效果依次为壳聚糖絮凝澄清-高速离心法>ZTC絮凝澄清-高速离心法>壳聚糖絮凝沉淀法>ZTC絮凝沉淀法>醇沉法>高速离心法。因此,本实验选择壳聚糖絮凝澄清-高速离心法作为杜仲叶水提液的澄清除杂工艺。
表1 澄清方法的筛选结果 (±s)

表1 澄清方法的筛选结果 (±s)
澄明度得分 综合评分高速离心法方法 绿原酸保留率/% 鞣质去除率/% 蛋白质去除率/% 87.4±0.26 45.2±0.44 48.6±0.42 3 72.5 92.7±0.47 15.3±0.29 14.8±0.17 2 59.0醇沉法 82.6±0.40 24.9±0.45 43.1±0.51 2 61.6壳聚糖絮凝沉淀法 90.4±0.48 43.9±0.32 48.4±0.37 2 70.3 ZTC絮凝沉淀法 88.5±0.39 42.5±0.29 44.7±0.54 2 68.4壳聚糖絮凝澄清-高速离心法 89.2±0.36 47.9±0.31 51.4±0.46 3 74.5 ZTC絮凝澄清-高速离心法
2.6壳聚糖絮凝澄清-高速离心工艺的优化 在单因素考察的基础上,选择壳聚糖用量、药液比、药液温度、搅拌时间、搅拌速度、药液pH值及离心转速7个因素,以绿原酸保留率、鞣质和蛋白质去除率以及药液澄明度为评价指标,采用L18(37)正交表设计方案。因素水平和结果见表2~3,方差分析见表4。
表3显示,各因素影响程度依次为A>B>F>E>G>C>D。由表4可知,因素 A、B、E、F具有显著性差异(P<0.05),而C、D、G差异无统计学意义 (P>0.05)。最终确定,最佳工艺条件为A3B2C2D3E2F2G3,即壳聚糖用量0.4 g/L,药液比1∶2,药液温度60℃,搅拌时间6 min,搅拌速度100 r/m in,药液 pH 5.0,离心转速10 000 r/min。
2.7验证实验 按最佳澄清工艺条件进行6次验证实验,结果见表5。由表可知,测得值与优化实验结果相近,说明壳聚糖絮凝澄清-高速离心法合理可行,稳定可靠。

表2 因素水平

表3 正交试验结果

表4 方差分析
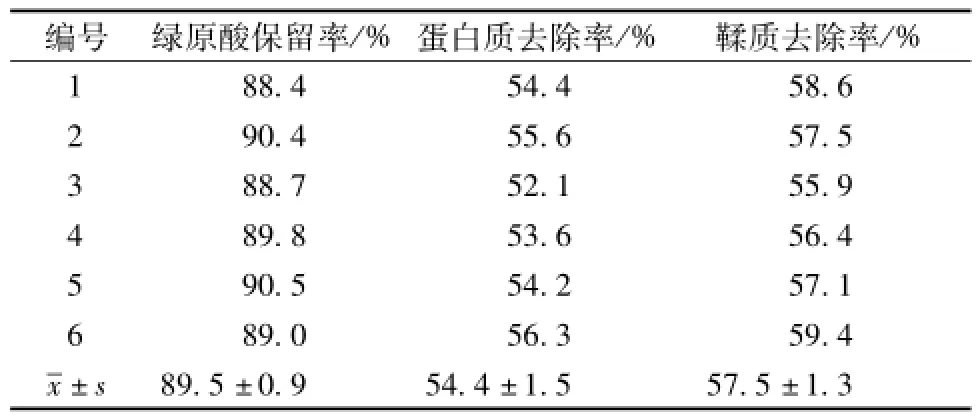
表5 验证实验结果(n=6)
3 讨论
中药成分复杂,提取液中往往含有大量树脂状胶体物、鞣质、纤维素、淀粉、蛋白质等无活性的杂质成分。药材制成胶囊、片剂、颗粒剂等制剂时,因提取浸膏固形物多,剂量大,故服用不便。杜仲平压片以绿原酸含有量为其质量评价标准,因此在对杜仲叶水提取液进一步纯化时,选择绿原酸保留率、鞣质去除率、蛋白质去除率、澄明度等作为评价指标,并进行综合评分,可用于评价澄清除杂工艺的优劣。
在筛选纯化方法时发现,醇沉法除杂后,浸膏得率较低,但有效成分损失较大,药液中杂质沉淀速度慢,费时,澄清液乳光严重,鞣质去除率低;高速离心法有效成分保留率相对较高,浸膏得率最大,但除杂效果不理想,澄清液长时间放置易产生沉淀;壳聚糖絮凝澄清-高速离心法与ZTC絮凝澄清-高速离心法处理后的样品在浸膏得率上无显著性差异,但前者较大程度上保留了药液中的有效成分,对鞣质及蛋白质的去除效果明显,药液澄明度好,澄清剂用量小,达到了精制中药提取液的要求,而且成本低,操作简便。因此,本实验选择该方法进行杜仲叶水提液的除杂工艺研究。
[1]马凤仙,赫锦锦,李 钦.RP-HPLC测定杜仲平压片中京尼平苷酸、绿原酸、京尼平苷的含量[J].中成药,2008,30(1):86-89.
[2]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准中药成方制剂:第11册[S].1996.
[3]罗兴洪,周进东,吴 静,等.壳聚糖用于咳喘宁口服液澄清工艺的研究[J].中成药,2002,24(5):337-339.
[4]王柏强,丁 红,杜 艳.均匀设计考察壳聚糖对杜仲叶提取液的絮凝澄清作用[J].山西医科大学学报,2006,37(7):765-767.
[5]邓 良,袁 华,喻宗沅.杜仲叶提取液除杂与脱色研究[J].化学与生物工程,2006,23(7):28-30.
[6]张 丹,李 毅,唐学贵,等.便塞通颗粒水提澄清工艺研究[J].时珍国医国药,2009,20(7):1686-1688.
[7]王柏强,刘 福,江承平,等.正交试验优选杜仲叶绿原酸的提取工艺[J].中国药房,2014,25(27):2527-2529.
[8]孙 娇,秦 莉,李桂水,等.壳聚糖对小儿咳喘灵原药提取液絮凝除杂效果研究[J].中草药,2013,44(2):174-179.
[9]刘 杰,孙 娇,秦 莉,等.复配絮凝剂用于小儿咳喘灵原药水提液絮凝效果研究[J].中草药,2013,44(8):2246-2251.
[10]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010.
[11]胡 松,程 璐,张 耕.葱白中蛋白质的凝胶电泳分析[J].医药导报,2013,32(8):1083-1084.
[12]靳梦亚,董 玲,戴俊东,等.Bradford法测量不同加工工艺鹿茸蛋白含量研究[J].中华中医药学刊,2015,33(3):592-594.
[13]孙立霞,常桂娟,李秋萌,等.参玉口服液澄清工艺优选[J].中国实验方剂学杂志,2013,19(17):4-7.
[14]刘 颖,管 娜,盛 蓉,等.参脉五味口服液澄清工艺优选[J].中国医院药学杂志,2011,31(16):1354-1357.
R284
B
1001-1528(2016)06-1418-04
10.3969/j.issn.1001-1528.2016.06.048
2015-05-13
王柏强 (1979—),男,硕士,主管药师,研究方向为药物制剂。Te1:(0817)2262244,E-mai1:31618187@qq.com
刘 福 (1965—),男,主任药师,硕士生导师,研究方向为医院药学。Te1:(0817)2262246,E-mai1:nc1f91@163.com
