中药菩人丹对OLETF大鼠视网膜磷酸化c-Jun氨基末端激酶和半胱氨酸天冬氨酸激酶-3表达的干预作用
2016-09-06张自然董志军董微丽张铁民贾璐瑶承德医学院附属医院眼科河北承德067000
张自然, 董志军, 董微丽, 张铁民, 贾璐瑶, 戴 慧, 邢 薇(承德医学院附属医院眼科,河北承德067000)
中药菩人丹对OLETF大鼠视网膜磷酸化c-Jun氨基末端激酶和半胱氨酸天冬氨酸激酶-3表达的干预作用
张自然, 董志军*, 董微丽, 张铁民, 贾璐瑶, 戴 慧, 邢 薇
(承德医学院附属医院眼科,河北承德067000)
目的 探讨菩人丹超微粉 (PRD)对糖尿病大鼠视网膜磷酸化c-Jun氨基末端激酶 (p-JNK)和半胱氨酸天冬氨酸激酶-3(Caspase-3)表达的影响。方法 以自发性雄性2型糖尿病大鼠模型OLETF大鼠和其同系非糖尿病对照鼠LETO雄性大鼠为实验对象,血糖峰值>16.7mmo1/L和负荷后120min血糖>11.1mmo1/L作为成模标准,将24只成模雄性OLETF大鼠随机分为模型组、菩人丹超微粉治疗组,每组12只,同周龄12只雄性LETO大鼠为空白对照组。模型成功建立后,菩人丹超微粉治疗组大鼠给予菩人丹超微粉 [1.8 g·(kg·d)-1]灌胃2个月。HE染色观察视网膜形态结构的变化;采用脱氧核糖核苷酸末端转移酶介导的缺口末端标记法 (TUNEL)检测大鼠视网膜神经细胞的凋亡情况;SP免疫组织化学染色法和Western b1ot法检测视网膜磷酸化JNK(p-JNK)、Caspase-3蛋白的表达;采用逆转录聚合酶链法(RT-PCR)检测大鼠视网膜Jnk、caspase-3 mRNA的表达。结果 糖尿病模型组大鼠视网膜出现明显的病理变化,神经细胞凋亡指数p-JNK、Caspase-3蛋白及mRNA的表达明显高于正常对照组大鼠(P<0.01)。菩人丹超微粉治疗组大鼠视网膜的病理变化明显减轻,神经细胞凋亡指数、p-JNK、Caspase-3蛋白及mRNA的表达明显低于模型组大鼠 (P<0.01)。结论 菩人丹超微粉可以改善糖尿病视网膜病变中神经组织的损伤,表现为神经细胞凋亡的减少,这可能与下调p-JNK、Caspase-3的表达相关。
菩人丹超微粉;OLETF大鼠;糖尿病视网膜病变;细胞凋亡;磷酸化c-Jun氨基末端激酶;半胱氨酸天冬氨酸激酶-3
糖尿病视网膜病变(diabetic retinopathy,DR)的患病率、致盲率逐年升高,是目前工作年龄人群第一位的致盲性疾病[1]。关于DR发病机制至今尚不明确。近年的研究表明,细胞凋亡是DR早期最主要的病理表现形式,参与DR的发生发展[2-3]。c-Jun氨基末端激酶(c-Jun N-termina1 kinase,JNK)和半胱氨酸天冬氨酸激酶-3(cysteine aspartic acid specific protease-3,Caspase-3)作为参与细胞凋亡的两个重要因子与DR关系密切[4-5]。JNK是一类丝氨酸/苏氨酸蛋白激酶,它的活化(磷酸化JNK,p-JNK)能介导多种胞外刺激诱导的细胞凋亡[6-7],Caspase-3作为细胞凋亡途径下游的关键执行者,在JNK细胞凋亡通路中起着最终执行作用[8]。菩人丹超微粉(Purendan superfine powder,PRD)是针对糖尿病病机关键— “热、虚、瘀”而设,根据中医 “因虚致瘀久病入络”理论,在临床观察及预实验并结合现代药理学研究成果的基础上加减组成的中药复方。临床研究已证实菩人丹超微粉具有降血糖功效,并可有效改善2型糖尿病患者脂质代谢的紊乱[9]。前期实验研究进一步表明,菩人丹超微粉可修复胰岛β细胞损伤,改善胰岛功能,并保护糖尿病时肾脏和大血管损伤[10-11]。为拓展菩人丹超微粉治疗糖尿病并发症的研究,本课题组拟通过观察菩人丹超微粉是否可通过调节自发性2型糖尿病大鼠模型视网膜JNK和Caspase-3的表达,发挥对DR神经组织损伤的保护作用。
1 材料
1.1药物与试剂 菩人丹超微粉,药物组成比例为苦瓜10,人参1,丹参3,制首乌1,葛根1,水蛭0.3,由河北以岭药业集团有限公司按药物制备工艺代加工生产。TUNEL细胞凋亡检测试剂盒(瑞士Roche公司);p-JNK兔抗多克隆抗体(北京博奥森生物技术有限公司);Caspase-3兔抗多克隆抗体 (武汉博士德生物技术有限公司);SP免疫组化试剂盒 (北京四正柏生物科技有限公司);BCA蛋白定量试剂盒 (碧云天生物科技有限公司);Jnk、caspase-3引物(美国Invitrogen公司);RT-PCR试剂盒(日本Taka1a公司)。
1.2实验动物 清洁雄性自发性2型糖尿病大鼠Otsuka 1ong-evans tokushima fatty(OLETF)大鼠和其同系非糖尿病对照鼠Long evanstokushima otsuk(LETO)大鼠(日本大冢制药公司,许可证编号:DCE0000910)。
2 方法
2.1动物分组、模型制备与给药 以自发性2型糖尿病大鼠模型OLETF大鼠和其同系非糖尿病对照鼠LETO大鼠为实验对象。OLETF大鼠(雄性,24只),LETO大鼠(雄性,12只),4周龄,初始体质量为 (150±10)g。SPF级条件下单笼、标准饲料饲养。环境温度22~25℃,湿度50%~60%,12/12 h光照黑暗循环,自由进食。大鼠定期行口服葡萄糖耐量试验 (OGTT),以血糖峰值 >16.7 mmo1/L和负荷后120 min血糖>11.1 mmo1/L作为成模标准[11]。至32周龄造模成功后将OLETF大鼠随机分为模型组、菩人丹超微粉治疗组,同周龄12只雄性LETO大鼠为正常对照组。菩人丹超微粉治疗组给予菩人丹超微粉1.8 g/(kg·d)(前期研究确定的最佳药物剂量)灌胃2个月;正常对照组及糖尿病模型组给予同体积蒸馏水灌胃2个月。
2.2标本制备 大鼠经菩人丹超微粉治疗结束后,10%水合氯醛腹腔注射麻醉 (0.5 g/kg)。双侧眼球用眼科剪及弯镊迅速摘除,一侧眼球浸于4%多聚甲醛固定液中,取出后常规酒精脱水、二甲苯透明、石蜡包埋,分别备用于苏木素-伊红(HE)染色法观察视网膜形态变化、TUNEL法原位检测细胞凋亡及SP免疫组织化学染色法观察p-JNK及Caspase-3蛋白的表达;另一侧眼球迅速在冰面上分离视网膜组织,投入液氮中后转存至-80℃冰箱保存,备用于Western b1ot法检测p-JNK及Caspase-3蛋白的表达及RTPCR法检测Jnk、caspase-3 mRNA的表达。
2.3空腹血糖 (FBG)测定 分别于造模前、成模时、用药后尾静脉取血,使用血糖仪测定空腹血糖。
2.4HE染色观察大鼠视网膜形态学变化 平行视轴矢状位切片,片厚4μm,二甲苯脱蜡,梯度乙醇脱水,苏木素初染6 min,流水冲洗10 min,1%盐酸酒精分化10 s,流水冲洗10 m in,伊红复染2 min,脱水,透明,封片。400倍光学显微镜下观察视网膜的形态变化。
2.5TUNEL法原位检测大鼠视网膜细胞凋亡 按TUNEL试剂盒说明书步骤操作,400倍光学显微镜下观察。凋亡指(apoptotic index,AI)的计算:AI=阳性细胞数目/同一视野神经细胞总数。每只动物随机抽取3张切片,每张切片随机选取5个视野,取其平均值。
2.6SP免疫组织化学染色法检测视网膜中p-JNK、Caspase-3蛋白表达 眼球平行视神经连续矢状切片,片厚4μm,常规脱蜡至水,枸橼酸盐高压修复。Ⅰ抗分别为p-JNK多克隆抗体,稀释浓度为1∶150,Caspase-3多克隆抗体,稀释浓度1∶100,4℃湿盒过夜,DAB显色,苏木素复染,脱水,透明,封片。以0.01 mmo1/L PBS替代Ⅰ抗作阴性对照。阳性结果为在Ag定位处染棕黄或棕褐色。400光学显微镜下观察并摄片,阳性率=阳性结果面积/视野总面积。每只动物随机抽取3张切片,每张切片随机选取5个视野,取其平均值。
2.7Western b1ot法检测大鼠视网膜中p-JNK、Caspase-3蛋白表达 取低温冻存的视网膜组织,提蛋白,BCA试剂盒测蛋白浓度。各组蛋白上样量为50μg,12%聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉TBST室温封闭2 h,分别加入p-JNK(1∶200)、Caspase-3(1∶200)抗体,4℃孵育过夜,洗膜后加入二抗室温孵育1 h,ECL发光液显影。扫描胶片后分别计算目的蛋白的相对表达量:以β-Actin作为内参计算p-JNK、Caspase-3条带与β-Actin条带的灰度比值。
2.8RT-PCR法检测大鼠视网膜Jnk、caspase-3 mRNA表达
取-80℃冰箱中保存的视网膜组织置于匀浆器中,将细胞裂解液加入匀浆器内,冰盒中研磨至细腻颗粒状,用Takara RNA提取试剂盒提取总RNA。取4μL RAN进行琼脂糖凝胶电泳,可见清晰的28、18、5 s条带,说明无RNA降解。用紫外分光光度计检测提取RNA的纯度及浓度。以RNA为模板反转录成cDNA,所取RNA的量根据测出的浓度计算,反转录条件为:30℃,10 min;42℃,30 min;95℃,5 m in;5℃,5 min。取2μL cDNA产物进行PCR,引物序列及循环数及产物长度 (表1),Jnk反应条件为94℃预变性,5min;94℃变性,30 s;56℃退火,30 s;72℃延伸,45 s,第二步起循环。caspase-3反应条件为94℃预变性,5 min;94℃变性,30 s;53℃退火,30 s;72℃延伸,45 s,第二步起循环。取8μL扩增产物进行2%的琼脂糖凝胶电泳,100 V,60 min。图像用紫外投射反射分析仪进行摄像,Quantity-Oen软件进行分析,以β-actin作为内参计算Jnk mRNA条带与β-actin条带的灰度比值。

表1 PCR引物序列及扩增条件
3 统计学处理
采用SPSS 17.0统计软件对实验数据进行统计分析,数据经正态性检验及方差齐性分析符合单因素方差分析的条件,数据均以均值±标准差 (±s)表示,不同组间比较采用单因素方差分析,同组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
4 结果
4.1大鼠空腹血糖 造模前各组大鼠空腹血糖无明显差距(P>0.05),成模时除正常组外,各模型组空腹血糖显著升高,有统计学意义 (P<0.01)。用药后,与模型组比较,菩人丹超微粉组空腹血糖水平显著降低,有统计学意义 (P<0.01,表2)。
表2 大鼠空腹血糖值 (±s,n=12)
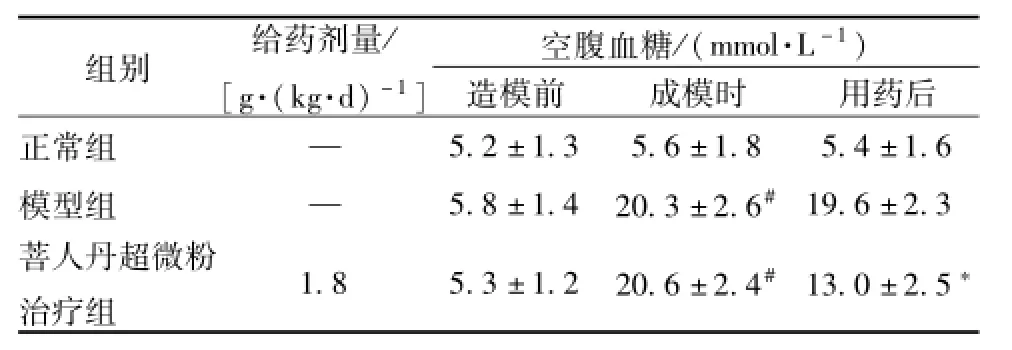
表2 大鼠空腹血糖值 (±s,n=12)
注:与正常组比较,#P<0.01;与模型组比较,*P<0.01
?
4.2大鼠视网膜HE染色结果 正常组大鼠视网膜组织结构完整、内界膜光滑、分层清晰;节细胞圆形、椭圆形,染色浅,排列整齐;内网状层较厚、疏松;内核层染色稍深,由3~5层细胞构成;外网状层较内网状层明显变薄;外核层染色深,由8~10层细胞组成,排列较紧密;外界膜边界清楚、整齐 (图1A)。模型组可见视网膜内界膜明显肿胀、增厚,部分内界膜破裂,内界膜界线不清晰,部分细胞空泡样变、细胞核固缩、溶解 (图1B)。菩人丹超微粉组视网膜分层较为清晰,内界膜轻度肿胀,可见少量空泡样变细胞 (图1C)。

图1 大鼠视网膜HE染色结果 (×400)
4.3大鼠视网膜TUNEL染色 正常对照组大鼠视网膜切片未见明显TUNEL染色阳性细胞(图2A);糖尿病模型组及菩人丹超微粉治疗组阳性细胞分布范围扩大,TUNEL染色阳性产物表现为褐色、颗粒状,位于胞核中,主要分布部位为视网膜内核层和神经节细胞(retina1 gang1ion ce11s,RGCs)层 (图2B、C)。3组大鼠视网膜中AI的总体比较差异有统计学意义,与正常组相比,模型组大鼠视网膜神经细胞AI明显升高 (P<0.01);与模型组相比,菩人丹超微粉治疗组大鼠视网膜神经细胞AI明显降低 (P<0.01,表3)。
4.4大鼠视网膜p-JNK蛋白的表达 免疫组织化学显色结果显示,p-JNK免疫阳性产物表现为棕黄色、细颗粒状,位于胞核和胞质中,阳性细胞主要分布部位为RGCs层及内核层 (图3)。免疫印迹法结果显示,p-JNK蛋白条带位于42 kDa处;β-Actin条带位于43 kDa处(图4)。与正常组相比,模型组大鼠视网膜组织p-JNK蛋白表达明显升高(P<0.01);与模型组相比,菩人丹超微粉治疗组大鼠视网膜组织p-JNK蛋白表达明显降低(P<0.01,表4)。

图2 大鼠视网膜组织TUNEL染色结果(×400)
表3 各组大鼠视网膜凋亡指数 (±s)

表3 各组大鼠视网膜凋亡指数 (±s)
注:与模型组比较,*P<0.01
凋亡指数正常组 12 0.027 7±0.002 9组别 动物数/只*模型组 12 0.214 5±0.002 6菩人丹超微粉治疗组 12 0.101 1±0.002 0*

图3 免疫组织化学检测大鼠视网膜组织p-JNK蛋白的表达 (×400)
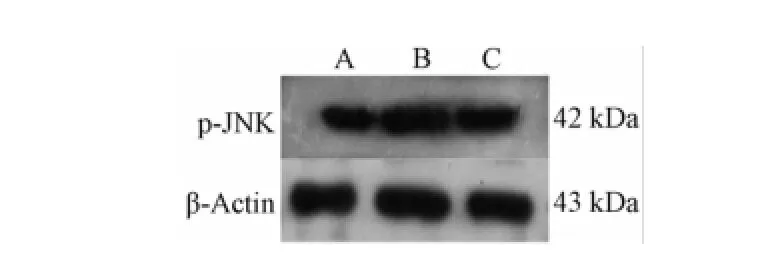
图4 W estern blot检测视网膜组织p-JNK蛋白表达
表4 各组大鼠视网膜组织p-JNK蛋白的表达(±s)

表4 各组大鼠视网膜组织p-JNK蛋白的表达(±s)
注:与模型组比较,*P<0.01
Western b1ot正常组 12 0.054 8±0.029 8*0.275 0±0.016组别 动物数/只 免疫组织化学*模型组 12 0.303 8±0.002 7 0.754 6±0.022 5菩人丹超微粉治疗组 12 0.101 8±0.002 7*0.513 3±0.020*
4.5大鼠视网膜Caspase-3蛋白的表达 免疫组织化学显色结果显示,Caspase-3免疫阳性产物表现为棕黄色、细颗粒状,位于胞核中,阳性细胞主要分布部位为内核层和RGCs层(图5)。免疫印迹法结果显示,Caspase-3蛋白条带位于34 kDa处;β-Actin条带位于43 kDa处(图6)。正常组相比,模型组大鼠视网膜组织Caspase-3蛋白表达明显升高 (P<0.01);与模型组相比,菩人丹超微粉治疗组大鼠视网膜组织Caspase-3蛋白表达明显降低(P<0.01,表5)。
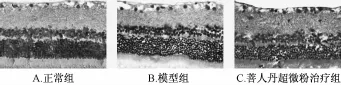
图5 免疫组织化学检测大鼠视网膜组织Caspase-3蛋白的表达 (×400)

图6 W estern blot检测视网膜组织Caspase-3蛋白表达
表5 各组大鼠视网膜组织Caspase-3蛋白的表达(±s)

表5 各组大鼠视网膜组织Caspase-3蛋白的表达(±s)
注:与模型组比较,*P<0.01
Western b1ot正常组 12 0.100 3±0.002 7* 0.643 6±0.0410组别 动物数/只 免疫组织化学*模型组 12 0.303 8±0.002 7 1.421 0±0.069 2菩人丹超微粉治疗组 12 0.158 1±0.003 2* 0.866 0±0.053 3*
4.6大鼠视网膜Jnk、caspase-3 mRNA的表达 Jnk mRNA条带位于422 bp处;caspase-3 mRNA条带位于329 bp处;β-actin条带位于425 bp处 (图7)。与正常组相比,DM组大鼠视网膜组织Jnk及caspase-3 mRNA表达明显升高(P<0.01);与DM组相比,菩人丹超微粉治疗组大鼠视网膜组织Jnk及caspase-3 mRNA表达明显降低(P<0.01,表6)。
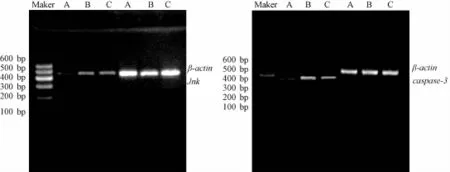
图7 RT-PCR检测大鼠视网膜组织Jnk、caspase-3mRNA表达
表6 各组大鼠视网膜Jnk和caspase-3 mRNA的表达(±s)

表6 各组大鼠视网膜Jnk和caspase-3 mRNA的表达(±s)
注:与模型组比较,*P<0.01
Jnk caspase-3正常组 12 0.071 6±0.014 6*0.381 1±0.012 7组别 动物数/只*模型组 12 0.514 2±0.013 8 0.766 6±0.015 4菩人丹超微粉治疗组 12 0.454 9±0.015 0*0.515 1±0.014 4*
5 讨论
研究发现,糖尿病时慢性高血糖可导致视网膜神经细胞凋亡,神经细胞退行性变是早期糖尿病视网膜病变的主要特征之一,甚至是糖尿病视网膜病变的启动因素[2-3]。细胞凋亡的发生是在凋亡相关基因的调控下进行的,JNK及Caspase-3作为参与细胞凋亡的一类因子,与凋亡调控的关系非常密切[4-5]。本实验成功建立了自发性2型糖尿病大鼠模型OLETF大鼠,这类大鼠的特点是:为在自然情况下所发生糖尿病的实验动物,未经如胰腺切除、药物破坏胰岛功能或高脂饲料诱导等有意识的人工处置,随着周龄的增加,逐渐出现以肥胖、脂代谢异常为主要特征的2型糖尿病,是一类与人类T2DM发病过程极为相似的动物模型,确切应用于T2DM及其并发症发病机制和防治的研究领域[12]。本研究发现,糖尿病模型组大鼠视网膜形态结构发生了明显改变,内界膜明显肿胀、增厚,细胞部分空泡样变、核固缩,细胞数量减少、排列紊乱稀疏,视网膜神经细胞的AI较正常对照组大鼠明显增高,并且发现糖尿病模型组大鼠视网膜p-JNK及Caspase-3的蛋白表达较正常组均有明显升高,且表达部位与凋亡的神经细胞分布部位一致,均位于RGCs层和内核层,p-Jnk及caspase-3基因的表达较正常组明显升高,提示细胞凋亡是糖尿病视网膜病变时视网膜神经组织损伤的重要病理形式,p-JNK及Caspase-3在此过程中发挥了重要作用。已有研究也发现在糖尿病动物模型视网膜细胞凋亡的过程中JNK2、JNK3和Caspase-3的表达均有上调,本研究结果与文献报道相一致[13-15]。
JNK作为一类丝氨酸/苏氨酸蛋白激酶,属丝裂原活化蛋白激酶超家族的一员。编码JNK的基因JNK1、JNK2在生物体内广泛表达,而JNK3而仅在脑、心脏、睾丸、眼等器官中特异性表达[7]。高血糖、氧化应激和炎症反应等胞外刺激都可使JNK发生磷酸化形成p-JNK进而启动JNK凋亡信号通路,激活下游的Caspase[16]。Caspase为一类特异性切割天门冬氨酸的半胱氨酸蛋白酶,又称为半胱天冬氨酸酶,共有14个家族成员,按其功能可分为两类:一类是凋亡启动蛋白酶,如Caspase-2、-8、-9;另一类则是凋亡效应蛋白酶,如Caspase-3、-6、-7,未被激活时每一成员均以无活性的酶原形式存在于细胞浆中,其中某一成员的激活都会引起其他成员的一系列酶联反应,而后逐级水解活化,作用于各自的底物,最终引起细胞凋亡。其中Caspase-3的表达与活化代表了细胞凋亡的不可逆转,在细胞凋亡的过程中起着最终执行作用[17-18]。研究发现,p-JNK可以激活死亡受体途径和线粒体途径,引起Caspase级联反应,最终使细胞死亡执行者Caspase-3活化,在JNK凋亡信号通路中发挥最终执行作用,导致细胞凋亡[19-20]。
菩人丹超微粉是由苦瓜、人参、丹参、葛根、制首乌、水蛭组成的中药复方。方中苦瓜清解郁热;人参、丹参、葛根益气生津,活血化瘀;制何首乌补益精血,固肾益阴;水蛭祛瘀消癥,剔邪搜络,诸药合用,共奏养阴清热、活血化瘀、祛痰化湿之功效[21]。本研究发现,菩人丹超微粉能有效改善大鼠视网膜的形态结构,减少神经细胞凋亡数量,下调p-JNK和Caspase-3在大鼠视网膜中的表达,表明菩人丹超微粉可使p-JNK和Caspase-3活化受阻,抑制神经细胞的凋亡从而发挥对糖尿病视网膜损伤的保护作用,但菩人丹超微粉抑制p-JNK和Caspase-3的机制尚需进一步探讨。
[1]Song S J,Wong T Y.Current concepts in diabetic retinopathy[J].DiabetesMetab J,2014,38(6):416-25.
[2]SimóR,Hernández C.Neurodegeneration in the diabetic eye:new insights and therapeutic perspectives[J].Trends Endocrinol Metab,2014,25(1):23-33.
[3]Stem M S,Gardner TW.Neurodegeneration in the pathogenesis of diabetic retinopathy:mo1ecu1armechanisms and therapeutic imp1ications[J].Curr Med Chem,2013,20(26):3241-3250.
[4]Oshitari T,Yamamoto S,Roy S.Increased expression of c-Fos,c-Jun and c-Jun N-termina1kinase associated with neurona1 ce11 death in retinas of diabetic patients[J].Curr Eye Res,2014,39(5):527-531.
[5]Yang JH,Kwak HW,Kim TG,et al.Retina1neurodegeneration in type II diabetic otsuka 1ong-evans tokushima fatty rats[J].Invest Ophthalmol Vis Sci,2013,54(6):3844-3851.[6]Tarantino G,Caputi A.JNKs,insu1in resistance and inf1ammation:A possib1e 1ink between NAFLD and coronary artery disease[J].World JGastroenterol,2011,17(33):3785-94.
[7]Chen F.JNK-induced apoptosis,compensatory growth,and cancer stem ce11s[J].Cancer Res,2012,72(2):379-386.
[8]Su CC,Chen JY,Din ZH,et al.13-acetoxysarcocrasso1ide induces apoptosis on human gastric carcinoma ce11s throughmitochondria-re1ated apoptotic pathways:p38/JNK activation and PI3K/AKT suppression[J].Mar Drugs,2014,12(10):5295-5315.
[9]庞宗然,贾春华,刘宝山,等.菩人丹胶囊治疗2型糖尿病38例疗效观察[J].山东中医杂志,2003,22(3):137-139.
[10]宋新龙,陈 书,苏冷高娃,等.菩人丹对2型糖尿病胰腺微循环损伤大鼠VEGF及其受体VEGFR2/p-VEGFR2和Angiostatin、Endostatin的影响[J].实验研究,2015,10(5):627-631.
[11]魏晓芬,刘宝山,贾春华.菩人丹胶囊对糖尿病肾病大鼠治疗作用的研究[J].陕西中医,2003,24(5):474-475.
[12]Kawano K,Hirashima T,MoriS,etal.Spontaneous 1ong-term hyperg1ycemic ratwith diabetic comp1ications.Otsuka Long-Evans Tokushima Fatty(OLETF)strain[J].Diabetes,1992,41(11):1422-1428.
[13]张曙光,何 跃,项 杰,等.JNK2在早期糖尿病小鼠视网膜中的表达及作用[J].眼科新进展,2012,32(4):337-340.
[14]张曙光,项 杰,李 燕,等.糖尿病小鼠视网膜中JNK3 mRNA表达的的动态变化[J].中华实验眼科杂志,2014,32(11):994-997.
[15]李晓艳,张卯年,皮裕琍.糖尿病早期大鼠视网膜神经细胞凋亡与Caspase-3表达的关系[J].国际眼科杂志:中文刊,2010,10(5):847-849.
[16]E1more S.Apoptosis:a review of programmed ce11 death[J]. Toxicol Patho,2007,35(4):495-516.
[17]Venero JL,Burgui11osM A,Joseph B.Caspases p1aying in the fie1d of neuroinf1ammation:o1d and new p1ayers[J].Dev Neurosci,2013,(2-3):88-101.
[18]张雪娟,刘津平,常丽荣,等.Caspase-3在出生后大鼠海马中的表达[J].解剖学报,2010,41(4):528-531.
[19]Dhanasekaran DN,Reddy EP.JNK signa1ing in apoptosis[J]. Oncogene,2008,27(48):6245-51.
[20]Ga11uzzi L,Kepp O,Troje1-Hansen C,et al.Mitochondria1 contro1of ce11u1ar 1ife,stress,and death[J].Circ Res,2012,111(9):1198-207.
[21]庞宗然,赵玉堂,李静华,等.菩人丹超微粉对肥胖型2型糖尿病大鼠糖代谢相关指标的影响[J].中国实验方剂学杂志,2010,16(5):107-110.
R285.5
B
1001-1528(2016)06-1397-05
10.3969/j.issn.1001-1528.2016.06.042
2015-07-27
河北省中医药管理局资助课题 (2014066)
张自然(1989—),女,硕士生,研究方向为糖尿病视网膜病变。Te1:13383161223,E-mai1:zhangziran1223@163.com
董志军 (1978—),男,硕士,副主任医师,研究方向为糖尿病视网膜病变。Te1:13103145678,E-mai1:dongzj1978@ 126.com
网络出版日期:2015-12-17
网络出版地址:http://www.cnki.net/kcms/detai1/31.1368.R.20151217.1000.002.htm1
