儿童肝脏局灶性结节增生临床表现与影像学表现关联分析
2016-09-06侯志彬王春祥李欣
侯志彬, 王春祥, 李欣
·儿科影像学·
儿童肝脏局灶性结节增生临床表现与影像学表现关联分析
侯志彬, 王春祥, 李欣
目的:探讨儿童肝脏局灶性结节增生(FNH)的影像表现,提高对该病影像学特征的认识。方法:回顾性分析6例经病理证实为FNH的患儿临床及影像学资料,其中3例患儿发病前确诊患有神经母细胞瘤、急性淋巴细胞白血病和髓母细胞瘤,另外3例患儿无恶性病变病史,均系偶然发现。3例患儿行MRI检查,2例患儿行CT检查,1例患者行CT及MRI检查,行CT检查者全部行增强扫描,2例行MRI增强扫描。结果:6例诊断为FNH患儿中3例(男2例,女1例,平均年龄8.7岁)存在远隔脏器恶性病变病史,影像学上3例患儿肝脏均呈多发病变,病变最大径2.0~5.2 cm,边界尚清楚,1例可见纤维分隔及中心瘢痕,1例可见引流静脉。其他3例FNH患儿(男1例,女2例,平均年龄7.3岁)无恶性病变病史,2例呈单发病变,1例呈多发病变;病变最大径4.3~7.6 cm,边界清楚,2例可见纤维分隔及中心瘢痕,3例均无明确引流静脉显示。结论:增强CT及MRI检查,尤其是MSCT血管成像能真实反映儿童FNH的病理学特点及血液动力学改变,对儿童肝脏FNH患者影像学特点的认知和了解对于该病的鉴别诊断及临床治疗具有重要意义。
局灶性结节增生; 肝脏; 儿童; 体层摄影术,X线计算机; 磁共振成像
肝脏局灶性结节增生(focal nodular hyperplasia,FNH)是以肝细胞过度增生和中心星状瘢痕为特征的良性肿瘤,一般常见于成年女性,男女发病率为1:2~4,儿童发病罕见,仅占儿童肝脏肿瘤的2%左右。由于该病目前认为是一种良性病变且生长缓慢,无恶变倾向,很少发生破裂、出血,因此术前需要与肝脏其他恶性病变相鉴别,避免不必要的手术切除。对于无临床症状患儿一般建议随诊复查,但对于肿瘤引起的相应临床症状加重或肿块直径增大患者需要手术切除。查找国内文献发现关于儿童FNH的影像学特征尤其是MRI表现特征的报道很少[1-2],本文回顾性分析6例FNH患儿的CT及MRI表现,旨在探讨CT及MRI对FNH的诊断价值。
材料与方法
1.病例资料
搜集我院2011年1月-2015年5月间6例经手术或穿刺活检证实为FNH的患儿,回顾性分析其临床及影像学资料。6例患者中男3例,女3例,年龄4~14岁,平均8岁,其中3例发病前3~7年存在其他恶性疾患,包括神经母细胞瘤、急性淋巴细胞白血病和髓母细胞瘤,并都进行过规范的放化疗治疗。另外3例患者无恶性疾患病史,均系偶然发现。3例患者行MRI检查,2例患者行CT检查,1例患者行CT及MRI检查,行CT检查者均行增强扫描,2例行MRI增强扫描。所有患者实验室检查AFP-125和糖链抗原19-9均呈阴性。本组研究对所有患者进行常规临床信息收集,包括性别、年龄、临床病史和是否口服避孕药。如果患儿存在恶性疾患病史,还需要进一步了解恶性病种类、放疗或化疗药物。
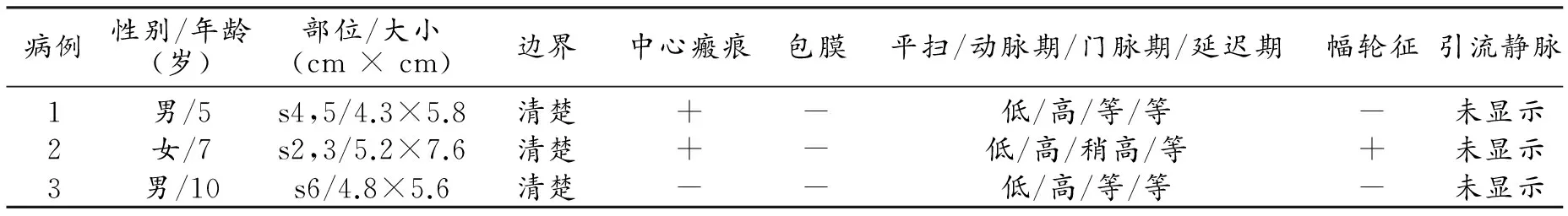
表1 无恶性病变组MSCT及MRI表现
注:s4,5,s2,3,s6均代表肝脏亚段。
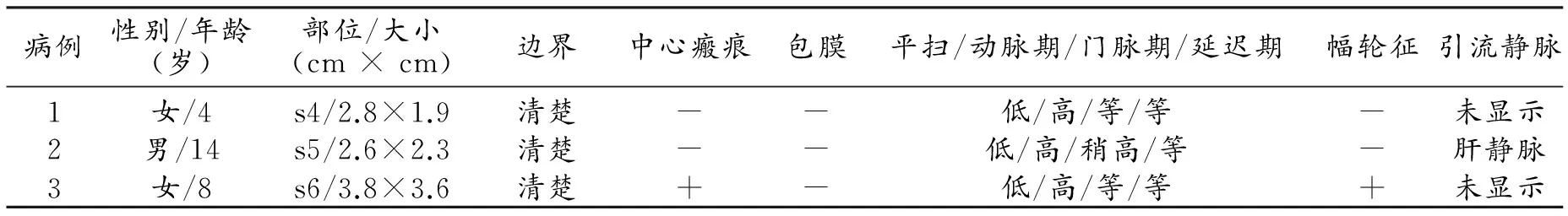
表2 恶性病变组MSCT及MRI表现
注:s4,s5,s6均代表肝脏亚段。
2.检查方法
CT检查采用Siemens Somatom Sensation 16层螺旋CT机,扫描范围自肝脏膈面至耻骨联合下缘,扫描参数:80~120 kV,100 mAs,扫描准直器0.75×16 mm,螺距0.85,层厚8~10 mm,重建层厚2 mm,重建间隔1 mm,重建卷积轴采用B30f,视野220 mm×220 mm。扫描时间约8 s。增强检查对比剂采用欧乃派克(300 mg I/mL),静脉手推或团注跟踪技术,腹主动脉起始部设定监测点,自动触发阈值设定为120 HU,动脉期延迟扫描时间为4 s,门脉期延迟扫描时间为25~30 s,55 s后进行延迟期扫描;对比剂流率1.0~3.5 mL/s,剂量1.5~2.0 mL/kg。患儿于检查前15~20 min接受对比剂过敏试验。4岁以下无法配合检查的患儿于扫描前15 min口服或静脉注射水合氯醛(6.5%,剂量1.5 mL/Kg),待患儿睡眠后检查。在满足诊断需求的条件下,尽可能降低放射剂量,从而避免对患儿的不必要损害。
MRI检查采用GE 1.5T Signa HDxt超导型磁共振,16通道腹部专用线圈,常规扫描包括轴面T1FLAIR (TR 580 ms,TE 9 ms),FSE T2(TR 2980 ms,TE 90 ms),矢状面T1FLAIR(TR 1750 ms,TE 9 ms),层厚8 mm,层间隔1 mm,视野320 mm×320 mm。DWI采用单次激发SE 回波平面成像(EPI)序列(b值=1000 s/mm2),TR 4800 ms,TE 79 ms,激励次数为1,扫描时间42 s,层厚6 mm,层间隔1 mm。MRI增强扫描对比剂采用钆双铵(欧乃影),剂量0.5 mmol/mL。由于年龄较小患儿无法进行屏气状态扫描,因此增强扫描一般采用经验延迟法,在患儿平静呼吸状态下,注射对比剂后立即进行动脉-门脉期和延迟扫描,一般采用快速FSE序列进行轴面及冠状面连续扫描。由两位有经验的副主任医师共同分析影像表现后协商做出诊断。
结 果
6例患儿均经手术或穿刺活检证实为肝脏FNH,手术或活检前所有患儿均行影像学检查。6例患儿中3例(男2例,女1例)存在远隔脏器恶性病变,包括神经母细胞瘤1例,髓母细胞瘤1例,急性淋巴细胞白血病1例。诊断FNH的平均年龄为8.7岁(4~14岁),两种疾病诊断间隔平均时间约为5年(3~7年),3例患者均经过规范的放化疗治疗,药物包括环磷酰胺、长春新碱、顺铂、美法伦。3例(男1例,女2例)无恶性病变,均系偶然发现,临床症状包括腹痛、腹胀、单核细胞增多症。诊断FNH的平均年龄为7.3岁(5~10岁)。3例无恶性病变患者中2例肝脏呈单发病变,CT平扫结节呈低密度影,增强后实性部分明显强化,中心瘢痕未强化(图1);病变于T1WI上呈稍低信号,T2WI上呈稍高信号,中心瘢痕于T1WI上呈更低信号(图2a~c),增强扫描门脉期病变呈明显均匀强化(图2d);另外1例为多发病变,病灶最大径4.3~7.6 cm,边界清楚,2例可见纤维分隔及中心瘢痕,假包膜1例;该组患者影像学特点基本一致,且本组患者引流静脉均未显示(表1)。存在远隔脏器恶性病变患者肝脏均呈多发病变,T1WI呈低信号,T2WI呈等或高信号,增强扫描动脉期呈均匀一致轻-中度强化(中心瘢痕和纤维分隔除外),门脉期呈等或高信号,平衡期与肝实质信号相近(图3)。病变最大径2.0~5.2 cm,边界尚清楚,1例可见纤维分隔及中心瘢痕,1例可见引流静脉(表2)。由两位有经验的副主任医师对6例FNH患儿的CT及MRI图像进行分析,分析内容包括:病变数量、发病部位、最大直径、边界、密度/信号特点、平扫及增强后中心瘢痕、纤维分隔、假包膜改变、供血及引流血管情况。
讨 论
FNH是儿童比较罕见的实性肿瘤,发生率仅占儿童全部实体肿瘤的0.02%,但在存在恶性疾患病史患儿中的发病率高达0.45%[3]。FNH发病机制目前尚不清楚,有学者认为该病与先天性或获得性血管异常相关。典型FNH病理特征包括:肝内结节由分化良好的肝细胞组成,被纤维性间隔所分离,小管增生伴中心瘢痕内血管畸形,无纤维包膜[4]。纤维间隔呈线状结构,从中心瘢痕向病变外缘放射延伸,偶见中心瘢痕缺失,病变多位于肝脏外周近包膜下[5]。
许多研究显示FNH的发生率在患有恶性肿瘤患儿接受过放化疗治疗后明显增高[6-7],抗肿瘤药物诱导的肝脏血管损伤可能与FNH形成相关。相关学者回顾性研究发现,存在恶性疾患病史的FNH患儿临床很少出现临床症状,肿块直径较对照组小 ,并且恶性疾患组患儿肝脏病变呈多灶性,较少出现中心瘢痕[8-9],本研究结果与该文献报道相一致。一些研究显示儿童FNH患者以女性居多,本组研究男女比例为1:1,可能与样本量较小且为单中心研究有关。儿童FNH患者缺乏相关临床症状,肿块破裂出血比较罕见,实验室检查缺乏特异性,AFP通常在正常范围[4]。
儿童肝脏FNH具有特征性影像学表现,典型表现为直径<5 cm的实性结节伴中心瘢痕和/或裂隙,约20%的病变CT上可显示中心瘢痕[10],多数仅显示星状或裂隙状低密度影。结节在动脉期呈均匀一致强化(中心瘢痕和纤维分隔除外),门脉期呈等或高密度,平衡期与肝实质密度相近。结节在T1WI上呈低或等信号,T2WI上呈等或稍高信号,约85%的中心瘢痕在MRI上能显示,与肝脏和结节相比,中心瘢痕在T2WI上呈更高信号,延迟期中心瘢痕仍可见对比剂残留。总之,FNH强化总体呈现“快进慢出” 特点。然而,相关文献报道约50%的FNH病灶缺乏以上典型影像表现,特别是较小结节缺乏典型中心瘢痕表现,对比剂呈“快进快出”[10]。此外,中心瘢痕征还多见于纤维板层肝细胞癌和巨大血管瘤,FNH中心宽度常<2 cm,而>2 cm者多考虑其他两种病变。FNH无纤维包膜,增强CT或MRI上呈边界较清楚的结节,但8%~36%的患者影像学检查可发现假包膜,T2WI呈高信号,动脉期呈环状低密度/低信号,门脉期及延迟期密度/信号增高,此征象在较大直径病变中更为多见,可能与病变周围血管或血窦扩张相关[10]。
纤维间隔是FNH的另一典型表现,在其他肝脏肿瘤中未见报道。但本研究中纤维间隔显示率不高(2/6),Kamel等[10]学者提出此征象应在门脉期容积再现(volume rendering,VR)重组图像上观察。纤维分隔在动脉期呈低密度/低信号,在门脉期和平衡期呈等密度/等信号。由于中心瘢痕可导致对比剂存留致最高延迟20 min。中心瘢痕征可见于42%~50%的FNH结节[11]。
FNH主要需要与一些儿童恶性肝脏肿瘤(如肝母细胞瘤和肝细胞癌)、肝结核等相鉴别,肝脏肿瘤AFP可升高,影像表现为不均匀密度/信号肿块,内部常合并有出血、坏死和钙化。MRI肝脏特殊对比剂(如钆贝酸二葡甲胺)对于鉴别诊断有一定价值,特别是延迟期FNH通常呈等或高信号影,很少出现低信号[12];肝脏结核实验室检查结核菌素呈阳性,平扫CT可见沙砾样钙化,增强CT或MRI呈典型延迟、边缘、分房样强化[13]。
儿童肝细胞腺瘤通常合并有糖原累积症,表现为多发病灶伴出血,内部密度不均匀,几乎不出现中心瘢痕。FNH可见偏心性和幅轮状供血血管,而肝腺瘤则为向心性和被膜下供血。婴儿型血管内皮瘤或婴幼儿血管瘤好发人群具有唯一性,约50%的病例存在点状钙化,增强特点与成人肝脏血管瘤一致,由边缘向中心呈渐进式强化。
本组研究中FNH影像表现与基础疾病有一定联系,有恶性疾患病史者均存在多发病变,病变最大径2.0~5.2 cm,中心瘢痕少见(1/3);无恶性病变组3例中仅1例出现多发病变,病变最大径3.6~8.0 cm,并且中心瘢痕更常见(2/3)。国外文献报道儿童恶性疾病常包括神经母细胞瘤、肾母细胞瘤、肝母细胞瘤、髓母细胞瘤、卵巢胚胎细胞瘤、骶尾部胚胎肿瘤、急性淋巴细胞/粒细胞白血病、肾上腺皮质癌、尤文氏肉瘤、再生障碍性贫血、胚胎癌等[14-17]。恶性病变组和无恶性病变组两组患儿诊断FNH的平均年龄相差不大,恶性病变组平均发病年龄为8岁,而无恶性病变组为7.3岁,这与国外研究有一定差异,可能与本组样本量较小有关。此外,年龄差异性对于诊断该病是否有意义仍需进一步研究。本研究中存在恶性病变组男女比率为2:1,而无恶性病变组男女比例为1:2,此发病比率可能与恶性肿瘤如神经母细胞瘤、髓母细胞瘤和肝母细胞瘤等多发生于男性有关。本研究存在一定不足,包括样本量较小、为回顾性研究、缺乏长期跟踪随访等,需要进一步完善。
综上所述,结合国内外文献及本组病例,笔者认为存在恶性疾患病史患儿的FNH影像学表现与无恶性病变患儿有一定差异[2,3,6,9,15],前者临床症状出现早,病变多位于肝包膜下,体积小、多发、中心瘢痕少见,内部裂隙样改变及引流血管多见;而后者特点为病变体积较大、单发,临床症状呈渐进性加重,中心瘢痕征多见,边界相对更清楚,偶见假包膜。两者在强化形式上基本一致,典型表现为动脉期结节呈均匀一致强化,门脉期则表现为等或高密度/信号影,延迟期表现为等密度/信号,薄层扫描及重组图像对显示纤维分隔和中心瘢痕具有重要意义。对于儿童患者,由于扫描时长、呼吸伪影及睡眠要求等因素影响,MSCT增强检查相对于MRI更易把握分期扫描的时间控制,并能够提供更多有价值的信息,如结节中心供血动脉、引流血管、中心瘢痕及周围裂隙改变强化程度等血流动力学改变;但MRI检查在显示一些细节方面如是否存在假包膜等,以及与其他一些肿瘤性病变鉴别方面优于MSCT。由于儿童FNH并非必须手术切除,只需密切随访,因此术前影像学检查及诊断具有重要意义。
[1]Chung EM,Cube R,Lewis RB,et al.From the archives of the AFIP:pediatric liver masses:radiologic-pathologic correlation part 1.Benign tumors[J].Radiographics,2010,30(3):801-826.
[2]Das CJ,Dhingra S,Gupta AK,et al.Imaging of paediatric liver tumours with pathological correlation[J].Clin Radiol,2009,64(10):1015-1025.
[3]Icher-De BC,Leclere J,Raimondo G,et al.Hepatic focal nodular hyperplasia in children previously treated for a solid tumor.Incidence,risk factors,and outcome[J].Cancer,2003,97(12):3107-3113.
[4]Chung EM,Cube R,Lewis RB,et al.From the archives of the AFIP:Pediatric liver masses:radiologic-pathologic correlation part 1.Benign tumors[J].Radiographics,2010,30(3):801-826.
[5]白人驹,张雪林.医学影像诊断学[M].北京:人民卫生出版社,2012:387.
[6]Sugito K,Uekusa S,Kawashima H,et al.The clinical course in pediatric solid tumor patients with focal nodular hyperplasia of the liver[J].Int J Clin Oncol,2011,16(5):482-487.
[7]Masetti R,Biagi C,Kleinschmidt K,et al.Focal nodular hyperplasia of theliver after intensive treatment for pediatric cancer:is hematopoieticstem cell transplantation a risk factor?[J].Eur J Pediatr,2011,170(6):807-812.
[8]Towbin AJ,Luo GG,Yin H,et al.Focal nodular hyperplasia in children,adolescents,and young adults[J].Pediatr Radiol,2011,41(3):341-349.
[9]Do RK,Shaylor SD,Shia J,et al.Variable MR imaging appearances of focal nodular hyperplasia in pediatric cancer patients[J].Pediatr Radiol,2011,41(3):335-340.
[10]Kamel IR,Liapi E,Fishman EK.Focal nodular hyperplasia: lesion evaluation using 16-MDCT and 3D CT angiography[J].AJR,2006,186(6):1587-1596.
[11]Johnson PT,Zaheer A,Anders R,et al.Dual-phase computed tomographic angiography of focal nodular hyperplasia:defining predictable postcontrast attenuation levelsrelative to aorta and inferior vena cava[J].J Comput Assist Tomogr,2010,34(5):720-724.
[12]Gupta RT,Iseman CM,Leyendecker JR,et al.Diagnosis of focal nodular hyperplasia with MRI:multicenter retrospective study comparing gadobenate dimeglumine to gadoxetate disodium[J].AJR,2012,199(1):35-43.
[13]郝亮,余日胜,崔凤,等,浆膜型肝结核的CT表现[J].放射学实践,2007,22(5):481-485.
[14]Benz-Bohm G,Hero B,Gossmann A,et al.Focal nodular hyperplasia of the liver in longterm survivors of neuroblastoma.How much diagnostic imaging is necessary?[J].Eur J Radiol,2010,74(3):1-5.
[15]Marabelle A,Campagne D,Déchelotte PM,et al Focal nodular hyperplasia of the liver in patients previously treated for pediatric neoplastic diseases[J].J Pediatr Hematol Oncol,2008,30(7):546-549.
[16]Takeyama J,Ando R,Sato T,et al.Focal nodular hyperplasia-like lesion of the liver in a child previously treated for nephroblastoma[J].Pathol Int,2008,58(9):606-608.
[17]Sudour H,Mainard L,Baumann C,et al.Focal nodular hyperplasia of the liver following hematopoietic SCT[J].Bone Marrow Transplant,2009,43(2):127-132.
Analysis of clinical and imaging manifestations of hepatic focal nodular hyperplasia in children
HOU Zhi-bin,WANG Chun-xiang,LI Xin.
Department of Radiology,Tianjin Children Hospital,Tianjin 300401,China
Objective:To analyze the clinical and imaging manifestations of focal nodular hyperplasia (FNH) in children,and to improve the knowledge of imaging characteristics of FNH.Methods:The clinical and imaging materials of 6 pediatric patients with pathology proved FNH were retrospectively analyzed.Three patients had the histroy of neuroblastoma,acute lymphoblastic leukemia and medulloblastoma respectively,the other three patients had no history of malignacy.All FNH lesions were revealed by chance.Three patients had MRI,2 patients had enhanced MSCT,and one had both MRI and enhanced CT,2 patients had enhanced MRI.Results:Of the six patients with FNH,3 patients (male,2 patients;female,1 patient;average age,8.7y) had a history of malignancy.They had multiple liver lesions,with the largest dimension as 2.0~5.2cm,well defined,with fibrous septa and central scar in 1 patient and draining vein in 1 patient.In the remaining three patients (male,1 patient;female,2 patients;average age,7.3y) had no history of malignancy,showing solitary lesion (2 patients) and multiple lesions (1 patient).The largest dimension was 4.3~7.6cm,with fibrous septa and central scar in 2 patients,no draining vein was assessed in all 3 patients.Conclusion:Enhanced CT and MRI,especially MSCTA can clearly show the pathologic characteristics and hemodynamic change of FNH in children,which is significant in the understanding of imaging characteristics and helpful in the differential diagnosis as well as clinical treatment.
Focal nodular hyperplasia; Liver; Children; Tomography,X-ray computed; Magnetic resonance imaging
300401天津,天津市儿童医院影像科
侯志彬(1980-),男,河北唐山人,主治医师,主要从事儿童CT及MRI诊断工作。
R575; R814.42; R445.2
A
1000-0313(2016)05-0429-05
10.13609/j.cnki.1000-0313.2016.05.010
2015-08-31
2015-12-16)
